INTRODUCCIÓN
Los retinoides sistémicos son los fármacos de elección en el tratamiento de los trastornos importantes de la queratinización. Se ha publicado mucho acerca de ellos, tanto de la isotretinoína1, 2 y del etretinato3 como del último retinoide sintetizado, el acitretín4. Gran parte de estos estudios se centran en los efectos secundarios de los retinoides1, 2, 5, fundamentalmente a nivel óseo. Los trabajos referentes a niños6-8 son menos numerosos y a veces algo contradictorios. Aportamos nuevos datos sobre el uso de retinoides en edades pediátricas.
PACIENTES Y MÉTODOS
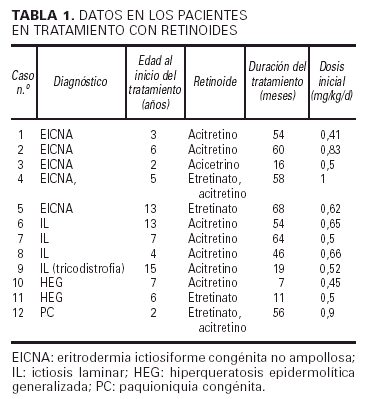
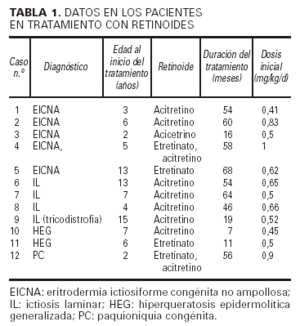
Hemos revisado un total de doce niños (siete mujeres y cinco hombres) con diferentes trastornos importantes de la queratinización que recibieron o están actualmente en tratamiento con retinoides sistémicos: un primer grupo tratado sólo con etretinato, un segundo grupo sólo con acitretino y un último grupo en que se cambió el etretinato inicial por acitretino. Los diagnósticos de los pacientes son: eritrodermia ictiosiforme congénita no ampollosa (EICNA) (cinco casos), ictiosis la-minar (IL) (cuatro casos, uno de los cuales se asociaba a tricotiodistrofia y otros 2 eran hermanos [casos 7 y 8]), hiperqueratosis epidermolítica generalizada (dos casos) y paquioniquia congénita (PC) (un caso).
En el estudio hemos obtenido los siguientes datos de cada paciente: diagnóstico, tipo de retinoide utilizado y edad al comienzo del tratamiento, duración del mismo (meses), dosis inicial según peso, grado de mejoría clínica, y efectos secundarios clínicos, de laboratorio (incluyendo pruebas de función hepática, colesterol y triglicéridos) y radiológicos (seguimiento mediante serie ósea).
RESULTADOS
La edad de nuestros pacientes al inicio del tratamiento con retinoides osciló entre los 2 y los 15 años, siendo la edad media de 7 años (tabla 1). Unos fueron tratados con etretinato solamente (casos 5 y 11), otros sólo con acitretino (casos 1, 2, 3, 6, 7, 8, 9 y 10) y sólo dos recibieron primero etretinato y después acitretino (casos 4 y 12). En el momento actual la duración del tratamiento se sitúa entre los 7 y los 64 meses, con una media de 42,7 meses. La dosis inicial de retinoide fue de 0,41 a 1 mg/kg/día, según la importancia del trastorno (tabla 1).
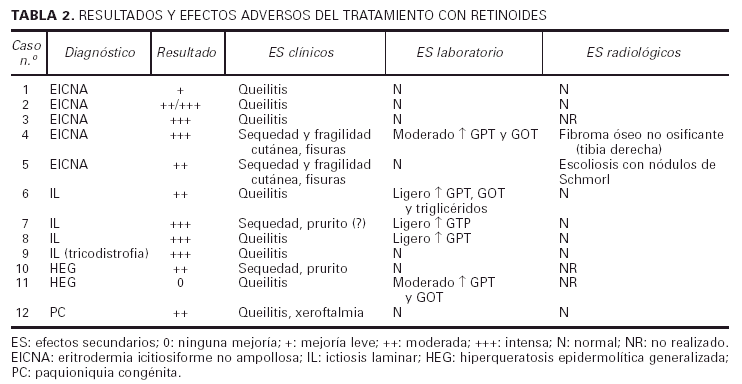
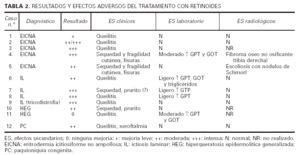
En todos los casos tratados, excepto en dos (casos 1 y 11), se observó una mejoría evidente, siendo realmente llamativa en la mayoría de los niños con IL y EICNA (tabla 2). Todos los enfermos aquejaron sequedad mucocutánea, en forma de queilitis (todos los casos) o de xeroftalmia (caso 12). Otras manifestaciones fueron fragilidad cutánea y fisuras en los casos 4 y 5, y sensación de prurito en los casos 7 y 10, aunque el caso 7 tenía antecedentes de dermatitis atópica por lo que este hallazgo es más difícil de valorar.
En cuanto a los datos de laboratorio, en 3 casos se apreció un discreto aumento de las transaminasas (GPT en los pacientes 7 y 8, GPT y GOT en el 6). Los triglicéridos también se elevaron ligeramente en el caso 6. En otros dos casos (4 y 11) el aumento de las transaminasas fue más importante. En el primero se controló disminuyendo la dosis a la mitad (0,5 mg/kg/d) y en el segundo se decidió suspender el retinoide por falta de respuesta.
Se realizaron estudios radiológicos (serie ósea) en nueve de los doce niños incluidos en este trabajo, dado que los casos 3 y 10 no llevan tiempo suficiente de tratamiento, y el caso 11 abandonó el tratamiento antes de llegar a efectuarse las pruebas radiológicas de control. En seis de los niños no se halló ninguna anomalía ósea. El caso 8, previamente al tratamiento, mostró una edad ósea retrasada. En el caso 4 se informó de la presencia de un fibroma óseo no osificante en la tibia derecha, mientras que en el caso 5 la paciente tenía una ligera escoliosis con nódulos de Schmorl en el segmento de D5 a D10. Dichas alteraciones se observaron a los 3 y 4 años del comienzo del tratamiento, respectivamente. Los pacientes estaban asintomáticos y ambos habían estado con etretinato y el caso 4 también con acitretino.
DISCUSIÓN
Dentro de los retinoides que se han llamado de segunda generación o aromáticos, los más significativos y eficaces en el tratamiento de la psoriasis y los trastornos graves de la queratinización son el etretinato y su principal metabolito, el acitretino9. Se han realizado múltiples investigaciones acerca de estos compuestos, incluyendo el posible mecanismo de actuación que tendría el etretinato a nivel cutáneo, concretamente en la diferenciación epidérmica y los cambios histológicos que provocaría10. El acitretino presenta una ventaja con relación al etretinato, y es que al ser menos lipofílico se acumula menos en el tejido adiposo, aunque parte del acitretino se transforma en etretinato11, 12. Por esta razón el riesgo de teratogenicidad de ambos compuestos es similar. En nuestra serie se llegaron a tratar 4 pacientes con etretinato, en uno se retiró por no responder y en otro fue sustituido a los pocos meses por acitretino.
En este trabajo la respuesta terapéutica fue variable según los casos y la intensidad del cuadro, pero en la mayoría de los pacientes se obtuvo una evolución favorable (tabla 2). Solamente el caso 11 no mejoró lo más mínimo, por lo que después de 11 meses de tratamiento con etretinato éste se suspendió. Los resultados más evidentes y espectaculares se lograron en los niños con IL y EICNA. Existe bastante conformidad entre los diferentes autores4, 9, 13, 14 en que son los pacien-tes con IL y EICNA los que más se benefician de la terapia con retinoides. En otras formas de ictiosis, en cambio, como en las neonatales tipo bebé colodión o feto arlequín estos tratamientos resultan poco satisfactorios en general15, aunque hay algún caso publicado con franca mejoría tras la toma de etretinato16.
El intervalo de dosis inicial empleado en nuestros pacientes está entre 0,4 y 1 mg/kg/día. Ciertos autores recomiendan en niños con trastornos graves de la queratinización una dosis inicial aproximada de retinoide de 0,5 mg/kg/día4, mientras que otros actúan con un intervalo que va de 0,5 a 1 mg/kg/día3. De cualquier modo hay que recordar que a la hora de instaurar una pauta de tratamiento tendremos que tener en cuenta tanto la gravedad del trastorno como la respuesta esperada.
Se ha puesto de manifiesto en muchos estudios que el acitretino es igual de eficaz que el etretinato11, 14. Nuestra experiencia apoya dicha afirmación, y tampoco hemos encontrado diferencias significativas en cuanto a la evolución entre los pacientes tratados con uno u otro fármaco, lográndose en ambos grupos resultados totalmente superponibles.
Aunque sabemos que el efecto beneficioso de los retinoides sólo se mantiene mientras se mantenga el tratamiento14, existen circunstancias que pueden mejorar las manifestaciones clínicas de algunos trastornos de la queratinización. En los casos 7 y 8, por ejemplo, se retiró el acitretino durante los meses de verano, aunque pasado este tiempo se tuvo que reinstaurar el retinoide. A pesar de las esperadas recaídas algunos autores recomiendan la terapia intermitente con retinoides en un intento de reducir los efectos secundarios a largo plazo e incluso la regresión de las alteraciones óseas en estadio muy precoz9.
Los efectos secundarios observados en nuestros pacientes se encuentran reflejados en la tabla 2. En general la tolerancia de los retinoides fue muy buena. En cuanto a los efectos secundarios clínicos, fue la sequedad cutánea leve o moderada, y concretamente la queilitis, el más frecuente (100%), al igual que en todas las series publicadas. Otras manifestaciones que pudimos apreciar fueron fragilidad cutánea, fisuras y prurito. Además de éstas se han descrito otras reacciones adversas, como alopecia tanto parcheada17 como difusa3, conjuntivitis o artromialgias11. En ningún paciente fue necesaria ni la suspensión ni la disminución de la dosis a causa de estos efectos que en todo momento fueron de leves a moderados y que a medida que pasaba el tiempo eran mejor tolerados. En alguna ocasión, sin embargo, la afectación puede ser muy marcada, como en el caso publicado de un niño con un prurito intratable que obligó al abandono del tratamiento18.
Las alteraciones analíticas que observamos en cinco de los doce casos correspondían a los niveles de transaminasas (GPT,GOT) y/o triglicéridos. En los tres casos en los que la elevación fue ligera, los valores llegaron a normalizarse a los pocos meses de tratamiento, hecho ya reflejado previamente por algunos autores19. De los dos casos en que la elevación fue más marcada, en uno se retiró el retinoide por falta de respuesta y en el otro la alteración se controló disminuyendo la dosis (de 1 a 0,5 mg/kg/día de etretinato).
Sin duda, la mayor preocupación al instaurar un tratamiento con retinoides orales, especialmente en niños, es la repercusión ósea a largo plazo. Se han descrito alteraciones óseas tras dosis altas de ácido 13-cis-retinoico (> 2 mg/kg/día)6, 20, 21, presentes incluso antes de finalizar el primer año de tratamiento1. También se ha encontrado toxicidad ósea en pacientes tratados durante años con etretinato7,8 (tanto a dosis de 2 mg/kg/día como inferiores a 1 mg/kg/día). Algunas de las anormalidades óseas más frecuentes han sido hiperostosis, calcificaciones de tendones y ligamentos1, osteoporosis, engrosamientos periósticos8, 17, 22, cierre epifisario precoz y retraso del crecimiento6, 7. En uno de nuestros pacientes se observó un fibroma óseo no osificante y en otro una escoliosis, esta última descrita también previamente22, con pequeñas zonas de osteoporosis (nódulos de Schmorl). El primero tuvo una dosis inicial de etretinato de 1 mg/kg/día que al poco tiempo se redujo a la mitad por aumento de las transaminasas. Después de llevar 3 meses con esta dosis se pasó a 0,7 mg/kg/día de acitretino. El otro caso estuvo con aproximadamente 0,6 mg/ kg/día de etretinato durante todo ese tiempo. Dichas alteraciones aparecieron a los 3 y 4 años de tratamiento, respectivamente, y probablemente no estén en relación con el tratamiento con retinoides.
Para otros autores el uso de retinoides a dosis inferiores a 1 mg/kg/día no produce ninguna reacción adversa a nivel óseo, o por lo menos ninguna de importancia clínica o que repercuta en el crecimiento del niño3, 17, 23-25. Incluso el retraso de crecimiento que presentan a veces podría deberse a su enfermedad crónica, y podría mejorarse gracias a la terapia con retinoides26. El caso 8 que tenía retraso de crecimiento (edad ósea retrasada) previo al tratamiento no pareció mejorar en este sentido. En conformidad con estas publicaciones nosotros no hemos encontrado ninguna alteración ósea secundaria de relevancia, como retraso de crecimiento o cierre epifisario precoz. Quizá sea porque las dosis empleadas siempre han sido inferiores a 1 mg/kg/día, tanto de etretinato como de acitretino, que por otra parte es la dosis recomendada en múltiples trabajos para evitar precisamente estos efectos4, 14. En cuanto al seguimiento radiológico, hay quien aconseja controles cada 12 a 18 meses14, mientras que otros piensan que éstos se deberían restringir a aquellos pacientes con anomalías radiológicas previas al tratamiento o que presenten algún síntoma musculoesquelético4, 17. Por último, aunque ciertos autores5 opinan que la toxicidad ósea del acitretino podría ser menor que la de su precursor, por acumularse menos en el organismo, no hay hasta la fecha ningún estudio comparativo al respecto.