INTRODUCCION
El penfigoide cicatrizal (PC) es un grupo de enfermedades autoinmunes, mediadas por autoanticuerpos IgG (inmunoglobulina) y/o IgA, que consisten en la aparición de ampollas subepidérmicas, que afectan principalmente a las mucosas, y en menor medida a la piel 1. En los últimos años, esta enfermedad ha recibido muchas denominaciones, como penfigoide benigno de mucosas, penfigoide oral o penfigoide ocular 2. No obstante, el curso no siempre es benigno; deja importantes secuelas en el paciente, y en ocasiones pueden observarse lesiones en varias localizaciones. Por este motivo, hoy día es más aceptado el nombre de penfigoide de mucosas (PM) para designar este grupo de enfermedades 3.
Varias proteínas constitutivas de la membrana basal de la epidermis se han implicado como antígenos en la patogenia del PM, destacando con una frecuencia mayor el antígeno del penfigoide ampolloso 2 (APA-2) o BP180 4-8. También se ha relacionado el (APA)-1 o BP230 4-8, la integrina a6b4 9,10, la laminina 5 11-13, la laminina 6 13 y el colágeno tipo VII 14. Además, un mismo paciente puede presentar autoanticuerpos dirigidos frente a varios de estos antígenos 13,15,16. Esta variedad antigénica muestra el gran espectro clínico de esta enfermedad, y la variabilidad clínica en su expresión. El diagnóstico de cada una de estas formas clínicas requiere, además de la presencia de los típicos hallazgos clínicos, de la utilización de técnicas de biología molecular y de inmunofluorescencia especiales, tal y como se ha establecido recientemente 3.
Se presenta nuestra experiencia en 5 pacientes con PM atendidos en nuestro departamento, en los que se realizaron diferentes técnicas de biología molecular y de inmunofluorescencia que ayudaron a realizar un diagnóstico correcto.
MATERIALES Y MÉTODOS
Pacientes y caracterización de los sueros
Nuestro estudio incluye 5 pacientes, 2 mujeres y 3 varones, diagnosticados de PM en el Departamento de Dermatología de la Clínica Universitaria de Navarra. Las características clínicas e inmunológicas de cada uno de los pacientes están incluidas en la tabla 1. La edad estuvo comprendida entre los 41 y los 69 años. Todos los pacientes presentaron afectación de mucosa oral, y solamente en 2 casos se observaron lesiones en la piel. En todos los casos se realizó biopsia de las lesiones, siguiendo las directrices indicadas 3. Los hallazgos histológicos de hematoxilina-eosina fueron compatibles con enfermedad ampollosa subepidérmica. Se realizaron estudios de inmunofluorescencia directa (IFD) e indirecta (IFI), incluyendo la técnica de salt-split mediante el empleo de piel humana incubada en una solución de cloruro sódico 1M.
Inmunofluorescencia y técnica desalt-split
Las técnicas de IFD e IFI se realizaron según se ha descrito en la literatura médica 17. Para llevar a cabo la técnica de salt-split se siguieron las directrices de Zillikens et al 18. Se incubó piel humana en una solución de cloruro sódico 1M. Los cortes obtenidos por congelación se pusieron en contacto con suero de los pacientes a una dilución 1:10 durante 30 min a una temperatura de 37 °C. Posteriormente, se lavó la muestra suero salino, y se incubaron con anticuerpos anti-IgA a anti-IgG humana marcados con fluoresceína (FITC), a una dilución de 1:100.
Técnicas deimmunobloty proteínas de fusión
Estas técnicas se llevaron a cabo en colaboración con el Departamento de Dermatología de la Universidad de Lübeck de Alemania (Dr. Cassian Sitaru), tal y como se ha descrito en la literatura médica 18. Las proteínas de fusión utilizadas se muestran en la figura 1, siguiendo la técnica propuesta por Georgi et al 19 y basándose en la secuenciación descrita por Giudice et al 20. La región soluble del ectodominio del BP180 (LAD-1) se aisló de un cultivo de células Ha CaT 21, creciendo en un medio para queratinocitos en condiciones de calcio bajo (Clonetics, La Jolla, CA, EE.UU.) hasta llegar a una confluencia del 70-80 % 21. El concentrado del cultivo de queratinocitos se separó con geles de electroforesis de poliacrilamida-sulfato dodecil-sódico (SDS-PAGE) al 8 % y electrotransferidos a papeles de nitrocelulosa. Se realizaron tiras de este papel, incubándose con sueros, a una dilución de 1:100 durante 4 h a temperatura ambiente. Posteriormente, se lavaron con suero con albúmina bovina al 1 % en solución tampón salino-TRIS, y se incubaron con anticuerpos específicos frente a IgG a IgA humanas, marcados con peroxidasa del rábano picante 21.
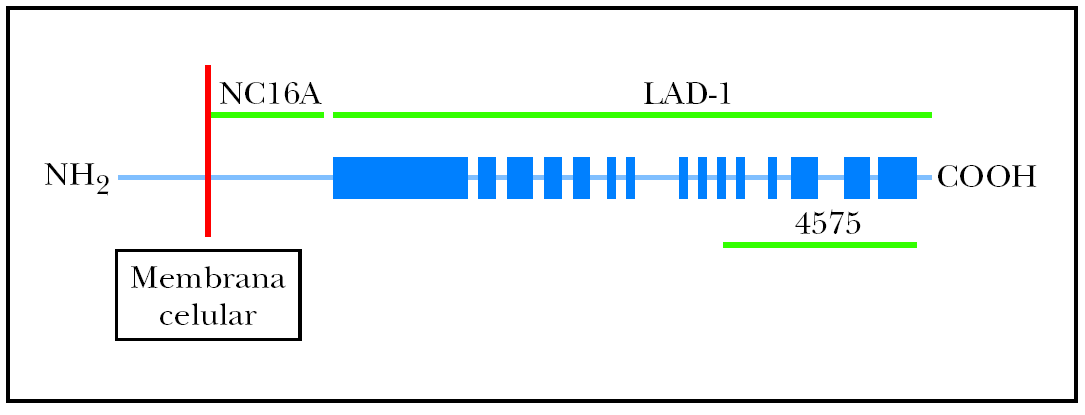
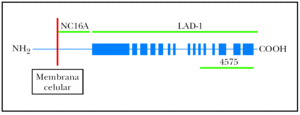
Fig. 1.--Diagrama que representa de forma esquemática el antígeno 2 del penfigoide ampolloso (BP180), con sus tres partes: porción intracelular, porción transmembrana y región extracelular. En este estudio se utilizan tres fragmentos recombinantes del BP180: fragmento extracelular LAD-1 (no es conocido exactamente el inicio de este fragmento, pero su extremo distal se extiende hasta el aminoácido 1497); el fragmento NC16A (desde el aminoácido 490 hasta el 565); y el fragmento carboxiterminal del ectodominio extracelular BP180 4575 (desde el aminoácido 1365 hasta el 1413).
Los fragmentos BP180 NC16 (desde los aminoácidos 490 a 562) y BP180 4575 (desde los aminoácidos 1365 a 1413) se expresaron en Escherichia coli DH5α 7. La proteína de fusión recombinante glutatión-S-transferasa (GST)-BP180 NC16A purificada se separó en geles de electroforesis de SDS-PAGE al 15 % y se electrotransfirió a papeles de nitrocelulosa. Se realizaron tiras de este papel, incubándose con los sueros de los pacientes, a una dilución de 1:100, a temperatura ambiente. Posteriormente se lavaron con suero con albúmina bovina al 1 % en solución tampón salino-TRIS, y se incubaron con anticuerpos específicos frente a IgG e IgA humanas, marcados con peroxidasa del rábano picante.
Técnica de ELISA para BP180 NC16A
Se realizó determinación de anticuerpos frente al fragmento recombinante NC16A mediante técnica de análisis de inmunoabsorción ligado a enzimas (ELISA), según está descrita en la literatura médica 22.
RESULTADOS
Inmunofluorescencia y técnica desalt-split
A pesar de presentar todos los pacientes lesiones características de PM, sólo en un caso se encontró IFD positiva en la biopsia de la piel (paciente 3). En 2 casos con IFD negativa la IFI fue positiva para IgG, con unos valores de 1:320 y 1:80. En 2 casos la IFI fue positiva mediante salt-split. En uno de ellos se observó únicamente positividad para IgG con un título de 1:80, con depósitos lineales en el lado epidérmico (fig. 2). En el otro, se encontró positividad con un título de 1:640 para IgG, y de 1:160 para IgA (fig. 3), con depósitos lineales en el lado epidérmico (tabla 1).
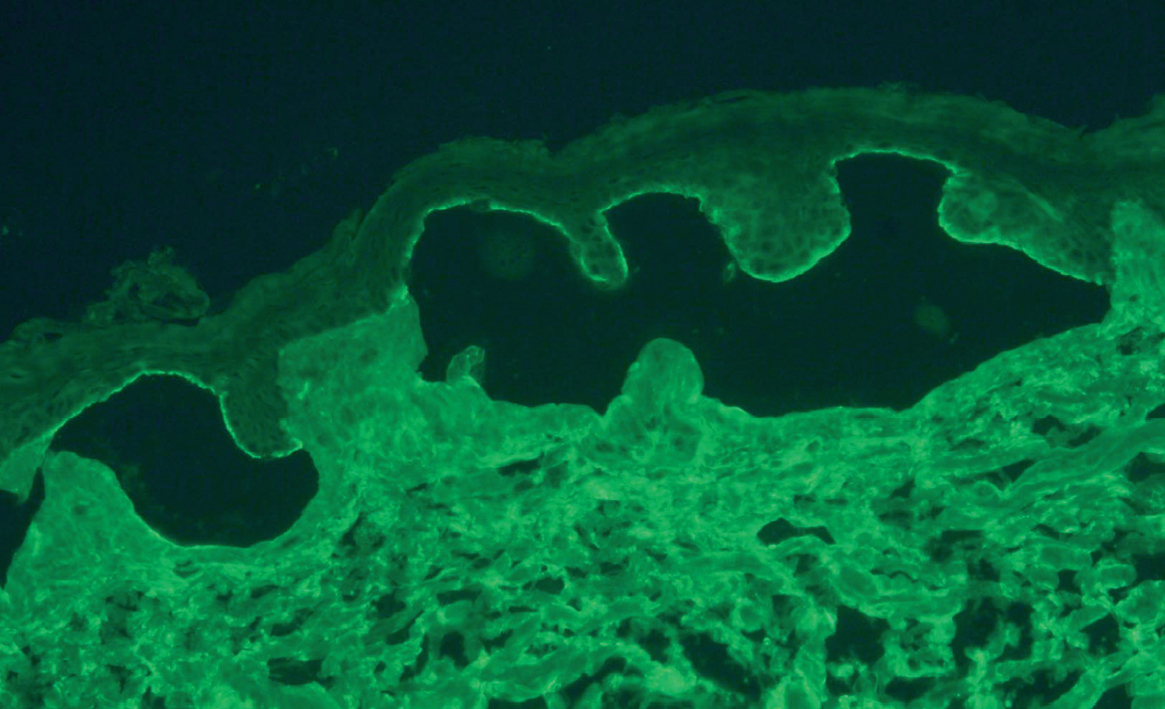
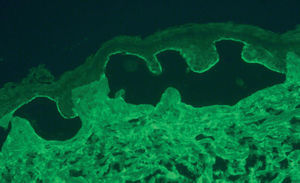
Fig. 2.--Depósitos lineales de autoanticuerpos IgG en la unión dermoepidérmica en el PM. La técnica de salt-split se realizó con piel humana en cloruro sódico 1M. Los anticuerpos anti-IgG humana marcan el lado epidérmico de la ampolla formada artificialmente (flechas) (paciente 4) (x200).
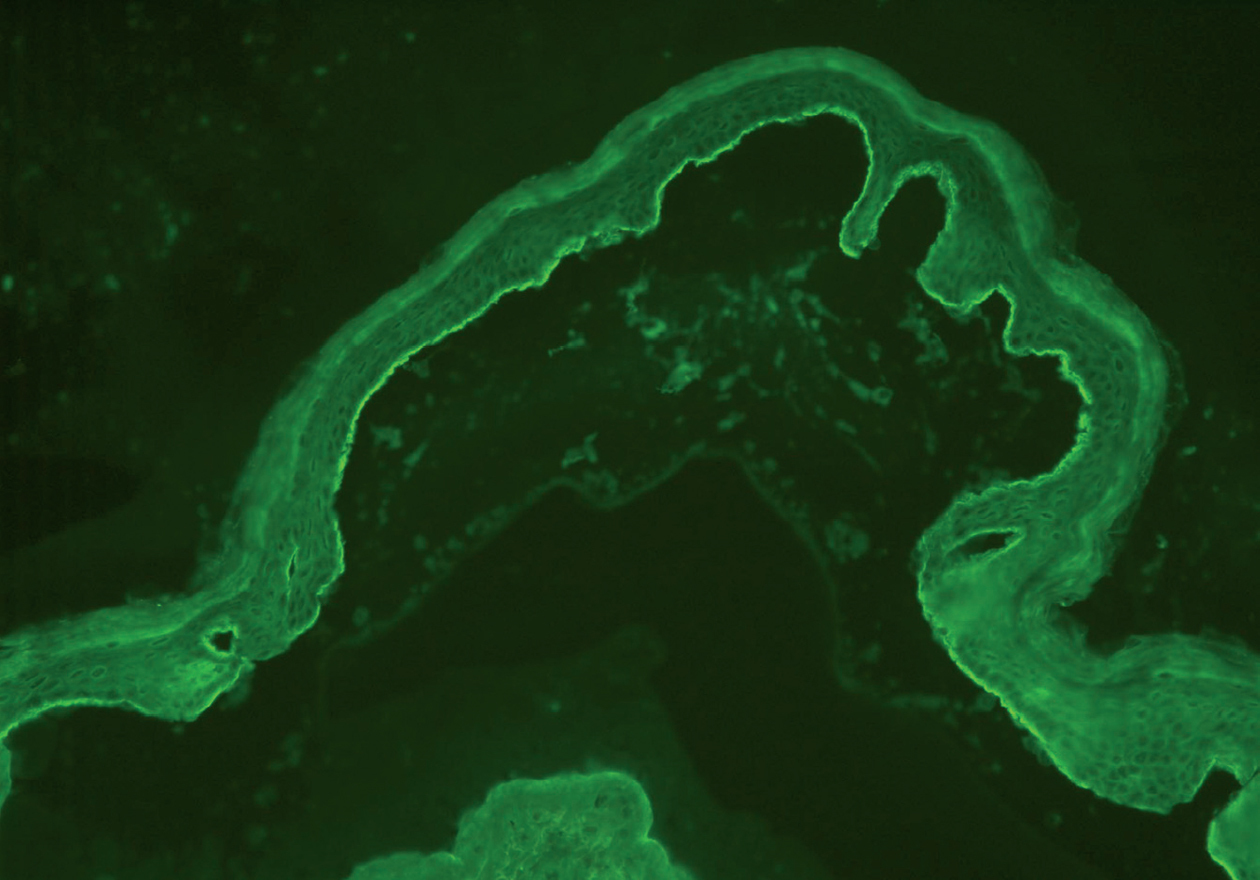
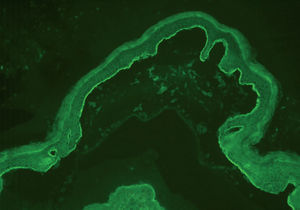
Fig. 3.--Depósitos lineales de autoanticuerpos IgA en la unión dermoepidérmica en el PM. Los anticuerpos anti-IgA humana marcan el lado epidérmico de la ampolla formada artificialmente (flechas) (paciente 5) (x200).
Immunoblotpara BP180 LAD-1, BP180 NC16A, y BP180 4575. ELISA para BP180 NC16A
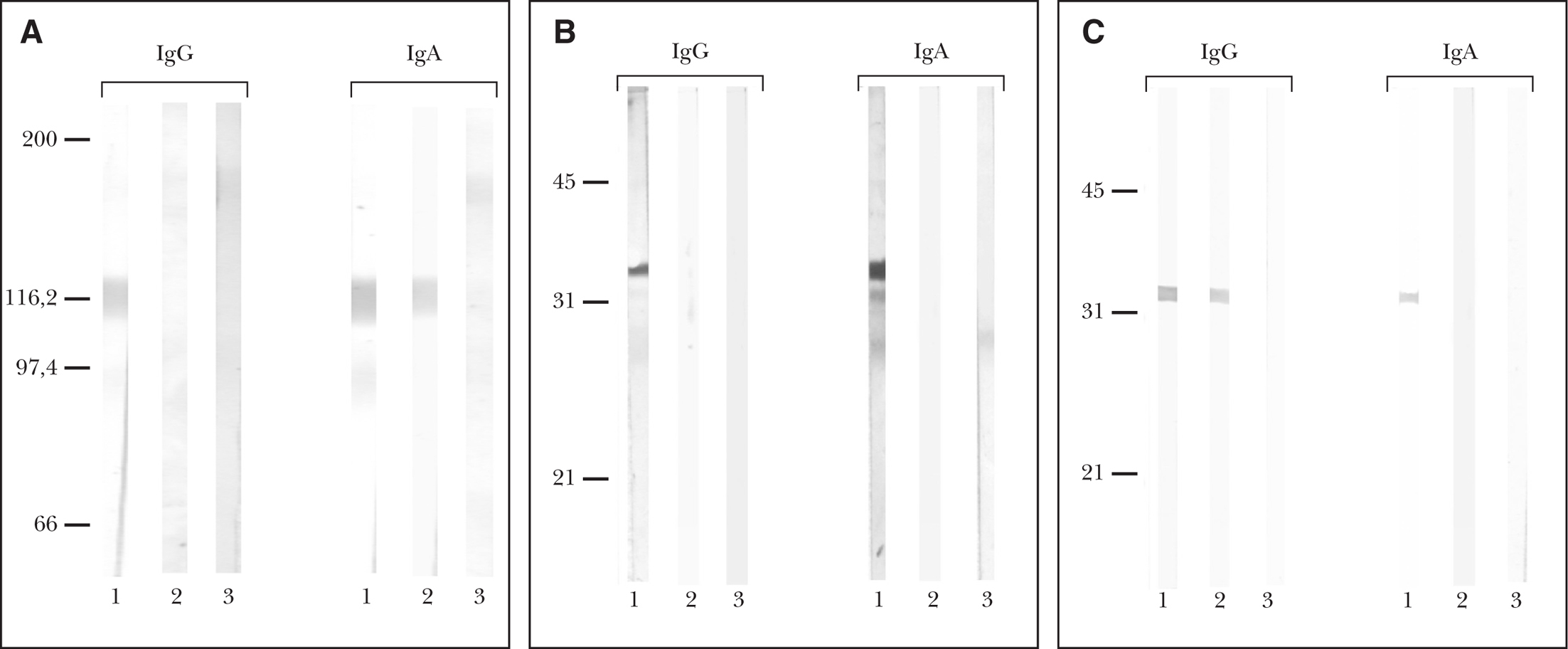
Tres de los cinco sueros reaccionaron frente a la proteína LAD-1, en 2 casos con IgA, y en otro caso fue IgG, encontrándose una banda de 116 kDa en cada uno de los casos (fig. 4A). Se realizó también inmunoblot frente a NC16A en 3 pacientes, que resultó positivo en 2 casos, en uno con IgG y otro con IgA, con un peso molecular de 38 kDa en ambos (fig. 4B). En los 2 pacientes en los que no se realizó inmunoblot frente a esta última proteína, se realizó técnica de ELISA frente a este mismo fragmento, que resultó negativo en ambos casos. Por último, se llevó a cabo inmunoblot frente a la porción más terminal del BP180 (BP180 4575), encontrando una positividad en 4 pacientes, en dos con IgG, en uno con IgA y en un caso con ambos anticuerpos, observándose una banda de 33 kDa en cada uno de los casos (tabla 1) (fig. 4C).
Fig. 4.--A) Inmunoblot para IgA e IgG frente al ectodominio LAD-1 del BP180. Línea 1, con suero control de penfigoide ampolloso; línea 2, con suero de nuestro paciente 3; línea 3, con suero de sujeto sano. El suero de nuestro paciente 3 no mostró reactividad al ectodominio soluble LAD-1 del BP180 para IgG pero sí para IgA. B) Inmunoblot para IgA e IgG frente a BP180 NC16A. Línea 1, con suero control de paciente con penfigoide ampolloso; línea 2, con suero de nuestro paciente 3; línea 3, con suero de sujeto sano. El suero de nuestro paciente 3 no mostró reactividad al dominio NC16A del BP180 para IgG ni para IgA. C) Inmunoblot para IgA e IgG frente a la porción carboxi-(C)-terminal de BP180 (BP180 4575). Línea 1, suero control de paciente con penfigoide cicatrizal; línea 2, con suero de nuestro paciente 3; línea 3, con suero de sujeto sano. El suero de nuestro paciente 3 mostró reactividad al dominio 4575 del BP180 para IgG, pero no para IgA.
DISCUSION
En este estudio se ha caracterizado la respuesta inmunológica frente al BP180 en 5 pacientes con PM. En la primera reunión de consenso sobre PM celebrada en Chicago el año 2002 3, se estableció que para el diagnóstico de esta enfermedad es necesario, además de las lesiones clínicas características, la presencia de IFD, IFI convencional y técnica de salt-split positivas. No obstante, estos hallazgos no se encuentran en todos los casos de PM descritos en la literatura médica 1,23,24, al igual que ha ocurrido en nuestros casos. Resultados semejantes encontraron Setterfield et al 23,24, observando que los pacientes en los que la IFD resultó negativa, la IFI en cambio fue positiva, al igual que en nuestros pacientes (tabla 1). Los resultados negativos en la IFD pueden deberse a la dificultad técnica de tomar una biopsia de mucosas, con el riesgo de que resulte un falso negativo. Por este motivo, cuando las lesiones clínicas son características y tenemos resultados negativos en los estudios de inmunofluorescencia, son necesarias otras técnicas diagnósticas que permitan argumentar tratamientos inmunosupresores sistémicos, como es el caso de pacientes que presentan afectación ocular, o en aquellos en que existe una afectación importante de otras mucosas 1,25,26.
Observamos IFI positiva únicamente en 2 casos de los cinco estudiados, resultados semejantes a los observados en la literatura especializada 1,21, y en el 50 % de los casos mediante la técnica de salt-split, al igual que en el estudio de Schmidt et al 21. En los casos en los que fue positiva, se observó que el depósito asentaba en el lado epidérmico, tal y como se ha descrito cuando está implicado el BP180 y la integrina a6b4. Por el contrario, cuando están implicadas la laminina 5 o 6, o el colágeno tipo VII, los depósitos se observan en el lado dérmico 27,28. En otros estudios, esta positividad fue del 80 % cuando existía afectación de piel y mucosas en el PM, descendiendo al 18 % cuando los pacientes presentaban únicamente afectación de mucosas, y sólo del 7 % en aquellos casos en los que existía afectación de mucosa ocular 29. La detección de anticuerpos circulantes en este grupo de pacientes puede ofrecer unos resultados más positivos si los sueros se estudian mediante radioinmunoanálisis 30, o mediante salt-split concentrando más los sueros estudiados 31.
En nuestro estudio se ha estudiado únicamente la autoinmunidad frente al BP180 en pacientes con PM. Este es el antígeno que con más frecuencia se ha implicado en el PM 7 y por este motivo fue el antígeno que estudiamos en nuestros casos. No se descarta que, además y al igual que se ha descrito en la literatura especializada, junto al BP180 puedan existir en nuestros pacientes otros antígenos implicados 13,15,16. Esto puede deberse a que durante el proceso de inflamación quedan expuestos otros antígenos que resultan accesibles al sistema inmunitario. Este fenómeno se ha denominado epitope spreading (expansión de epítopos), y se ha demostrado su papel en la progresión de ciertas enfermedades autoinmunes 32,33.
En todos nuestros casos se produjeron resultados positivos frente a alguno de los fragmentos estudiados de BP180. Resultados semejantes observaron Schumann et al 28 y Balding et al 7, encontrando anticuerpos frente al BP180 en el 100 y 96 % de sus pacientes con PM, respectivamente, o en el 84 % en el estudio de Schmidt et al 21.
El dominio NC16A es una región inmunodominante del BP180, donde asientan epítopos implicados en enfermedades como el penfigoide ampolloso (PA), herpes gestational, liquen plano-penfigoide (LPP) y PM 27,28,34. En el presente estudio, se observa que en 2 de los 4 pacientes en los que se realiza inmunoblot frente a NC16A, se encontró positividad, uno con IgG y otro con IgA. En un paciente más en el que se realizó la técnica de ELISA, ésta fue negativa. En otros estudios, al igual que en nuestros pacientes, se ha observado que en el 58 % de los pacientes con PM esta determinación fue positiva, principalmente para IgG 21. Así pues, este dominio del BP180 está implicado en la patogenia de muchas enfermedades autoinmunes ampollosas, interviniendo diferentes epítopos en cada una de ellas 27.
Se ha descrito también que el antígeno de la enfermedad IgA lineal del adulto (LAD-1) asienta también en el BP180 y, en concreto, en el ectodominio de esta proteína, con un peso molecular de 120 kDa 35, o un fragmento suyo de 97 kDa 36. Los estudios de reactividad frente al fragmento LAD-1 que llevamos a cabo mostraron una positividad del 75 % (3 de los 4 pacientes en los que lo estudiamos), dos de ellos para IgA y uno para IgG. Schmidt et al 21 observaron únicamente anticuerpos frente a este dominio en el 42 % de los pacientes, principalmente de tipo IgA. Si se considera globalmente la positividad frente a NAC16A y frente a LAD-1, tanto para IgG como para IgA, encontramos que el 80 % presentaron autoanticuerpos, al menos frente a uno de los dos fragmentos. Estos hallazgos se corresponden con los observados en otros estudios, donde esta positividad fue del 84 % 21 y 85 % 37, y demuestra que la sensibilidad de la técnica de inmunoblot es superior a la IFI.
En 4 de los 5 pacientes (80 %) en los que determinamos la presencia de autoanticuerpos frente al fragmento BP180 4575, se observó positividad para IgG o IgA, lo que demuestra una inmunorreactividad alta en nuestros pacientes para este fragmento del BP180. En algunos estudios solamente estos autoanticuerpos se han detectado en el 32 % de los casos con PM 21. Sólo encontramos un paciente en el que la determinación de anticuerpos frente a LAD-1 y NC16A fueron negativos (paciente 4) (tabla 1), pero que presentaba anticuerpos IgG frente a la región C-terminal (fragmento BP180 4575) del BP180. En el paciente 5 no se encontraron anticuerpos frente a este fragmento, pero en cambio observamos una positividad para BP180 LAD-1. Estos hallazgos demuestran la inmunorreactividad tan distinta que existe frente al BP180 en la patogenia del PM.
Recientemente, Setterfield et al 23, demostraron que aquellos pacientes con PM que presentaban IFI positiva mediante la técnica de salt-split, tanto para IgG como para IgA, tenían un curso clínico peor que cuando solamente uno de los dos autoanticuerpos era positivo. Esta situación únicamente se encontró en un paciente (paciente 5) y su evolución no ha sido peor que la del resto de los pacientes. Por lo tanto, se necesitan más casos para confirmar esta observación.
En resumen, se piensa que la realización de técnicas de biología molecular es de gran ayuda en aquellos pacientes en los que, a pesar de presentar lesiones clínicas características, los estudios histológicos o de inmunofluorescencia no muestran los resultados esperados. Esta información será fundamental antes de establecer tratamientos inmunosupresores sistémicos en una enfermedad que puede producir morbilidad importante en los pacientes.