La nueva guía europea sobre dermatitis atópica (DA) ha sido recientemente publicada, cubriendo la principal revolución de este campo: los nuevos fármacos sistémicos. En la edad adulta baricitinib, ciclosporina, dupilumab, upadacitinib y tralokinumab son los fármacos con grado de recomendación fuerte, mientras que en la infancia y la adolescencia quedan limitados a ciclosporina, dupilumab y upadacitinib. La pregunta principal por esclarecer es: ¿podemos seleccionar un fármaco específico según las características del paciente?
La DA es una enfermedad compleja con amplia heterogeneidad respecto a fenotipos clínicos, edad, origen étnico y gravedad. En su origen participan una respuesta inmune desregulada, una barrera cutánea alterada y una disbiosis con sobrecrecimiento de Staphylococcus aureus. Si bien, en un primer momento se pensó que era una enfermedad ocasionada únicamente por la vía inmunológica Th2, se ha descubierto que existen otras vías involucradas como la Th1, Th17 o Th22, con distinta importancia según el momento de la enfermedad, grupo de edad y etnia1,2.
Este amplio espectro fenotípico e inmunológico ha llevado a la búsqueda de biomarcadores que nos permitan determinar de manera objetiva el cribado, diagnóstico, pronóstico, monitorización de la gravedad de la DA y comorbilidades asociadas a esta. No obstante, la definición de biomarcador no está uniformemente aceptada. La Agencia Europea del Medicamento lo define como «una molécula detectable en sangre, fluidos o tejidos corporales que permite monitorizar un proceso corporal o patológico». Su equivalente americano, la Food and Drug Administration, amplía este concepto a «toda característica medible que actúa como indicador de un proceso biológico normal, un proceso patológico o respuesta a una exposición o intervención, incluidas las intervenciones terapéuticas». Así, se incluyen no solo a las moléculas, sino también los datos histológicos o radiográficos y las características fisiológicas3–5.
Uno de los biomarcadores que más se ha estudiado en DA son las mutaciones en el gen de la filagrina. Este gen codifica proteínas esenciales para el correcto funcionamiento de la barrera cutánea y se ha propuesto como biomarcador de cribado y predictor de formas graves y precoces de la enfermedad y de posible riesgo aumentado de desarrollar asma en conjunción con las alteraciones inmunológicas3–5. Otros autores, basándose en la variedad de moléculas involucradas en el origen de la DA, han propuesto clasificar a los pacientes en grupos moleculares, los llamados endotipos, para poder seleccionar las terapias dirigidas frente a las leucinas y quimiocinas alteradas en esos grupos de pacientes e incrementar la ratio de eficacia terapéutica1,2.
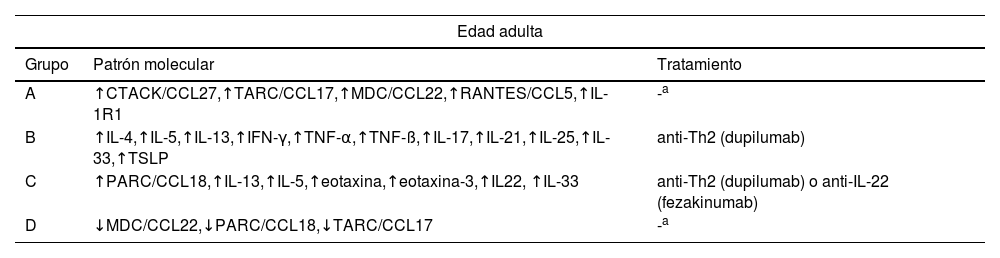
En esta línea Daphne et al.1 clasificaron a 146 pacientes en 4 grupos, en función de 143 biomarcadores séricos: grupo A «quimiocinas de fijación cutánea/IL-1R1 dominante», grupo B «Th1/Th2/Th17 dominante», grupo C «Th2/Th22/PARC dominante» y grupo D «Th2/eosinófilo inferior». Clínicamente, la gravedad era significativamente superior en el grupo C, pero no se detectaron diferencias relevantes en edad, sexo, edad de inicio, comorbilidades atópicas u hospitalizaciones. Los grupos B y C probablemente responderían mejor a dupilumab, pudiéndose beneficiar el grupo C de fármacos anti-IL-22. En el momento en el que se realizó el estudio, y con los fármacos disponibles, los autores no pudieron realizar una sugerencia terapéutica para los grupos A y D.
El estudio previo fue replicado con una cohorte de 240 niños de 0 a 17 años, resultando en 4 grupos: grupo 1 «Th2/retinol dominante», grupo 2 «fijación cutánea dominante», grupo 3 «Th1/Th2/Th17/IL-1–dominante» y grupo 4 «Th1/IL-1/eosinófilo inferior». Solo el grupo 3 tenía su correspondiente en la edad adulta, con el grupo B (tabla 1). Clínicamente, los grupos no se diferenciaban por la edad, pero el grupo 1 presentaba más varones y el 2 tenía significativamente mayor gravedad y pacientes con alergia alimentaria. Se sugiere que el grupo 1 y 3 tendrían una mayor respuesta a fármacos anti-Th2, mientras que, en el momento de realización del estudio, no se pudieron realizar sugerencias terapéuticas para los grupos 2 y 42.
Endotipos descritos en adultos y niños-adolescentes y tratamiento sugerido
| Edad adulta | ||
|---|---|---|
| Grupo | Patrón molecular | Tratamiento |
| A | ↑CTACK/CCL27,↑TARC/CCL17,↑MDC/CCL22,↑RANTES/CCL5,↑IL-1R1 | -a |
| B | ↑IL-4,↑IL-5,↑IL-13,↑IFN-γ,↑TNF-α,↑TNF-ß,↑IL-17,↑IL-21,↑IL-25,↑IL-33,↑TSLP | anti-Th2 (dupilumab) |
| C | ↑PARC/CCL18,↑IL-13,↑IL-5,↑eotaxina,↑eotaxina-3,↑IL22, ↑IL-33 | anti-Th2 (dupilumab) o anti-IL-22 (fezakinumab) |
| D | ↓MDC/CCL22,↓PARC/CCL18,↓TARC/CCL17 | -a |
| Infancia-adolescencia | ||
|---|---|---|
| Grupo | Patrón molecular | Tratamiento |
| 1 | ↑RBP4,↑IL-4,↑IL-5,↑IL-13,↑TSLP,↑IL-23,↑IL-26 | anti-Th2 (dupilumab) |
| 2 | ↑Apelina,↑PARC/CCL18,↑TARC/CCL17,↑CTACK/CCL27,↓adiponectina, ↓MMP-8,↓TIMP1 | -a |
| 3 | ↑IL-2,↑IL-12,↑IFN-α,↑IFN-γ,↑TNF-α,↑TNF-ß,↑MIG/CXCL9, ↑ITAC/CXCL11,↑IL-4,↑IL-5,↑IL-13,↑eotaxina3/CCL26,↑TSLP, ↑MCP-4/CCL13,↑IL-23,↑IL26,↑MIP3a/CCL20,↑GM-CSF,↑IL-1a, ↑IL-1Ra,↑IL-1R1,↑IL-18BPa,↑IL-37,↑TNFR1,↑TNFR2, ↑TWEAK/TNFSF12,↑LIGHT/TNFSF14,↑sIL2Ra | anti-Th2 (dupilumab) |
| 4 | ↑RANTES/CCL5,↑PF4/CXCL4,↑marcador soluble de activación monocitarioCD14,↓MIG/CXCL9,↓ITAC/CXCL11,↓MIP1b/CCL2, ↓eotaxina-1/CCL11,↓eotaxina-3/CCL26,↓IL-1R1,↓IL-18BPa,↓TNFR1, ↓TNFR2,↓TWEAK/TNFSF12,↓elastasa,↓GCP2,↓sIL2Ra,↓CTACK | -a |
C-C motif MCP-4/CCL13: proteína quimioatrayente de monocitos/quimiocina ligando 13; C-C motif MDC/CCL22: quimiocina derivada de macrófagos/quimiocina ligando 22; C-C motif PARC/CCL18: quimiocina pulmonar y de activación regulada/quimiocina ligando18; C-C motif TARC/CCL17: timo y quimiocina relacionada con la activación/quimiocina ligando 17; CTACK/CCL27: quimiocina (C-C motif) ligando 27; CTACK: células T cutáneas que atraen la quimiocina; C-X-C motif ITAC/CXCL11: células T α inducibles por IFN, un quimioatrayente/quimiocina (C-X-C motif) ligando 11; C-X-C motif MIG/CXCL9: monoquina inducida por γ interferón/quimiocina ligando 9; GM-CSF: factor estimulante de colonias de granulocitos y monocitos; LIGHT/TNSF14: miembro 14 de la superfamilia del factor de necrosis tumoral; MIP: proteínas inflamatorias de macrófagos; MMP: metaloproteinasas de la matriz; PF C-C motif RANTES/CCL5: factor plaquetario regulado tras la activación de las células T normales, comprimidas y secretadas/quimiocina ligando 5; RBP: proteína transportadora de retinol; sIL2RA: receptor alfa soluble de interleucina 2 de ratón; TIMP: inhibidores tisulares de la metaloproteinasa; TSLP: linfopoyetina estromal tímica; TWEAK/TNSF12: inductor débil de apoptosis similar al factor de necrosis tumoral/miembro 12 de la superfamilia del factor de necrosis tumoral.
En el momento de realización del estudio, y con las terapias disponibles, no se realizaron sugerencias terapéutica para los grupos A y D de la edad adulta y 2 y 4 de la edad pediátrica.Datos extraídos de Bakker et al.1,2.
Adicionalmente, algunos ensayos clínicos han detectado biomarcadores predictivos aislados. El ensayo con fezakinumab reveló que la mayor expresión de IL-22 en biopsias cutáneas correlacionaba con una mayor reducción de índices de gravedad6. De igual forma, el ensayo con tralokinumab mostró que la mejor respuesta se asociaba a niveles acrecentados de DPP-4 y periostina séricos7.
Los biomarcadores podrían mejorar el cribado, diagnóstico, pronóstico, monitorización de la gravedad de la DA y predicción de comorbilidades asociadas, con el consecuente abordaje precoz y reducción de la morbimortalidad. Sin embargo, ninguno de estos está validado o se usa en la práctica diaria, así que son necesarios estudios de alta calidad para identificar biomarcadores clínicamente relevantes, precisos y coste-efectivos, preferiblemente obtenidos por métodos no invasivos como cinta adhesiva, sangre, suero o saliva3–5.
La guía actual sigue un único modelo, sin tener en cuenta la singularidad de cada paciente. Su contrapartida es la medicina de precisión, que aboga por tratamientos seleccionados en función de biomarcadores. Los autores mencionados han podido identificar qué grupos de pacientes responderían presumiblemente mejor a los anti-Th2 y anti-IL22; quizás en el futuro se desarrollen fármacos que actúen frente a las rutas alteradas en el resto de grupos. Debido a los limitados recursos del sistema sanitario y al alto precio de los biológicos e inhibidores JAK disponibles, esta estrategia podría evitar el empleo de fármacos inadecuados en relación con las rutas alteradas.