Sr. Director:
El cetuximab (C225) es un anticuerpo contra el receptor del factor de crecimiento epidérmico (EGFR) que bloquea la proliferación celular1. El efecto adverso más frecuente es la erupción acneiforme folicular.
Presentamos el caso de un varón de 69 años con antecedentes personales de hipertensión arterial y diabetes mellitus tipo 2. En julio de 2004 fue diagnosticado de un adenocarcinoma de sigma practicándose una resección local. Se realizó estudio de extensión evidenciándose en la tomografía axial computadorizada (TAC) toracoabdominal adenopatías retroperitoneales, por lo que se inició tratamiento con cetuximab.
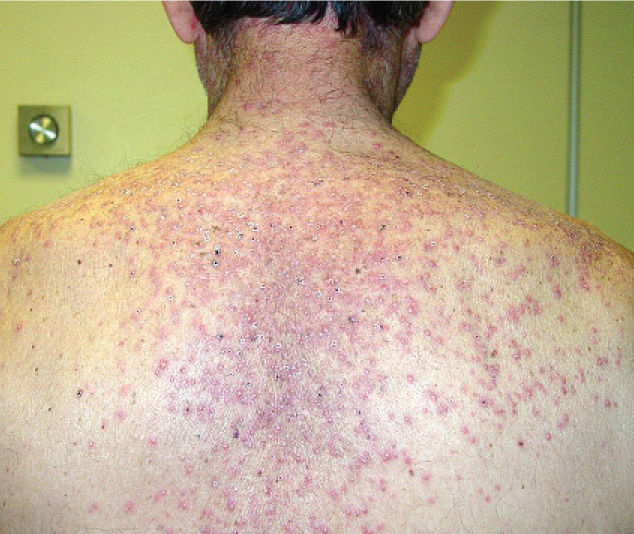
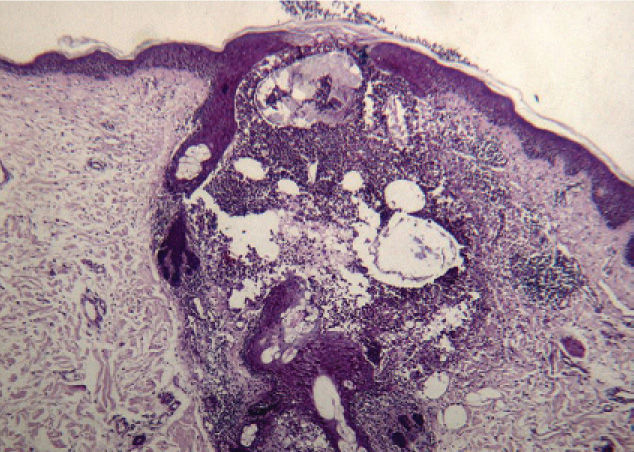
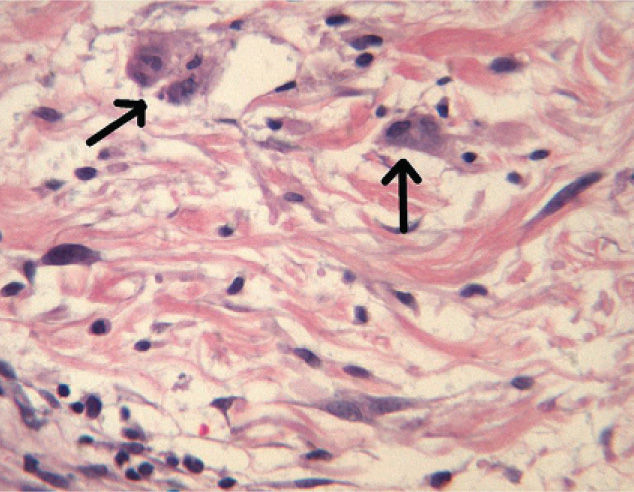
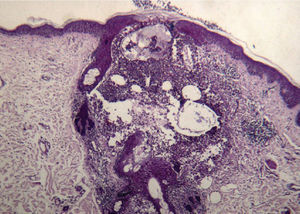
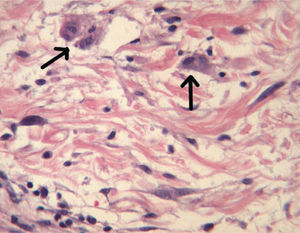
Una semana después del segundo ciclo de cetuximab el paciente acudió por una erupción de aparición brusca monomorfa de papulopústulas eritematosas y de distribución folicular que predominaba en la cara, el cuero cabelludo y la espalda (fig. 1). El estudio histopatológico mostraba una destrucción folicular con un infiltrado de predominio neutrofílico, de aspecto similar a una foliculitis supurada aguda, sin evidencia de bacterias ni hongos en la tinción con ácido periódico de Schiff (PAS) (fig. 2). Al estudiar la dermis se apreciaba edema y un infiltrado inflamatorio perivascular e intersticial compuesto por linfocitos, células plasmáticas, aislados eosinófilos y células grandes de citoplasma grisáceo, con pleomorfismo, binucleación, nucleolos prominentes, hipercromáticos y presencia de mitosis aisladas (fig. 3). El estudio inmunohistoquímico para estas células fue positivo para CD-68 y lisozima, y negativo para PAS y mieloperoxidasa, confirmando su naturaleza histiocitoide. Se orientó como una erupción acneiforme secundaria a cetuximab y la erupción mejoró con peróxido de benzoilo tópico y minociclina oral.
El cetuximab es un anticuerpo monoclonal quimérico que bloquea el EGFR2. La actividad antitumoral del cetuximab se basa en su capacidad para inhibir la proliferación celular, la angiogénesis y la formación de metástasis a distancia, así como promover la apoptosis celular. Se ha utilizado sobre todo en cánceres sólidos en estadios avanzados3 en los que se ha visto que sus células expresan EGFR4.
Estos quimioterápicos no asocian sintomatología sistémica, pero en múltiples publicaciones recientes se describen sus efectos secundarios cutáneos. Aunque se desconoce el mecanismo, distintos estudios sugieren un papel central del EGFR en la fisiología folicular. Estos inhibidores del EGFR causan un fallo en la transición de la fase anágena a la catágena del ciclo folicular2,5, además de una dilatación infundibular, hiperqueratosis y tapones córneos, que favorece la alteración de la flora local, aumentando de este modo la patogenicidad de microorganismos no patógenos6. A pesar de esto se han realizado cultivos microbianos y fúngicos de las pústulas resultando negativos en todas las publicaciones3. Otros autores han propuesto un efecto directo del cetuximab sobre el sistema inmunitario con una producción descontrolada de citocinas y quimiotaxis de neutrófilos4.
Aproximadamente un tercio de los pacientes tratados con cetuximab presentan entre 2 y 6 semanas después del inicio del tratamiento una erupción acneiforme que no ha demostrado tener ninguna relación con el tipo de tumor, fototipo cutáneo, sexo, ni antecedentes de acné o rosácea5.
Los efectos secundarios cutáneos son dosis dependientes y reversibles. La suspensión del tratamiento oncológico no suele ser necesaria5. Inicialmente se postuló que la respuesta tumoral mejoraba cuanto mayor era la toxicidad cutánea, pero esto no se ha confirmado en un estudio recientemente publicado6.
En el estudio histopatológico se aprecian diferentes grados de foliculitis, desde una dilatación infundibular hasta la destrucción de folículos pilosos, como consecuencia de un denso infiltrado de polimorfonucleares de predominio neutrofílico en la parte más superficial, mientras que en las partes más profundas existe un infiltrado de predominio linfocitario e histiocitario4.
En nuestro caso el estudio histopatológico mostraba una foliculitis neutrofílica supurativa con unas células histiocitoides grandes y grisáceas con pleomorfismo, binucleación, nucleolos prominentes y mitosis aisladas. En el estudio inmunohistoquímico dichas células fueron positivas para CD-68 y lisozima, y negativas para PAS y mieloperoxidasa. Probablemente estas células son histiocitos atípicos que no habían sido descritos hasta el momento en este tipo de reacciones cutáneas secundarias a los inhibidores del EGFR.
Estos histiocitos atípicos se han observado y se consideran diagnósticos en las erupciones cutáneas agudas que aparecen después de administrar factores de estimulación de colonias granulocíticas (FSC-G) y de mastocitos (FSC-GM)7,8. Otros autores, en cambio, han observado estas células en pacientes que han recibido una quimioterapia agresiva, pero sin recibir ningún tipo de FSC9. También se ha sugerido que estos hallazgos podrían ser específicos de la implicación de la piel en las leucemias10, considerando estas células proliferaciones de la leucemia en la piel. Nuestro enfermo no había sido tratado con FSC-G ni FSC-GM ni se demostró ninguna neoplasia hematológica. Tras un año de seguimiento el paciente presenta una metástasis hepática sin evidencia de otras complicaciones.
Hemos mostrado el caso de un paciente con un tumor sólido, en tratamiento con un inhibidor del EGFR, en el que se observan unos histiocitos atípicos infiltrando la dermis. Probablemente existan algunos mecanismos de los inhibidores de los EGFR que aún desconocemos y que podrían ser los responsables de estas células pseudomalignas.