Los agentes biológicos en el tratamiento de la psoriasis son más caros y, en general, de eficacia similar o superior que la terapia clásica. Sin embargo, se desconoce su eficiencia en términos de coste/ eficacia (coste por cada paciente que responde en las condiciones de los ensayos clínicos).
ObjetivoEstimar los cocientes de coste/eficacia de adalimumab, etanercept, infliximab y efalizumab en el manejo de la psoriasis moderada-grave.
Material y métodosModelo de evaluación económica, construyendo un árbol de decisión para cada uno de los tratamientos sobre los que existe evidencia científica. Se ha usado la perspectiva del financiador (Sistema Nacional de Salud), considerando sólo los costes del fármaco. La eficacia (proporción de pacientes que responden con el criterio PASI-75) asignada es la que consta en los ensayos clínicos. Cuando había más de un ensayo para cada tratamiento se han realizado metanálisis. Cuando la dosis depende del peso, este último en los sujetos del estudio se ha estandarizado por edad y sexo a la población española, corregido por el incremento de peso de los sujetos con psoriasis. La incertidumbre se ha manejado mediante análisis de sensibilidad.
Resultados y ConclusionesAsignando en los modelos la eficacia de los 15 ensayos clínicos publicados, el agente biológico más eficiente en términos de coste/eficacia es adalimumab, con el que se consigue un respondedor PASI-75 a un coste de 8.013 euros. Con el resto de los biológicos y con diferentes pautas el coste/respondedor osciló entre 9.370 € y 17.112 €. El análisis de sensibilidad confirma la robustez de estos hallazgos.
In the treatment of psoriasis, biologic agents are more expensive than conventional therapy while showing similar or superior efficacy. However, their efficiency in terms of cost/efficacy (cost per responder in clinical trial conditions) is unknown.
ObjectiveTo estimate the cost/efficacy ratios of adalimumab, etanercept, infliximab, and efalizumab in the management of moderate to severe psoriasis.
Material and MethodsA model for the costs analysis was elaborated by building a decision tree for each of the treatments for which scientific evidence was available. The payer perspective (Spanish national health system) was used, only considering drug costs. The efficacy (proportion of patients who respond according to Psoriasis Area Severity Index [PASI] 75 criterion) was assigned according to the results of the clinical trials. When more than 1 trial was available per treatment, a meta-analysis was undertaken. In the case of weight-dependent dosing, the weight of the study participants was adjusted by age and sex to the standard Spanish population with correction for increased weight in individuals with psoriasis. Uncertainty was investigated with a sensitivity analysis.
Results and ConclusionsAssigning the efficacy reported in the 15 published clinical trials, the most efficient biologic agent in terms of the cost/efficacy ratio was adalimumab, with one PASI 75 response at a cost of €8,013. For the remaining biologic agents and with different regimens, the cost per responder ranged from €9,370 to €17,112. The sensitivity analysis confirmed the robustness of these figures.
La psoriasis es una enfermedad cutánea de carácter inflamatorio, generalmente de curso crónico y recidivante y de etiología desconocida. Su diagnóstico es fundamentalmente clínico y se basa en la identificación de placas eritematosas con escamas nacaradas y bordes bien definidos. Suele evolucionar con remisiones y recaídas espontáneas, y puede persistir toda la vida o durar sólo unos meses. Se estima que su prevalencia en la raza blanca es del 1,5 al 3 % de la población. Afecta a ambos sexos, puede aparecer en cualquier edad, pero es rara en menores de 5 años. Se estima que 125 millones de personas padecen psoriasis en todo el mundo1. En España la prevalencia es del 1,4 %2. Entre el 5-7 % de los pacientes con psoriasis, y aproximadamente el 40 % de los que tienen enfermedad cutánea extensa, desarrollan artritis psoriásica3. El instrumento de medida más usado para evaluar la psoriasis en los ensayos clínicos es el Psoriasis Area Severity Index (PASI). La European Medicines Agency (EMEA) reconoce la respuesta PASI-75 (mejoría del 75 % del PASI basal) como indicador en los ensayos clínicos de que la psoriasis grave ha respondido al tratamiento4.
Dependiendo de la gravedad de la enfermedad se puede aplicar fototerapia, tratamientos tópicos o sistémicos. Entre los tratamientos sistémicos clásicos se utiliza metotrexato, acitretino y ciclosporina A. Sin embargo, en los últimos años se han desarrollado nuevos agentes biológicos en el manejo de la psoriasis3,5-8. Las terapias biológicas para la psoriasis se clasifican en dos grupos:
- 1.
Agentes que se dirigen al factor de necrosis tumoral alfa (TNFa), por ejemplo etanercept, infliximab y adalimumab.
- 2.
Agentes que interfieren específicamente la activación o funciones de las células T, por ejemplo efalizumab y alefacept.
Los agentes biológicos son más caros y, en general, de eficacia similar o superior a la terapia convencional8,9. Sin embargo, se desconoce su eficiencia en términos de coste/ eficacia (coste por cada paciente que responde). Por estas razones se ha diseñado el presente proyecto, cuyo propósito general es producir conocimiento sobre la eficiencia de los agentes biológicos en el tratamiento de la psoriasis. El objetivo concreto es calcular la ratio de coste/eficacia de las terapias con agentes biológicos (adalimumab, etanercept, infliximab y efalizumab) en pacientes con psoriasis moderada-grave.
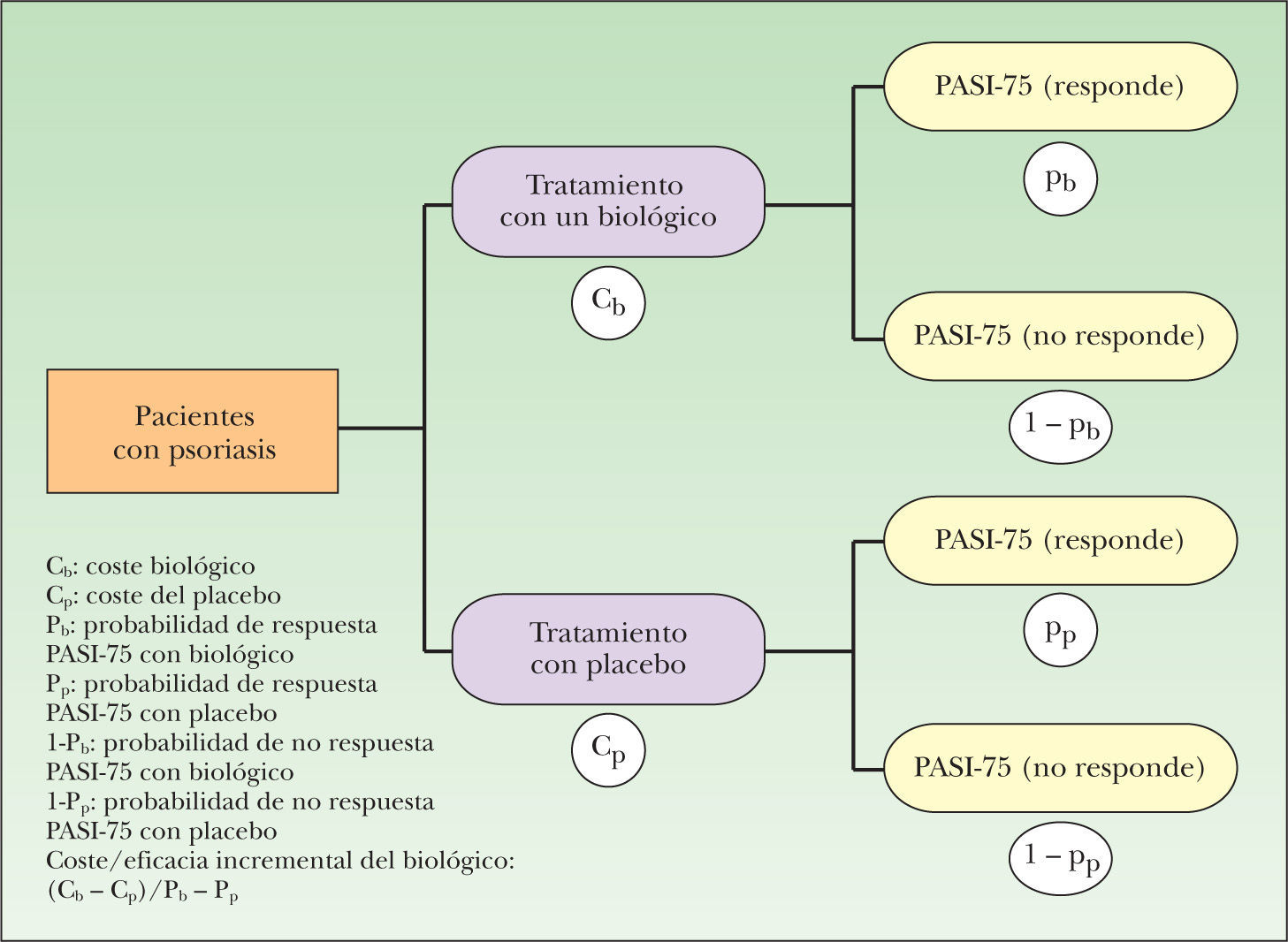
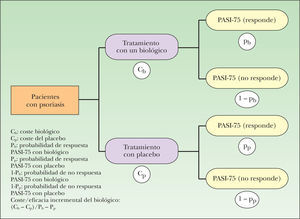
MetodologíaDiseñoEstudio de evaluación económica de la eficiencia (coste/eficacia) de los agentes biológicos mediante la construcción de árboles de decisión deterministas con análisis de sensibilidad. Para ello se han construido árboles de decisión que permiten calcular los costes directos, eficacia (tasa de respondedores con criterio de PASI-75) y la eficiencia (coste/eficacia) de cada uno de los tratamientos (en función de la dosis y duración) de los 4 agentes biológicos que se han comparado (adalimumab, etanercept, infliximab y efalizumab). Para construir cada árbol de decisión se ha partido de los ensayos clínicos en los que se utiliza el tratamiento correspondiente y se ha reproducido su estructura frente a placebo. El modelo simplificado tiene dos ramas: una corresponde al tratamiento con el biológico correspondiente y la otra al tratamiento con placebo (fig. 1). La perspectiva del análisis es la del financiador: Sistema Nacional de Salud (SNS). En consecuencia, se han tenido en cuenta sólo los costes directos. Como tales se han considerado los costes que los agentes biológicos representan para el SNS. El horizonte temporal del modelo es el de la duración de los ensayos clínicos en los que se ha basado cada comparación9-23. No es necesario realizar un ajuste temporal mediante una tasa de descuento de los costes y resultados futuros, dado que los costes y la eficacia se producen como máximo en 24 semanas.
Síntesis de la evidencia científica sobre la eficaciaPara poder asignar en los modelos los estimadores de eficacia se realizó una búsqueda de la evidencia científica en las bases de datos Medline, Embase, Biblioteca Cochrane (Registro de ensayos clínicos) e IME (Indice Médico Español). Los términos usados en la búsqueda fueron: psoriasis, psoria*, clinical trial, randomized trial, controlled trial, ensayo clínico, ensayo aleatorio, ensayo aleatori* y ensayo controlado. Los fármacos fueron definidos en la búsqueda con los siguientes términos: adalimumab, Humira, efalizumab, Raptiva, etanercept, Enbrel, infliximab, Remicade. Se acotó la búsqueda a documentos publicados en inglés o español, desde cualquier fecha hasta marzo de 2008. Después de localizar las referencias bibliográficas se eliminaron las repetidas. Se obtuvieron los resúmenes de las referencias seleccionadas, y fueron leídos de forma independiente por dos investigadores (AJB, PL), quienes decidieron si tras su lectura no se solicitaba el artículo por no superar los criterios de inclusión, o si no podía ser excluido, en cuyo caso se solicitaba el trabajo. Los artículos fueron leídos de forma independiente por dos investigadores (AJB, PL), quienes decidieron si el artículo en texto completo cumplía los criterios de inclusión, en cuyo caso se incorporó al análisis. Los criterios aplicados para incluir un estudio en el análisis fueron:
- 1.
Tratarse de un artículo original.
- 2.
Que el diseño del estudio correspondiera a un ensayo clínico aleatorio controlado.
- 3.
Que se mencionase explícitamente la definición clínica de psoriasis moderada-grave.
- 4.
Que al menos uno de los tratamientos en el ensayo clínico fuera uno de los fármacos de interés (adalimumab, efalizumab, etanercept o infliximab).
- 5.
Que al menos uno de los comparadores fuera placebo.
- 6.
Que como mínimo una de las variables de respuesta fuese el PASI-75.
- 7.
El tamaño muestral podía ser cualquiera, así como la pauta de tratamiento y el periodo de seguimiento.
A cada rama del árbol de decisión se asignó la eficacia de la estrategia del correspondiente tratamiento y del placebo. La medida de eficacia fue la probabilidad de obtener respuesta con el criterio PASI-75, según la evidencia científica publicada en los ensayos clínicos considerados en este estudio9-23. Como estimador de la eficacia del biológico frente a placebo se ha considerado la eficacia incremental, es decir, la ganancia en la proporción de pacientes en los que el biológico consigue respuesta al tratamiento con el criterio PASI-75 respecto al placebo, representada en la figura 1 como Pb-Pp. Expresado en términos de epidemiología clínica, la eficacia incremental es la reducción absoluta del riesgo de no obtener respuesta PASI-75.
Cuando sólo se disponía de un ensayo clínico la eficacia incremental y sus intervalos de confianza fueron calculados como diferencia de proporciones entre la eficacia del biológico y la del placebo por el método de Fleiss24, y si hemos tenido más de un ensayo clínico se ha realizado un metanálisis, calculando la reducción absoluta del riesgo (eficacia incremental) y sus intervalos de confianza, asumiendo un modelo de efectos aleatorios y, en consecuencia, aplicando el método de DerSimonian-Laird25. La heterogeneidad de los ensayos clínicos ha sido medida con el indicador I2. El valor del I2 oscila entre 0 y 100 %, y describe el grado de inconsistencia entre los ensayos incluidos en el metanálisis. Aunque no hay una categorización de los valores recomendados del I2, en general se acepta que la heterogeneidad es baja, moderada, o alta, para I2 del 25, 50 y 75 %, respectivamente26.
Como medida adicional de la eficacia se ha calculado el número necesario de pacientes a tratar (NNT) para conseguir un respondedor PASI-75. El NNT y sus intervalos de confianza se han calculado como el inverso de la reducción absoluta del riesgo, esto es, como el inverso de la eficacia incremental.
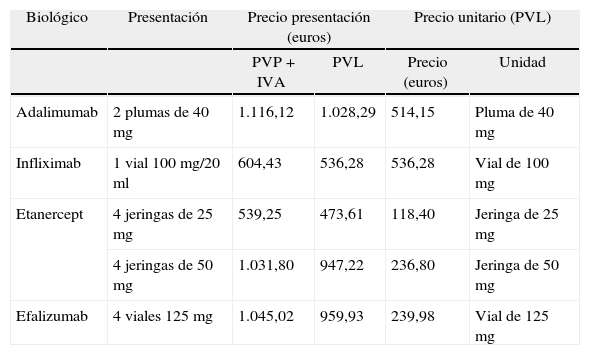
Asignación de los costes de los tratamientosSe han considerado sólo los costes diferenciales, que son los de los fármacos biológicos a precio de venta de laboratorio (PVL). Se asume que el resto de costes son idénticos con cada uno de los biológicos. Para calcular el coste de cada tratamiento se ha considerado la dosis que recibió cada paciente según el ensayo clínico en que se basa el análisis. Ésta se ha multiplicado por el PVL de la dosis de cada medicamento. Para calcular el PVL se partió del precio de venta al público (PVP) de cada fármaco, según la base de datos del medicamento que administra la Organización Farmacéutica Colegial y que ofrece en su página web27. Para pasar el coste según PVP + IVA al PVL se han utilizado los factores de conversión establecidos por la Dirección General de Farmacia y Productos Sanitarios28. Un resumen de los costes de los agentes biológicos se muestra en la tabla 1. Cuando el fármaco se presenta en viales de una determinada cantidad se ha calculado el número requerido de éstos a partir de los miligramos necesarios, asignando al residuo el coste de un vial completo. Por ejemplo, si un paciente necesita 347 mg de un fármaco cuya presentación es en viales de 100 mg, se ha asignado el coste de 4 viales de 100 mg.
Costes de los agentes biológicos (España, 2008)
| Biológico | Presentación | Precio presentación (euros) | Precio unitario (PVL) | ||
| PVP + IVA | PVL | Precio (euros) | Unidad | ||
| Adalimumab | 2 plumas de 40 mg | 1.116,12 | 1.028,29 | 514,15 | Pluma de 40 mg |
| Infliximab | 1 vial 100 mg/20 ml | 604,43 | 536,28 | 536,28 | Vial de 100 mg |
| Etanercept | 4 jeringas de 25 mg | 539,25 | 473,61 | 118,40 | Jeringa de 25 mg |
| 4 jeringas de 50 mg | 1.031,80 | 947,22 | 236,80 | Jeringa de 50 mg | |
| Efalizumab | 4 viales 125 mg | 1.045,02 | 959,93 | 239,98 | Vial de 125 mg |
PVL: precio de venta de laboratorio; PVP: precio de venta al público.
En el caso de los biológicos cuya dosis depende del peso (infliximab y efalizumab) se ha calculado el coste de la dosis según el peso de los pacientes. Como no todos los estudios ofrecen cifras del peso de los pacientes, y para que el análisis tenga validez para España, se ha calculado el peso de los pacientes del estudio si fueran españoles, aplicando el peso de los adultos españoles29 estandarizado por edad y sexo, según la edad y proporción de hombres y mujeres del estudio. Este peso estandarizado se ha incrementado en la proporción en la que el peso de los pacientes con psoriasis es mayor que el de la población general de su misma edad y sexo. Para calcular la diferencia de peso entre los pacientes con psoriasis y la población general se ha utilizado la diferencia encontrada en el índice de masa corporal (IMC) en el estudio de Herron et al 30. Este estudio ofrece información sobre el IMC, pero no del peso, por lo que se ha estandarizado el IMC a la población española de la misma edad y sexo y se ha calculado el peso a partir del IMC correspondiente a la estatura de la población española según estas dos variables29.
Cálculo del cociente de coste/eficacia incrementa!Para calcular la eficiencia de cada agente biológico con respecto al placebo se ha calculado la ratio de coste/eficacia incremental. Para ello se ha efectuado el cálculo de un cociente en el que el numerador es la diferencia de costes entre los tratamientos comparados (biológico y placebo) y el denominador es la eficacia incremental. En la figura 1 está representado por la fórmula: (Cb – Cp)/(Pb – Pp).
Análisis de sensibilidadEn el modelo de evaluación económica subyace cierto grado de incertidumbre procedente de los estimadores de eficacia y de costes, y de las asunciones del modelo. El efecto que esta incertidumbre tiene sobre la eficiencia ha sido evaluado mediante un análisis de sensibilidad. Dicho análisis se ha realizado construyendo tres escenarios: basal, más favorable y menos favorable para cada tratamiento. En el escenario basal las ratios de eficiencia se han calculado como una ratio en la que el numerador es el estimador central del coste incremental del biológico y el denominador es el estimador central de la eficacia incremental. En el escenario más favorable para cada tratamiento las ratios de eficiencia se han calculado como un cociente, en el que el numerador es el estimado más favorable del coste incremental y el denominador es el estimado más favorable de la eficacia incremental del biológico. En el escenario más desfavorable las ratios de eficiencia se han calculado como un cociente en el que el numerador es el estimado más desfavorable del coste incremental y el denominador es el estimado más desfavorable de la eficacia incremental del biológico.
Para calcular el estimado más favorable y más desfavorable del coste incremental se han utilizado diversas aproximaciones, según la información disponible. Cuando no constaba información sobre la dosis y ésta depende del peso (infliximab y efalizumab), se ha aplicado el peso medio de la población española estandarizada a la edad y sexo de los sujetos de estudio, y corregida por el aumento de peso que tienen los pacientes con psoriasis29,30. Los estimados más favorables y desfavorables se han calculado a partir de los intervalos de confianza de la diferencia de peso entre sujetos con psoriasis y sin psoriasis, calculados a partir del estudio de Herron30, ajustados por el peso de la población española 29. Para los costes de los fármacos que se dan a una dosis fija y no hay variabilidad (adalimumab y etanercept) los estimados más favorable, menos favorable y basal coinciden.
Para calcular el estimado más favorable y más desfavorable de la eficacia incremental se han utilizado, respectivamente, los límites superior e inferior del intervalo de confianza al 95 %. Cuando se disponía de un único ensayo clínico fueron calculados como diferencia de proporciones con el método de Fleiss24. Si el tratamiento ha sido utilizado en más de un ensayo clínico, la reducción absoluta de riesgo y sus intervalos de confianza fueron calculados con el método de DerSimonian-Laird, asumiendo un modelo de efectos aleatorios25. El software empleado para el metanálisis ha sido el desarrollado por el grupo CASPe31, y para el modelo de evaluación económica se ha utilizado el programa MS-Excel.
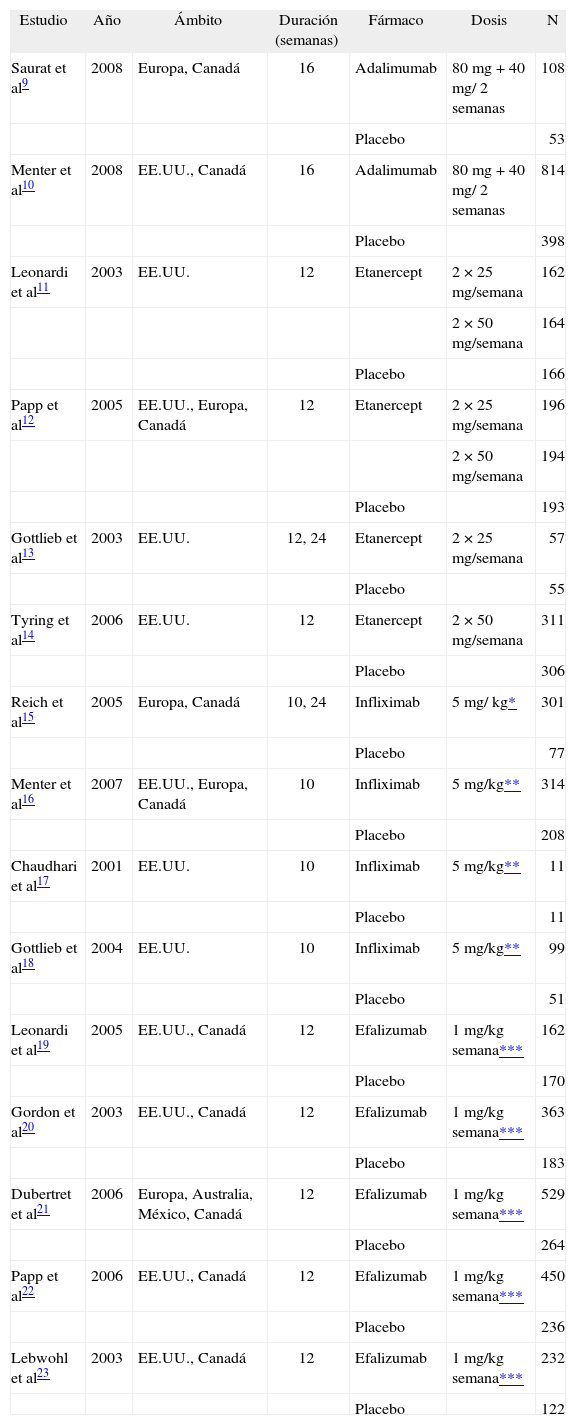
ResultadosLas fuentes de la evidencia científicaEn la búsqueda de la evidencia se identificaron 15 ensayos clínicos sobre la eficacia de los agentes biológicos en el tratamiento de la psoriasis moderada-grave que cumplían los criterios de inclusión9-23. No hubo ningún ensayo publicado en español. La información sobre las pautas, dosis de tratamiento y eficacia de cada uno de los agentes biológicos se ha obtenido de estos 15 ensayos, que fueron realizados en diversos países y han sido publicados entre los años 2001 y 2008. De estos artículos dos se refieren a adalimumab9,10, 4 a etanercept11-14, 4 a infliximab15-18 y 5 a efalizumab 19-23. Varios utilizan diferentes dosis del agente biológico; en este estudio se ha tenido en cuenta únicamente las pautas y dosis recomendadas por la ficha técnica32-35. En algunos de los ensayos el grupo placebo pasó a ser tratado con un biológico en algún momento del seguimiento; en estos casos se ha considerado como duración del tratamiento el tiempo en el que este grupo se ha mantenido sólo con la terapia con placebo. La duración del tratamiento osciló, según los ensayos, entre 10 y 24 semanas.
Un resumen de las características de los artículos incluidos se muestra en la tabla 2.
Evidencia científica utilizada
| Estudio | Año | Ámbito | Duración (semanas) | Fármaco | Dosis | N |
| Saurat et al9 | 2008 | Europa, Canadá | 16 | Adalimumab | 80 mg + 40 mg/ 2 semanas | 108 |
| Placebo | 53 | |||||
| Menter et al10 | 2008 | EE.UU., Canadá | 16 | Adalimumab | 80 mg + 40 mg/ 2 semanas | 814 |
| Placebo | 398 | |||||
| Leonardi et al11 | 2003 | EE.UU. | 12 | Etanercept | 2 × 25 mg/semana | 162 |
| 2 × 50 mg/semana | 164 | |||||
| Placebo | 166 | |||||
| Papp et al12 | 2005 | EE.UU., Europa, Canadá | 12 | Etanercept | 2 × 25 mg/semana | 196 |
| 2 × 50 mg/semana | 194 | |||||
| Placebo | 193 | |||||
| Gottlieb et al13 | 2003 | EE.UU. | 12, 24 | Etanercept | 2 × 25 mg/semana | 57 |
| Placebo | 55 | |||||
| Tyring et al14 | 2006 | EE.UU. | 12 | Etanercept | 2 × 50 mg/semana | 311 |
| Placebo | 306 | |||||
| Reich et al15 | 2005 | Europa, Canadá | 10, 24 | Infliximab | 5 mg/ kg* | 301 |
| Placebo | 77 | |||||
| Menter et al16 | 2007 | EE.UU., Europa, Canadá | 10 | Infliximab | 5 mg/kg** | 314 |
| Placebo | 208 | |||||
| Chaudhari et al17 | 2001 | EE.UU. | 10 | Infliximab | 5 mg/kg** | 11 |
| Placebo | 11 | |||||
| Gottlieb et al18 | 2004 | EE.UU. | 10 | Infliximab | 5 mg/kg** | 99 |
| Placebo | 51 | |||||
| Leonardi et al19 | 2005 | EE.UU., Canadá | 12 | Efalizumab | 1 mg/kg semana*** | 162 |
| Placebo | 170 | |||||
| Gordon et al20 | 2003 | EE.UU., Canadá | 12 | Efalizumab | 1 mg/kg semana*** | 363 |
| Placebo | 183 | |||||
| Dubertret et al21 | 2006 | Europa, Australia, México, Canadá | 12 | Efalizumab | 1 mg/kg semana*** | 529 |
| Placebo | 264 | |||||
| Papp et al22 | 2006 | EE.UU., Canadá | 12 | Efalizumab | 1 mg/kg semana*** | 450 |
| Placebo | 236 | |||||
| Lebwohl et al23 | 2003 | EE.UU., Canadá | 12 | Efalizumab | 1 mg/kg semana*** | 232 |
| Placebo | 122 |
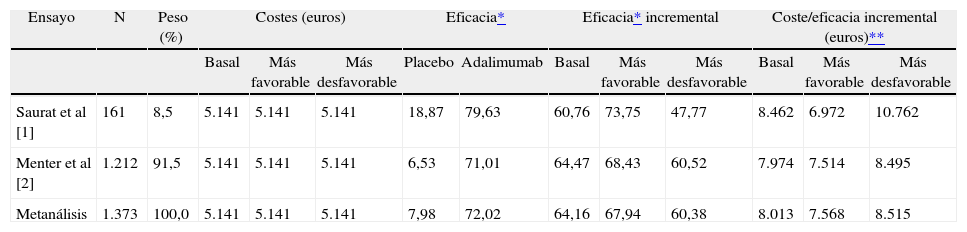
Dos ensayos clínicos publicados comparan la eficacia de adalimumab con placebo a las 16 semanas de tratamiento9,10. Los pacientes tratados con adalimumab recibieron 80 mg subcutáneos en la semana 0, seguido de 40 mg cada dos semanas desde la semana 1 a la 15. Los costes de adalimumab, por paciente, son de 5.141 euros en los tres escenarios (basal, más favorable y más desfavorable). Con el metanálisis realizado con estos dos artículos la eficacia incremental de adalimumab con respecto a placebo es de 64,16 % (60,38 %-67,94 %) (límite inferior del intervalo de confianza al 95 %-límite superior del intervalo de confianza al 95 %). El NNT es 2 (2-2). El I2 es de 0 %, por lo que no hay heterogeneidad entre los artículos incluidos en el metanálisis. La ratio de coste/eficacia incremental en el escenario basal es de 8.013 euros por respondedor PASI-75 ganado, en el escenario más favorable es de 7.568 euros y en el más desfavorable asciende a los 8.515 euros (tabla 3).
Coste/eficacia de adalimumab frente a placebo (16 semanas)
| Ensayo | N | Peso (%) | Costes (euros) | Eficacia* | Eficacia* incremental | Coste/eficacia incremental (euros)** | |||||||
| Basal | Más favorable | Más desfavorable | Placebo | Adalimumab | Basal | Más favorable | Más desfavorable | Basal | Más favorable | Más desfavorable | |||
| Saurat et al [1] | 161 | 8,5 | 5.141 | 5.141 | 5.141 | 18,87 | 79,63 | 60,76 | 73,75 | 47,77 | 8.462 | 6.972 | 10.762 |
| Menter et al [2] | 1.212 | 91,5 | 5.141 | 5.141 | 5.141 | 6,53 | 71,01 | 64,47 | 68,43 | 60,52 | 7.974 | 7.514 | 8.495 |
| Metanálisis | 1.373 | 100,0 | 5.141 | 5.141 | 5.141 | 7,98 | 72,02 | 64,16 | 67,94 | 60,38 | 8.013 | 7.568 | 8.515 |
En los ensayos realizados con etanercept11-14 se han utilizado tres pautas de tratamiento en cuanto a la dosis y la duración: 25 mg dos veces por semana durante 12 semanas11-13; 25 mg dos veces por semana durante 24 semanas 13; y 50 mg dos veces por semana durante 12 semanas11,12,14.
La eficacia de etanercept en pauta de 25 mg dos veces por semana durante 12 semanas ha sido analizada en tres ensayos clínicos11-13, por lo que se ha realizado un metaná- lisis de éstos. Los costes por paciente son 2.842 euros en los tres escenarios (basal, más favorable y más desfavorable). Con el metanálisis realizado con los tres ensayos la eficacia incremental con respecto a placebo es de 30,33 % (25,49 %-35,16 %). El NNT es 4 (4-3). El I2 es de 0 %, por lo que no hay heterogeneidad entre los artículos incluidos en el metanálisis. Dada la eficacia incremental y el coste, la ratio de coste/eficacia incremental es de 9.370 euros en el escenario basal, de 8.082 euros en el más favorable y de 11.147 euros en el más desfavorable (tabla 4).
Coste/eficacia de etanercept frente a placebo
| Pauta: 25 mg 2 veces/semana (12 semanas) | |||||||||||||
| Ensayo | N | Peso (%) | Costes (euros) | Eficacia* | Eficacia incremental* | Coste/eficacia incremental (euros)** | |||||||
| Basal | Más favorable | Más desfavorable | Placebo | Etanercept | Basal | Más favorable | Más desfavorable | Basal | Más favorable | Más desfavorable | |||
| Leonardi et al [3] | 328 | 38,1 | 2.842 | 2.842 | 2.842 | 3,61 | 33,95 | 30,34 | 38,16 | 22,51 | 9.367 | 7.446 | 12.624 |
| Papp et al [4] | 389 | 46,6 | 2.842 | 2.842 | 2.842 | 3,11 | 34,18 | 31,07 | 38,15 | 24,00 | 9.145 | 7.448 | 11.842 |
| Gottlieb et al [5] | 112 | 15,2 | 2.842 | 2.842 | 2.842 | 1,82 | 29,82 | 28,01 | 40,40 | 15,62 | 10.146 | 7.034 | 18.197 |
| Metanálisis | 829 | 100,0 | 2.842 | 2.842 | 2.842 | 3,14 | 33,49 | 30,33 | 35,16 | 25,49 | 9.370 | 8.082 | 11.147 |
| Pauta: 25 mg 2 veces/semana (24 semanas) | |||||||||||||
| Gottlieb et al13 | 112 | na | 5.683 | 5.683 | 5.683 | 5,45 | 56,14 | 50,69 | 64,90 | 36,47 | 11.213 | 8.757 | 15.582 |
| Pauta: 50 mg 2 veces/semana (12 semanas) | |||||||||||||
| Leonardi et al11 | 330 | 24,9 | 5.683 | 5.683 | 5.683 | 3,61 | 49,39 | 45,78 | 53,94 | 37,61 | 12.415 | 10.537 | 15.110 |
| Papp et al12 | 387 | 29,9 | 5.683 | 5.683 | 5.683 | 3,11 | 49,48 | 46,38 | 53,83 | 38,93 | 12.255 | 10.559 | 14.600 |
| Tyring et al [6] | 617 | 45,2 | 5.683 | 5.683 | 5.683 | 4,90 | 47,27 | 42,36 | 48,42 | 36,31 | 13.415 | 11.738 | 15.651 |
| Metanálisis | 1.334 | 100,0 | 5.683 | 5.683 | 5.683 | 4,06 | 48,43 | 44,41 | 48,48 | 40,34 | 12.797 | 11.722 | 14.088 |
La eficacia de etanercept en pauta de 25 mg dos veces por semana durante 24 semanas ha sido analizada en un solo ensayo clínico 13. Los costes son de 5.683 euros por paciente en los tres escenarios (basal, más favorable y más desfavorable). La eficacia incremental con respecto a placebo es de 50,69 % (36,47-64,90 %), NNT = 2 (2-3). Por lo tanto, la ratio de coste/eficacia incremental es de 11.213 euros en el escenario basal, de 8.757 euros en el más favorable y de 15.582 euros en el más desfavorable (tabla 4).
La eficacia de etanercept en pauta de 50 mg dos veces por semana durante 12 semanas ha sido analizada en tres ensayos clínicos11,12,14, por lo que se ha realizado un metanálisis de estos tres. Los costes son de 5.683 euros por paciente en los tres escenarios (basal, más favorable y más desfavorable). Con el metanálisis realizado con estos tres ensayos, la eficacia incremental con respecto a placebo es de 44,41 % (40,34-48,48 %); NNT = 3 (3-3). El I2 es de 0 %, por lo que no hay heterogeneidad entre los artículos incluidos en el metanálisis. Dados estos costes y eficacia incremental, la ratio de coste/eficacia incremental es de 12.797 euros en el escenario basal, de 11.722 euros en el más favorable y de 14.088 euros en el más desfavorable (tabla 4).
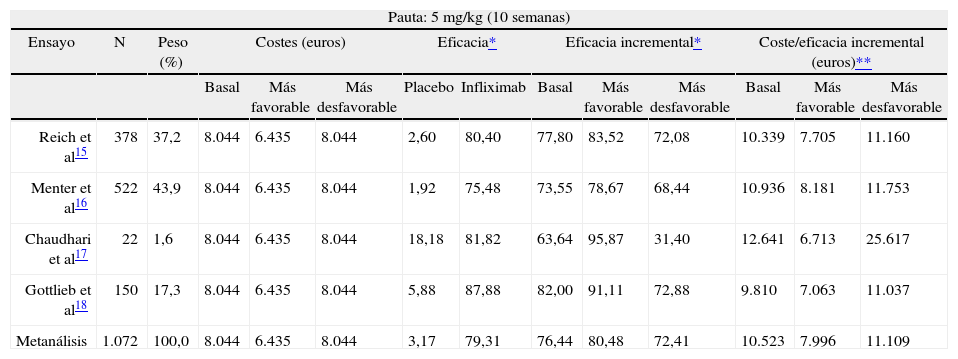
Coste/eficacia de infliximabSe han identificado 4 ensayos clínicos que analizan la eficacia de infliximab 15-18. En éstos la dosis utilizada fue 5 mg/kg y la duración 1015-18 o 24 semanas 15. Cuando el tiempo fue 10 semanas infliximab se administró a los pacientes en las semanas 0, 2 y 6, y cuando fue de 24 semanas se administró en las semanas 0, 2, 6, 14 y 22. Infliximab existe en presentaciones de 100 mg (vial de 20 cc y 100 mg en polvo)34. Por lo tanto, para asignar costes en los ensayos clínicos analizados se ha considerado que el de cada fracción residual de 100 mg es el coste de 100 mg.
La eficacia de infliximab a dosis de 5 mg/kg ha sido analizada en 4 ensayos clínicos15-18 de 10 semanas de duración; por lo tanto se ha realizado un metanálisis con estos 4 ensayos. Los costes son de 8.044 euros por paciente en los escenarios basal y más desfavorable y de 6.435 euros en el más favorable. Con el metanálisis realizado con estos 4 ensayos la eficacia incremental con respecto a placebo es de 76,44 % (72,41-80,48 %). NNT = 2 (2-2). El I2 es de 16 %, indicando una baja heterogeneidad entre los artículos incluidos en el metanálisis. La ratio de coste/eficacia incremental, por tanto, es de 10.523 euros en el escenario basal, de 7.996 euros en el más favorable y de 11.109 euros en el más desfavorable (tabla 5).
Coste/eficacia de infliximab frente a placebo
| Pauta: 5 mg/kg (10 semanas) | |||||||||||||
| Ensayo | N | Peso (%) | Costes (euros) | Eficacia* | Eficacia incremental* | Coste/eficacia incremental (euros)** | |||||||
| Basal | Más favorable | Más desfavorable | Placebo | Infliximab | Basal | Más favorable | Más desfavorable | Basal | Más favorable | Más desfavorable | |||
| Reich et al15 | 378 | 37,2 | 8.044 | 6.435 | 8.044 | 2,60 | 80,40 | 77,80 | 83,52 | 72,08 | 10.339 | 7.705 | 11.160 |
| Menter et al16 | 522 | 43,9 | 8.044 | 6.435 | 8.044 | 1,92 | 75,48 | 73,55 | 78,67 | 68,44 | 10.936 | 8.181 | 11.753 |
| Chaudhari et al17 | 22 | 1,6 | 8.044 | 6.435 | 8.044 | 18,18 | 81,82 | 63,64 | 95,87 | 31,40 | 12.641 | 6.713 | 25.617 |
| Gottlieb et al18 | 150 | 17,3 | 8.044 | 6.435 | 8.044 | 5,88 | 87,88 | 82,00 | 91,11 | 72,88 | 9.810 | 7.063 | 11.037 |
| Metanálisis | 1.072 | 100,0 | 8.044 | 6.435 | 8.044 | 3,17 | 79,31 | 76,44 | 80,48 | 72,41 | 10.523 | 7.996 | 11.109 |
| Pauta: 5 mg/kg (24 semanas) | |||||||||||||
| Reich et al15 | 378 | na | 13.407 | 10.726 | 13.407 | 3,90 | 82,25 | 78,35 | 85,43 | 71,27 | 1 7.11 2 | 12.555 | 18.812 |
La eficacia de infliximab a dosis de 5 mg/kg ha sido analizada en un único ensayo clínico15 de 24 semanas de duración. Los costes por paciente son de 13.407 euros en los escenarios basal y más desfavorable y de 10.726 euros en el escenario más favorable. En este ensayo la eficacia incremental es de 78,35 % (71,27-85,43 %). NNT = 2 (2-2). Por lo tanto, la ratio de coste/eficacia incremental es de 17.112 euros en el escenario basal, de 12.555 euros en el más favorable y de 18.812 euros en el más desfavorable (tabla 5).
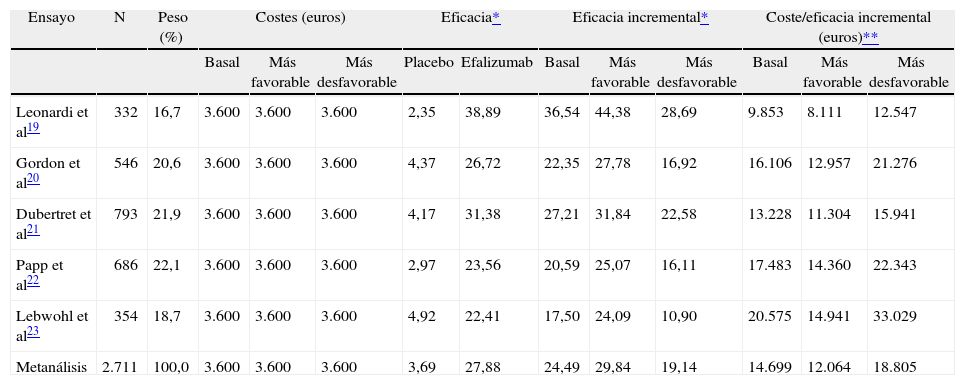
Coste/eficacia de efalizumabSe han identificado 5 ensayos clínicos que analizan la eficacia de efalizumab a las 12 semanas19-23, por lo tanto se ha realizado un metanálisis con éstos. Los pacientes recibieron 0,7 mg/kg en la primera dosis y 1 mg/kg en las siguientes 11 dosis.
Como efalizumab se dispensa en viales de 125 mg, en los ensayos clínicos analizados se ha considerado que el coste de cada fracción residual de 125 mg es el de 125 mg.
Los costes por paciente son de 3.600 euros en los tres escenarios (basal, más favorable y más desfavorable). Con el metanálisis realizado con estos 5 ensayos la eficacia incremental con respecto a placebo es de 24,49 % (19,14-29,84%). NNT = 5 (4-6). El I2 es de 78 %, indicando una alta heterogeneidad entre los artículos incluidos en el metanálisis. Esta alta heterogeneidad es debida en gran medida a la elevada variabilidad en la eficacia encontrada entre los ensayos, que oscila entre el 17,50 %23 y el 36,54 %19 (tabla 6). Por lo tanto, la ratio de coste/eficacia incremental es de 14.699 euros en el escenario basal, de 12.064 euros en el más favorable y de 18.805 euros en el más desfavorable (tabla 6).
Coste/eficacia de efalizumab 1 mg/kg frente a placebo (12 semanas)
| Ensayo | N | Peso (%) | Costes (euros) | Eficacia* | Eficacia incremental* | Coste/eficacia incremental (euros)** | |||||||
| Basal | Más favorable | Más desfavorable | Placebo | Efalizumab | Basal | Más favorable | Más desfavorable | Basal | Más favorable | Más desfavorable | |||
| Leonardi et al19 | 332 | 16,7 | 3.600 | 3.600 | 3.600 | 2,35 | 38,89 | 36,54 | 44,38 | 28,69 | 9.853 | 8.111 | 12.547 |
| Gordon et al20 | 546 | 20,6 | 3.600 | 3.600 | 3.600 | 4,37 | 26,72 | 22,35 | 27,78 | 16,92 | 16.106 | 12.957 | 21.276 |
| Dubertret et al21 | 793 | 21,9 | 3.600 | 3.600 | 3.600 | 4,17 | 31,38 | 27,21 | 31,84 | 22,58 | 13.228 | 11.304 | 15.941 |
| Papp et al22 | 686 | 22,1 | 3.600 | 3.600 | 3.600 | 2,97 | 23,56 | 20,59 | 25,07 | 16,11 | 17.483 | 14.360 | 22.343 |
| Lebwohl et al23 | 354 | 18,7 | 3.600 | 3.600 | 3.600 | 4,92 | 22,41 | 17,50 | 24,09 | 10,90 | 20.575 | 14.941 | 33.029 |
| Metanálisis | 2.711 | 100,0 | 3.600 | 3.600 | 3.600 | 3,69 | 27,88 | 24,49 | 29,84 | 19,14 | 14.699 | 12.064 | 18.805 |
El resumen de los hallazgos se muestra en la tabla 7. La eficacia incremental en el estimador central de la eficacia (escenario basal) osciló entre un mínimo de 24,29 % (efalizumab) y un máximo de 78,35 % (infliximab 5 mg/kg a las 24 semanas de tratamiento). Los biológicos más eficaces son infliximab y adalimumab, ambos con una eficacia incremental superior al 60 % de respondedores PASI-75. La eficiencia, en términos de coste/eficacia incremental, en el escenario basal, osciló entre 8.013 euros (adalimumab a las 16 semanas) y 17.112 euros (infliximab a dosis de 5 mg/kg a las 24 semanas) por respondedor PASI-75 ganado. En consecuencia, el biológico más eficiente, en términos de coste/eficacia, es adalimumab (8.013 euros por respondedor PASI-75 ganado). Según el análisis de sensibilidad, adalimumab se mantiene como el biológico más eficiente, tanto en el escenario más favorable (7.568 euros por respondedor PASI-75 ganado), como en el más desfavorable (8.515 euros por respondedor PASI-75 ganado).
Resumen de los resultados de coste/eficacia de los agentes biológicos frente a placebo
| Agente biológico | Dosis | Duración del tratamiento | Caso basal | Coste/eficacia incremental euros/respondedor PASI-75 ganado | |||
| (semanas) | Eficacia incremental | NNT | Caso basal | Escenario más favorable | Escenario más desfavorable | ||
| Adalimumab | 80 mg + 40 mg/2 semanas | 16 | 64,16 | 2 | 8.013 | 7.568 | 8.515 |
| Etanercept | 2 × 25 mg/semana | 12 | 30,33 | 4 | 9.370 | 8.082 | 11.147 |
| Etanercept | 2 × 25 mg/semana | 24 | 50,69 | 2 | 11.213 | 8.757 | 15.582 |
| Etanercept | 2 × 50 mg/semana | 12 | 44,41 | 3 | 12.797 | 11.722 | 14.088 |
| Infliximab | 50 mg × kg*** | 10 | 76,44 | 2 | 10.523 | 7.996 | 11.109 |
| Infliximab | 50 mg × kg*** | 24 | 78,35 | 2 | 17.112 | 12.555 | 18.812 |
| Efalizumab | 1 mg/kg semana*** | 12 | 24,49 | 5 | 14.699 | 12.064 | 18.805 |
NNT: número necesario de pacientes a tratar (criterio de eficacia para el NNT: PASI-75).
Según los hallazgos de nuestro estudio el agente biológico que tiene el mejor cociente de coste/eficacia, a corto plazo (periodo de aclaramiento), es adalimumab, con el que se consigue un respondedor PASI-75 a un coste medio de 8.013 euros, que podría oscilar entre 7.568 y 8.515 euros. El menos eficiente es infliximab en pauta de 5 mg/kg durante 24 semanas, que consigue un respondedor PASI-75 a un coste medio de 17.112 euros, y que podría oscilar entre 12.555 y 18.812 euros. Esto es debido a que infliximab en esta pauta tiene una eficacia un 14 % mayor que adalimumab, pero la consigue a más del doble de coste que adalimumab. Efalizumab es el menos eficaz y el segundo más costoso, con lo cual se sitúa como el segundo menos eficiente. Etanercept es el segundo menos eficaz, pero dependiendo de la dosis tiene unos costes que le sitúan como el segundo o tercero más eficiente (tabla 7).
El presente estudio tiene sus fortalezas y limitaciones; uno de los puntos fuertes es que se ha considerado toda la evidencia científica disponible sobre la eficacia de biológicos en el tratamiento de la psoriasis moderada-grave. Se han incluido todos los ensayos clínicos aleatorizados que comparan un biológico frente a un placebo y que han sido publicados en revistas de difusión científica publicadas en inglés hasta marzo de 2008. Además, cuando un mismo tratamiento ha sido comparado en más de un ensayo clínico se han realizado metanálisis con las técnicas más robustas y conservadoras. Se puede considerar que nuestra búsqueda es completa, dado que los artículos encontrados son los mismos que los que han utilizado Brimhall et al en un metanálisis sobre la eficacia y seguridad del tratamiento con biológicos en la psoriasis36, publicado con posterioridad a la búsqueda realizada en el presente estudio. Por otra parte, los indicadores de eficacia que hemos obtenido realizando nuestros metanálisis son consistentes con los de Brimhall et al. En general, los artículos incluidos en nuestros metanálisis tienen una gran consistencia, excepto para el caso de efalizumab en dosis de 1 mg/kg. Ello se debe a que ha sido incluido el estudio de Leonardi et al19 sobre la eficacia de efalizumab, en el cual surgen dudas sobre la validez de este ensayo. Por una parte, llama la atención que la eficacia sea mayor cuando el tratamiento es pautado a una dosis de 1 mg/kg que cuando la dosis utilizada es 2 mg/kg. Por otra parte, los resultados de eficacia obtenidos con una dosis de 2 mg/kg son similares a los de otros estudios20-23 con la dosis de 1 mg/kg. Esto hace que el metanálisis realizado con los datos de los ensayos en los que se utiliza efalizumab a dosis de 1 mg/kg presente una gran heterogeneidad y cuestione los hallazgos del estudio de Leonardi19.
Una de las posibles limitaciones de nuestro trabajo es que no se han considerado los costes derivados de las reacciones adversas; la razón principal es que la evidencia científica sobre reacciones adversas es más limitada que sobre la efectividad. En el metanálisis de Brimhall et al se encontró una asociación estadísticamente significativa entre el uso del biológico y el riesgo de tener uno o más efectos adversos con respecto al placebo en el caso de efalizumab e infliximab, pero no se constató asociación para los efectos adversos serios36. El metanálisis de Brimhall et al36 no incluyó adalimumab. Sin embargo, un reciente informe del NICE (National Institute for Health and Clinical Excellence) del Reino Unido37, también concluye que el riesgo para los efectos adversos es mayor con adalimumab que con placebo, pero no se encontraron diferencias para los efectos adversos graves. En consecuencia, es razonable pensar que si se hubiesen incluido los costes derivados de los efectos adversos en nuestro estudio, nuestros hallazgos hubiesen sido muy similares a los encontrados.
Otra posible limitación es que sólo se han considerado los costes de los medicamentos, y no se han tenido en cuenta los de administración, que, por otro lado, son irrelevantes para adalimumab, etanercept y efalizumab por tratarse de medicamentos que se administran por vía subcutánea. Sin embargo, podrían ser elevados en el caso del infliximab, debido a que se administra por vía intravenosa, y por lo tanto su administración debe ser realizada en un centro hospitalario. El tratamiento con infliximab se tiene que iniciar y supervisar por médicos cualificados, recomendándose un tiempo de perfusión de dos horas, tras el cual el paciente debe permanecer en observación entre una a dos horas como consecuencia de las posibles reacciones agudas relacionadas con la perfusión 34. Esto supone que se incurre en costes de premedicación, salario de enfermería, material utilizado para realizar la perfusión, costes indirectos del hospital y salario del médico. Con estos costes añadidos la eficiencia (en términos de coste/eficacia) de infliximab disminuiría considerablemente.
Tampoco se han tenido en cuenta los costes de las pruebas diagnósticas (por ejemplo analítica, Mantoux y radiografía de tórax, entre otras) que se suelen pedir al inicio del tratamiento con un agente biológico. Sin embargo, aunque los costes pueden ser diferentes para cada biológico, son bastantes similares y no alterarían nuestros hallazgos.
También podría considerarse con reservas la forma de asignar el peso de los pacientes en los estudios de biológicos cuya dosis depende de este factor. El problema es que no todos los ensayos mencionan el peso de los pacientes y, además, el peso y talla de los sujetos puede variar de un país a otro, por ejemplo entre España y los Estados Unidos. Por otra parte, nuestro estudio pretende conocer las ratios de coste/eficacia para España. Para obviar esta limitación y para que los hallazgos tengan sentido en España, se han estandarizado los pesos de los sujetos de cada estudio a la población española a partir de la distribución de la edad y sexo de los pacientes que fueron incluidos en cada estudio. Desde nuestro punto de vista, es la mejor opción metodológica y la que otorga validez al estudio, en cuanto a la extrapolación a la población española. Además, en cuanto al cálculo del peso de los pacientes que padecen psoriasis, varios trabajos han demostrado que existe asociación entre psoriasis y obesidad30,38. Sin embargo, se mantiene la controversia de si la obesidad es debida a la psoriasis o si, por el contrario, es un factor de riesgo39. En todo caso, dado que no se dispone de datos del peso de los enfermos de psoriasis en España, el peso de los pacientes se ha estimado a partir del estudio de Herron30, en el cual se compara el IMC de la población general con el de los enfermos de psoriasis de Utah. Se ha asumido que el incremento de peso de los enfermos de psoriasis con respecto a la población general en España es el mismo que en Utah, y en consecuencia, tal incremento se ha estandarizado por edad y sexo a la población española. En nuestro análisis el peso asignado a los pacientes de los ensayos clínicos, dependiendo de la proporción de hombres y mujeres y de su edad, ha sido de alrededor de 78 kg en el escenario más favorable, de 80 kg en el basal y de 83 kg en el más desfavorable. Estos pesos estimados son muy consistentes con los obtenidos en una encuesta realizada en 2007 en 5 países europeos (Reino Unido, Alemania, Francia, Italia y España) que incluyó a 598 pacientes con psoriasis moderada-grave40. Según esta encuesta el peso medio de los sujetos con psoriasis moderada es de 78,1 kg y con psoriasis grave de 80,1 kg. En consecuencia, no es razonable pensar que nuestra aproximación haya sesgado los costes para aquellos biológicos cuya dosis depende del peso.
Otra posible limitación del estudio es que los costes y resultados se han calculado en función de la duración de seguimiento de cada ensayo. Por lo tanto, para unos fármacos hay información de eficacia y costes a las 10 semanas, mientras que para otros la hay a las 12, 16 y 24 semanas. Este hecho no puede ser corregido por análisis, dado que la eficacia se describe en los ensayos en el momento en que los autores estiman que el fármaco ha llegado a su meseta de efecto, y la forma de la curva de eficacia terapéutica en el tiempo no es lineal y no está descrita en los ensayos clínicos. Por ejemplo, el tratamiento con infliximab a dosis de 5 mg/kg durante 24 semanas con respecto al tratamiento durante 10 semanas aumenta la eficacia en un 2 %, pero incrementa los costes en un 67 %. En este caso se podría calcular la ratio de coste/eficacia marginal de las 14 semanas adicionales de tratamiento, pero no de cada semana adicional. Por lo tanto, con la información disponible en los ensayos clínicos no es posible elaborar una ratio de coste eficacia incremental por semana de tratamiento metodológicamente válida. Pensamos que como los ensayos clínicos se centran en el tiempo de tratamiento que maximiza la eficacia, el análisis realizado en nuestro estudio ayuda a comprender mejor las ratios de coste/eficacia en un escenario en el que, lo que se desea, es maximizar los resultados clínicos en los pacientes con las pautas de tratamiento según la evidencia científica procedente de los ensayos clínicos. Sin embargo, en un escenario de contención de costes los cocientes de coste/eficacia (según ensayos clínicos) deberían ser completadas con estudios de coste/ efectividad, con datos procedentes de la práctica clínica habitual.
ConclusionesConsiderando las dosis admitidas según la ficha técnica de los agentes biológicos estudiados, autorizada por la Agencia Española de Medicamentos y Productos Sanitarios, para el tratamiento de la psoriasis moderada-grave y en función de la mejor evidencia científica disponible, se puede concluir que el biológico más eficiente, en términos de coste por respondedor PASI-75, es adalimumab a las 16 semanas (8.013 euros), seguido de etanercept en dosis de 25 mg dos veces por semana a las 12 semanas (9.370 euros) e infliximab en dosis de 5 mg/kg de peso a las 10 semanas (10.523 euros). La ventaja de la eficiencia de adalimumab es robusta, ya que se mantiene comparativamente con los demás biológicos y pautas en los escenarios basal, más favorable y más desfavorable.
El 19 de febrero de 2009, estando el manuscrito en prensa, la European Medicines Agency (EMEA) recomendó la suspensión de la autorización comercial de Raptiva® por razones de seguridad que incluyen el riesgo de aparición de leucoencefalopatía multifocal progresiva en pacientes tratados con este fármaco.
Asimismo, la EMEA ha suspendido la comercialización de efalizumab, al considerar que su beneficio terapéutico ya no compensa el riesgo de su administración.
Por otra parte, en la ficha técnica de etanercept se ha incluido la posibilidad de tratamiento continuado y el tratamiento en pacientes pediátricos (a partir de 8 años) a la dosis de 0,8 mg/kg.
[http://www.emea.europa.eu/humandocs/Humans/EPAR/raptiva/raptiva.htm]
Conflicto de intereses
Este trabajo ha sido financiado por Abbott Laboratories. A. García es miembro de consejo asesor para psoriasis de Abbott y de Merck Serono; C. Ferrándiz ha recibido honorarios como consultor, conferenciante y por la participación en ensayos clínicos por parte de Merck-Serono, Wyeth, Schering-Plough, Abbott, Centocor y Janssen-Cilag.
Los demás autores no presentan ningún potencial conflicto de interés con el contenido del presente trabajo.