INTRODUCCION
La necrólisis epidérmica tóxica (NET) o síndrome de Lyell es una toxicodermia poco frecuente y rápidamente progresiva con alta mortalidad1-9.
Su incidencia varía de 0,4-1,2 casos por millón de habitantes y año4,5.
La etiología de la NET es mayoritariamente farmacológica, sobre todo sulfamidas, anticonvulsionantes, antiinflamatorios no esteroides (AINE) tipo oxicam, clormezanona y alopurinol (riesgo relativo alto)4,5,11. También se ha descrito NET por penicilinas, tetraciclinas, quinolonas, imidazólicos, eritromicina y cefalosporinas (asociación significativa)8,11-13. Se ha documentado igualmente por nuevos medicamentos como nevirapina o lamotrigina5.
La aparición de necrólisis epidérmica tóxica por radioterapia sin fármacos asociados es rara8,12, pero su incidencia aumenta al asociar anticonvulsionantes8. La única serie encontrada en la literatura que estima la incidencia de necrólisis epidérmica tóxica por fenitoína y radioterapia objetiva un caso entre 289 pacientes (0,3 %)14.
La patogenia de la NET está en discusión. Casi todos los autores están de acuerdo en asociar anomalías en el metabolismo de medicamentos (destoxificación deficiente de metabolitos) con un probable componente hereditario4,5,8,9 y una respuesta inmunitaria citotóxica con mediación celular1,5-9,12,15-17. Se ha visto asociación significativa con HLA-B12, que demuestra una susceptibilidad genética4,5,8. Aún es más discutido por qué la fenitoína y la radioterapia conjuntamente producen necrólisis epidérmica tóxica. Este hecho puede ser debido a la actuación sobre el eje hipotálamo-hipofisario por la radioterapia8,12, a una reacción de hipersensibilidad a la fenitoína desencadenada por la inmunosupresión8,9,12, a una actuación de ambas independientemente sobre el sistema inmunitario8 o a una disminución de la destoxificación de los metabolitos favorecida por la propia inmunodepresión del paciente por la neoplasia, la cirugía, la radioterapia y los corticoides9.
El tiempo transcurrido entre la introducción de la fenitoína y el inicio de la erupción oscila, según los autores, entre 10 días y 2 meses4,8-10,13, siendo mayor el riesgo en los primeros 2 meses de administración5. Este tiempo disminuye a 1-2 días con la reintroducción del fármaco después de una necrólisis epidérmica tóxica anterior5,10,18. Con la radioterapia, el tiempo transcurrido oscila entre 1 y 2 meses8,13. Muchas veces también está asociada a cirugía craneal por neoplasia con posterior tratamiento con fenitoína y radioterapia5.
DESCRIPCION DE LOS CASOS
Caso 1
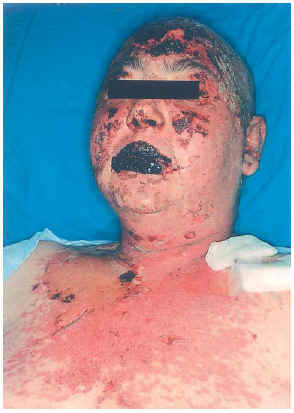
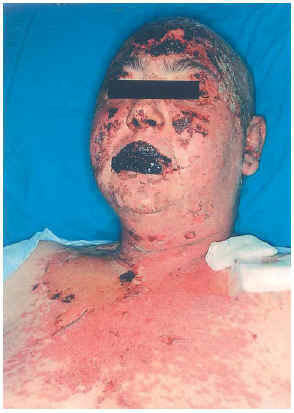
Una mujer de 33 años, fue intervenida de parotidectomía superficial conservadora y disección radical cervical derecha por metástasis ganglionares cervicales de melanoma en 2000, sin que se localizara el melanoma primario. Posteriormente recibió tratamiento con interferón alfa 2B (IFN-α2B). En noviembre de 2001 se observaron metástasis pulmonares y suprarrenales, por lo que recibió 5 ciclos de quimioterapia (cisplatino-dacarbazina), y en marzo de 2002 se diagnostican metástasis cerebrales, para lo cual se pauta dexametasona (16 mg/día) y fenitoína (100 mg/8 h) (24 de marzo de 2002). Se pautaron sesiones de radioterapia (27 marzo a 12 abril), iniciando a la semana de la última sesión una erupción maculopapular en cabeza y mitad superior del tronco, asociada a síndrome febril y molestias orofaríngeas. Las lesiones cutáneas aumentaron de tamaño, formando grandes ampollas flácidas en las localizaciones mencionadas, con signo de Nikolski positivo que afectaba al 30 % de la superficie corporal (fig. 1). Presentaba también afectación de la mucosa oral, consistente en erosiones y costras hemorrágicas en labios. Con el diagnóstico de necrólisis epidérmica tóxica por fenitoína asociada a radioterapia se suspendió la fenitoína, se pautó ácido valproico y se mantuvo la dexametasona. Al cuarto día se inició tratamiento con ciclosporina por vía intravenosa (100 mg/8 h; 4,5 mg/kg/día), y la mejoría comenzó al séptimo día. La paciente fue dada de alta a los 35 días de su ingreso.
Fig. 1.--Caso clínico 1. Exantema maculo-papular con despegamiento epidérmico, costras hemorrágicas e intesa afectación mucosa.
Caso 2
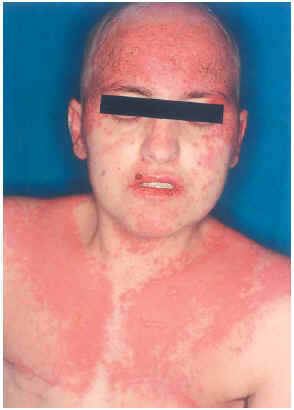
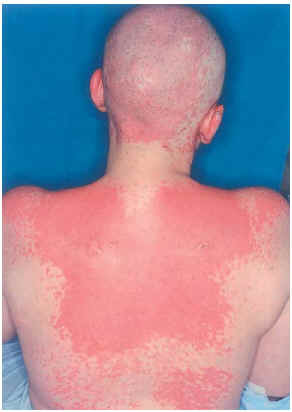
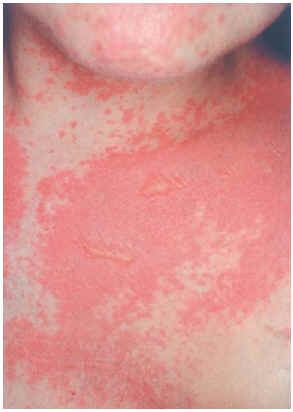
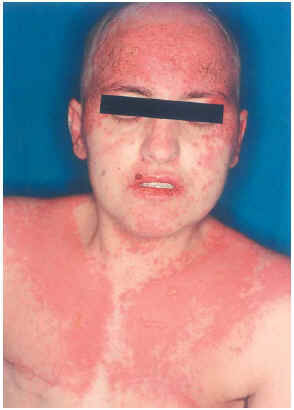
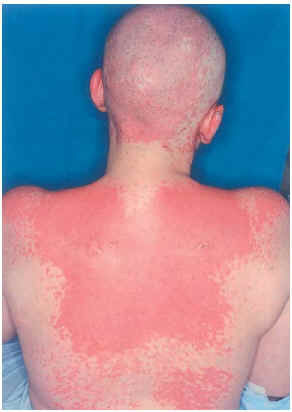
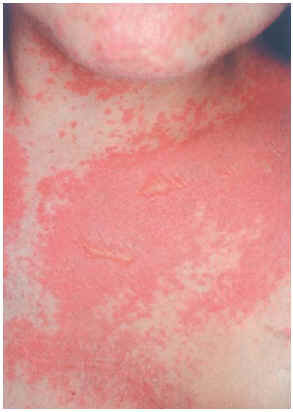
Una mujer de 29 años, diagnosticada en 2000 de carcinoma ductal infiltrante bilateral de mama, recibió tratamiento con cirugía (mastectomía bilateral y disección axilar), quimioterapia (6 ciclos de 5-fluorouracilo, adriamicina y ciclofosfamida) y radioterapia adyuvante sobre lechos quirúrgicos y cadenas ganglionares. En agosto de 2001 sufrió una recidiva de su enfermedad con metástasis óseas y hepáticas, por lo que recibió distintos ciclos de quimioterapia (9 ciclos de taxol-herceptín y posteriormente 3 de gemzar-vinorelbina) hasta marzo de 2002. Ese mismo mes presentó una crisis comicial generalizada, diagnosticándose metástasis cerebrales e iniciando tratamiento con dexametasona (32 mg/día) y fenitoína (100 mg/8 h) (28 de marzo de 2002) y radioterapia holocraneal (dosis total 30 Gy) (1-12 de abril de 2002). El 24 de abril ingresó por sintomatología neurológica secundaria a afectación de raíces sacras por su proceso de base, presentando además exantema en cabeza y región torácica asociado a mucositis de 72 h de evolución. La erupción empeoró en los días siguientes con aparición de ampollas en la localización mencionada (alrededor de un 20 % de la superficie corporal) y desarrollo de ascitis a tensión (figs. 2-4). Con el diagnóstico de necrólisis epidérmica tóxica por fenitoína asociada a radioterapia se suspendió la fenitoína y se pautó ácido valproico y se mantuvo la corticoterapia. Al sexto día se inició tratamiento con ciclosporina por vía intravenosa (250 mg/día; 4,5 mg/kg/día), con lo que disminuyeron las ampollas y presentando erosiones más profundas en mucosa oral, labios, cuero cabelludo y espalda, y aparecieron edemas en los miembros inferiores. Los síntomas cutáneos evolucionaron favorablemente, pero presentó hiperemia conjuntival con secreciones mucopurulentas y seudomembranas blanquecinas y gran afectación de la mucosa oral. La situación general de la paciente empeoró y falleció al mes de su ingreso.
Fig. 2.--Caso clínico 2. Exantema maculo-pauloso con ampollas fláccidas y afectación mucosa.
Fig. 3.--Caso clínico 2. Exantema maculo-papuloso.
Fig. 4.--Caso clínico 2. Exantema maculo-papuloso con ampollas fláccidas.
DISCUSION
Ambas pacientes presentaron un cuadro clínico de necrólisis epidérmica tóxica o más correctamente, un síndrome de solapamiento entre síndrome de Stevens-Johnson (SSJ) y NET11. Es posible que debido a la introducción precoz de la ciclosporina, el proceso se frenase sin llegar a desarrollar una necrólisis epidérmica tóxica extensa. En ambos destaca la limitación del proceso a la mitad superior del cuerpo, cuando lo habitual es que esta entidad se inicie en el sitio primario de irradiación y se generalize en 2 o 3 días4,5,12,13.
Aunque no se conozcan los mecanismos, existen suficientes datos para pensar que la asociación entre fenitoína y radioterapia predispone a la necrólisis epidérmica tóxica; nuestros 2 casos refuerzan esta idea. El tiempo transcurrido entre la introducción de la fenitoína y la radioterapia y la aparición de las primeras lesiones, 26 días y 23 días (primer caso) y 24 días y 21 días (segundo caso), respectivamente, es similar a lo publicado por otros autores4,8-10,13.
Las metástasis cerebrales producen convulsiones en el 20 % de los pacientes, pero este porcentaje asciende al 40 % si se trata de gliomas y al 50 % si son metástasis cerebrales de melanoma; por lo tanto, sólo se recomienda profilaxis con anticonvulsionantes en pacientes oncológicos con crisis convulsivas evidentes y en casos de metástasis cerebrales de melanoma9. Se recomienda usar en estos casos ácido valproico, por la menor incidencia de necrólisis epidérmica tóxica en su uso5,9,10,17; sin embargo, Roujeau et al11 encuentran en su estudio que éste tiene un riesgo similar al de los anticonvulsionantes aromáticos. En los 2 casos presentados era necesario iniciar una terapia anticonvulsionante, que se realizó con fenitoína, aunque posteriormente a la necrólisis epidérmica tóxica se administró ácido valproico, sin crisis por parte de las pacientes ni cambios en la evolución del cuadro. No hay documentado ningún artículo que haga referencia a una posible necrólisis epidérmica tóxica por radioterapia y ácido valproico.
Se han publicado reacciones cruzadas por anticonvulsionantes de la misma familia (mefenitoína y fenitoína, primidona y fenobarbital)10; aunque con menos frecuencia también existen reacciones cruzadas entre fenitoína, fenobarbital y barbitúricos, por lo que se recomienda contraindicar los tres si se presenta una necrólisis epidérmica tóxica con uno de ellos como posible desencadenante4,10,17,18. No se han observado estas reacciones con la carbamazepina17, pero se trata del anticonvulsionante con mayor riesgo de producir necrólisis epidérmica tóxica, seguido por la fenitoína y el fenobarbital5. Si ocurren reacciones cruzadas se recomienda el uso de ácido valproico como alternativa17. La lamotrigina no tiene reacciones cruzadas, por lo que es una buena opción4. Nosotros no encontramos ninguna reacción cruzada entre el ácido valproico y la fenitoína.