Las enfermedades cutáneas inmunomediadas están desencadenadas por una compleja interacción entre la susceptibilidad genética del individuo y los factores ambientales. Existen numerosos datos genéticos y epidemiológicos que apoyan la asociación entre enfermedades en apariencia poco relacionadas, como la enfermedad de Crohn, la colitis ulcerosa, el liquen plano, la dermatitis herpetiforme (DH) o la psoriasis. Una de estas posibles asociaciones es la de la psoriasis con la DH. La presencia de polimorfismos genéticos comunes a la DH y a la psoriasis en diversos genes relacionados con la regulación del sistema inmune permitiría justificar esta asociación. También va a favor de la posible relación entre ambas entidades la mayor prevalencia de celiaquía en los pacientes con psoriasis (4,34%), con respecto a la prevalencia observada en la población general (1-2%)1.
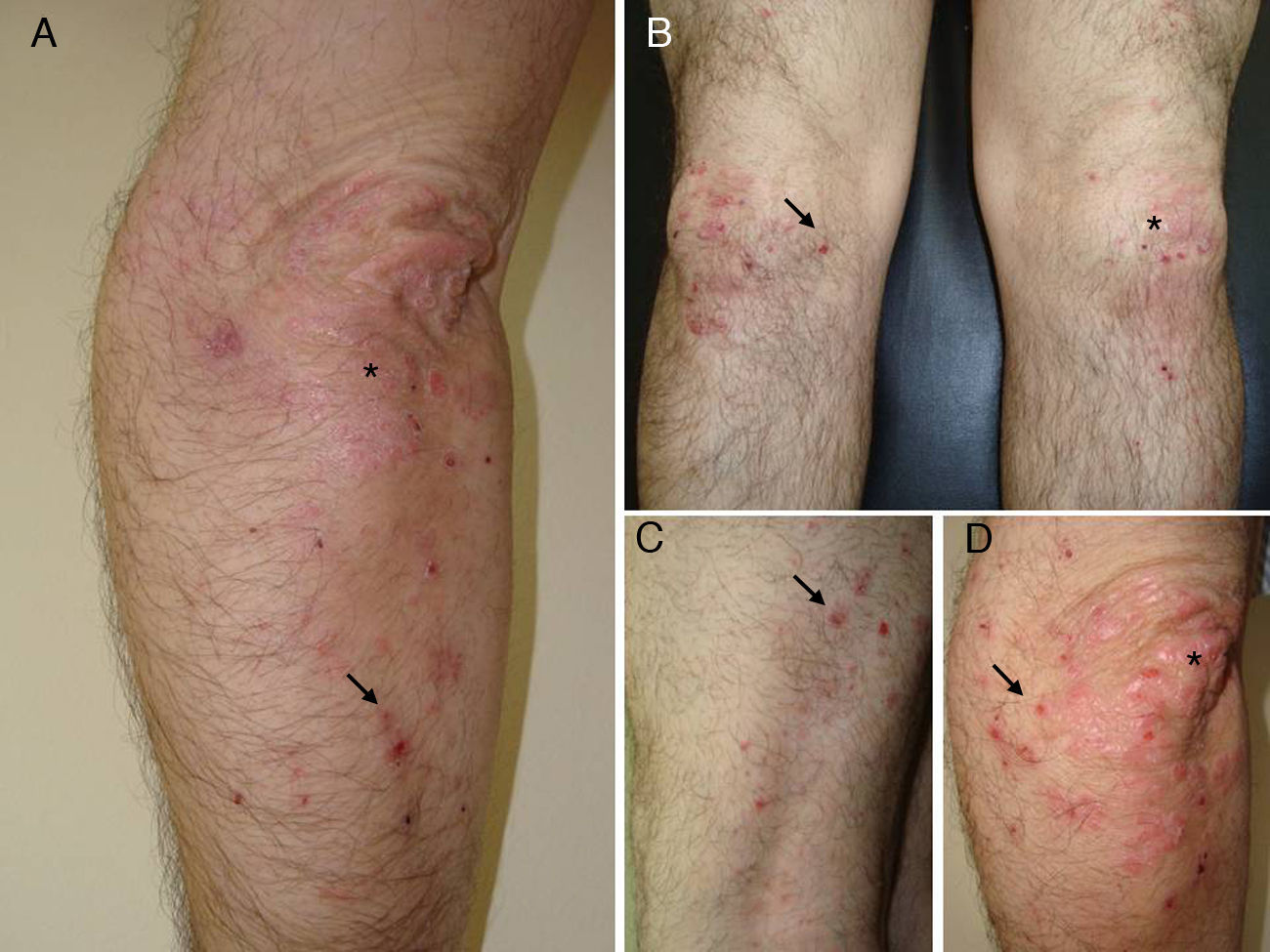
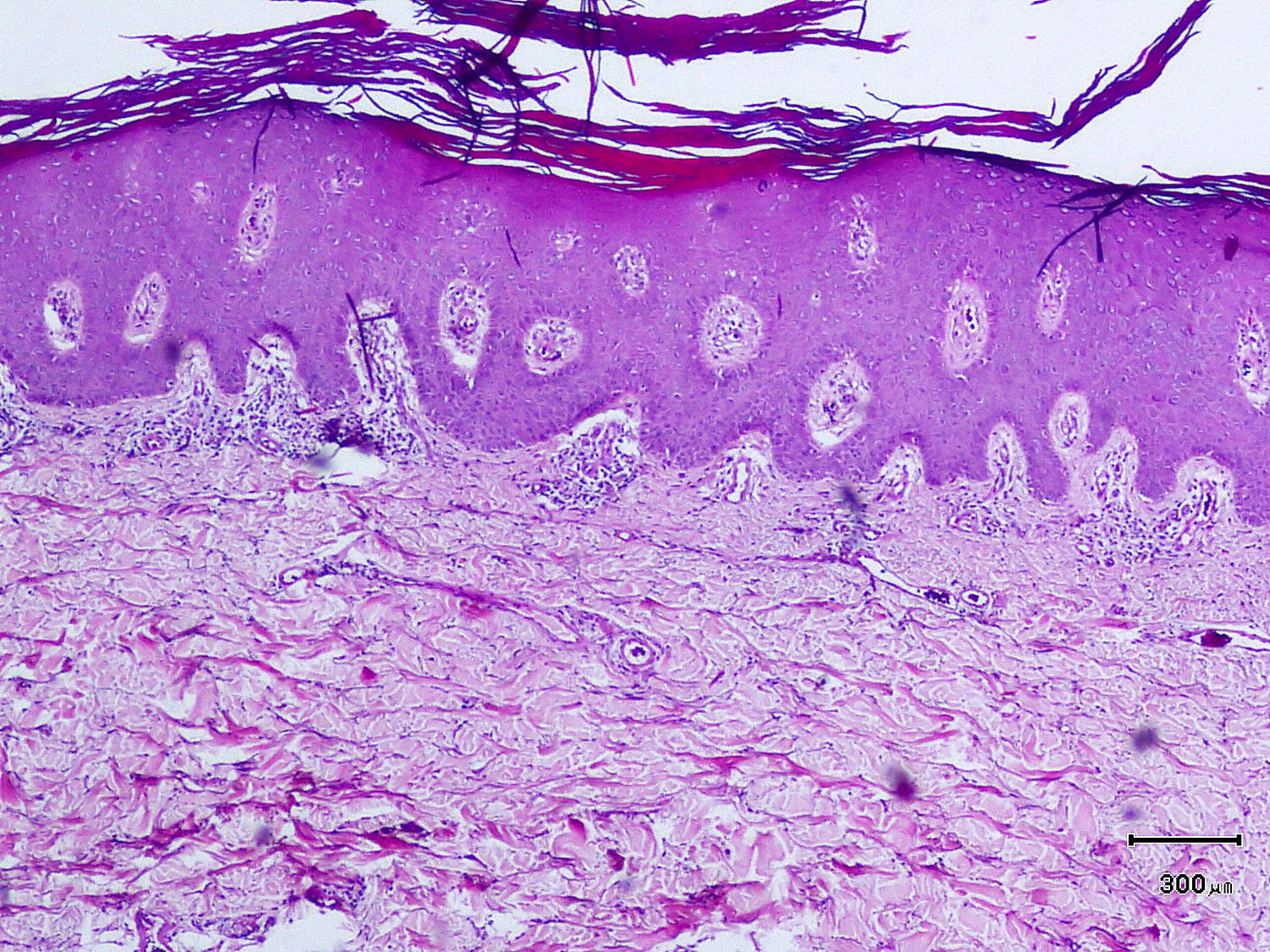
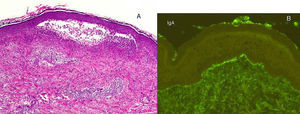
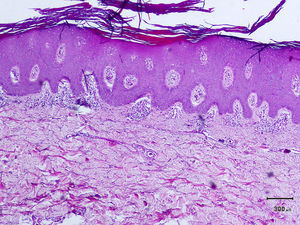
Un varón de 50 años, sin antecedentes de interés excepto psoriasis en placas leve de más de 20 años de evolución en codos y rodillas, consultó por la aparición progresiva en los últimos meses de unas lesiones ampollosas e intensamente pruriginosas, dispuestas alrededor de las placas de psoriasis en la superficie extensora de las extremidades. A la exploración se observaron, distribuidas de forma simétrica, pequeñas ampollas sobre una base eritematosa, monomorfas, de 3 a 7 mm de diámetro y de contenido claro (fig. 1). El paciente no refería otra clínica asociada por aparatos y sistemas. El resto de la exploración cutánea fue totalmente normal. La biopsia de una de las ampollas, para el estudio con hematoxilina-eosina, mostró numerosos infiltrados neutrofílicos en las papilas dérmicas y la presencia de una ampolla en la unión dermo-epidérmica. El estudio con inmunofluorescencia directa de la piel sana perilesional evidenció la presencia de depósitos granulares de IgA en la dermis papilar (fig. 2). La biopsia de una de las placas de los codos confirmó el diagnóstico de psoriasis, como se aprecia en la figura 3. En el estudio analítico se detectaron anticuerpos antitransglutaminasa tisular a título > 100, con anticuerpos antiendomisio y antigliadina negativos. El resto de estudios analíticos, que incluyeron niveles de glucosa-6-fosfato-deshidrogenasa, fueron normales o negativos. El paciente fue diagnosticado de dermatitis herpetiforme (DH) en coincidencia con psoriasis en placas. El estudio gastroenterológico confirmó el diagnóstico de enfermedad celiaca mediante biopsia del intestino delgado. Después de tres meses de iniciada una dieta exenta de gluten y seguir tratamiento con sulfona oral a dosis de 100 mg/día, el paciente experimentó la total resolución de la clínica ampollosa y una mejoría de la psoriasis, valorada mediante el Índice de Gravedad y Área de la Psoriasis (PASI), que varió de un PASI con valor de 3 a un PASI final con valor de 1.
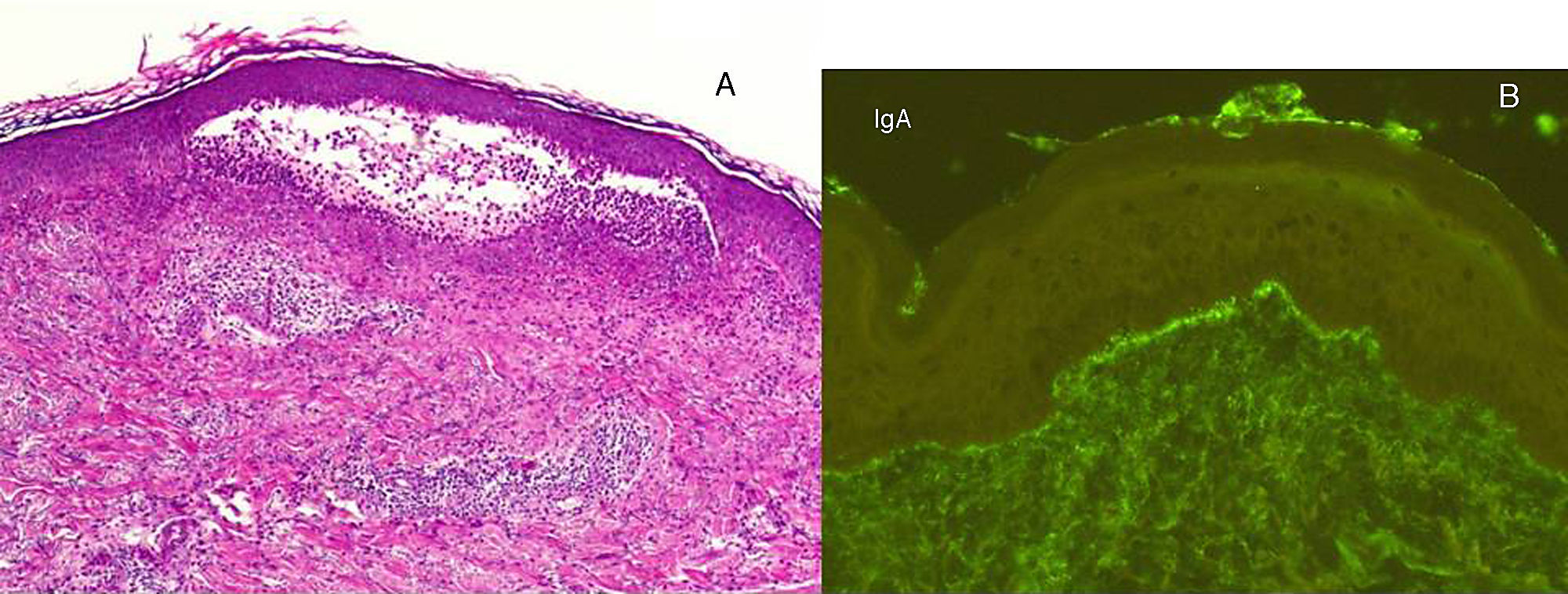
A. El estudio con hematoxilina-eosina (x 20) de una de las lesiones ampollosas muestra numerosos infiltrados neutrofílicos en las papilas dérmicas y la presencia de una ampolla en la unión dermoepidérmica, sugestivos de dermatitis herpetiforme. B. La inmunofluorescencia directa de la piel sana perilesional pone de manifiesto los depósitos de IgA de forma granular en la dermis papilar, propios de la dermatitis herpetiforme.
La coexistencia de lesiones de psoriasis en placas y de DH en un mismo paciente, como en el caso presentado, es rara y ha sido descrita previamente de forma anecdótica. No obstante, numerosos autores defienden la asociación entre la psoriasis y la enfermedad celíaca. Se ha observado que más del 16% de los pacientes con psoriasis presentan IgG e IgA antiendomisio, antigliadina y antitransglutaminasa2. Algunas series han permitido demostrar, además, una mejoría de las lesiones de psoriasis después de seguir entre 3 y 6 meses una dieta exenta de gluten, sin otro tratamiento farmacológico añadido, mientras que la reintroducción del gluten desencadena nuevos brotes de psoriasis3. Resulta interesante subrayar que en aquellos pacientes que carecían de autoanticuerpos propios de la celiaquía no se observó mejoría de la psoriasis con la dieta sin gluten3. En función de estas observaciones2, algunos autores recomiendan el despistaje analítico de celiaquía en los pacientes con psoriasis4. La psoriasis también se ha asociado a otras patologías autoinmunes relacionadas con la IgA: pénfigo IgA lineal, vasculitis renal glomerular necrotizante IgA y nefropatía IgA5.
Entre los hallazgos genéticos más recientes cabe destacar la mayor prevalencia del «alelo *2 potenciador de la cadena pesada de inmunoglobulinas HS1,2» en pacientes afectos de dermatitis herpetiforme, psoriasis en placas y artritis psoriásica. Esta circunstancia permitiría sugerir que los pacientes psoriásicos presentan una predisposición a desarrollar una respuesta distinta en la inducción de inmunoglobulinas con respecto a la población general6. También se han descrito otros factores genéticos comunes (polimorfismos en el gen de la IL 23 y haplotipos HLA de tipo II), que predispondrían a una respuesta inmune excesiva/mal regulada y a un estado proinflamatorio crónico7–9.
Todos estos datos, valorados en conjunto, van a favor de la existencia de una alteración inmune común subyacente a estas enfermedades cutáneas fundamentada en una desregulación de la IgA. Sin embargo, los mecanismos implicados no están bien esclarecidos.
Por otra parte, otros autores creen que, dada la alta prevalencia tanto de la psoriasis como de la EC y, por tanto, la DH en la población general, la coincidencia de ambos procesos en un mismo paciente sería probablemente fortuita. En la actualidad la mayoría de datos a favor de la asociación entre EC y psoriasis proceden de casos aislados, por lo que no es posible establecer de forma concluyente la asociación entre ambas, ya que podría ser exclusivamente casual. Sin embargo, la mejoría observada en nuestro caso y en otros similares tras el adecuado manejo de la celiaquía hace conveniente la puesta en práctica de estudios controlados que verifiquen la auténtica naturaleza de la asociación entre ambas patologías.