Los tratamientos tópicos e intralesionales (IL) pueden ser considerados como de primera línea en pacientes con hidradenitis supurativa (HS), sin embargo, la evidencia que apoya su uso es limitada. El objetivo de nuestra revisión es evaluar la eficacia y la seguridad de los tratamientos tópicos e IL en pacientes con HS.
Material y métodosDiseñamos una revisión sistemática de la literatura siguiendo el método población, intervención, comparación, resultado (outcome) y tipo (PICOT). Incluimos todo tipo de estudios (tipo [T]) que integraran individuos con HS de cualquier sexo, edad y etnicidad (población [P]), que recibieran cualquier tratamiento tópico o IL para la HS (intervención [I]) que compararan con placebo, otros tratamientos o no tratamiento (comparador [C]) y reportaran resultados de eficacia y/o seguridad (outcomes [O]). Dos resultados fueron definidos: calidad de vida (CdV) y número de pacientes con al menos un efecto adverso. La búsqueda se llevó a cabo en las bases de datos Cochrane Library, MEDLINE y Embase; la selección de estudios se realizó de acuerdo con los criterios predefinidos. El riesgo de sesgo se determinó en cada estudio.
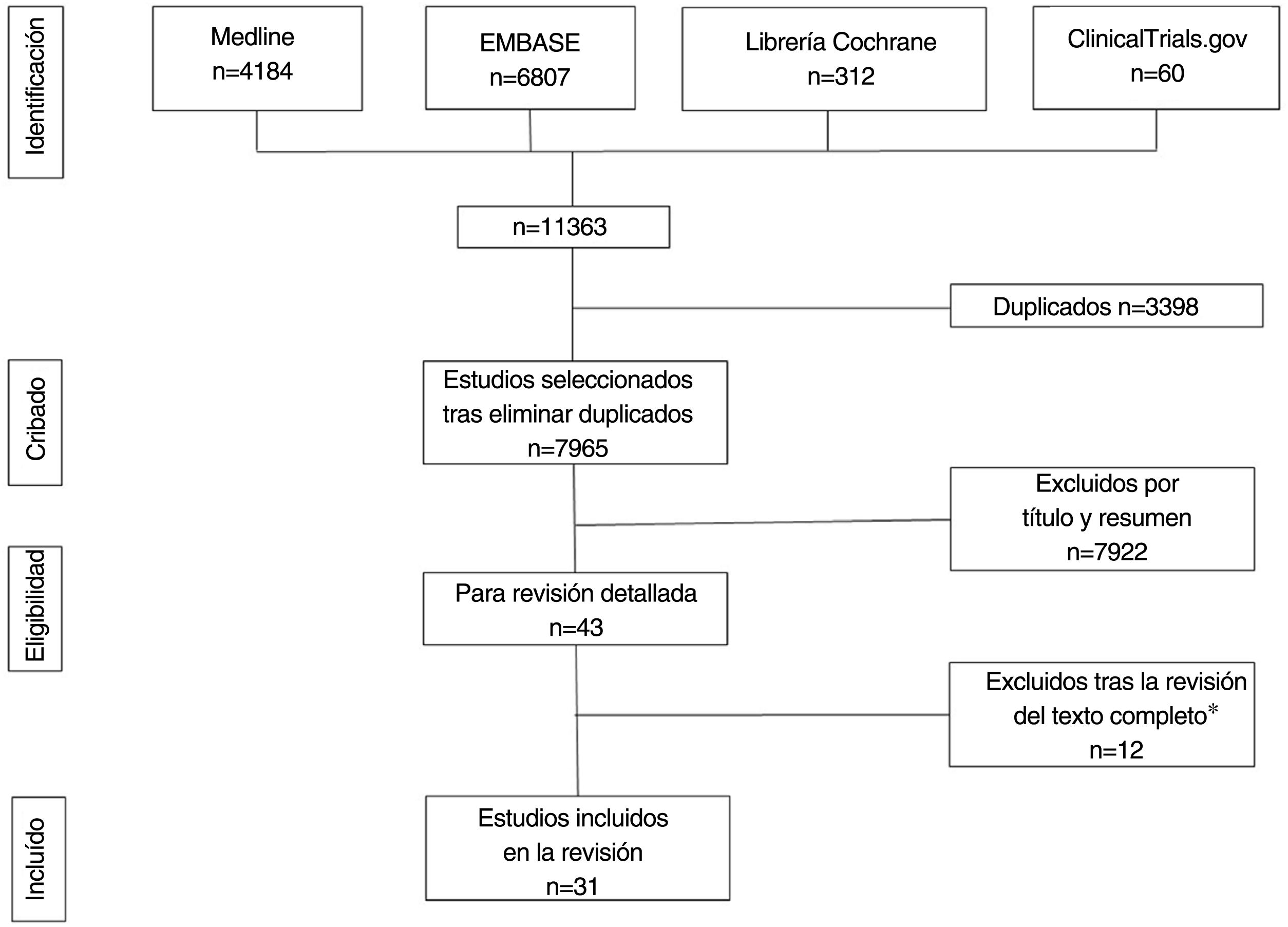
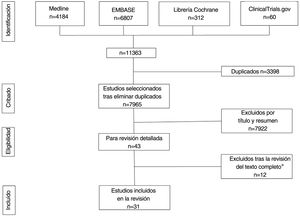
ResultadosSe obtuvieron 11.363 referencias de las cuales 31 cumplieron los criterios de inclusión. Estos estudios incluyeron 1.143 pacientes con HS, 62% fueron mujeres. Evaluaron la terapia fotodinámica (TFD) 10 estudios, ocho los glucocorticoides, seis el resorcinol, dos los antibióticos tópicos y cinco otras intervenciones. La mayoría de los artículos fueron series de casos (n=25), con solo cinco ensayos clínicos aleatorizados (ECA) y un estudio de cohortes. Los ECA demostraron mejoría de la actividad de la enfermedad con clindamicina tópica y con toxina botulínica tipo B (BTX) frente a placebo y TFD con azul de metileno (AM) niosomal (AMN) frente a AM libre (AML); sin embargo, el acetónido de triamcinolona (ACT) IL no fue superior al placebo. El riesgo de sesgo fue bajo en tres y alto en dos ECA.
ConclusiónLa calidad de la evidencia que apoya el uso de tratamientos tópicos o IL es baja, pero respalda el empleo de clindamicina tópica, TFD y BTX. Se requieren ECA adecuadamente diseñados con resultados estandarizados y poblaciones homogéneas de pacientes y lesiones para apoyar la toma de decisiones en la práctica clínica.
Topical and intralesional (IL) treatments may be considered the first-line therapy in patients with hidradenitis suppurativa (HS); however, the evidence supporting their use is limited. The aim of our review is to evaluate the efficacy and safety profile of topical and IL treatments in patients with HS.
Materials and methodsWe designed a systematic review of the current medical literature available following the PICO(T) method. And including all types of studies (Study type [T]) of individuals with HS of any sex, age, and ethnicity (Population [P]) who received any topical or IL treatment for HS (Intervention [I]) compared to placebo, other treatments, or no treatment at all (Comparator [C]), and reported efficacy and/or safety outcomes (Outcomes [O]). Two outcomes were defined: quality of life and the no. of patients with, at least, one adverse event. The search was conducted in the Cochrane Library, MEDLINE, and Embase databases; study selection was performed based on pre-defined criteria. The risk of bias was determined in each study.
ResultsWe obtained a total of 11,363 references, 31 of which met the inclusion criteria. These studies included 1143 patients with HS, 62% of whom were women. A total of 10, 8, 6, 2, and 5 studies, respectively, evaluated the use of photodynamic therapy (PDT), glucocorticoids, resorcinol, topical antibiotics, and other interventions. Most articles were case series (n=25), with only five randomized clinical trials (RCTs) and one cohort study. RCTs showed improvement in disease activity with topical clindamycin and botulinum toxin (BTX) vs placebo, and PDT with methylene blue (MB) niosomal vs free MB; however, intralesional triamcinolone acetonide was not superior to placebo. The risk of bias was low in three RCTs and high in two RCTs.
ConclusionThe quality of evidence supporting the use of topical, or IL treatments is low. However, it supports the use of topical clindamycin, PDT, and BTX. Well-designed RCTs with standardized outcomes and homogeneous populations of patients and lesions are needed to support decision-making in the routine clinical practice.
La hidradenitis supurativa (HS) es una enfermedad inflamatoria crónica de la piel, caracterizada por nódulos recurrentes, abscesos, fístulas y cicatrices. Estas lesiones suelen aparecer en las axilas, las ingles, la región perianal, perineal o inframamaria1,2. Tanto la aparición como la progresión se han asociado a factores de riesgo como el tabaquismo, la obesidad y el sexo femenino3,4. La HS es relativamente frecuente, con una prevalencia estimada de 1-4% en las poblaciones europeas5,6, y afecta principalmente a adultos jóvenes. En general, la HS es un problema de salud infravalorado que tiene un impacto significativo en la calidad de vida (CdV) de los pacientes7–9.
Actualmente, se dispone de una amplia gama de opciones terapéuticas para tratar la HS10. La mayoría de los estudios se centran en el perfil de eficacia y seguridad en las formas moderadas y graves de HS. Sin embargo, las pruebas científicas que respaldan el uso de terapias tópicas e intralesionales (IL) son escasas. En la práctica clínica habitual, las terapias tópicas e IL suelen ser de primera línea para tratar los estadios iniciales de la HS. También pueden ser útiles para brotes limitados en pacientes que ya reciben un tratamiento sistémico10–12. Aunque una revisión bibliográfica sistemática Cochrane (SLR) previa10 resumió las pruebas de ensayos clínicos aleatorizados (ECA), hasta donde sabemos, a la fecha, no se ha publicado ninguna SLR sobre tratamientos tópicos e IL para la HS. Por lo tanto, el objetivo de nuestra revisión fue evaluar la eficacia y el perfil de seguridad de los tratamientos tópicos e IL en pacientes con HS.
MétodosSe diseñó una SLR para evaluar la eficacia y el perfil de seguridad de los tratamientos tópicos e IL para tratar a los pacientes con HS. Siguiendo el enfoque PICOT, se definió la población (P), la intervención (I), el comparador (C), los resultados (O) y el tipo de estudios (T) como parte de esta SLR realizada de acuerdo con las guías de práctica clínica proporcionadas por la declaración de elementos de información preferidos para revisiones sistemáticas y metanálisis (PRISMA)13. PROSPERO (ID núm. CRD42022361114)14.
Se incluyeron estudios sobre individuos con HS de cualquier sexo, edad y etnia
(P). El diagnóstico de HS podía ser definido por el médico tratante, o cumplir los criterios diagnósticos disponibles15.
Se incluyó cualquier tipo de tratamiento tópico o IL para la HS (I). Por lo tanto, se podían tomar en cuenta tanto intervenciones farmacológicas como físicas. Las terapias destructivas como el láser o la cirugía se consideraron fuera del ámbito de esta revisión. También se excluyeron los estudios que evaluaban una combinación de intervenciones tópicas y sistémicas. Para facilitar la interpretación, se predefinieron un total de cinco grupos de intervención: terapia fotodinámica (TFD), corticosteroides IL, resorcinol tópico, antibióticos y otras intervenciones. No se impusieron restricciones a los comparadores (C); se incluyeron placebo, ausencia de intervención o cualquier otra intervención médica (tópica o sistémica). También se consideraron estudios sin comparador, así como aquellos comparativos entre diferentes terapias tópicas o IL.
La selección de los resultados se basó en el documento de consenso «International Dermatology Outcome Measures» (IDEOM) para el desarrollo de los hallazgos de la HS en mediciones sanitarias16. Se definieron dos resultados coprimarios (O), uno relativo a la eficacia (la CdV autopercibida) y otro relativo a la seguridad (número de pacientes con, al menos, un evento adverso [EA]). Para evaluar la CdV, se incluyeron escalas genéricas (SF-36 o EQ-5D), específicas de dermatología (Dermatology Life Quality Index [DLQI], Skindex 29) y de la HS (Hidradenitis Suppurativa Quality of Life 24 [HSQoL-24]). Los resultados secundarios de eficacia predefinidos incluyeron la evaluación global del paciente, el dolor, el prurito, la actividad de la enfermedad, la evaluación global del médico y la satisfacción con el tratamiento. Los resultados podían evaluarse en cualquier escala.
Se incluyeron todos los tipos de estudios (T): aleatorizados, de casos y controles, de cohortes y series de casos. Para ser tomadas en cuenta, estas últimas debían informar sobre más de cinco pacientes. Se excluyeron las revisiones narrativas; las revisiones sistemáticas previas de la literatura solo se utilizaron para la identificación secundaria de referencias. También se omitieron los estudios cuyo documento completo no estaba disponible o si estaba escrito en un idioma distinto del inglés, el español o el francés.
La búsqueda se realizó en tres bases de datos científicas principales (Cochrane Library, MEDLINE y Embase) el 29 de septiembre de 2022 sin limitaciones de tiempo. Debido a la dificultad de definir con precisión las múltiples intervenciones, la búsqueda se centró en recuperar artículos con la población de estudio (pacientes con HS). Para ello, se utilizó una combinación de términos estandarizados (Medical Subject Headings [MeSH]) y libres. Los detalles de la búsqueda se muestran en el Apéndice B información complementaria (Anexo, tabla 1). Se realizó una búsqueda en ClinicalTrials.gov utilizando los términos «hidradenitis suppurativa» y el filtro «complete».
Los resultados obtenidos de la búsqueda se añadieron a un gestor de citas (EndNote® X7). Los títulos y resúmenes recuperados fueron revisados de forma independiente por dos autores (JCP y RHQ). Tras el cribado de títulos y resúmenes, se realizó una revisión del texto completo de los estudios seleccionados. Los desacuerdos entre los autores fueron resueltos por un árbitro (FS). Los criterios de inclusión siguieron la estructura PICOT descrita anteriormente. A continuación, se comprobó la lista de referencias de los estudios incluidos en la SLR para identificar los artículos omitidos. No se efectuaron búsquedas adicionales en las reuniones internacionales ni en las revistas clave.
La curación de los datos fue realizada de forma independiente por JCP y RHQ mediante una hoja de extracción de datos diseñada ad hoc, basada en la «Checklist of items to consider in data collection or data extraction» disponible en el «Cochrane Handbook for Systematic Reviews of Interventions». Las discrepancias se resolvieron por consenso.
También se evaluó el riesgo de sesgo y la calidad metodológica de los estudios incluidos. Debido a la heterogeneidad de estos (desde series de casos hasta ECA), se establecieron diferentes herramientas para su correcta evaluación: la de «riesgo de sesgo» de la Cochrane versión 2 (RoB 2)17 para los ensayos clínicos, y la «Newcastle-Ottawa Quality Assessment Scale» (NOS)17 para los estudios observacionales18. Todas las series de casos se consideraron de alto riesgo de sesgo.
Si la heterogeneidad era baja, se planificó un metanálisis. Los resultados de las variables dicotómicas se expresaron como frecuencias relativas, mientras que los de las variables continuas como medias y desviaciones estándar. Se planificaron los análisis del sesgo de publicación y se expresaron mediante un gráfico en embudo (funnel plot). Sin embargo, debido a la insuficiencia de material, estos análisis no pudieron realizarse.
ResultadosLa búsqueda recuperó un total de 11.363 referencias, 4.184 de las cuales se obtuvieron de MEDLINE, 6.807 de Embase, 312 de Cochrane Library y 60 de Clinicaltrials.gov. Tras la eliminación de duplicados y el cribado por título y resumen, se seleccionó un total de 43 estudios para la revisión del texto completo. De ellos, 31 cumplían todos los criterios de inclusión (tablas 1-5)19–49 y 12 fueron excluidos (Anexo, tabla 2)50–61 (fig. 1). Los 31 estudios seleccionados informaron sobre un total de 1.143 pacientes con HS, 62% de los cuales eran mujeres. La edad media de los participantes era de 34,1 años. El número medio de sujetos por estudio fue de 36,2, oscilando entre cinco20,21 y 13137, y el seguimiento medio fue de 113,2 días. La mayoría de los pacientes tenían HS crónica con una evolución media de la enfermedad de 11,7 años, y gravedad moderada (21,4% eran Hurley I y 62,9% Hurley II) (Anexo, tablas 3 y 4).
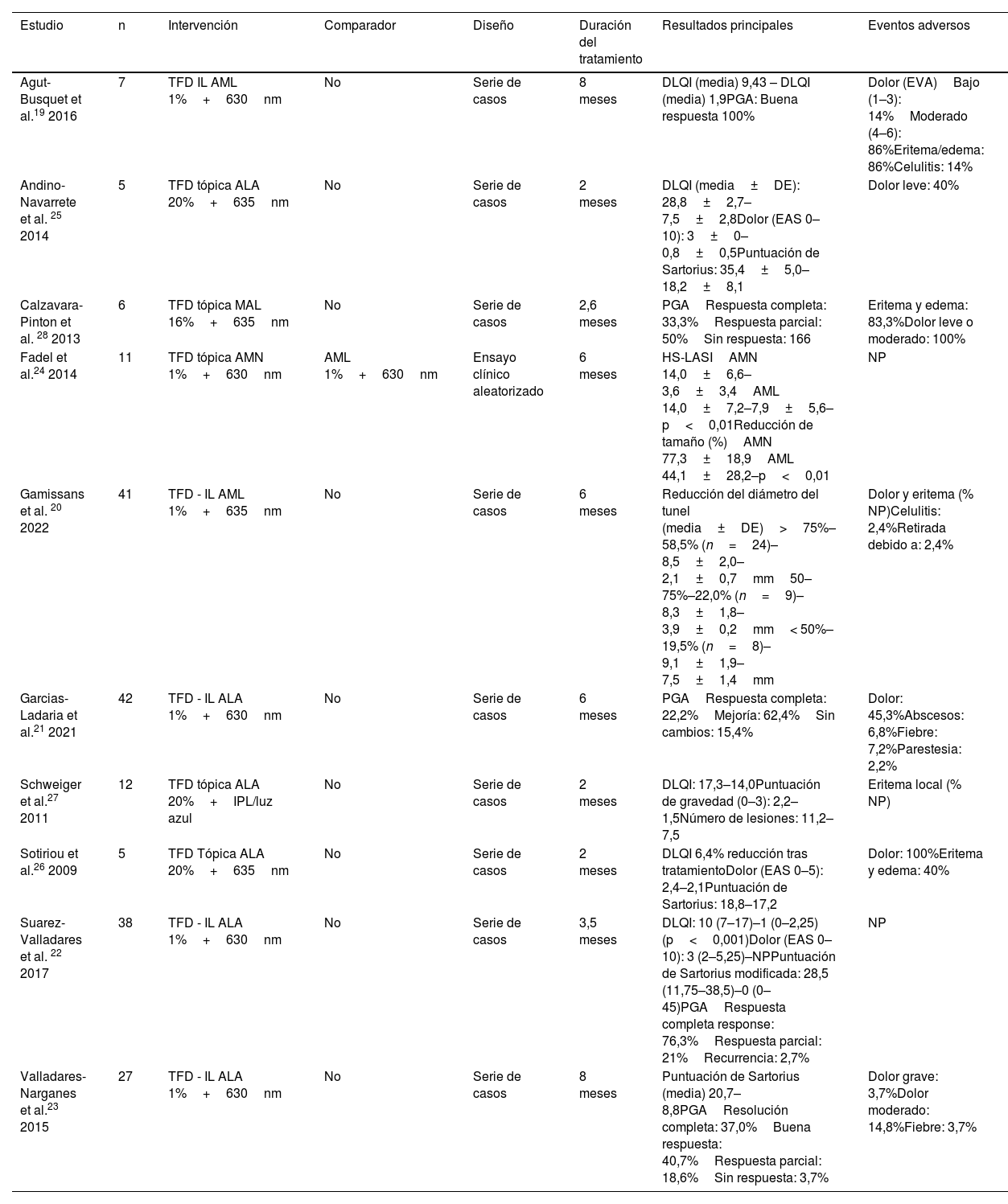
Resumen de los estudios incluidos que evalúan la terapia fotodinámica
| Estudio | n | Intervención | Comparador | Diseño | Duración del tratamiento | Resultados principales | Eventos adversos |
|---|---|---|---|---|---|---|---|
| Agut-Busquet et al.19 2016 | 7 | TFD IL AML 1%+630nm | No | Serie de casos | 8 meses | DLQI (media) 9,43 – DLQI (media) 1,9PGA: Buena respuesta 100% | Dolor (EVA)Bajo (1–3): 14%Moderado (4–6): 86%Eritema/edema: 86%Celulitis: 14% |
| Andino-Navarrete et al. 25 2014 | 5 | TFD tópica ALA 20%+635nm | No | Serie de casos | 2 meses | DLQI (media±DE): 28,8±2,7–7,5±2,8Dolor (EAS 0–10): 3±0–0,8±0,5Puntuación de Sartorius: 35,4±5,0–18,2±8,1 | Dolor leve: 40% |
| Calzavara-Pinton et al. 28 2013 | 6 | TFD tópica MAL 16%+635nm | No | Serie de casos | 2,6 meses | PGARespuesta completa: 33,3%Respuesta parcial: 50%Sin respuesta: 166 | Eritema y edema: 83,3%Dolor leve o moderado: 100% |
| Fadel et al.24 2014 | 11 | TFD tópica AMN 1%+630nm | AML 1%+630nm | Ensayo clínico aleatorizado | 6 meses | HS-LASIAMN 14,0±6,6–3,6±3,4AML 14,0±7,2–7,9±5,6–p<0,01Reducción de tamaño (%)AMN 77,3±18,9AML 44,1±28,2–p<0,01 | NP |
| Gamissans et al. 20 2022 | 41 | TFD - IL AML 1%+635nm | No | Serie de casos | 6 meses | Reducción del diámetro del tunel (media±DE)>75%–58,5% (n=24)–8,5±2,0–2,1±0,7mm50–75%–22,0% (n=9)–8,3±1,8–3,9±0,2mm< 50%–19,5% (n=8)–9,1±1,9–7,5±1,4mm | Dolor y eritema (% NP)Celulitis: 2,4%Retirada debido a: 2,4% |
| Garcias-Ladaria et al.21 2021 | 42 | TFD - IL ALA 1%+630nm | No | Serie de casos | 6 meses | PGARespuesta completa: 22,2%Mejoría: 62,4%Sin cambios: 15,4% | Dolor: 45,3%Abscesos: 6,8%Fiebre: 7,2%Parestesia: 2,2% |
| Schweiger et al.27 2011 | 12 | TFD tópica ALA 20%+IPL/luz azul | No | Serie de casos | 2 meses | DLQI: 17,3–14,0Puntuación de gravedad (0–3): 2,2–1,5Número de lesiones: 11,2–7,5 | Eritema local (% NP) |
| Sotiriou et al.26 2009 | 5 | TFD Tópica ALA 20%+635nm | No | Serie de casos | 2 meses | DLQI 6,4% reducción tras tratamientoDolor (EAS 0–5): 2,4–2,1Puntuación de Sartorius: 18,8–17,2 | Dolor: 100%Eritema y edema: 40% |
| Suarez-Valladares et al. 22 2017 | 38 | TFD - IL ALA 1%+630nm | No | Serie de casos | 3,5 meses | DLQI: 10 (7–17)–1 (0–2,25) (p<0,001)Dolor (EAS 0–10): 3 (2–5,25)–NPPuntuación de Sartorius modificada: 28,5 (11,75–38,5)–0 (0–45)PGARespuesta completa response: 76,3%Respuesta parcial: 21%Recurrencia: 2,7% | NP |
| Valladares-Narganes et al.23 2015 | 27 | TFD - IL ALA 1%+630nm | No | Serie de casos | 8 meses | Puntuación de Sartorius (media) 20,7–8,8PGAResolución completa: 37,0%Buena respuesta: 40,7%Respuesta parcial: 18,6%Sin respuesta: 3,7% | Dolor grave: 3,7%Dolor moderado: 14,8%Fiebre: 3,7% |
ALA: ácido aminolevulínico; AML: azul de metileno libre; AMN: azul de metileno niosomal; DE: desviación estándar; DLQI: Dermatology Life Quality Index; EVA: escala visual analógica; HS-LASI: HS lesion, area and severity index; IL: intralesional; IPL: intense pulsed light; MAL: aminolevulinato de metilo; nm: nanómetro; NP: no proporcionado; PGA: physician global assessment; TFD: terapia fotodinámica.
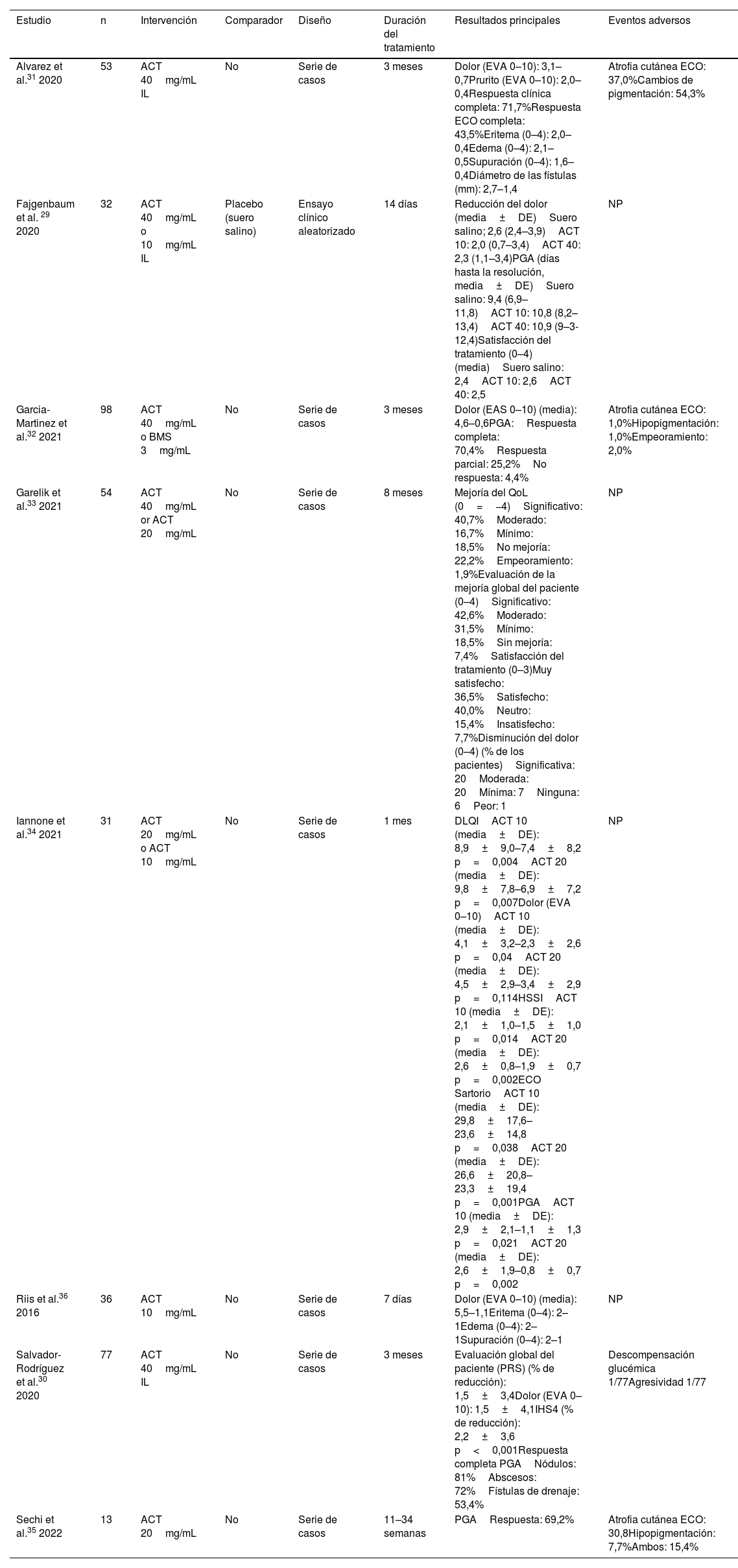
Resumen de los estudios incluidos que evalúan los corticosteroides intralesionales
| Estudio | n | Intervención | Comparador | Diseño | Duración del tratamiento | Resultados principales | Eventos adversos |
|---|---|---|---|---|---|---|---|
| Alvarez et al.31 2020 | 53 | ACT 40mg/mL IL | No | Serie de casos | 3 meses | Dolor (EVA 0–10): 3,1–0,7Prurito (EVA 0–10): 2,0–0,4Respuesta clínica completa: 71,7%Respuesta ECO completa: 43,5%Eritema (0–4): 2,0–0,4Edema (0–4): 2,1–0,5Supuración (0–4): 1,6–0,4Diámetro de las fístulas (mm): 2,7–1,4 | Atrofia cutánea ECO: 37,0%Cambios de pigmentación: 54,3% |
| Fajgenbaum et al. 29 2020 | 32 | ACT 40mg/mL o 10mg/mL IL | Placebo (suero salino) | Ensayo clínico aleatorizado | 14 días | Reducción del dolor (media±DE)Suero salino; 2,6 (2,4–3,9)ACT 10: 2,0 (0,7–3,4)ACT 40: 2,3 (1,1–3,4)PGA (días hasta la resolución, media±DE)Suero salino: 9,4 (6,9–11,8)ACT 10: 10,8 (8,2–13,4)ACT 40: 10,9 (9–3-12,4)Satisfacción del tratamiento (0–4) (media)Suero salino: 2,4ACT 10: 2,6ACT 40: 2,5 | NP |
| Garcia-Martinez et al.32 2021 | 98 | ACT 40mg/mL o BMS 3mg/mL | No | Serie de casos | 3 meses | Dolor (EAS 0–10) (media): 4,6–0,6PGA:Respuesta completa: 70,4%Respuesta parcial: 25,2%No respuesta: 4,4% | Atrofia cutánea ECO: 1,0%Hipopigmentación: 1,0%Empeoramiento: 2,0% |
| Garelik et al.33 2021 | 54 | ACT 40mg/mL or ACT 20mg/mL | No | Serie de casos | 8 meses | Mejoría del QoL (0=−4)Significativo: 40,7%Moderado: 16,7%Mínimo: 18,5%No mejoría: 22,2%Empeoramiento: 1,9%Evaluación de la mejoría global del paciente (0–4)Significativo: 42,6%Moderado: 31,5%Mínimo: 18,5%Sin mejoría: 7,4%Satisfacción del tratamiento (0–3)Muy satisfecho: 36,5%Satisfecho: 40,0%Neutro: 15,4%Insatisfecho: 7,7%Disminución del dolor (0–4) (% de los pacientes)Significativa: 20Moderada: 20Mínima: 7Ninguna: 6Peor: 1 | NP |
| Iannone et al.34 2021 | 31 | ACT 20mg/mL o ACT 10mg/mL | No | Serie de casos | 1 mes | DLQIACT 10 (media±DE): 8,9±9,0–7,4±8,2 p=0,004ACT 20 (media±DE): 9,8±7,8–6,9±7,2 p=0,007Dolor (EVA 0–10)ACT 10 (media±DE): 4,1±3,2–2,3±2,6 p=0,04ACT 20 (media±DE): 4,5±2,9–3,4±2,9 p=0,114HSSIACT 10 (media±DE): 2,1±1,0–1,5±1,0 p=0,014ACT 20 (media±DE): 2,6±0,8–1,9±0,7 p=0,002ECO SartorioACT 10 (media±DE): 29,8±17,6–23,6±14,8 p=0,038ACT 20 (media±DE): 26,6±20,8–23,3±19,4 p=0,001PGAACT 10 (media±DE): 2,9±2,1–1,1±1,3 p=0,021ACT 20 (media±DE): 2,6±1,9–0,8±0,7 p=0,002 | NP |
| Riis et al.36 2016 | 36 | ACT 10mg/mL | No | Serie de casos | 7 días | Dolor (EVA 0–10) (media): 5,5–1,1Eritema (0–4): 2–1Edema (0–4): 2–1Supuración (0–4): 2–1 | NP |
| Salvador-Rodríguez et al.30 2020 | 77 | ACT 40mg/mL IL | No | Serie de casos | 3 meses | Evaluación global del paciente (PRS) (% de reducción): 1,5±3,4Dolor (EVA 0–10): 1,5±4,1IHS4 (% de reducción): 2,2±3,6 p<0,001Respuesta completa PGANódulos: 81%Abscesos: 72%Fístulas de drenaje: 53,4% | Descompensación glucémica 1/77Agresividad 1/77 |
| Sechi et al.35 2022 | 13 | ACT 20mg/mL | No | Serie de casos | 11–34 semanas | PGARespuesta: 69,2% | Atrofia cutánea ECO: 30,8Hipopigmentación: 7,7%Ambos: 15,4% |
ACT: acetónido de triamcinolona; BMS: betametasona; DE: desviación estándar; EVA: escala visual analógica; ECO: ecografía; HSSI: hidradenitis suppurativa severity index IHS4: International Hidradenitis Suppurativa Severity Score System; IL: intralesional; NP: no proporcionado; PGA: physician global assessment; QoL: quality of life.
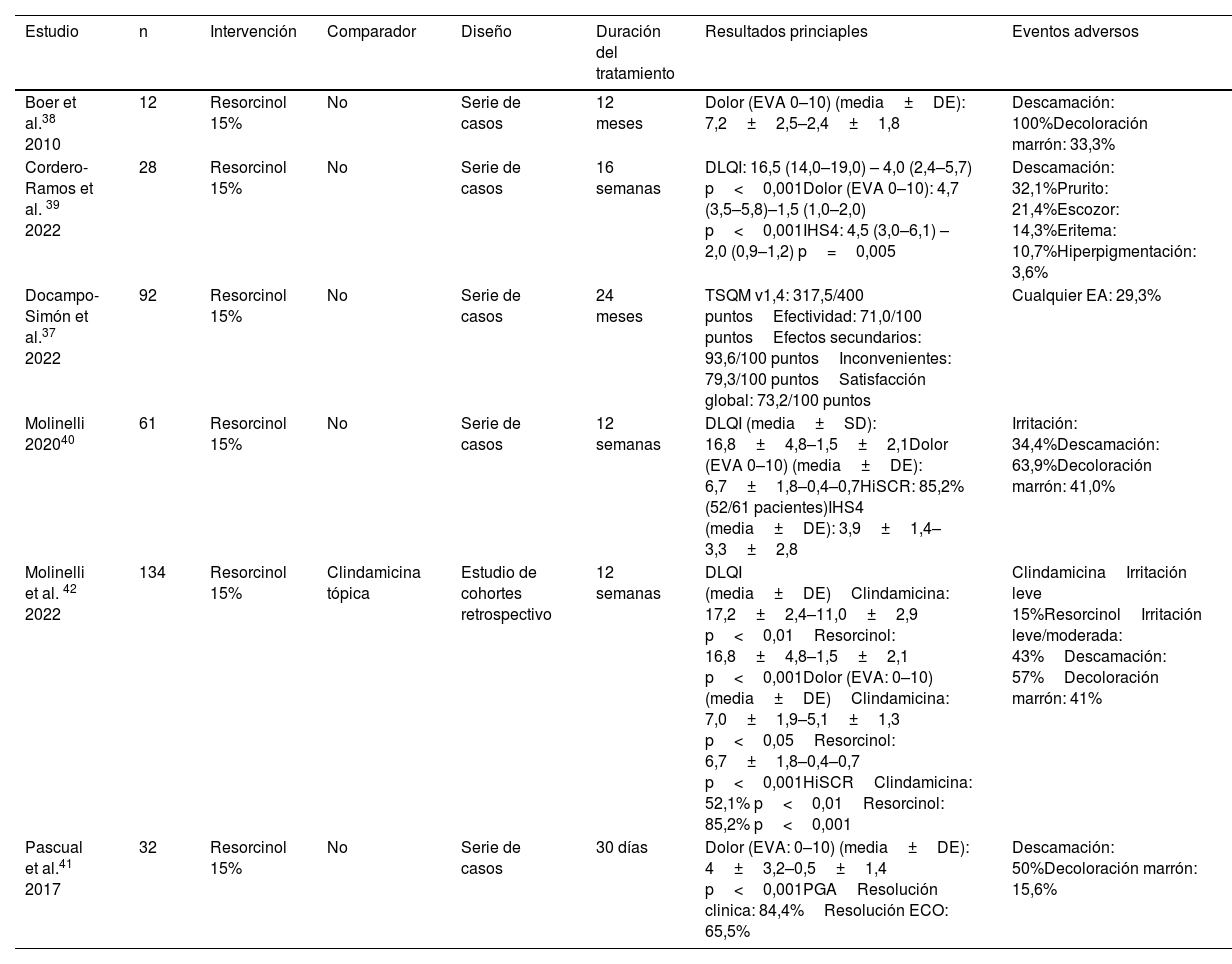
Resumen de los estudios incluidos que evalúan el resorcinol tópico
| Estudio | n | Intervención | Comparador | Diseño | Duración del tratamiento | Resultados princiaples | Eventos adversos |
|---|---|---|---|---|---|---|---|
| Boer et al.38 2010 | 12 | Resorcinol 15% | No | Serie de casos | 12 meses | Dolor (EVA 0–10) (media±DE): 7,2±2,5–2,4±1,8 | Descamación: 100%Decoloración marrón: 33,3% |
| Cordero-Ramos et al. 39 2022 | 28 | Resorcinol 15% | No | Serie de casos | 16 semanas | DLQI: 16,5 (14,0–19,0) – 4,0 (2,4–5,7) p<0,001Dolor (EVA 0–10): 4,7 (3,5–5,8)–1,5 (1,0–2,0) p<0,001IHS4: 4,5 (3,0–6,1) – 2,0 (0,9–1,2) p=0,005 | Descamación: 32,1%Prurito: 21,4%Escozor: 14,3%Eritema: 10,7%Hiperpigmentación: 3,6% |
| Docampo-Simón et al.37 2022 | 92 | Resorcinol 15% | No | Serie de casos | 24 meses | TSQM v1,4: 317,5/400 puntosEfectividad: 71,0/100 puntosEfectos secundarios: 93,6/100 puntosInconvenientes: 79,3/100 puntosSatisfacción global: 73,2/100 puntos | Cualquier EA: 29,3% |
| Molinelli 202040 | 61 | Resorcinol 15% | No | Serie de casos | 12 semanas | DLQI (media±SD): 16,8±4,8–1,5±2,1Dolor (EVA 0–10) (media±DE): 6,7±1,8–0,4–0,7HiSCR: 85,2% (52/61 pacientes)IHS4 (media±DE): 3,9±1,4–3,3±2,8 | Irritación: 34,4%Descamación: 63,9%Decoloración marrón: 41,0% |
| Molinelli et al. 42 2022 | 134 | Resorcinol 15% | Clindamicina tópica | Estudio de cohortes retrospectivo | 12 semanas | DLQI (media±DE)Clindamicina: 17,2±2,4–11,0±2,9 p<0,01Resorcinol: 16,8±4,8–1,5±2,1 p<0,001Dolor (EVA: 0–10) (media±DE)Clindamicina: 7,0±1,9–5,1±1,3 p<0,05Resorcinol: 6,7±1,8–0,4–0,7 p<0,001HiSCRClindamicina: 52,1% p<0,01Resorcinol: 85,2% p<0,001 | ClindamicinaIrritación leve 15%ResorcinolIrritación leve/moderada: 43%Descamación: 57%Decoloración marrón: 41% |
| Pascual et al.41 2017 | 32 | Resorcinol 15% | No | Serie de casos | 30 días | Dolor (EVA: 0–10) (media±DE): 4±3,2–0,5±1,4 p<0,001PGAResolución clinica: 84,4%Resolución ECO: 65,5% | Descamación: 50%Decoloración marrón: 15,6% |
DE: desviación estándar; DLQI: Dermatology Life Quality Index; EVA: escala visual analógica; ECO: ecografía; HiSCR: hidradenitis suppurativa clinical response; IHS4: International Hidradenitis Suppurativa Severity Score System; PGA: physician global assessment; TSQM: treatment questionnaire for medication.
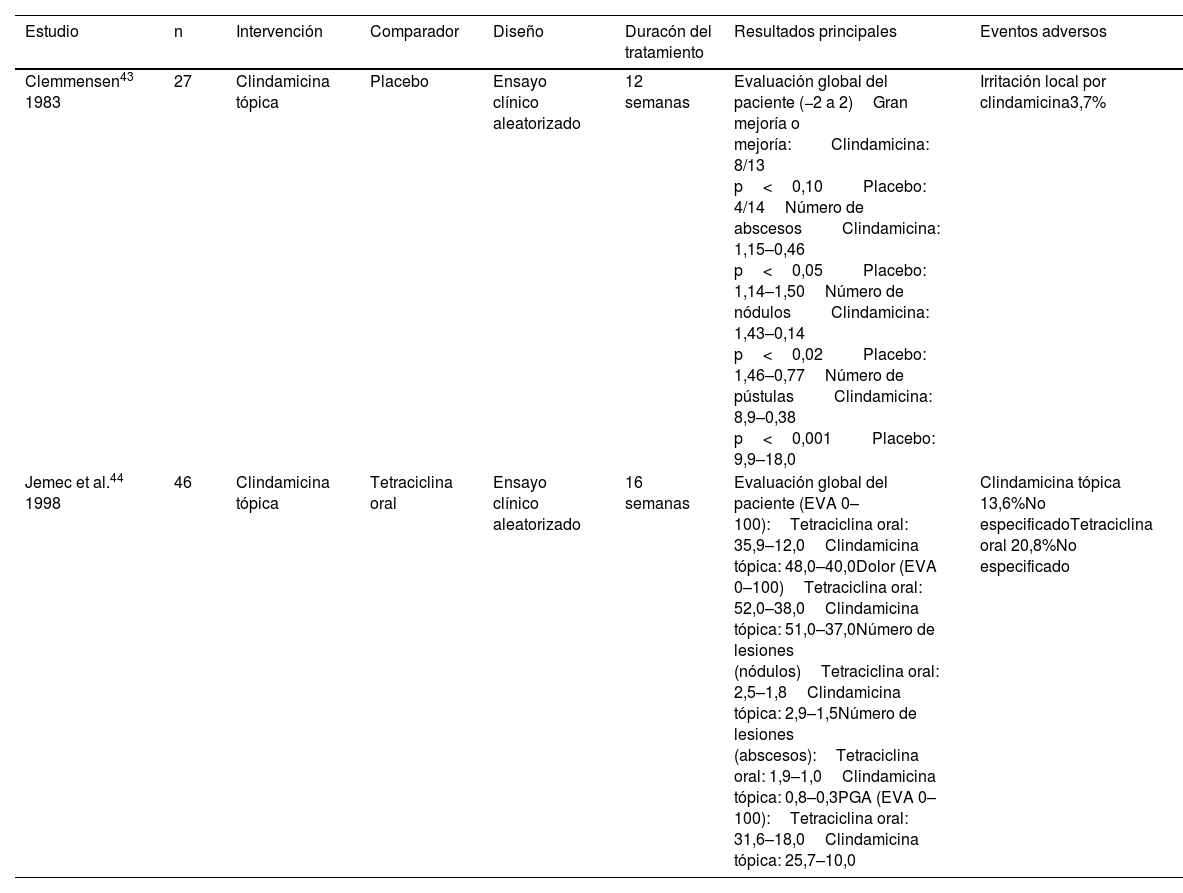
Resumen de los estudios incluidos que evalúan los antibióticos tópicos
| Estudio | n | Intervención | Comparador | Diseño | Duracón del tratamiento | Resultados principales | Eventos adversos |
|---|---|---|---|---|---|---|---|
| Clemmensen43 1983 | 27 | Clindamicina tópica | Placebo | Ensayo clínico aleatorizado | 12 semanas | Evaluación global del paciente (−2 a 2)Gran mejoría o mejoría:Clindamicina: 8/13 p<0,10Placebo: 4/14Número de abscesosClindamicina: 1,15–0,46 p<0,05Placebo: 1,14–1,50Número de nódulosClindamicina: 1,43–0,14 p<0,02Placebo: 1,46–0,77Número de pústulasClindamicina: 8,9–0,38 p<0,001Placebo: 9,9–18,0 | Irritación local por clindamicina3,7% |
| Jemec et al.44 1998 | 46 | Clindamicina tópica | Tetraciclina oral | Ensayo clínico aleatorizado | 16 semanas | Evaluación global del paciente (EVA 0–100):Tetraciclina oral: 35,9–12,0Clindamicina tópica: 48,0–40,0Dolor (EVA 0–100)Tetraciclina oral: 52,0–38,0Clindamicina tópica: 51,0–37,0Número de lesiones (nódulos)Tetraciclina oral: 2,5–1,8Clindamicina tópica: 2,9–1,5Número de lesiones (abscesos):Tetraciclina oral: 1,9–1,0Clindamicina tópica: 0,8–0,3PGA (EVA 0–100):Tetraciclina oral: 31,6–18,0Clindamicina tópica: 25,7–10,0 | Clindamicina tópica 13,6%No especificadoTetraciclina oral 20,8%No especificado |
DE: desviación estándar; DLQI: Dermatology Life Quality Index; EVA: escala visual analógica; HiSCR: hidradenitis suppurativa clinical response; PGA: physician global assessment.
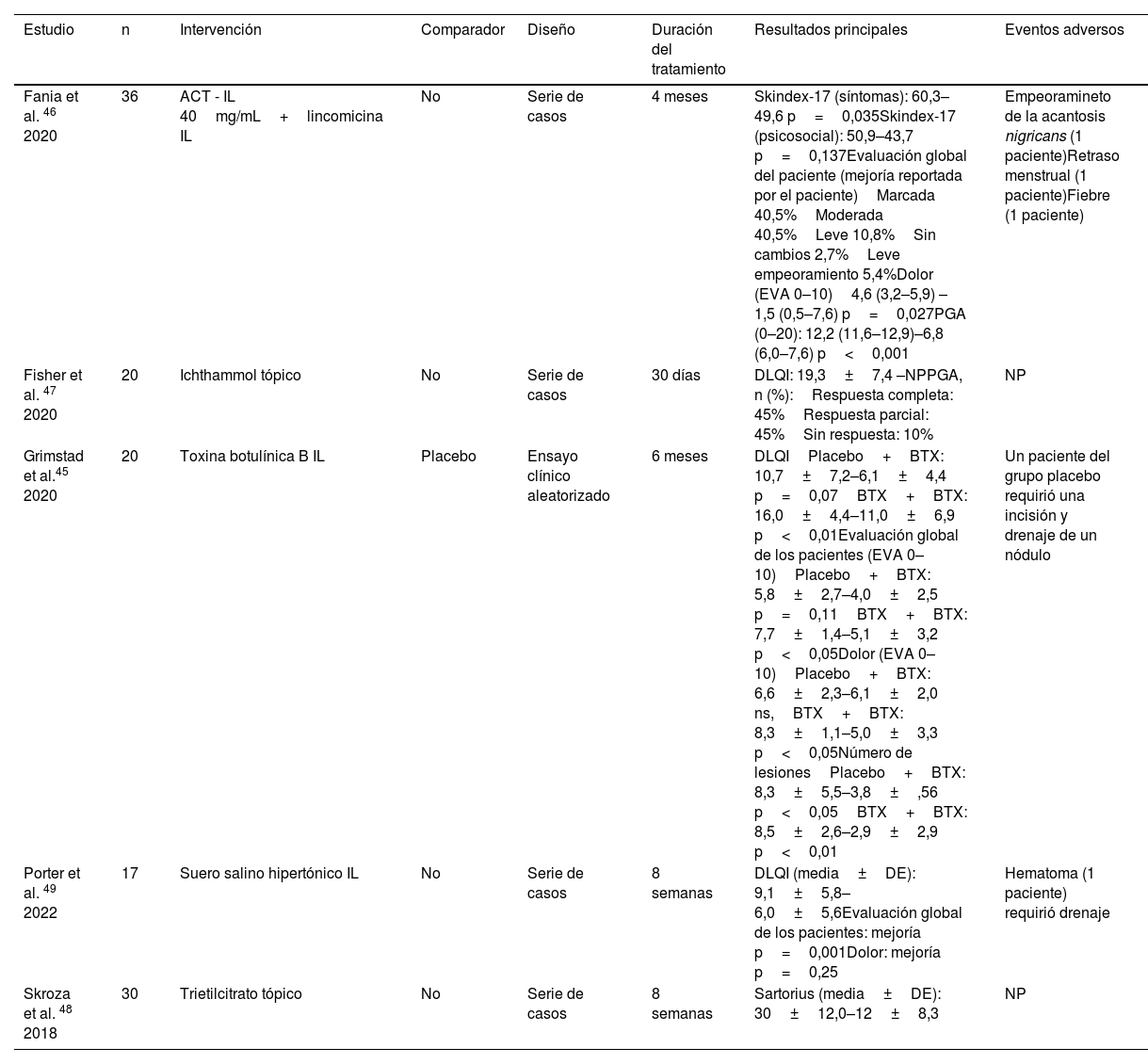
Resumen de los estudios incluidos con otras intervenciones
| Estudio | n | Intervención | Comparador | Diseño | Duración del tratamiento | Resultados principales | Eventos adversos |
|---|---|---|---|---|---|---|---|
| Fania et al. 46 2020 | 36 | ACT - IL 40mg/mL+lincomicina IL | No | Serie de casos | 4 meses | Skindex-17 (síntomas): 60,3–49,6 p=0,035Skindex-17 (psicosocial): 50,9–43,7 p=0,137Evaluación global del paciente (mejoría reportada por el paciente)Marcada 40,5%Moderada 40,5%Leve 10,8%Sin cambios 2,7%Leve empeoramiento 5,4%Dolor (EVA 0–10)4,6 (3,2–5,9) – 1,5 (0,5–7,6) p=0,027PGA (0–20): 12,2 (11,6–12,9)–6,8 (6,0–7,6) p<0,001 | Empeoramineto de la acantosis nigricans (1 paciente)Retraso menstrual (1 paciente)Fiebre (1 paciente) |
| Fisher et al. 47 2020 | 20 | Ichthammol tópico | No | Serie de casos | 30 días | DLQI: 19,3±7,4 –NPPGA, n (%):Respuesta completa: 45%Respuesta parcial: 45%Sin respuesta: 10% | NP |
| Grimstad et al.45 2020 | 20 | Toxina botulínica B IL | Placebo | Ensayo clínico aleatorizado | 6 meses | DLQIPlacebo+BTX: 10,7±7,2–6,1±4,4 p=0,07BTX+BTX: 16,0±4,4–11,0±6,9 p<0,01Evaluación global de los pacientes (EVA 0–10)Placebo+BTX: 5,8±2,7–4,0±2,5 p=0,11BTX+BTX: 7,7±1,4–5,1±3,2 p<0,05Dolor (EVA 0–10)Placebo+BTX: 6,6±2,3–6,1±2,0 ns,BTX+BTX: 8,3±1,1–5,0±3,3 p<0,05Número de lesionesPlacebo+BTX: 8,3±5,5–3,8±,56 p<0,05BTX+BTX: 8,5±2,6–2,9±2,9 p<0,01 | Un paciente del grupo placebo requirió una incisión y drenaje de un nódulo |
| Porter et al. 49 2022 | 17 | Suero salino hipertónico IL | No | Serie de casos | 8 semanas | DLQI (media±DE): 9,1±5,8–6,0±5,6Evaluación global de los pacientes: mejoría p=0,001Dolor: mejoría p=0,25 | Hematoma (1 paciente) requirió drenaje |
| Skroza et al. 48 2018 | 30 | Trietilcitrato tópico | No | Serie de casos | 8 semanas | Sartorius (media±DE): 30±12,0–12±8,3 | NP |
ACT: acetónido de triamcinolona; BTX: toxina botulínica; DE: desviación estándar; DLQI: Dermatology Life Quality Index; EVA: escala visual analógica; IL: intralesional; NP: no proporcionado; ns: no significativo: PGA: physician global assessment.
La mayoría de los trabajos informaron sobre series de casos (n=25), con solo cinco ECA y un único estudio de cohortes. Los ECA exploraron una variedad de intervenciones: TFD tópica, comparando una formulación de azul de metileno niosomal al 1% (AMN) con azul de metileno libre (AML)24, corticosteroides IL, contrastando acetónido de triamcinolona (ACT) con solución salina normal29, clindamicina tópica, comparada con tetraciclina oral44 o placebo43, y toxina botulínica tipo B (BTX) vs. placebo45. El estudio de cohortes contrastó la clindamicina tópica con el resorcinol tópico42. Las 25 series de casos restantes evaluaron las intervenciones y otras como la combinación de corticosteroides IL y lincomicina46, ictiamol tópico47, citrato de trietilo tópico48 o solución salina hipertónica IL49.
Considerando los resultados primarios, 14 estudios proporcionaron datos sobre la CdV, 12 de los cuales utilizaron el DLQI19,22,25–27,33,34,39,40,42,45–47,49. Mientras tanto, 23 informaron de la frecuencia de pacientes con, al menos, un EA19-21,23,25-28,30-32,35,37-46,49. Los resultados restantes se evaluaron en un número menor de estudios: evaluación global por el paciente del estado de la enfermedad (n=7)24,30,33,43-45,49, dolor (n=20)22,23,25,26,29-34,36,38-42,44,45,49, prurito31 (n=1), actividad de la enfermedad (n=17)20,22-27,30,34,36,39,40,42,44,45,48,49 evaluación global del médico (n=16)19,21-23,28-32,34,35,41,44,46,47,49 y satisfacción con el tratamiento (n=4)29,33,37,46 (Anexo, tabla 5).
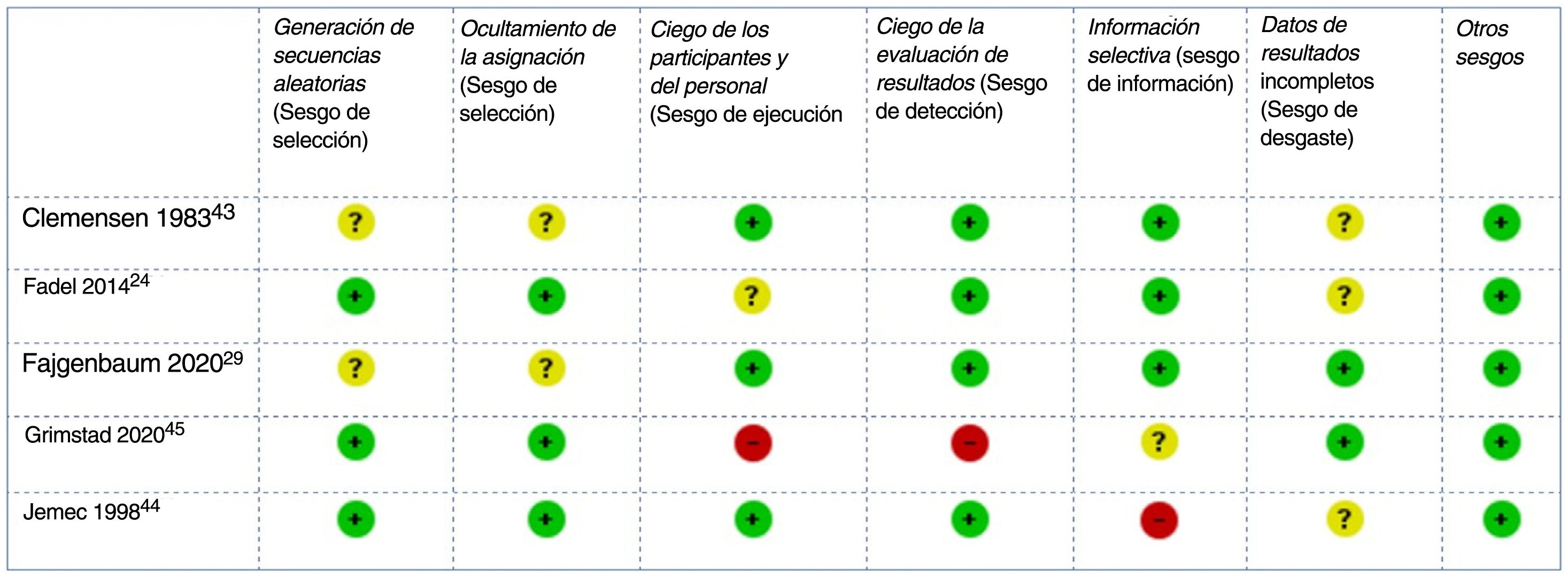
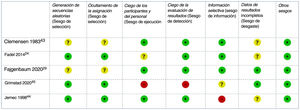
El RoB de los ensayos clínicos incluidos se consideró bajo para tres y alto para dos44,45 estudios: el primero con un riesgo elevado de sesgo de desgaste debido a retiradas no equilibradas y a un análisis por protocolo44, el segundo con un alto riesgo de sesgo de rendimiento y detección debido a su diseño abierto45 (fig. 2). El RoB del único estudio de cohortes también se consideró bajo42.
Terapia fotodinámicaUn total de 10 estudios investigaron el uso de la TFD, incluyendo 194 pacientes19-28. Estos estudios incluyeron cinco series de casos retrospectivas19-21,28, cinco series de casos prospectivos22,23,25-27 y un ECA intraindividual de cuerpo dividido24. El tipo de lesiones abarcadas fue heterogéneo, ya que se consideraron nódulos, abscesos y fístulas. La mayoría de los informes sobre TFD-IL se centran en el tratamiento de las fístulas. Se han evaluado tres fotosensibilizadores diferentes: azul de metileno (AM), ácido 5-aminolevulínico (ALA) y aminolevulinato de metilo (MAL). También se han estudiado diferentes fuentes y longitudes de onda. Tanto la DLP tópica como la TFD-IL proporcionan datos similares sobre eficacia, aunque la aplicación tópica se asocia a menos EA. El EA notificado con más frecuencia fue el dolor durante el tratamiento, con hasta 100% de los pacientes que notificaron dolor en algunos estudios. La ecografía (ECO) se utilizó para medir la respuesta en tres series de casos19,20,23.
Un único ECA con bajo riesgo de sesgo evaluó el perfil de eficacia de la TFD tópica con AMN en comparación con el AML24. Este estudio mostró una mayor mejoría de la actividad de la HS cuando se utilizó el AMN (AMN, 75,9% vs. AML, 46,3% de mejoría). Además, también reveló una mayor reducción del tamaño de la fístula. Sin embargo, no se aportaron datos de CdV ni de seguridad.
Corticosteroides intralesionalesHan evaluado el tratamiento con corticosteroides para la HS ocho estudios, incluyendo un total de 394 pacientes. Todas las publicaciones se han centrado en el uso de corticosteroides IL29-36; en nuestra SLR no se consideraron publicaciones sobre corticosteroides tópicos. Se incluyeron un ECA29, cuatro prospectivos30,31,34,36 y tres series de casos retrospectivas32,33,35. Los estudios engloban lesiones agudas, nódulos o abscesos, lesiones crónicas más persistentes y fístulas. El ACT fue el corticosteroide estudiado con mayor frecuencia, con dosis que oscilaban entre 10mg/mL y 40mg/mL. Los EA oscilaron entre 2 y 56% de los casos en cada estudio, siendo la atrofia cutánea y la hipopigmentación los más frecuentes. La ECO se utilizó para la liberación del tratamiento o para determinar la respuesta en cinco estudios30-32,34,35.
Un ECA reciente evaluó dos dosis IL de ATC (40mg/mL [ATC40] y 10mg/mL [ATC10]) frente a placebo (solución salina normal)29. Este ECA no encontró diferencias significativas entre ninguno de los brazos de tratamiento activo y el placebo. La reducción del dolor cinco días después del tratamiento, evaluada con una escala visual analógica (EVA) de 0-10, fue similar en todos los brazos (TCA40 2,3 vs. TCA10 2,0 vs. placebo 2,6). Otros resultados, como la duración media de las lesiones hasta su resolución y la satisfacción con el tratamiento, también fueron similares entre los grupos.
Resorcinol tópicoSeis publicaciones han evaluado el perfil de eficacia y seguridad del resorcinol tópico al 15% para la HS, incluyendo un total de 359 pacientes37-42. Tres estudios fueron series de casos prospectivas39-41, dos fueron series de casos retrospectivas37,38, y un estudio de cohortes retrospectivo evaluó el perfil de eficacia del resorcinol al 15% frente a la clindamicina tópica al 1%. El resorcinol fue superior a la clindamicina en la mejoría del International Hidradenitis Suppurativa Severity Score System (IHS4), hidradenitis suppurativa clinical response (HiSCR), dolor y DLQI42.
Ningún ECA ha evaluado la eficacia o el perfil de seguridad del resorcinol tópico. Los pacientes incluidos presentaban un estado de la enfermedad más leve (Hurley I y II), y las lesiones tratadas eran principalmente nódulos y abscesos. Un total de 15% de resorcinol se asoció a una mejoría del DLQI, el dolor y la actividad de la HS, determinada por el IHS4 o el HiSCR, y a una elevada satisfacción con el tratamiento. Se produjeron EA en 29-100% de los pacientes, siendo la descamación y la pigmentación marrón reversible los signos más frecuentes. En tres publicaciones se utilizó la ECO para evaluar la eficacia39-41.
AntibióticosDos ECA exploraron el uso de antibióticos tópicos para la HS incluyendo a 73 pacientes43,44. El primero, evaluó la eficacia y el perfil de seguridad de la clindamicina tópica 1% vs. placebo43. La evaluación de los síntomas por parte de los pacientes se realizó mediante un diario de síntomas, en el que con cada entrada se sumaban hasta dos puntos si estos notaban mejoría clínica, y se restaban hasta dos puntos en caso de empeoramiento. Se registró una diferencia estadísticamente significativa entre el grupo de clindamicina tópica y el grupo placebo (media, +311 y −91, respectivamente). El número de nódulos inflamatorios, abscesos y pústulas mostró una reducción significativa en los pacientes en tratamiento activo. En cuanto a los EA, solo se notificó un episodio de irritación local (3,7%). El segundo ECA comparó la clindamicina tópica al 1% con las tetraciclinas orales44. Al realizar esta comparación, no se encontraron diferencias significativas entre ambos tratamientos. En cuanto a la seguridad, se describieron tres EA en el grupo de tetraciclina oral frente a cinco en el grupo de clindamicina tópica, aunque no se proporcionó ninguna descripción adicional.
Otras intervencionesEn cuanto a otras intervenciones tópicas o IL, un único ECA evaluó el perfil de eficacia de un ciclo de tres meses de inyecciones de BTX vs. placebo, seguido de tres meses de BTX en ambos grupos45. A los tres meses, la CdV mejoró 6,6% en el grupo de BTX (DLQI basal BTX: 16 vs. DLQI tres meses BTX: 9,9), y 0,9% en el grupo placebo. Por último, cuatro series de casos informaron sobre la combinación IL de TCA40 y lincomicina46, ictiamol tópico al 10%47, citrato de trietilo tópico al 1% y linoleato de etilo péptido G48, o solución salina hipertónica IL49. Esta última publicación informó de una mejora significativa en el DLQI y el número de lesiones. Todas las publicaciones sobre lavados antisépticos cumplían los criterios para ser incluidas en esta SLR.
DiscusiónHasta donde sabemos, esta es la primera SLR realizada sobre tratamientos tópicos e IL para la HS. Varias revisiones sistemáticas en los últimos cinco años han evaluado la eficacia o el perfil de seguridad de los tratamientos para la HS: Robert et al.62, Gracia et al.63 y Cuenca-Barrales et al.64. La primera se centra en terapias sistémicas y láser (incluyendo TFD), la segunda en tratamientos lumínicos, y por tanto incluye datos sobre TFD, mientras que la última se enfoca exclusivamente en terapias IL. Desde esta última SLR, se han publicado tres nuevos estudios sobre tratamientos IL que se han recogido en nuestra SLR34,35,49. Una revisión Cochrane previa publicada por Ingram et al., hace ocho años evaluó todas las intervenciones disponibles para la HS10; siguiendo las recomendaciones Cochrane, los autores incluyeron exclusivamente ECA, el mejor diseño para aportar datos sobre opciones terapéuticas. Sin embargo, los resultados muestran escasa evidencia sobre terapias poco estudiadas, como las tópicas y las IL, incluyéndose solo tres publicaciones43,44,65. No se consideraron los datos de los 29 estudios restantes tomados en cuenta en nuestra SLR, incluidos dos ECA publicados recientemente. Por último, debemos mencionar que ninguna de estas revisiones abordó estudios sobre resorcinol tópico ni BTX. Los estudios incluidos en nuestra SLR presentaban un alto grado de heterogeneidad en cuanto a las características de los pacientes, el tipo de lesiones, los resultados evaluados y el periodo de seguimiento. Esto subraya la necesidad de llegar a un consenso sobre los dominios centrales de resultados que deben evaluarse en los estudios de pacientes con HS66. Este ha demostrado ser un camino exitoso en otras enfermedades, como la artritis reumatoide, estableciendo un conjunto de dominios centrales de resultados a través de OMERACT, que se han aplicado universalmente en los estudios realizados desde entonces67. Además, la ECO se utilizó en 12 de los 31 estudios incluidos en esta revisión, tanto como ayuda para la administración del tratamiento como para evaluar el perfil de eficacia19,20,23,30-32,34,39-41,49. Este hallazgo refuerza la utilidad de la ECO en el manejo de los pacientes con HS. Por otro lado, la historia natural de la HS complica la evaluación del perfil de eficacia de los tratamientos tópicos para nódulos y abscesos. Von der Werth et al. describieron que los nódulos y abscesos suelen resolverse en siete a 10 días incluso sin tratamiento68, lo que pone de relieve la necesidad de un comparador para establecer la eficacia. Por ejemplo, todas las lesiones en las que se utilizó resorcinol fueron nódulos y abscesos. No obstante, algunos resultados, como la satisfacción del paciente, pueden respaldar indirectamente la eficacia37.
En la última década se ha producido un aumento de las opciones de tratamiento de la HS moderada y grave, con la aprobación del adalimumab por la Agencia Europea del Medicamento (EMA) y varios fármacos nuevos en busca de aprobación. Este mayor esfuerzo de la industria farmacéutica se ha centrado en las formas moderadas o graves de la HS, lo que ha dado lugar a un mayor número de estudios científicos de alta calidad (ECA) en estos subtipos de pacientes69-72. Sin embargo, la evidencia que respalda el tratamiento de las formas leves de la enfermedad sigue siendo escasa. La HS leve suele ser el escalón que conduce a las formas moderadas o graves. Además, incluso las formas leves de la enfermedad tienen un impacto en la CdV73. El uso de fármacos tópicos e IL, utilizados habitualmente en la práctica clínica en las formas leves, no está en general respaldado por ECA. Este hecho se pone de manifiesto en la presente SLR y exige el desarrollo de un ECA para determinar el perfil de eficacia y seguridad de dichos tratamientos, independientemente de los intereses farmacéuticos. Aunque los EA parecen estar asociados al uso de terapias tópicas e IL, estos son, en general, leves y no requieren la interrupción del tratamiento.
Los resultados relativos a la TFD sugieren que podría ser un procedimiento eficaz y bien tolerado, siendo el principal EA, el dolor. En cuanto a los corticoides IL, aunque el estudio realizado por Fajgenbaum et al.29 está metodológicamente bien diseñado, dos limitaciones dificultan su validez externa, el pequeño volumen de corticoides utilizado (0,1mL) y el tamaño reducido de la muestra. Las publicaciones sobre el resorcinol podrían sugerir un buen perfil de eficacia y seguridad, pero carecen de un grupo de control. Un único estudio de cohortes confirmó la superioridad del resorcinol sobre la clindamicina tópica, destacando una alternativa terapéutica que podría evitar la aparición de la resistencia a los antibióticos. Por último, un único ECA con BTX sugiere eficacia; un posible mecanismo de acción podría ser su efecto anhidrótico que podría cambiar la microbiota cutánea.
La guía de la Asociación Británica de Dermatólogos sobre el manejo de pacientes con HS solo incluye dos tratamientos tópicos o IL en sus recomendaciones: clindamicina tópica y corticoides IL, este último, exclusivamente para lesiones agudas. Ambos tratamientos se clasifican como recomendaciones fuertes, ya que los beneficios superan a los riesgos. Las directrices europeas sobre el tratamiento de la HS sugieren74 el uso de resorcinol tópico, adapaleno y ácido azelaico. También se menciona el uso de corticosteroides IL y, como tratamientos experimentales, BTX y TFD. Sin embargo, en su algoritmo final solo se incluye la clindamicina tópica para las formas leves8. Las guías norteamericanas sobre el manejo de la HS recomiendan limpiadores cutáneos y queratolíticos, clindamicina tópica y corticosteroides IL11. Como vemos, las guías son heterogéneas en su recomendación de terapias tópicas e IL, muchas veces basadas en preferencias de expertos y no en el soporte de la evidencia.
Esta SLR adolece de algunas limitaciones. Se tomaron todas las precauciones para recopilar toda la información disponible, con una amplia búsqueda en tres bases de datos. Los estudios incluidos muestran un amplio grado de heterogeneidad con respecto a la intervención, la población, el diseño del estudio, los resultados y las escalas, y el análisis de los datos. De hecho, la heterogeneidad de las intervenciones, junto con la falta de un comparador en la mayoría de los estudios, ha impedido el desarrollo del metaanálisis previsto. Además, los periodos de seguimiento en muchos de estos estudios son cortos, sin que se pueda profundizar en la administración prolongada de estas terapias.
En conclusión, aunque cada vez hay más interés y más estudios sobre la HS, la calidad de las pruebas que respaldan el uso de tratamientos tópicos individuales o IL en esta enfermedad es muy baja, con un apoyo condicional hacia la clindamicina tópica, la TFD con AMN y BTX. Se agradecería la realización de más ECA adecuadamente diseñados, con resultados estandarizados y poblaciones de pacientes y lesiones homogéneas para respaldar las decisiones de la práctica clínica.
FinanciaciónEste trabajo no ha recibido ninguna financiación.
Conflicto de interesesJ.C. Pascual declara ser consultor de Abbvie, Novartis y UCB en el campo de la HS. R. Hernández-Quiles, V. Sánchez-García A. Viudez-Martínez, I. Belinchón y F. Siver declaran no tener ningún conflicto de intereses.