La dermatitis atópica (DA) tiene un impacto negativo significativo en la calidad de vida de los pacientes, que incluye prurito, alteraciones del sueño y estrés potencial entre los familiares1,2. Actualmente, más del 20% de los niños de los países del primer mundo tienen DA, y en muchos casos la enfermedad comienza dentro de los dos primeros años de vida2. Los casos graves de DA en niños representan <10%3. El conocimiento creciente de la patogenia de la DA se traduce en nuevos objetivos y vías terapéuticos4. Las nuevas terapias dirigidas, tales como los inhibidores de la quinasa Janus (JAK) y los bloqueantes de interleucina 4/13 (IL-4/13) o IL-13 han sido aprobadas recientemente para tratar la DA en la población adulta5. Sin embargo, los fármacos con un ratio beneficio-riesgo favorable siguen siendo limitados en los niños3. El tratamiento a largo plazo con corticosteroides sistémicos se desaconseja firmemente en los niños. Los inmunosupresores sistémicos se utilizan fuera de indicación en los pacientes pediátricos cuya DA está controlada de manera inadecuada por los tratamientos tópicos sin fuerte evidencia que respalde su uso en niños3,6. Dupilumab - un anticuerpo monoclonal que inhibe la vía de señalización de interleucina IL-4/IL-13 – ha sido aprobado tanto por la FDA (Food and Drug Administration) como por la EMA (European Medicines Agency) para los niños ≥6 a <12 años con DA de moderada a grave que requieren tratamientos sistémicos3,6. Además de este grupo (6 a 12 años), dupilumab para el tratamiento de DA severa incontrolada ha sido aprobado recientemente para su uso en niños de 6 meses a 5 años7 por parte de la FDA, pero no aún por la EMA, lo cual significa que escasean las series sobre experiencia en el mundo real en los niños ≥6 meses a <12 años8–10.
Se realizó un estudio unicéntrico de una serie de casos de niños ≥6 meses a <12 años con DA de moderada a grave, que fueron tratados mensualmente con 200mg o 300mg de dupilumab de junio a diciembre de 2022 en la unidad de dermatología de un centro de atención terciaria de España. Las variables del estudio medidas incluyeron los datos demográficos de los pacientes, las comorbilidades atópicas clásicas (asma, rinitis, conjuntivitis, alergia alimentaria o ambiental, y esofagitis eosinofílica) y dosis de dupilumab (Tabla 1). La gravedad de la enfermedad se midió utilizando las escalas EASI (Eczema Area and Severity Index), BSA (Body Surface Area), IGA (Investigator Global Assessment) validada para DA, siendo evaluada la mejora de la calidad del sueño por los padres en la visita basal y en las semanas 4, 16 y 24. El criterio de valoración primario fue evaluar la eficacia de dupilumab mediante el logro de un valor global de EASI<3 e IGA 0 o 1 a las 4, 16 y 24 semanas de seguimiento. El criterio de valoración secundario fue evaluar la seguridad de dupilumab durante el seguimiento. Las variables cuantitativas fueron expresadas como mediana (± desviación estándar y/o rangos), y las cualitativas como frecuencias.
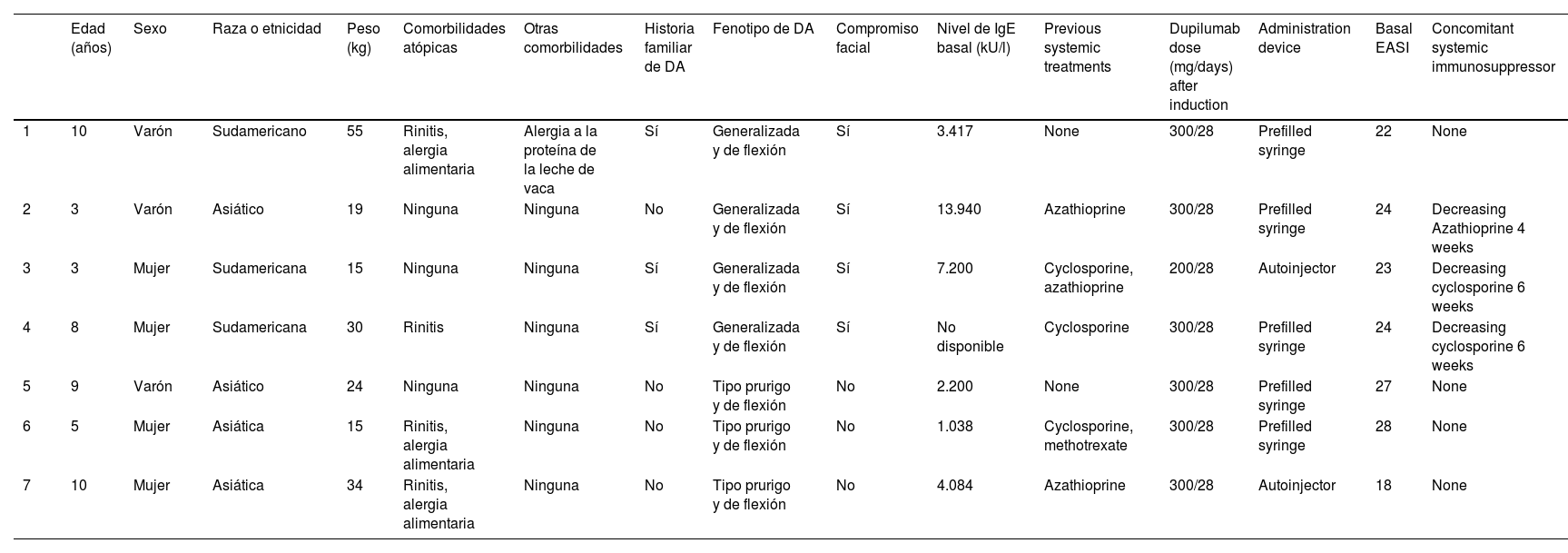
Datos demográficos, comorbilidades, tratamientos sistémicos previos, dosis de dupilumab y dispositivos de administración de los pacientes
| Edad (años) | Sexo | Raza o etnicidad | Peso (kg) | Comorbilidades atópicas | Otras comorbilidades | Historia familiar de DA | Fenotipo de DA | Compromiso facial | Nivel de IgE basal (kU/l) | Previous systemic treatments | Dupilumab dose (mg/days) after induction | Administration device | Basal EASI | Concomitant systemic immunosuppressor | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 10 | Varón | Sudamericano | 55 | Rinitis, alergia alimentaria | Alergia a la proteína de la leche de vaca | Sí | Generalizada y de flexión | Sí | 3.417 | None | 300/28 | Prefilled syringe | 22 | None |
| 2 | 3 | Varón | Asiático | 19 | Ninguna | Ninguna | No | Generalizada y de flexión | Sí | 13.940 | Azathioprine | 300/28 | Prefilled syringe | 24 | Decreasing Azathioprine 4 weeks |
| 3 | 3 | Mujer | Sudamericana | 15 | Ninguna | Ninguna | Sí | Generalizada y de flexión | Sí | 7.200 | Cyclosporine, azathioprine | 200/28 | Autoinjector | 23 | Decreasing cyclosporine 6 weeks |
| 4 | 8 | Mujer | Sudamericana | 30 | Rinitis | Ninguna | Sí | Generalizada y de flexión | Sí | No disponible | Cyclosporine | 300/28 | Prefilled syringe | 24 | Decreasing cyclosporine 6 weeks |
| 5 | 9 | Varón | Asiático | 24 | Ninguna | Ninguna | No | Tipo prurigo y de flexión | No | 2.200 | None | 300/28 | Prefilled syringe | 27 | None |
| 6 | 5 | Mujer | Asiática | 15 | Rinitis, alergia alimentaria | Ninguna | No | Tipo prurigo y de flexión | No | 1.038 | Cyclosporine, methotrexate | 300/28 | Prefilled syringe | 28 | None |
| 7 | 10 | Mujer | Asiática | 34 | Rinitis, alergia alimentaria | Ninguna | No | Tipo prurigo y de flexión | No | 4.084 | Azathioprine | 300/28 | Autoinjector | 18 | None |
Se incluyó un total de 7 pacientes (4 niñas, 57,1%). La edad media fue de 6,8 (3–10) años, siendo tres pacientes menores de 6 años. Ninguno de ellos era caucásico. El nivel de IgE medio al diagnosticarse la DA fue de 5.313±4.712,9kU/l. Cuatro pacientes (57,1%) tenían DA de flexión y generalizada clásica, tres pacientes (42,8%) tenían DA tipo prurigo, y tenían niños (57,1%) tenían compromiso facial en la visita basal. Todos los participantes con DA tipo prurigo eran asiáticos. Los datos demográficos de los pacientes, las comorbilidades coexistentes relacionadas con DA, la dosis de dupilumab, y los inmunosupresores previos y transicionales se muestran en la Tabla 1. Cinco participantes (71,4%) habían recibido previamente inmunosupresores sistémicos fuera de indicación, y dos (29,6%) habían recibido dupilumab como primera terapia sistémica. Los valores basales medios de EASI y BSA fueron de 23,7±3,3 y 44,2±10,9% respectivamente. Todos los pacientes tenían un valor IGA >3, así como alteraciones del sueño. Los datos sobre eficacia evaluados utilizando los valores medios globales de EASI, BSA, IGA y de mejora de la calidad del sueño reportados por los padres en las semanas 4, 12, 16 y 24 se muestran en la Tabla 2. No se reportaron diversos acontecimientos adversos inducidos por dupilumab, efectos adversos oculares ni exacerbación de la dermatitis facial. Sólo 2/7 pacientes (29,6%) experimentaron dolor relacionado con el dispositivo autoinyector de dupilumab, que fue cambiado por una jeringa prellenada.
Eficacia de Dupilumab valorada mediante los valores medios de EASI, BSA, IGA y mejora de la calidad del sueño en las semanas 4, 16 y 24
| Basal | Sem. 4 | Sem. 16 | Sem. 24 | |
|---|---|---|---|---|
| EASI | 23,7±3,3 | 7,2±2,9 | 1±0 | 0,9±0,7 |
| BSA (%) | 44,3±10,9 | 10,4±5,2 | 1.3±0.5 | 1,4±1,1 |
| IGA (medio) | 4 (3–4) | 3 (3–4) | 1 (0–1) | 1 (0–1) |
| Mejora de las alteraciones del sueño (% de pacientes) | Sí (85,7%) | Sí (100%) | Sí (100%) |
La seguridad y eficacia clínicas de dupilumab en nuestra cohorte es similar a la observada en los ensayos clínicos3,6,7 y las series del mundo real publicados8–12. La mayoría de nuestros pacientes logró un valor EASI<3 o IGA 0–1 global de manera temprana, mejorando significativamente su calidad del sueño, independientemente de su peso, fenotipo clínico, dispositivo de administración, edad y etnicidad. No se evaluó la escala DLQI (Dermatology Life Quality Index) debido a las limitaciones relacionadas con la edad. También quisiéramos mencionar la efectividad y seguridad prometedoras de dupilumab en los niños de 6 meses a 5 años de edad con DA tipo prurigo. Sobre la base de nuestros resultados, la jeringa prellenada se tolera mejor que el dispositivo autoinyector, y es preferida por los niños. Este estudio tiene ciertas limitaciones tales como el pequeño tamaño de la muestra, el corto seguimiento, la falta de un grupo control, y su naturaleza retrospectiva. En conclusión, quisiéramos destacar la eficacia de dupilumab en los niños ≥6 meses a <12 años con DA de moderada a grave, tanto en pacientes nuevos como en pacientes refractarios a las terapias sistémicas.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.