El tratamiento biológico ha permitido establecer nuevos estándares de eficacia y seguridad terapéutica en la psoriasis moderada a grave que son amplia y uniformemente reconocidos con base en la evidencia de ensayos clínicos, registros y metaanálisis. Las consideraciones económicas son el principal motivo por el que algunas guías y la mayoría de las agencias encargadas de la autorización de prescripción reembolsada en la Unión Europea (UE) y en España los posicionen como tratamientos de segunda línea en caso de fallo, intolerancia o contraindicaciones de los tratamientos sistémicos clásicos (metotrexato, acitretina, ciclosporina) o la fototerapia1. Desde una perspectiva estrictamente basada en la evidencia, los tratamientos sistémicos clásicos presentan unas expectativas de eficacia en general inferiores a las de todos los tratamientos biológicos –a excepción quizás de etanercept, ya apenas considerado en prescripción dermatológica–, además de un mayor riesgo de interacciones farmacológicas y, en su conjunto, inferior perfil de seguridad y mayores riesgos de toxicidad orgánica2. En este sentido, en un contexto liberado de connotaciones económicas deberían posicionarse después de aquellos.
La introducción de los biosimilares en los sistemas de salud de muchos países europeos ha representado un cambio profundo en los patrones de prescripción y la entrada de los farmacéuticos hospitalarios y de los pagadores como actores relevantes en la toma de decisiones. El impacto y las consecuencias finales de esta circunstancia en el manejo clínico de los pacientes con psoriasis moderada a grave todavía están por determinar. Aunque la reducción en el coste de adquisición puede significar un alivio financiero en el uso de fármacos selectivos en psoriasis y facilitar el acceso a estos, también introduce aspectos negativos o inciertos. Aunque la eficiencia de la elección terapéutica puede intuirse a partir de datos objetivos (por ejemplo, el coste para conseguir una respuesta PASI90 por paciente)3, de hecho habitualmente se esgrime tan solo el factor «precio» – y no la eficiencia– en la toma de decisiones. La introducción de los biosimilares parece estar detrás de decisiones institucionales (Informes de Posicionamiento Terapéutico) que hacen referencia a las condiciones de reembolso de algunos de los últimos fármacos aprobados para el tratamiento de la psoriasis. Se han introducido restricciones improcedentes en el reembolso de nuevas moléculas originales, sin relación con el Informe de Posicionamiento Terapéutico previo y anteponiendo criterios de clase (anti-TNF) a eficiencia (biosimilares disponibles, teniendo en cuenta el coste por paciente tratado adecuadamente) que determinan inequidad y complican el itinerario a médicos y pacientes en la práctica clínica4.
Definición de biosimilitud basada en la totalidad de la evidenciaLos biosimilares son agentes biológicos altamente similares a un biológico previamente aprobado (biológico original o de referencia) que no presentan diferencias clínicamente significativas en cuanto a seguridad, pureza o potencia cuando se comparan con el producto de referencia, aunque pueden diferir tanto en cuanto al proceso de manufactura como en el excipiente o dispositivo de administración5. Las secuencias de aminoácidos se pueden (y deben) reproducir exactamente, pero en un proceso de fabricación complejo como el de los agentes biológicos se pueden introducir múltiples factores capaces de determinar cambios en la conformación de la estructura proteica o alteraciones postraslacionales (por ejemplo, en la glucosilación) que pueden afectar la eficacia, inmunogenicidad y/o seguridad del producto final. Por este motivo, las agencias reguladoras exigen la presentación de completos estudios analíticos preclínicos con más de 200 determinaciones, complementados por estudios de farmacocinética/farmacodinámica en voluntarios sanos o pacientes y por lo menos un estudio que confirme la equivalencia terapéutica del biosimilar y su biológico de referencia en una población de pacientes que permita la máxima sensibilidad estadística6,7.
Se permiten diferencias mínimas en los componentes inactivos, siempre que no tengan implicaciones en cuanto a la seguridad, pureza y potencia del fármaco; por otra parte, se producen variaciones entre lotes (por cambios en el proceso o la factoría) en el propio biológico de referencia, que en algunos casos dan lugar a una mayor variabilidad en la potencia del biológico de referencia que en la del biosimilar8. Aunque estos cambios o desviaciones entre lotes generalmente no resultan críticos desde el punto de vista cualitativo9,10, se ha publicado recientemente evidencia de que pueden tener implicaciones en cuanto a la eficacia terapéutica de trastuzumab11,12. En el caso de los anticuerpos monoclonales biosimilares antagonistas del factor de necrosis tumoral alfa (TNF-α), deben evaluarse tanto la capacidad de unión al TNF-α como las funciones efectoras mediadas por el dominio Fc, como por ejemplo la citotoxicidad dependiente de complemento y la mediada por células y dependiente de anticuerpo.
La biosimilitud del pretendido biosimilar también se evalúa en un estudio farmacocinético con diseño de grupos paralelos a ciego simple, o cruzado a doble ciego, en el que individuos sanos o pacientes reciben un número predeterminado de dosis del fármaco por vía intravenosa o subcutánea y se obtienen muestras de sangre para efectuar determinaciones farmacocinéticas (concentración máxima, semivida y área bajo la curva de concentración-tiempo) y de inmunogenicidad (títulos de anticuerpos antifármaco y anticuerpos neutralizantes); asimismo se evalúa la seguridad del fármaco.
Finalmente se efectúa un estudio clínico comparativo de la eficacia y seguridad del fármaco, con un diseño generalmente de equivalencia; el margen de error empleado en los estudios de biosimilares en psoriasis oscila entre ±14% y ±18%13. El objetivo primario del estudio y el tiempo de la determinación pueden o no ser los mismos que en los ensayos pivotales del biológico de referencia, pero el número de pacientes incluidos generalmente es inferior por las características del diseño estadístico, que son actualmente objeto de investigación activa14,15. Esta es la explicación, junto con el hecho de que no sea necesario repetir estudios para cada indicación si se cumplen las condiciones de extrapolabilidad, de que el coste del desarrollo clínico de los biosimilares sea inferior al de los biológicos «innovadores». De hecho, conforme aumenta la experiencia en el proceso analítico de comparación preclínica y se confirma la equivalencia de los biosimilares introducidos en la práctica clínica, se está discutiendo la necesidad de incluir ensayos clínicos de equivalencia para inhibidores del TNF-α16. Se recomienda efectuar el ensayo clínico por lo menos en la indicación que incluye una población más sensible para detectar posibles diferencias (por ejemplo, la psoriasis, por la escasa tasa de respuesta placebo y la ausencia de medicación concomitante que pueda reducir la inmunogenicidad del biológico original y el biosimilar)7. De entre los biosimilares anti-TNF-α aprobados por la European Medicines Agency en las mismas indicaciones que sus correspondientes biológicos de referencia, han sido objeto de ensayos de equivalencia en psoriasis los siguientes: Erelzi® (Sandoz), Amgevita® (Amgen), Hyrimoz®/Halimatoz®/Hefiya® (Sandoz), Cyltezo ® (Boehringer Ingelheim), e Idacio®/Kromeya® (Fresenius Kabi)17; de entre los otros biosimilares mencionados en la tabla 1, se han ensayado en pacientes con psoriasis los siguientes: BCD-057, M923, MYL-1401A, CHS-1420, y ONS-3010 (búsqueda en www.clinicaltrials.gov y www.clinicaltrialsregister.eu).
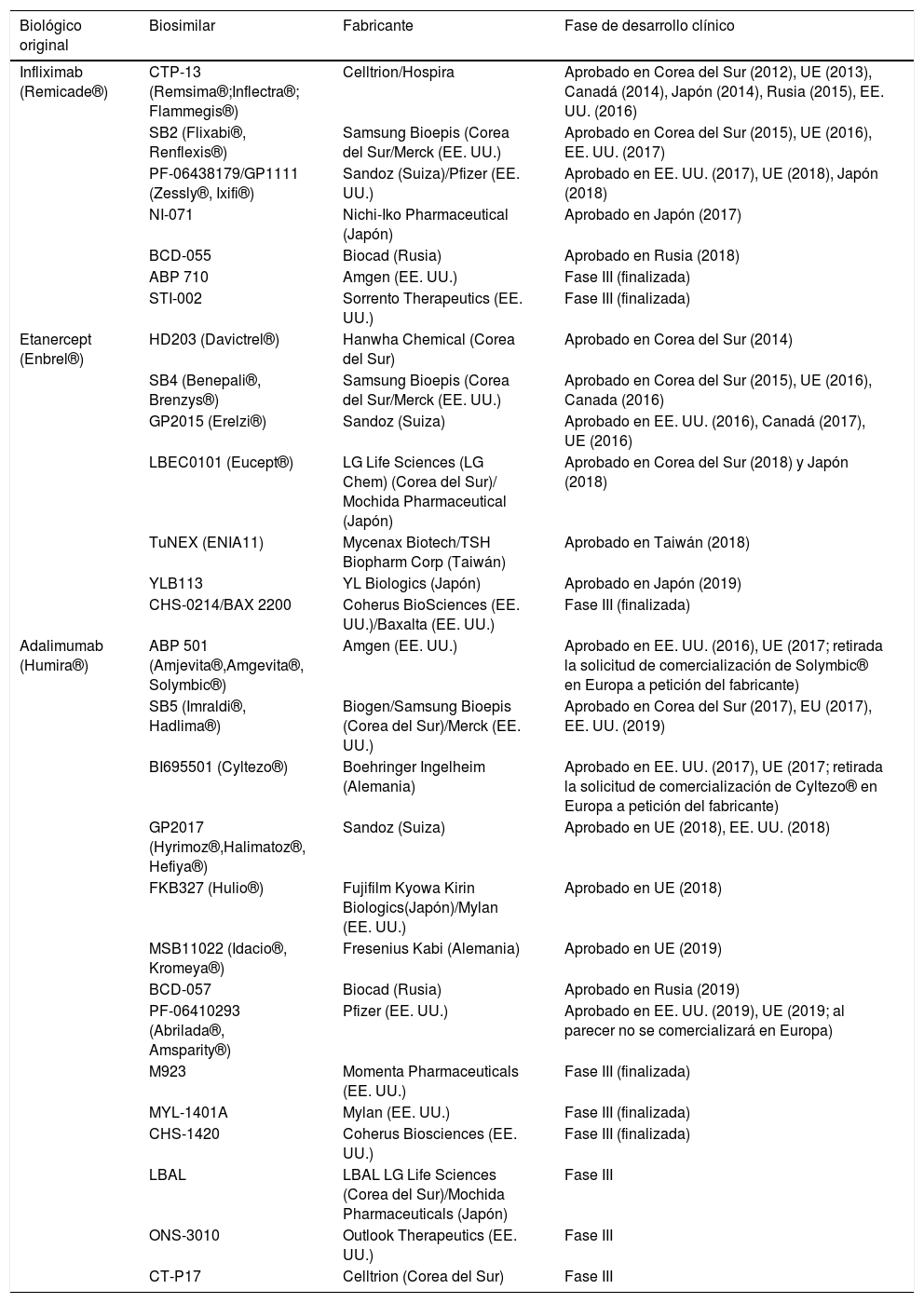
Biosimilares de antagonistas del factor de necrosis tumoral alfa (TNF-α) aprobados o en fase iii de desarrollo clínico
| Biológico original | Biosimilar | Fabricante | Fase de desarrollo clínico |
|---|---|---|---|
| Infliximab (Remicade®) | CTP-13 (Remsima®;Inflectra®; Flammegis®) | Celltrion/Hospira | Aprobado en Corea del Sur (2012), UE (2013), Canadá (2014), Japón (2014), Rusia (2015), EE. UU. (2016) |
| SB2 (Flixabi®, Renflexis®) | Samsung Bioepis (Corea del Sur/Merck (EE. UU.) | Aprobado en Corea del Sur (2015), UE (2016), EE. UU. (2017) | |
| PF-06438179/GP1111 (Zessly®, Ixifi®) | Sandoz (Suiza)/Pfizer (EE. UU.) | Aprobado en EE. UU. (2017), UE (2018), Japón (2018) | |
| NI-071 | Nichi-Iko Pharmaceutical (Japón) | Aprobado en Japón (2017) | |
| BCD-055 | Biocad (Rusia) | Aprobado en Rusia (2018) | |
| ABP 710 | Amgen (EE. UU.) | Fase III (finalizada) | |
| STI-002 | Sorrento Therapeutics (EE. UU.) | Fase III (finalizada) | |
| Etanercept (Enbrel®) | HD203 (Davictrel®) | Hanwha Chemical (Corea del Sur) | Aprobado en Corea del Sur (2014) |
| SB4 (Benepali®, Brenzys®) | Samsung Bioepis (Corea del Sur/Merck (EE. UU.) | Aprobado en Corea del Sur (2015), UE (2016), Canada (2016) | |
| GP2015 (Erelzi®) | Sandoz (Suiza) | Aprobado en EE. UU. (2016), Canadá (2017), UE (2016) | |
| LBEC0101 (Eucept®) | LG Life Sciences (LG Chem) (Corea del Sur)/ Mochida Pharmaceutical (Japón) | Aprobado en Corea del Sur (2018) y Japón (2018) | |
| TuNEX (ENIA11) | Mycenax Biotech/TSH Biopharm Corp (Taiwán) | Aprobado en Taiwán (2018) | |
| YLB113 | YL Biologics (Japón) | Aprobado en Japón (2019) | |
| CHS-0214/BAX 2200 | Coherus BioSciences (EE. UU.)/Baxalta (EE. UU.) | Fase III (finalizada) | |
| Adalimumab (Humira®) | ABP 501 (Amjevita®,Amgevita®, Solymbic®) | Amgen (EE. UU.) | Aprobado en EE. UU. (2016), UE (2017; retirada la solicitud de comercialización de Solymbic® en Europa a petición del fabricante) |
| SB5 (Imraldi®, Hadlima®) | Biogen/Samsung Bioepis (Corea del Sur)/Merck (EE. UU.) | Aprobado en Corea del Sur (2017), EU (2017), EE. UU. (2019) | |
| BI695501 (Cyltezo®) | Boehringer Ingelheim (Alemania) | Aprobado en EE. UU. (2017), UE (2017; retirada la solicitud de comercialización de Cyltezo® en Europa a petición del fabricante) | |
| GP2017 (Hyrimoz®,Halimatoz®, Hefiya®) | Sandoz (Suiza) | Aprobado en UE (2018), EE. UU. (2018) | |
| FKB327 (Hulio®) | Fujifilm Kyowa Kirin Biologics(Japón)/Mylan (EE. UU.) | Aprobado en UE (2018) | |
| MSB11022 (Idacio®, Kromeya®) | Fresenius Kabi (Alemania) | Aprobado en UE (2019) | |
| BCD-057 | Biocad (Rusia) | Aprobado en Rusia (2019) | |
| PF-06410293 (Abrilada®, Amsparity®) | Pfizer (EE. UU.) | Aprobado en EE. UU. (2019), UE (2019; al parecer no se comercializará en Europa) | |
| M923 | Momenta Pharmaceuticals (EE. UU.) | Fase III (finalizada) | |
| MYL-1401A | Mylan (EE. UU.) | Fase III (finalizada) | |
| CHS-1420 | Coherus Biosciences (EE. UU.) | Fase III (finalizada) | |
| LBAL | LBAL LG Life Sciences (Corea del Sur)/Mochida Pharmaceuticals (Japón) | Fase III | |
| ONS-3010 | Outlook Therapeutics (EE. UU.) | Fase III | |
| CT-P17 | Celltrion (Corea del Sur) | Fase III |
Llama la atención que en muchos estudios de equivalencia efectuados en psoriasis y artritis reumatoide las tasas de respuesta resulten superiores que en los estudios pivotales del original; ello puede deberse al diseño, con ausencia de un brazo placebo, que aumentaría las expectativas de los investigadores con respecto a la eficacia18.
Desde el punto de vista de la seguridad e inmunogenicidad, los resultados de los ensayos clínicos confirman la biosimilitud dentro del margen de equivalencia, aunque la variabilidad de los excipientes puede justificar algunas pequeñas diferencias. Por ejemplo, Erelzi® provoca menos reacciones en el lugar de inyección que Enbrel®19. En el caso de los biosimilares de adalimumab, los ensayos de equivalencia se han efectuado siempre tomando como referencia Humira® antes de los cambios (eliminación del citrato en el vehículo, reducción del volumen de inyección y el diámetro de la aguja), que han reducido el dolor de la inyección20; de los biosimilares actualmente disponibles, tan solo Hulio® no contiene citrato ni acetato en su excipiente21.
En la mayoría de los ensayos clínicos de biosimilares inhibidores del TNF-α se añade un estudio de extensión con transición simple del original al biosimilar, o bien un diseño cruzado con aleatorización y transición entre el original y el biosimilar (switch) único o múltiple, para cumplir con los requisitos de la Food and Drug Administration de los Estados Unidos de América en la demostración de la intercambiabilidad del biosimilar22. En el caso de Hyrimoz®/Halimatoz®/Hefiya®, se dispone de los resultados de un estudio de transición múltiple en pacientes con psoriasis23. Aunque la duración y el tamaño de los estudios de transición pueden no ser los adecuados para detectar posibles diferencias, existen evidencias científicas de la comparabilidad entre 2 biosimilares24 que apoyan la eficacia y seguridad del intercambio, incluso entre diferentes biosimilares. Esta circunstancia podría, a medio plazo, determinar que se fuesen intercambiando los biosimilares de un mismo principio activo, no considerando sus diferencias técnicas sino como consecuencia de los cambiantes acuerdos financieros locales o nacionales. En esta proyección, podría disminuir el papel del clínico, excepto cuando se produzca fracaso o contraindicación del biosimilar (u original) en curso. En este sentido, las sociedades científicas y líderes de opinión recuerdan que, como en cualquier otro campo de la terapéutica médica, los clínicos deben ser parte central de la toma de decisiones ya que el manejo personalizado, fundamentado en múltiples variables –también la confianza de los pacientes– es esencial para el éxito de cualquier acción a largo plazo25.
A partir de 2013 se introdujeron en la UE los primeros biosimilares para el tratamiento de la psoriasis en placas moderada a grave (etanercept, infliximab) y otras indicaciones por extrapolación, y se promovió su prescripción por los pagadores, con el objetivo de reducir el coste del tratamiento biológico, y posiblemente mejorar el acceso terapéutico en diversos sistemas sanitarios26. Ello llevó también a una reducción del precio de los referentes biológicos y la implantación de precios de referencia en España. Pero el impacto económico fue moderado, y aún menor el impacto sobre la prescripción en Dermatología. Ello se debió a la inconveniencia de las infusiones de infliximab y la escasa efectividad de etanercept en comparación con las alternativas disponibles para el tratamiento de la psoriasis.
Tras la extinción en 2018 de la patente de Humira® en la UE, la European Medicines Agency ha aprobado numerosos biosimilares de adalimumab (Amgevita®, Imraldi®, Cyltezo®, posteriormente retirado, Hyrimoz®, Hulio®, Idacio®, y Amsparity® hasta la fecha) y la reducción de precios ha sido muy relevante y rápida, llegando al 80% sobre el coste del adalimumab original antes de que hubiera alternativas biosimilares. En nuestro medio, incluso teniendo en cuenta el precio de referencia establecido para todas las variantes de adalimumab, la competencia comercial ha dado lugar a ofertas que actualmente ponen el coste de este tratamiento al mismo nivel, o incluso por debajo de la ciclosporina y algún tratamiento tópico, y ya no puede considerarse una barrera económica relevante.
En un metaanálisis en red recientemente publicado27, los tratamientos biológicos más eficaces pertenecen a 2 grupos: a) antagonistas de IL-17A y su receptor, y b) antagonistas de IL-23(p19). Los inhibidores del TNF-α tienen una eficacia inferior (y en algunos casos un mayor riesgo de infecciones y tal vez cáncer cutáneo no melanoma en pacientes con psoriasis), pero en cualquier caso superior a la de los tratamientos sistémicos convencionales. A modo de ejemplo, los NNT 100 (número de pacientes que hay que tratar para conseguir un aclaramiento completo en un paciente) calculados son inferiores a 3 para ixekizumab, risankizumab, brodalumab y guselkumab, 4 para infliximab, cerca de 6 para adalimumab y guselkumab, 14 para etanercept y alrededor de 50 para dimetilfumarato y apremilast. En una revisión Cochrane reciente, el riesgo relativo redondeado a la unidad con respecto a placebo de obtener una respuesta PASI90 (mejoría del 90% o superior con respecto al valor basal) en el momento del objetivo primario de los ensayos clínicos (entre 8 y 24 semanas) fue superior a 25 para infliximab, ixekizumab, risankizumab, y guselkumab, 24 para secukinumab, 22 para brodalumab, 18 para adalimumab, 17 para ustekinumab y tildrakizumab, 10 para ciclosporina, etanercept y metotrexato, 7 para apremilast, 4 para fumarato, y 2 para acitretina2.
Así pues, los biosimilares de inhibidores del TNF-α (tabla 1), y en concreto los biosimilares de adalimumab, representan un tratamiento de primera línea, más efectivo y seguro a largo plazo y a un coste similar al de los tratamientos sistémicos para los pacientes con psoriasis en placas moderada-grave, con una eficiencia superior incluso a las de los biológicos innovadores. Sin embargo, debe de tenerse en cuenta que un porcentaje significativo de pacientes presentará fracaso primario o secundario o algún efecto adverso que condicionará el cambio del biosimilar a otro principio activo innovador en unos meses. De este modo, la ventaja financiera inicial puede seguirse, a medio plazo, de un incremento del gasto derivado del cambio a originales, de precio sensiblemente mayor. Esta expansión, tanto de la prescripción de biosimilares como de los innovadores a partir de los cambios, podría producirse en un escenario en el que las autoridades hubiesen limitado o reducido el presupuesto dedicado a biológicos en psoriasis, confiados en los efectos ahorrativos de la llegada de biosimilares. La consecuencia podría ser el racionamiento o la introducción de listas de espera en la prescripción.
Desde el punto de vista de la práctica clínica, la supervivencia de los biosimilares, por lo menos en el campo de la psoriasis, parece ser similar a la de su fármaco de referencia28. Sin embargo, resulta difícil estudiar la supervivencia de los biosimilares en la vida real cuando existe una fuerte presión a favor de su prescripción inicial y el cambio del/al biosimilar, y los controles históricos son de dudosa validez por los cambios en los patrones de prescripción.
Finalmente, el efecto nocebo –definido como una percepción subjetiva del paciente de peores prestaciones en eficacia o seguridad del biosimilar con respecto del original no relacionadas con características objetivas del fármaco– podría explicar una tendencia a una mayor tasa de discontinuación después de la transición; este efecto sería especialmente relevante en enfermedades cuya evaluación depende fundamentalmente de síntomas (como es el caso de los pacientes con enfermedades reumatológicas o enfermedad inflamatoria intestinal) pero tal vez no sería tan aplicable a las pérdidas de respuesta tras la transición de original a biosimilar que pueden observarse en algunos pacientes con psoriasis9,29–31.
En definitiva, los fármacos biosimilares están sometidos a una regulación específica que, incorporando análisis estructurales, estudios farmacocinéticos y al menos un ensayo clínico comparativo con el original, avala su uso en las mismas condiciones que el fármaco original. Debiendo ser similares en eficacia y seguridad, los beneficios de su incorporación a los servicios de salud y a la prescripción médica están fundamentados exclusivamente en una reducción de costes y en una mejora de la eficiencia que será tanto mayor cuanto mayor sea dicha reducción de coste.
La incorporación de biosimilares debería permitir el acceso a terapias biológicas a todos los pacientes en quienes estén indicadas. Paradójicamente, en un escenario que debería mejorar nuestras posibilidades de prescripción, facilitando la eficiencia técnica y económica, se ha producido un aumento de la intervención por las agencias reguladoras (nacionales, autonómicas y locales), en muchas ocasiones centrada exclusivamente en la reducción de costes. Esta eventualidad puede dificultar –o lo ha hecho ya– la libertad de prescripción y tensionar la relación entre los clínicos, los servicios de Farmacia, las comisiones farmacoterapéuticas y los pagadores (las Consejerías de Salud).
En opinión de los autores, es necesario un alineamiento entre todas las partes implicadas con el objetivo común de ofrecer las mejores alternativas terapéuticas a los pacientes con psoriasis moderada a grave (que requiere tratamiento sistémico por definición)32. La elección del tratamiento debe atender a criterios de eficiencia (no de costes, sin tener en cuenta la efectividad) sin menoscabo de los objetivos clínicos (reducir el impacto de la enfermedad a su mínima expresión con el tratamiento idóneo en cada caso) y sin perjuicio para la seguridad en cada paciente concreto. Ello implicará, en muchos casos, el empleo en primera línea de los biosimilares disponibles en cada momento (o fármacos innovadores de eficiencia similar), dejando la segunda línea y posteriores a criterio del especialista.
Conflicto de interesesL. Puig ha percibido honorarios como consultor y/o ponente de y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Baxalta, Biogen, Boehringer Ingelheim, Celgene, Gebro, Janssen, JS BIOCAD, Leo-Pharma, Lilly, Merck-Serono, MSD, Mylan, Novartis, Pfizer, Regeneron, Roche, Sandoz, Samsung-Bioepis, Sanofi y UCB.
J.M. Carrascosa ha percibido honorarios como consultor y/o ponente de y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Amgen, Biogen, Boehringer Ingelheim, Celgene, Gebro, Janssen, Leo-Pharma, Lilly, Mylan, Novartis, Pfizer, Amgen, Sandoz, Samsung-Bioepis, Sanofi y UCB.
J. Notario ha percibido honorarios como consultor y/o ponente de y/o ha participado en ensayos clínicos patrocinados por Abbvie, Almirall, Celgene, Gebro, Janssen, Leo-Pharma, Lilly, Merck-Serono, MSD, Novartis, Pfizer, Sandoz y UCB.