La biopsia selectiva del ganglio centinela representa la herramienta más importante para determinar el estatus ganglionar en el paciente con melanoma.
ObjetivosAnalizar la capacidad de detección y disección de la técnica de biopsia selectiva de ganglio centinela con la incorporación de una gammacámara portátil intraoperatoria, así como las morbilidades derivadas de la misma.
MétodosEstudio observacional sobre una serie de casos incluidos prospectivamente y de forma consecutiva de pacientes a los cuales se les realizó la técnica de biopsia selectiva de ganglio centinela radioguiada mediante gammacámara portátil. Se realizó un análisis de concordancia entre los ganglios detectados entre la linfografía prequirúrgica, la gammagrafía portátil y los ganglios disecados.
ResultadosDurante el período de estudio se incluyeron 29 pacientes diagnosticados de melanoma cutáneo. Eran 17 mujeres (62,5%) y 12 varones (37,5%) y la edad media fue de 52,6 años (rango: 26-82). Se realizó disección del ganglio centinela en el 100% de los pacientes; además se obtuvieron en algunos casos ganglios secundarios.
En el número detectado de ganglios mediante linfografía preoperatoria hubo concordancia con respecto a la gammagrafía portátil y a los ganglios disecados finalmente en 16 de los pacientes (55,2%). Respecto a las complicaciones se observaron solo seromas en un 3,64% de los casos, no presentando en ningún caso dehiscencia de la herida, infección, hematoma o hemorragia.
ConclusionesLa biopsia selectiva de ganglio centinela radioguiada mediante gammacámara portátil es una técnica que podría colaborar en mejorar la capacidad de detección y disección del ganglio centinela, así como en una disminución en la morbilidad quirúrgica derivada de la técnica, aspectos que resultan esenciales en una técnica cuyo objetivo inicial es la estadificación del paciente con melanoma.
Sentinel lymph node biopsy is the most important tool available for node staging in patients with melanoma.
ObjectivesTo analyze sentinel lymph node detection and dissection with radio guidance from a portable gamma camera. To assess the number of complications attributable to this biopsy technique.
MethodsProspective observational study of a consecutive series of patients undergoing radioguided sentinel lymph node biopsy. We analyzed agreement between nodes detected by presurgical lymphography, those detected by the gamma camera, and those finally dissected.
ResultsA total of 29 patients (17 women [62.5%] and 12 men [37.5%]) were enrolled. The mean age was 52.6 years (range, 26-82 years). The sentinel node was dissected from all patients; secondary nodes were dissected from some.
In 16 cases (55.2%), there was agreement between the number of nodes detected by lymphography, those detected by the gamma camera, and those finally dissected. The only complications observed were seromas (3.64%). No cases of wound dehiscence, infection, hematoma, or hemorrhage were observed.
ConclusionsPortable gamma-camera radio guidance may be of use in improving the detection and dissection of sentinel lymph nodes and may also reduce complications. These goals are essential in a procedure whose purpose is melanoma staging.
El estatus ganglionar en pacientes con melanoma representa un indicador pronóstico fundamental de recurrencia y supervivencia, y el número de ganglios afectados por el tumor en la disección se relaciona directamente con el pronóstico del paciente. Por ello, el estudio exhaustivo de las regiones ganglionares se ha convertido en una fase esencial del manejo del paciente con melanoma1,2.
La biopsia selectiva del ganglio centinela (BSGC) representa la herramienta más importante para determinar el estatus ganglionar. Se trata de una técnica de estadificación y no terapéutica3,4, de tal forma que deben hacerse los máximos esfuerzos en desarrollar la técnica con la mínima morbilidad operatoria posible. En este sentido, la incorporación de la gammacámara portátil a la técnica ha supuesto un avance tanto en efectividad como en disminución de la morbilidad quirúrgica5.
El presente estudio describe la técnica de BSGC radioguiada mediante gammacámara portátil (BSGCR) y analiza los resultados relacionados con la capacidad de la técnica para la detección y disección de ganglios centinela, así como los indicadores de morbilidad quirúrgica derivados de la misma.
Material y métodosSe trata de un estudio observacional sobre una serie de casos incluidos prospectivamente y de forma consecutiva, a los cuales se les realizó BSGCR. El estudio analiza pacientes incluidos prospectivamente desde septiembre de 2008 hasta junio de 2010 por la unidad de melanoma del Departamento de Dermatología y el Servicio de Medicina Nuclear del Hospital Universitario Virgen Macarena.
Durante este período se incluyeron consecutivamente todos aquellos pacientes atendidos en la unidad de melanoma que cumplían con los siguientes criterios de inclusión: melanoma primario con espesor de Breslow igual o superior a 1mm o melanoma primario con espesor de Breslow entre 0,75 y 1,00mm que se acompañaba de ulceración, regresión superior al 75%, índice mitótico elevado, o nivel de Clark IV-V, y siempre en ausencia de enfermedad metastásica ganglionar o a distancia. Para la estadificación y toma de decisiones sobre la práctica de la BSGC se aplicaron los sistemas del American Joint Committee on Cancer de 2002 hasta diciembre de 2009, y la versión de 2009 en aquellos pacientes incluidos a partir de enero de 20101. El protocolo aceptado y vigente en la unidad de melanoma fue aplicado a estos pacientes que previamente a la BSGC fueron sometidos a TAC de tórax y abdomen y ecografía de territorios ganglionares para descartar enfermedad metastásica que contraindicase la BSGC. Según se describe en dicho protocolo, y una vez realizada linfografía preoperatoria, en aquellos casos de ganglio centinela (GC) localizados en regiones inguinales y axilares la BSGC es realizada en el área quirúrgica de la unidad clínica de dermatología, mientras que en el caso de detección de GC localizados en la cabeza y el cuello, incluida la localización parotídea, esta es realizada por la unidad de cirugía maxilofacial; la realización y responsables de la misma es decidida en el ámbito del comité de melanoma del centro.
La técnica que se realizó en el estudio incluye las 3 siguientes etapas: linfografía preoperatoria, mapeo intraoperatorio y disección del GC.
Linfografía preoperatoriaSe realiza el día previo a la intervención en el servicio de medicina nuclear.
Se inyecta 2mCi de Nanocoll® (1mCi si es diferido) en un volumen de 0,4ml distribuido en 4 puntos intradérmicos alrededor de la lesión o cicatriz (0,1ml en cada punto). De forma inmediata se realiza un estudio dinámico (60imágenes/20seg.). Posteriormente se obtiene imagen estática (300seg) en distintas proyecciones según la localización de la lesión primaria, incluyendo rastreo de cuerpo completo si se estima oportuno. Se marca con tinta indeleble sobre la piel la zona de proyección del GC (punto en proyección anterior y aspa en proyección lateral). En caso de visualizar algún ganglio en tránsito se puede reinyectar 0,4mCi de Nanocoll® instantes previos a la intervención.
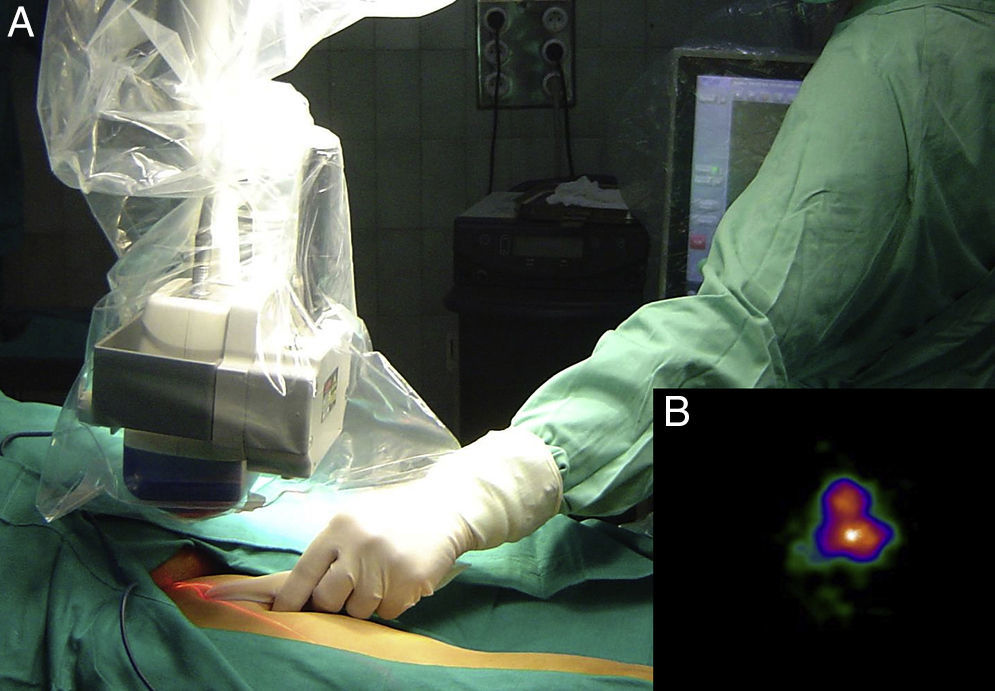
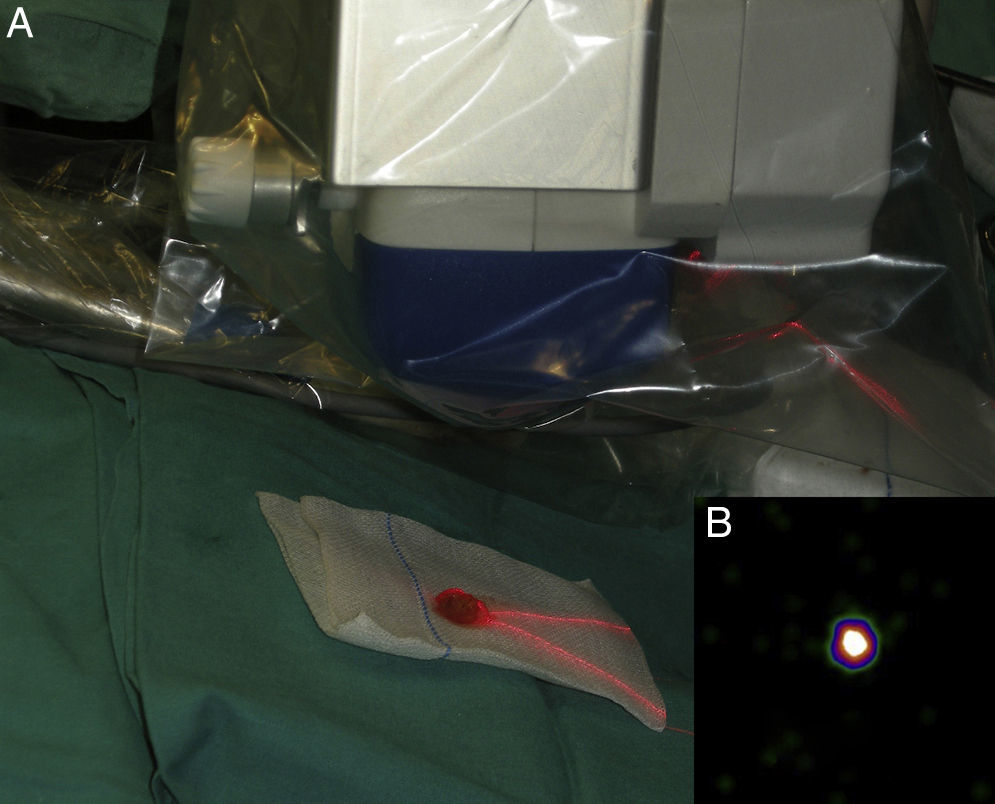
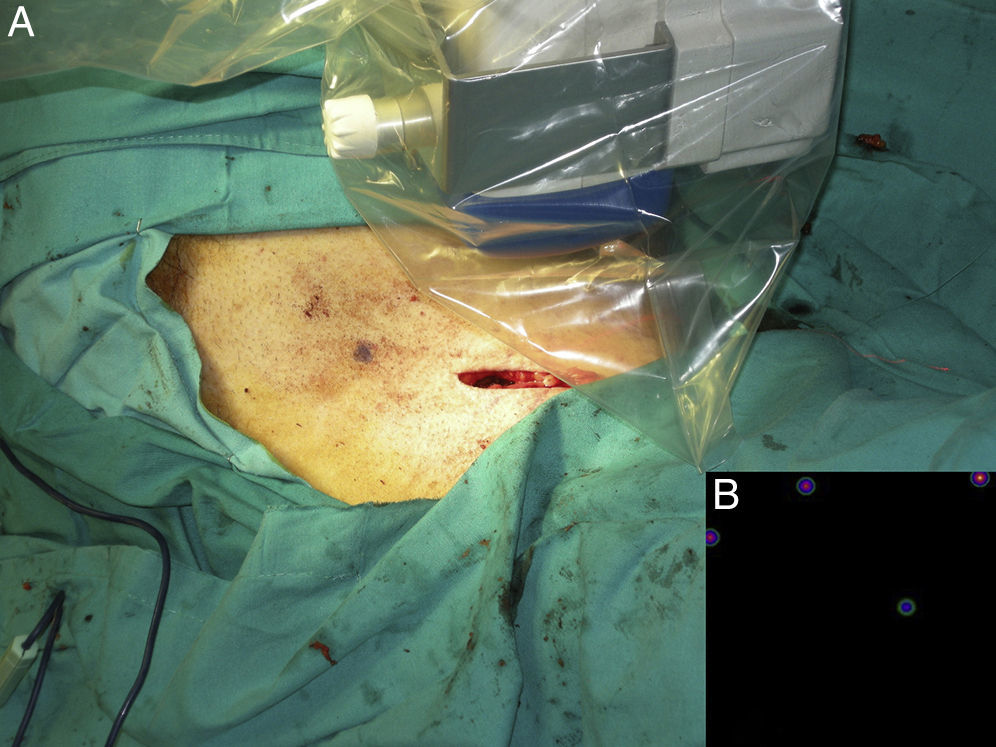
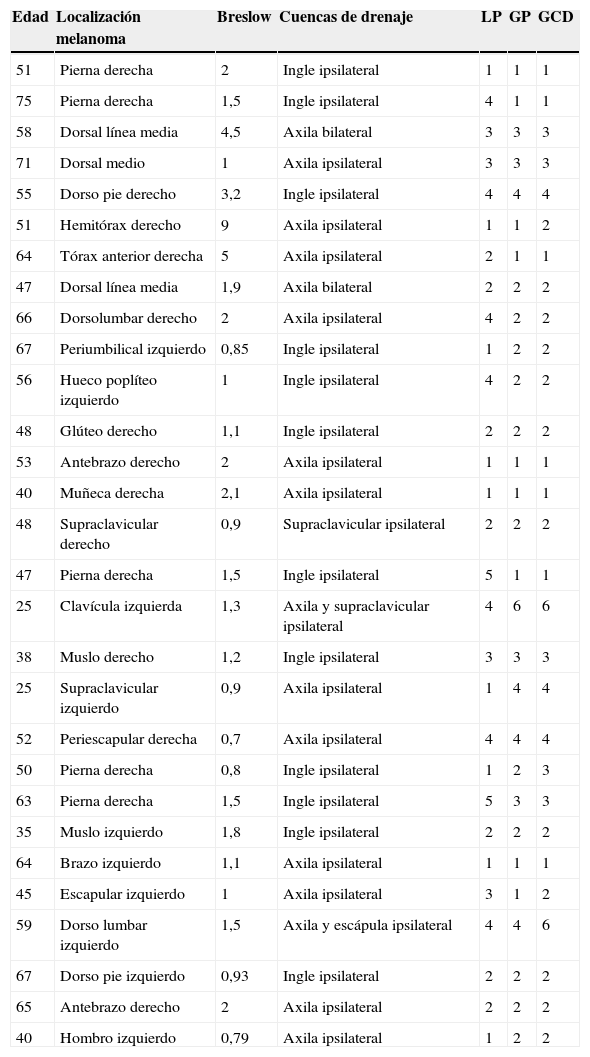
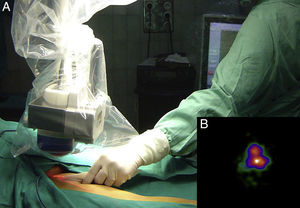
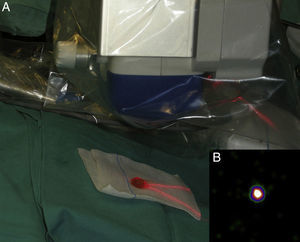
Mapeo intraoperatorio y disección del ganglio centinelaSe abordan todas las cuencas ganglionares señaladas en la linfografía, así como los ganglios en tránsito. El médico nuclear realiza la localización preoperatoria inmediata y percutánea del GC mediante la gammacámara portátil (Sentinella® Oncovisión) sobre la región ganglionar portadora del GC marcada en la linfografía realizada el día anterior (fig. 1). Sobre el centro de máxima captación, y con ayuda de un puntero de tecnecio, se localiza el lugar exacto de abordaje quirúrgico realizando una incisión con bisturí frío ajustada a este lugar de captación. A continuación se procede a la disección dirigida mediante la sonda acústica y la tinción de azul vital hasta la identificación del GC. Una vez identificado el GC, y antes de su extracción, se procede a la confirmación de su naturaleza de GC mediante la toma de imágenes in vivo con diferentes orientaciones del foco de la cámara y su comparación con la imagen gammagráfica percutánea tomada en el prequirúrgico inmediato. Una vez extraído el GC se procede a la toma de imágenes ex vivo sobre el GC (fig. 2) y del campo quirúrgico para comprobar la ausencia o presencia de otros focos de captación correspondientes a otros GC, y en caso positivo proceder de nuevo a su extracción. El médico nuclear comprobará con la gammacámara portátil la ausencia de actividad en el lecho quirúrgico (fig. 3). Los GC se envían a la unidad de anatomía patológica, en envases con formol debidamente señalizados para estudio histopatológico con hematoxilina-eosina, así como estudio inmunohistoquímico (HMB-45, S-100, Melan-A).
El análisis aplicado a los resultados obtenidos consistió en un cálculo de porcentaje de acuerdo entre las intervenciones realizadas, así como un estudio descriptivo de frecuencias de complicaciones, ejecutados mediante Excel® para Mac 2010.
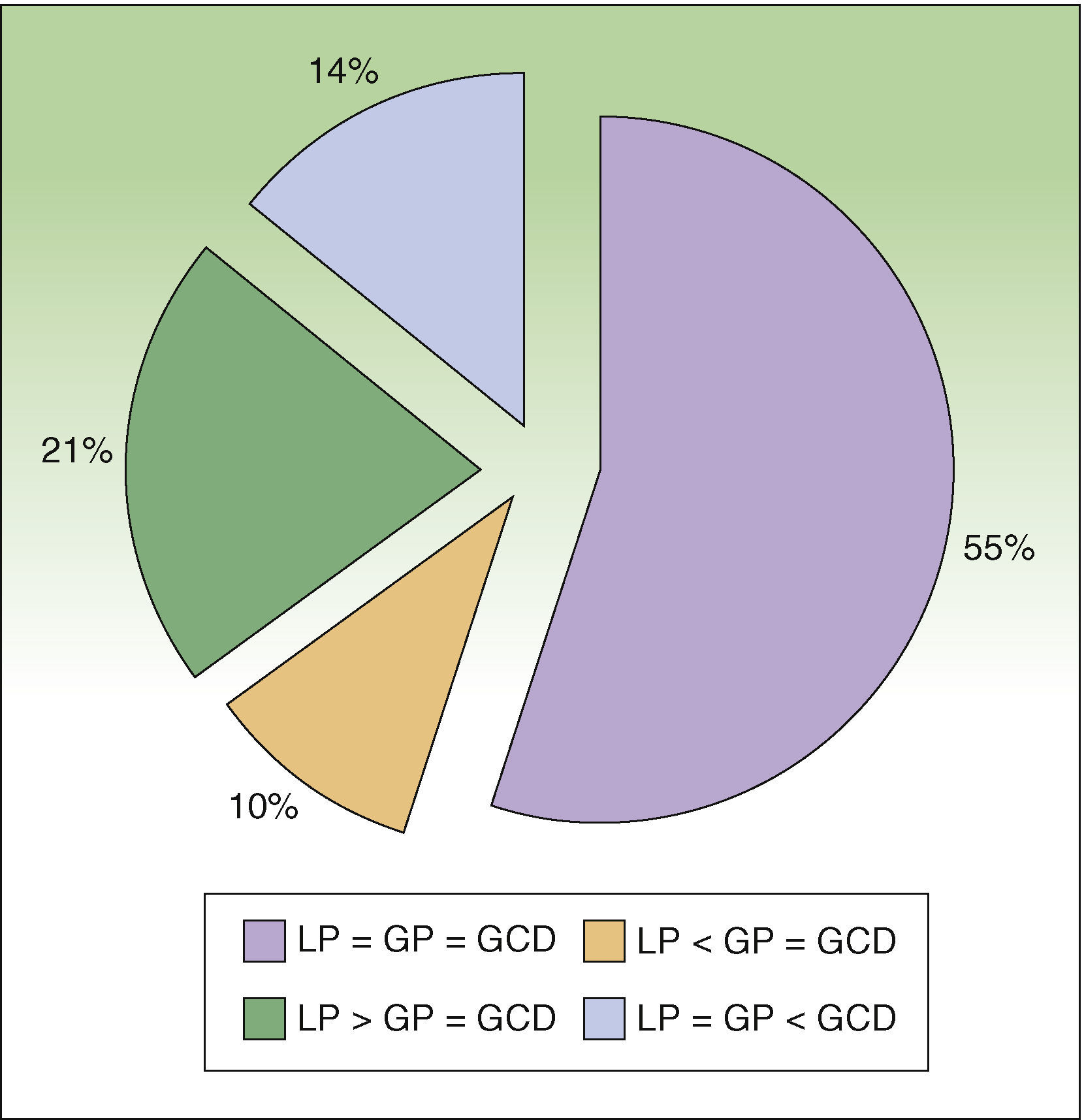
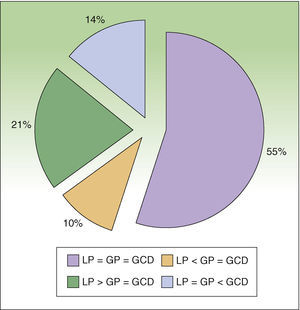
ResultadosDurante el período de estudio se incluyeron 29 pacientes diagnosticados de melanoma cutáneo con criterios de BSGC (≥estadio IB con ausencia de enfermedad ganglionar clínica o radiológica (N0) y enfermedad a distancia (M0). A todos los pacientes se les realizó la técnica de BSGCR. Eran 17 mujeres (62,5%) y 12 varones (37,5%) y la edad media fue de 52,6 años (rango: 26-82). La localización más frecuente del melanoma fue en los miembros inferiores (43,7%), seguida del tronco (28,1%) y de los miembros superiores (21,8%). La media del espesor de Breslow fue de 1,90mm (rango 0,79-9,00mm). Ocho casos (27,5%) fueron de espesor delgado (≤1mm), 16 casos (55,2%) de espesor intermedio (1,01-4,00mm) y 5 casos (17,2%) melanomas de espesor grueso (>4mm). En cuanto a los tipos histológicos en un 50% eran melanomas de extensión superficial, en un 34,3% melanomas nodulares y en un 16,6% melanomas lentiginosos acrales. Presentaban ulceración 5 casos (17,2%). Se encontró al menos una mitosis/mm2 en 5 pacientes (17,1%). En 6 pacientes (20,7%) se observaron signos de regresión. La estadificación prequirúrgica no varió respecto a la posquirúrgica en ningún caso, ya que todos los ganglios extirpados fueron negativos. Solo un caso presentó afectación metastásica ganglionar durante los primeros 3 años de seguimiento. En la linfogammagrafía 25 pacientes (86,2%) presentaron captación en un área de drenaje ganglionar, y 4 (13,8%) en 2 áreas de drenaje distintas. Se realizó disección del ganglio centinela en el 100% de los casos, además se obtuvieron en algunos casos ganglios secundarios (tabla 1). En el número detectado de ganglios mediante linfografía preoperatoria hubo concordancia con respecto a la gammagrafía portátil y a los ganglios disecados en 16 de los pacientes (55,2%), en 9 pacientes (31,0%) el número de ganglios detectados en la gammagrafía portátil coincide con los disecados, pero estos difieren de los presentes en la linfografía prequirúrgica. De estos 9 casos 6 de ellos (21,0%) en la linfografía prequirúrgica presentaban detección de un mayor número de ganglios y los otros 3 (10%) un número menor (fig. 4). Por último, en 4 pacientes (13,7%) el número de ganglios disecados es mayor a los detectados por la linfografía o la gammacámara portátil. Respecto a las complicaciones se observaron solo seromas en un 3,6% de los casos, los cuales remitieron espontáneamente sin precisar punción. No se presentó ningún caso dehiscencia de la herida, infección, hematoma o hemorragia.
Pacientes incluidos en el estudio donde se muestran las variables de localización de cuencas ganglionares y número de ganglios detectados mediante linfografía prequirúrgica (LP), gammacámara portátil (GP) y el número de ganglios disecados (GCD)
| Edad | Localización melanoma | Breslow | Cuencas de drenaje | LP | GP | GCD |
|---|---|---|---|---|---|---|
| 51 | Pierna derecha | 2 | Ingle ipsilateral | 1 | 1 | 1 |
| 75 | Pierna derecha | 1,5 | Ingle ipsilateral | 4 | 1 | 1 |
| 58 | Dorsal línea media | 4,5 | Axila bilateral | 3 | 3 | 3 |
| 71 | Dorsal medio | 1 | Axila ipsilateral | 3 | 3 | 3 |
| 55 | Dorso pie derecho | 3,2 | Ingle ipsilateral | 4 | 4 | 4 |
| 51 | Hemitórax derecho | 9 | Axila ipsilateral | 1 | 1 | 2 |
| 64 | Tórax anterior derecha | 5 | Axila ipsilateral | 2 | 1 | 1 |
| 47 | Dorsal línea media | 1,9 | Axila bilateral | 2 | 2 | 2 |
| 66 | Dorsolumbar derecho | 2 | Axila ipsilateral | 4 | 2 | 2 |
| 67 | Periumbilical izquierdo | 0,85 | Ingle ipsilateral | 1 | 2 | 2 |
| 56 | Hueco poplíteo izquierdo | 1 | Ingle ipsilateral | 4 | 2 | 2 |
| 48 | Glúteo derecho | 1,1 | Ingle ipsilateral | 2 | 2 | 2 |
| 53 | Antebrazo derecho | 2 | Axila ipsilateral | 1 | 1 | 1 |
| 40 | Muñeca derecha | 2,1 | Axila ipsilateral | 1 | 1 | 1 |
| 48 | Supraclavicular derecho | 0,9 | Supraclavicular ipsilateral | 2 | 2 | 2 |
| 47 | Pierna derecha | 1,5 | Ingle ipsilateral | 5 | 1 | 1 |
| 25 | Clavícula izquierda | 1,3 | Axila y supraclavicular ipsilateral | 4 | 6 | 6 |
| 38 | Muslo derecho | 1,2 | Ingle ipsilateral | 3 | 3 | 3 |
| 25 | Supraclavicular izquierdo | 0,9 | Axila ipsilateral | 1 | 4 | 4 |
| 52 | Periescapular derecha | 0,7 | Axila ipsilateral | 4 | 4 | 4 |
| 50 | Pierna derecha | 0,8 | Ingle ipsilateral | 1 | 2 | 3 |
| 63 | Pierna derecha | 1,5 | Ingle ipsilateral | 5 | 3 | 3 |
| 35 | Muslo izquierdo | 1,8 | Ingle ipsilateral | 2 | 2 | 2 |
| 64 | Brazo izquierdo | 1,1 | Axila ipsilateral | 1 | 1 | 1 |
| 45 | Escapular izquierdo | 1 | Axila ipsilateral | 3 | 1 | 2 |
| 59 | Dorso lumbar izquierdo | 1,5 | Axila y escápula ipsilateral | 4 | 4 | 6 |
| 67 | Dorso pie izquierdo | 0,93 | Ingle ipsilateral | 2 | 2 | 2 |
| 65 | Antebrazo derecho | 2 | Axila ipsilateral | 2 | 2 | 2 |
| 40 | Hombro izquierdo | 0,79 | Axila ipsilateral | 1 | 2 | 2 |
Análisis de concordancia en porcentaje entre el número de ganglios detectados mediante linfografía prequirúrgica (LP), gammacámara portátil (GP) y el número de ganglios disecados (GCD).LP=GP=GCD: concordancia completa; LP<GP=GCD: número menor de ganglios detectados en linfografía prequirúrgica respecto a los detectados con la gammacámara y los disecados finalmente; LP>GP=GCD: número mayor de ganglios detectados en linfografía prequirúrgica respecto a los detectados con la gammacámara y los disecados finalmente; LP=GP<GCD: mayor número de ganglios disecados respecto a los detectados mediante linfografía o gammacámara.
Durante la última década se ha discutido sobre la finalidad terapéutica o pronóstica de la BSGC. En este sentido los resultados del Multicenter Selective Lymphadenectomy Trial (MSLT) de Morton et al.2,3, establece las ventajas e indicaciones de la BSGC en función de una amplia muestra prospectiva de pacientes con melanoma con índice de Breslow entre 1,20 y 3,50mm. En este estudio aleatorizado y controlado se proporciona el máximo nivel de evidencia a favor de la BSGC como procedimiento de estadificación y para el control regional inmediato de la enfermedad en pacientes con melanoma de riesgo intermedio. Evidencias que se han reforzado posteriormente en una serie de 1.270 pacientes con seguimiento a 10 años5. Por lo tanto, aceptando la utilidad de la BSGC como técnica de estadificación, y no terapéutica3–5, deben hacerse esfuerzos en desarrollar la técnica con la máxima capacidad de disección del ganglio centinela y mínima morbilidad operatoria posible.
Con estos 2 objetivos, mejora de la sensibilidad y descenso de la morbilidad quirúrgica, el Departamento de Dermatología y el Servicio de Medicina Nuclear del Hospital Universitario Virgen Macarena incorporaron una gammacámara portátil (Sentinella®), que empleada en el período intraoperatorio podría mejorar la tasa de identificación del GC con una baja tasa de complicaciones quirúrgicas.
Anteriormente a la utilización de la gammacámara portátil, la incorporación de la gammasonda acústica a la técnica anterior, la cual se realizaba mediante tinción con azul vital6, representó una mejora de la sensibilidad en la detección y disección del GC, así como una disminución de la morbilidad7–9. En relación con la capacidad de disección Landi7 et al., en un estudio retrospectivo realizado sobre 430 pacientes a los cuales se les realizaba la técnica asociada a azul vital y la gammasonda acústica, pudieron realizar la disección en el 99,5% de los casos, no obteniendo los GC en 2 pacientes, uno de localización ganglionar cervical y otro axilar. Similares resultados se han encontrado en otras series como en la de Leong et al.8, en la cual sobre 163 pacientes consiguieron un 98% de disección de GC, o en el caso de Kaptejin et al.9, con una muestra de 110 pacientes obtuvieron un 99%. Los resultados obtenidos en nuestro estudio confirman la capacidad de disección en el 100% de los casos de al menos un GC utilizando la gammacámara portátil. La gammacámara intraoperatoria también ha permitido extraer más GC de los inicialmente identificados en un 10% de los casos, esto es debido a la superposición de otros GC por un GC predominante en la linfografía prequirúrgica. Los datos reflejan que en más de la mitad de los casos (55,2%) existe una concordancia entre las 3 variables estudiadas, es decir, se trataría de pacientes donde la localización del GC es mucho más segura. Los casos en los cuales el número de ganglios disecados fue menor que el observado en la linfografía prequirúrgica, es decir el 21%, se localizan todos en el área inguinal, esto es debido a que estos ganglios corresponden a las cadenas ganglionares iliacas, es decir, en profundidad, por lo que la técnica no se aconseja debido a la gran morbilidad que presenta este abordaje para una técnica que no deja de ser diagnóstica y no terapéutica. Por último en 4 pacientes (13,7%) el número de ganglios disecados es mayor a los detectados por la linfografía o la gammacámara portátil; normalmente se trata de conglomerados ganglionares que en prueba de imagen aparecen como uno. En nuestra experiencia la sonda acústica encuentra limitaciones relacionadas con la profundidad a la que se localizan los GC, que hace que la captación preincisional se vea dificultada en pacientes con mayor espesor del panículo adiposo; por otro lado, la interpretación de la señal acústica y su correlación con la cuentas por minuto no siempre responde a una regla fija, por lo que la definición de un ganglio determinado como GC presenta una reproducibilidad variable10. Antes de la introducción de la gammacámara portátil el abordaje quirúrgico se realizaba con unas imágenes estáticas tomadas después de la inyección de tecnecio nanocoloide el día anterior e inmediatamente antes de la intervención, se procedía entonces al marcaje sobre la piel, que correspondía con las proyecciones anterior y lateral del supuesto GC7. Ya en quirófano se localizaba la incisión de forma aproximada mediante la sonda acústica, lo cual a veces planteaba problemas por la posición del paciente, el espesor de tejido celular subcutáneo, o la profundidad del GC, y también por la contaminación acústica procedente del área del tumor primario10.
La gammacámara portátil utilizada durante el período intraoperatorio aporta esencialmente una mejor sensibilidad en la detección y extracción de GC11 y se ha incorporado de forma importante a múltiples procedimientos quirúrgicos oncológicos12–18. Inicialmente nos localiza mediante un mapa real la posible localización del GC, marcándonos el lugar exacto del abordaje quirúrgico y haciendo por lo tanto que la longitud necesaria de la incisión sea menor. Una vez extraído el GC, y mediante un estudio ex vivo de la lesión disecada, nos confirma mediante captación que se trata del GC. Por último, nos confirma si hemos realizado la disección completa del GC mediante una imagen sobre el campo quirúrgico, donde observaremos la desaparición de la captación marcada anteriormente a la disección, confirmándonos en el mismo acto operatorio la disección ganglionar11. Anteriormente a la utilización de esta técnica, una vez extraído el ganglio identificado como GC se procedía a un rastreo con la sonda acústica durante el que resultaba difícil diferenciar captaciones traza o contaminantes de captaciones procedentes de segundos GC ocultos tras la hipercaptación de un GC gammagráficamente predominante. De la misma forma, la identificación intraabdominal de GC y la captación contaminante procedente del área del tumor primario dificultaban igualmente la correcta identificación del GC10.
En cuanto a la morbilidad, ninguno de los pacientes presentó hematoma, hemorragia o dehiscencia de la herida, y solo presentaron seromas en un 3,64% de los casos, ninguno precisó punción y en todos los pacientes remitieron de forma espontánea. En comparación con la técnica que asocia la tinción con azul vital y gammasonda acústica, en la serie publicada más extensa presentaron complicaciones en un 4,2% de los pacientes7.
La limitación principal de nuestro estudio radica en la ausencia de casos de cabeza y cuello.
En conclusión, la BSGC representa el método estándar para el conocimiento del estatus ganglionar, factor del máximo interés pronóstico en el sistema de estatificación actualmente vigente. Sin embargo, la BSGC no ha demostrado todavía beneficio sobre la supervivencia libre de enfermedad ni la supervivencia global del paciente con melanoma sin metástasis ganglionar. Por ello, la técnica radioguiada con visión directa, motivo del estudio, puede colaborar en mejorar su capacidad de disección y su morbilidad quirúrgica, aspectos que nos parecen esenciales en una técnica cuyo objetivo, de momento, es la estatificación lo más detallada posible del paciente con melanoma. Este estudio pone de manifiesto que la técnica radioguiada con visión directa permite completar la detección y disección de los ganglios centinela, aumentando la capacidad de disección hasta en el 100% de los casos y pudiendo disminuir la morbilidad con respecto a la técnica anterior, cuestión que consideramos esencial en una técnica quirúrgica que a día de hoy no tiene una clara intención terapéutica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.