Existe gran cantidad de información sobre la terapia sistémica y biológica de la psoriasis moderada-grave. Sin embargo, pueden identificarse numerosas situaciones clínicas concretas en las que la evidencia clínica es controvertida y donde resulta útil la opinión consensuada de los expertos.
Material y métodosUn comité científico revisó, de forma sistemática, la bibliografía disponible en 5 escenarios clínicos. En aquellas cuestiones en las que la evidencia era controvertida se llevó a cabo un cuestionario on line según la metodología Delphi, realizado por dermatólogos con experiencia en el manejo de la psoriasis moderada-grave.
ResultadosEl cuestionario recogió opiniones de 23 dermatólogos y se alcanzó el consenso en 37 de las 66 aseveraciones propuestas (56%).
Los resultados permitieron consensuar propuestas en diversas situaciones clínicas, aun cuando la evidencia no fuese firme. Así, tanto el tratamiento intermitente como la desintensificación se consideraron estrategias adecuadas en la optimización de la terapia biológica y en la reducción de costes. La determinación de niveles de fármaco y de anticuerpos antifármaco debería incluirse rutinariamente en el seguimiento de los pacientes psoriásicos tratados con terapia biológica. La coexistencia de artropatía psoriásica y de antecedentes cardiovasculares condiciona la elección de la terapia biológica, prefiriéndose los fármacos anti-TNF alfa como primera elección. En pacientes embarazadas o con deseos de gestación la evaluación personalizada, la gravedad de la psoriasis y la vida media del fármaco son factores relevantes en la toma de decisiones.
ConclusionesLa combinación de una revisión sistemática de la literatura y la discusión y opinión estructurada de los expertos permite realizar propuestas para situaciones clínicas concretas.
A great amount of information on systemic and biologic therapies for moderate to severe psoriasis is now available. However, applying the evidence in numerous clinical scenarios has engendered debate; under these circumstances, the consensus of experts is useful.
Material and methodsA scientific committee systematically reviewed the literature relevant to 5 clinical scenarios. An online Delphi survey of dermatologists with experience treating moderate to severe psoriasis was then carried out in order to shed light on questions that remained unresolved by the available evidence.
ResultsTwenty-three dermatologists responded to the survey and consensus was reached on 37 (56%) of the 66 statements proposed. These results led to consensus on various clinical situations even though firm evidence was lacking. Thus, intermittent therapeutic regimens and strategies for reducing the intensity of treatment are considered appropriate for optimizing biologic treatment and reducing costs. The measurement of drug and antidrug antibody levels should be included routinely when following patients on biologics to treat psoriasis. Concomitant psoriatic arthritis or a history of cardiovascular conditions will influence the choice of biologic; in these situations, an agent with anti-tumor necrosis factor properties will be preferred. Tailored management is important when the patient is pregnant or intends to conceive; drug half-life and disease severity are important factors to take into consideration in these scenarios.
ConclusionsA combination of systematic review of the literature and structured discussion of expert opinion facilitates decision-making in specific clinical scenarios.
La psoriasis es una enfermedad crónica y recidivante que afecta aproximadamente a un 2,3% de la población española1. Los avances en investigación y patogénesis han permitido el desarrollo de un nuevo grupo terapéutico, conocido en su conjunto como terapia biológica, que ha significado un salto cualitativo en el manejo de los pacientes con psoriasis moderada y grave. Las recomendaciones con respecto al empleo de estos fármacos se fundamentan en los estudios pivotales que han dado lugar a la aprobación de sus fichas técnicas por las agencias reguladoras y que representan una base de evidencia firme para buena parte de los pacientes tributarios de recibir estos tratamientos en psoriasis moderada y grave2–13. Sin embargo, en el contexto de una creciente experiencia clínica con estos fármacos, se hace evidente que las limitaciones de estos estudios dificultan su aplicabilidad en un número notable de situaciones no contempladas, o directamente excluidas en ellos. A pesar de que los documentos de consenso y estudios clínicos postautorización implementan en parte este déficit, persisten aún numerosos supuestos en los que la evidencia es escasa.
El objetivo del presente trabajo fue llevar a cabo una revisión en algunos de estos escenarios y complementar, cuando la evidencia no fuese firme, esta información con la opinión estructurada de los autores a través de un cuestionario Delphi, y así desarrollar un documento útil para la práctica clínica.
Material y métodosConstitución del comité científico y definición de los escenarios evaluablesEn una primera fase se constituyó un comité científico integrado por 6 dermatólogos clínicos con experiencia en el manejo clínico de la psoriasis moderada-grave. A cada uno de ellos se les solicitó que planteasen escenarios clínicos en los que confluyeran un interés clínico práctico y en los que, en su opinión, existiesen dificultades en el manejo clínico de los pacientes.
A través de una reunión conjunta se consensuaron 5 de estos escenarios.
Revisión de la literaturaEl comité científico, con ayuda de un metodólogo externo independiente, llevó a cabo una revisión y síntesis de la bibliografía evaluando las guías de práctica clínica y revisiones sistemáticas en el intervalo 2009-2013, o ensayos clínicos que abordaran el tema sin límite temporal. Para ello se revisaron de manera exhaustiva las siguientes fuentes: Medline, Embase, The Cochrane Library, U.S. National Guidelines Clearinghouse, Tripdatabase y la Biblioteca de Guías de Práctica Clínica del Sistema Nacional de Salud (GuiaSalud). La búsqueda se realizó en diciembre de 2013 e incluyó solo artículos en español o en inglés. Los niveles de evidencia (NE) fueron evaluados según el método SIGN14.
Las labores adicionales del comité científico consistieron en la revisión crítica de la literatura, la elaboración del cuestionario inicial y la selección de un panel más amplio de expertos a los que se les remitiría un cuestionario elaborado a partir de las preguntas en las que, una vez evaluada la evidencia disponible, existiesen dudas acerca del peso de la evidencia.
Tomando como referencia la revisión de la literatura se elaboraron presentaciones en las que se incluyeron los datos más relevantes de la revisión realizada. Los miembros del comité científico también fueron los responsables de la redacción de las recomendaciones entre las 2 rondas del proceso y de la redacción final del documento.
Reunión presencial del comité de expertos. Elaboración y evaluación del cuestionarioSe llevó a cabo una reunión presencial en la que los miembros del comité científico compartieron con el comité de expertos la evidencia disponible para cada uno de los escenarios. El panel de expertos ampliado constaba de 23 especialistas en dermatología provenientes de distintas comunidades autónomas. En la reunión presencial cada miembro del comité científico desarrolló uno de los escenarios, dejándose tiempo suficiente para la discusión.
Después de 2 semanas los miembros del comité de expertos recibieron un cuestionario on line en 2 rondas de votación según la metodología estándar del método Delphi.
Con el objetivo de alcanzar un consenso, se usó el método Delphi modificado siguiendo recomendaciones de la RAND/UCLA15,16. En este método se elabora un cuestionario con recomendaciones que es evaluado y puntuado en 2 rondas por parte de un panel de expertos (anexo 1).
El análisis de la evidencia disponible para cada uno de los escenarios, los resultados de la votación según la metodología Delphi y la discusión se presenta en este documento.
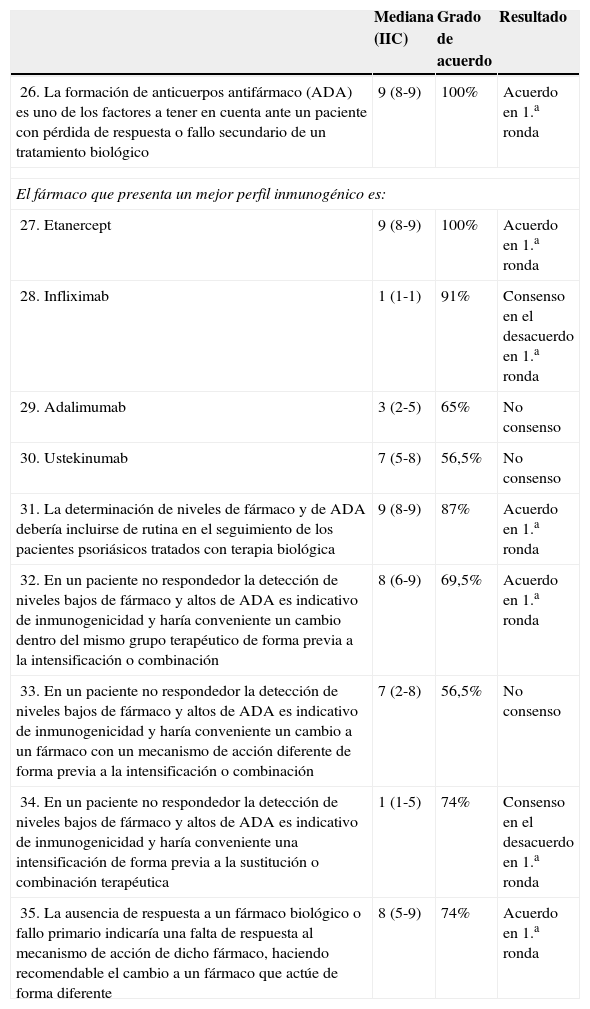
ResultadosEn la primera ronda de evaluación se consensuaron 32 de las 66 cuestiones planteadas (26 en el acuerdo y 6 en el desacuerdo). Cinco ítems fueron reformulados para el comité científico para eliminar ambigüedades y estos fueron sometidos, junto con las preguntas no consensuadas en primera ronda, a una segunda ronda de votación. En total, tras las 2 rondas de votación se alcanzó un consenso en 37 de los 66 ítems planteados (un 56%): 29 en el acuerdo y 8 en el desacuerdo (tablas 1–4).
Resultados escenario 1. Optimización del tratamiento biológico en un entorno de costes complicado
| Mediana (IIC) | Grado de acuerdo | Resultado | |
|---|---|---|---|
| 1. El tratamiento intermitente es una alternativa en la optimización de costes en terapia biológica | 8 (7-9) | 87% | Acuerdo en 1.a ronda |
| El fármaco biológico que presenta el mejor perfil para efectuar terapia intermitente es: | |||
| 2. Etanercept | 9 (8-9) | 96% | Acuerdo en 1.a ronda |
| 3. Adalimumab | 2 (1-5) | 61% | No consenso |
| 4. Ustekinumab | 2 (1-3) | 70% | Consenso en el desacuerdo en 2.a ronda |
| 5. Infliximab | 2 (1-3) | 100% | Consenso en el desacuerdo en 1.a ronda |
| 6. La desintensificación (reducción de dosis y/o alargamiento del intervalo de administración) es una alternativa en la optimización de costes en terapia biológica | 9 (9-9) | 96% | Acuerdo en 1.a ronda |
| El fármaco que presenta un mejor perfil para realizar una desintensificación (reducción de dosis y/o alargamiento del intervalo de administración) en terapia biológica es: | |||
| 7. Infliximab | 2 (1-3) | 78% | Consenso en el desacuerdo en 2.a ronda |
| 8. Adalimumab | 7 (5-8) | 65% | No consenso |
| 9. Etanercept | 8 (6-9) | 70% | Acuerdo en 1.a ronda |
| 10. Ustekinumab | 7 (3-8) | 56,5% | No consenso |
| 11. La combinación terapéutica de terapia clásica y biológica es una alternativa en la optimización de costes en terapia biológica | 9 (8-9) | 91% | Acuerdo en 1.a ronda |
| El fármaco biológico que presenta mejor perfil para usar en combinación con un fármaco sistémico clásico es: | |||
| 12. Adalimumab | 7 (4-7) | 56,5% | No consenso |
| 13. Infliximab | 7 (3-8) | 65% | No consenso |
| 14. Etanercept | 8 (7-9) | 78% | Acuerdo en 1.a ronda |
| 15. Ustekinumab | 5 (2-6) | 35% | No consenso |
IIC: intervalo intercuartílico.
Escenario 2. Artritis psoriásica y psoriasis activa tras fallo a FAME
| Mediana (IIC) | Grado de acuerdo | Resultado | |
|---|---|---|---|
| 16. El dermatólogo debe llevar a cabo en su práctica clínica test de cribado para el diagnóstico de sospecha de la artropatía psoriásica | 9 (7-9) | 78% | Acuerdo en 1.a ronda |
| 17. Es adecuado que el dermatólogo trate a pacientes con artritis psoriásica | 4 (2-7) | 22% | No consenso |
| 18. Es adecuado que el dermatólogo colabore con el reumatólogo en el tratamiento de los pacientes con artritis psoriásica | 9 (9-9) | 100% | Acuerdo en 1.a ronda |
| 19. Las visitas conjuntas dermatólogo-reumatólogo representan un buen instrumento para el manejo de los pacientes con psoriasis y artropatía psoriásica | 9 (8-9) | 100% | Acuerdo en 1.a ronda |
| 20. El tratamiento de elección en pacientes con artritis psoriásica y psoriasis tras fallo a FAME son los anti-TNF | 9 (8-9) | 100% | Acuerdo en 1.a ronda |
| En un paciente con dactilitis/entesitis persistente que no responde a FAME (por ejemplo metotrexato) con psoriasis cutánea controlada con metotrexato la mejor opción de tratamiento es: | |||
| 21. Etanercept | 8 (6-9) | 74% | Acuerdo en 1.a ronda |
| 22. Adalimumab | 7 (5-8) | 61% | No consenso |
| 23. Golimumab | 5 (2-8) | 30% | No consenso |
| 24. Infliximab | 7 (5-8) | 56,5% | No consenso |
| 25. Ustekinumab | 5 (2-7) | 26% | No consenso |
FAME: fármacos modificadores de la enfermedad; IIC: intervalo intercuartílico.
Escenario 3. Switching entre fármacos biológicos en pacientes con psoriasis que han presentado fallo primario/secundario
| Mediana (IIC) | Grado de acuerdo | Resultado | |
|---|---|---|---|
| 26. La formación de anticuerpos antifármaco (ADA) es uno de los factores a tener en cuenta ante un paciente con pérdida de respuesta o fallo secundario de un tratamiento biológico | 9 (8-9) | 100% | Acuerdo en 1.a ronda |
| El fármaco que presenta un mejor perfil inmunogénico es: | |||
| 27. Etanercept | 9 (8-9) | 100% | Acuerdo en 1.a ronda |
| 28. Infliximab | 1 (1-1) | 91% | Consenso en el desacuerdo en 1.a ronda |
| 29. Adalimumab | 3 (2-5) | 65% | No consenso |
| 30. Ustekinumab | 7 (5-8) | 56,5% | No consenso |
| 31. La determinación de niveles de fármaco y de ADA debería incluirse de rutina en el seguimiento de los pacientes psoriásicos tratados con terapia biológica | 9 (8-9) | 87% | Acuerdo en 1.a ronda |
| 32. En un paciente no respondedor la detección de niveles bajos de fármaco y altos de ADA es indicativo de inmunogenicidad y haría conveniente un cambio dentro del mismo grupo terapéutico de forma previa a la intensificación o combinación | 8 (6-9) | 69,5% | Acuerdo en 1.a ronda |
| 33. En un paciente no respondedor la detección de niveles bajos de fármaco y altos de ADA es indicativo de inmunogenicidad y haría conveniente un cambio a un fármaco con un mecanismo de acción diferente de forma previa a la intensificación o combinación | 7 (2-8) | 56,5% | No consenso |
| 34. En un paciente no respondedor la detección de niveles bajos de fármaco y altos de ADA es indicativo de inmunogenicidad y haría conveniente una intensificación de forma previa a la sustitución o combinación terapéutica | 1 (1-5) | 74% | Consenso en el desacuerdo en 1.a ronda |
| 35. La ausencia de respuesta a un fármaco biológico o fallo primario indicaría una falta de respuesta al mecanismo de acción de dicho fármaco, haciendo recomendable el cambio a un fármaco que actúe de forma diferente | 8 (5-9) | 74% | Acuerdo en 1.a ronda |
IIC: intervalo intercuartílico.
Escenario 4. Pacientes ancianos
| Mediana (IIC) | Grado de acuerdo | Resultado | |
|---|---|---|---|
| 36. La eficacia de los tratamientos biológicos empleados en la psoriasis es comparable en personas de más o de menos de 65 años | 9 (8-9) | 100% | Acuerdo en 1.a ronda |
| 37. La seguridad de los tratamientos biológicos empleados en la psoriasis es comparable en personas de más o de menos de 65 años | 9 (7-9) | 83% | Acuerdo en 1.a ronda |
| 38. Los objetivos terapéuticos del tratamiento con fármacos biológicos en la psoriasis (respuesta PASI 75, PGA 0-1, PASI<3) son distintos en individuos mayores de 65 años | 2 (1-3) | 87% | Consenso en el desacuerdo en 1.a ronda |
| 39. En el paciente anciano es recomendable la desintensificación precoz o el tratamiento intermitente con vistas a conseguir la mínima exposición posible al fármaco | 7 (5-8) | 70% | Acuerdo en 2.a ronda |
| La mejor opción en el tratamiento biológico de los pacientes mayores de 65 años con psoriasis es: | |||
| 40. Infliximab | 2 (1-3) | 83% | Consenso en el desacuerdo en 1.a ronda |
| 41. Adalimumab | 5 (2-7) | 39% | No consenso |
| 42. Etanercept | 9 (7-9) | 87% | Acuerdo en 1.a ronda |
| 43. Ustekinumab | 7 (3-8) | 56,5% | No consenso |
IIC: intervalo intercuartílico.
Paciente con psoriasis de larga evolución. Presenta un brote de psoriasis moderada-grave que se controla con tratamiento biológico durante un año. Se plantea un tratamiento intermitente con el fin de optimizar costes.
El elevado impacto económico en una dermatosis prevalente y crónica como la psoriasis ha pasado a ser un factor a tener muy en cuenta en la toma de decisiones estratégicas en esta enfermedad. En pacientes con respuesta óptima y mantenida a largo plazo se ha planteado la posibilidad de suspender el tratamiento o disminuir la dosis y/o la frecuencia de administración de fármacos biológicos, aunque no existe evidencia científica suficiente que permita establecer el abordaje ideal en cada caso17. Tampoco se conoce si estas estrategias son coste-efectivas. Sin embargo, se trata de propuestas y actuaciones reconocidas por los autores y de interés.
En el caso de suspender el tratamiento —tratamiento intermitente— se estima que las recurrencias ocurrirán entre los 2-6 meses posteriores a la interrupción18. Aunque las recomendaciones en este punto son variables, en la práctica se recomienda considerar la reintroducción si tras la interrupción se observa un PGA>2 y/o PASI≥5 y/o DLQI ≥5, o hay una recurrencia rápida de la enfermedad12.
Etanercept contempla en su ficha técnica el tratamiento intermitente y cuenta con una mayor experiencia acumulada en este sentido. Su uso en este contexto se considera seguro y eficaz, tanto en adultos18–22 (NE 1+) como en niños23 (NE 1+). El primer estudio que examinó la suspensión del tratamiento con etanercept después de una respuesta satisfactoria y su posterior reanudación incluyó un total de 652 pacientes que fueron aleatorizados en varios grupos con distintas dosis. Un total de 409 pacientes respondedores (PASI 50) en la semana 24 suspendieron el tratamiento, y fueron retratados con la misma dosis tras su recaída. La respuesta PASI 50 tras 12 semanas de retratamiento se situó entre el 71 y el 87% en función de la dosis empleada (NE 2+). La mediana de tiempo hasta la recaída fue de 85 días y no se observaron efectos adversos graves19. Otro estudio más amplio se realizó con 2.546 pacientes que se asignaron aleatoriamente a 2 grupos de tratamiento, continuo o intermitente. Todos los pacientes recibieron etanercept 50mg2v/s durante las primeras 12 semanas. Los pacientes en tratamiento continuo siguieron con una dosis de 50mg1v/s durante otras 12 semanas y los pacientes en pauta intermitente respondedores (PGA≤2) suspendieron y fueron retratados en caso de recaída de la enfermedad con etanercept 50mg1v/s. La respuesta (PGA≤2) en la semana 24 fue superior en el grupo continuo (71,0%) que en el intermitente (59,5%; p<0,001). La mayoría de los pacientes recuperaron la respuesta tras el retratamiento. Fue una limitación del estudio el corto periodo de retratamiento entre 4-8 semanas (NE 1+)20. El estudio CRYSTEL19 fue un trabajo abierto y multicéntrico que incluyó 720 pacientes que se aleatorizaron en 2 grupos y que recibieron bien etanercept 25mg2v/s en pauta continua, bien una dosis de inicio de 50mg2v/s durante 12 semanas o hasta la obtención de la respuesta (PGA≤2) si seguían una pauta intermitente, momento en el cual se interrumpía el tratamiento. Posteriormente, en caso de recaída (PGA≥3) se reanudaba la administración con una dosis de etanercept de 25mg/semanales. Ambas pautas de tratamiento fueron eficaces. La puntuación media del PGA a lo largo de 54 semanas fue significativamente menor en el grupo de tratamiento continuo que en el intermitente —1,98 frente a 2,51, respectivamente (p<0,001)— y también fue superior la mejoría del PASI entre la semana basal y la semana 24 (68% vs. 59%). Un análisis post-hoc de este mismo estudio incluyó un total de 226 pacientes respondedores (PGA≤2) que suspendieron el tratamiento. El 83% de ellos recuperaron la respuesta durante el primer ciclo de retratamiento (NE 2+)21. En todos estos estudios se comprobó que tras la interrupción del tratamiento la reaparición de la enfermedad fue gradual, sin efectos adversos graves ni hospitalizaciones por agravamiento de la psoriasis y sin cambios en la morfología19–21. Un nuevo análisis del estudio CRYSTEL, publicado recientemente24, muestra un acortamiento del tiempo sin tratamiento pasado el segundo ciclo. Así, la mediana de tiempo sin tratamiento entre el ciclo 1 y 2 fue de 11 semanas, mientras que este periodo se redujo a una mediana de 6 semanas entre los ciclos 2-3, 3-4 y 4-5. La duración del tratamiento con etanercept fue significativamente menor en el primer ciclo que en el segundo (media de 9,8 vs. 13,6 semanas, p<0,001), aunque no hubo diferencias significativas entre los ciclos 2 y 3 o entre los ciclos 3 y 4. La porporción de pacientes muy satisfechos, satisfechos o algo satisfechos descendió del 100% en el primer ciclo al 97% y 91% en el segundo y tercer ciclo respectivamente.
El estudio más amplio de «suspensión-retratamiento» en niños fue llevado a cabo en 211 pacientes pediátricos con edades comprendidas entre los 4 y 17 años, con una psoriasis en placas de moderada a grave23. En este trabajo 138 pacientes respondedores (PASI75) fueron asignados aleatoriamente en la semana 36 a seguir etanercept en pauta continua o a suspender el tratamiento. De los pacientes asignados a placebo el 42% perdieron la respuesta y fueron nuevamente tratados con etanercept en régimen abierto. La respuesta (PASI 75) fue del 80% (52/65) en los pacientes con tratamiento continuo y del 73,5% (50/68) en pacientes con interrupción y retratamiento en la semana 12 (NE.1+)23.
La experiencia con respecto a la terapia intermitente es limitada para adalimumab25–27 En el estudio REVEAL25 pacientes respondedores (PASI75) en la semana 40 fueron aleatorizados; mientras un grupo recibió adalimumab de forma continua otro suspendió el tratamiento y fue retratado 19 semanas después. El 38% y el 55% de los pacientes que fueron retratados alcanzaron un PASI75 tras 12 y 24 semanas de retratamiento respectivamente. La respuesta fue mejor cuando este se hizo antes de perder el PASI50. En el periodo de extensión de 108 semanas la respuesta PASI75 fue similar entre los pacientes en tratamiento continuo e intermitente (75% vs. 73%) (NE 1+), considerando que entre los pacientes que siguieron una pauta intermitente había pacientes que durante el periodo de suspensión recayeron y pacientes que no lo hicieron. Por último, un total de 347 respondedores estables (PGA≤2) participaron en una evaluación de suspensión y retratamiento en un estudio de extensión abierto. El tiempo medio de recaída fue aproximadamente de 5 meses. Un 69,1% (123/178) de los pacientes que recayeron durante la retirada alcanzaron una respuesta PGA≤2 en la semana 16. El perfil de seguridad observado durante el retratamiento fue similar al de antes de la retirada (NE 2++)26. En el estudio REVEAL también se observó que los pacientes que pierden la respuesta más lentamente tras la suspensión obtienen con el retratamiento una respuesta mayor y más sostenida que aquellos que pierden la respuesta de forma más precoz y rápida con la suspensión27.
La terapia intermitente con infliximab se asocia a una alta tasa de reacciones infusionales28 (NE 1+). Esto se ha evidenciado en estudios como el RESTORE228, en el que se produjeron reacciones infusionales en el 15% de los pacientes en tratamiento intermitente frente al 9% de aquellos en tratamiento continuo28. La proporción de reacciones infusionales fue menor en el caso de otros trabajos, como el EXPRESS II en el que, a diferencia del estudio anterior, el retratamiento se hacía con pautas de mantenimiento cada 8 semanas en lugar de emplear dosis de inducción29.
La evidencia de tratamiento intermitente con ustekinumab es escasa30. La mayor experiencia procede del estudio Phoenix I. Los pacientes con buena respuesta en la semana 40 fueron aleatorizados bien a continuar el tratamiento bien a supenderlo (periodo de suspensión/retratamiento). Entre los 195 pacientes que suspendieron y reiniciaron ustekinumab, el 85,6% alcanzaron una respuesta PASI75 a las 12 semanas de retratamiento (NE 1+)30.
Resultados del consensoPreguntados sobre la terapia intermitente, los panelistas consideraron que el tratamiento intermitente es una alternativa válida en la optimización de costes en terapia biológica. Entre las pautas disponibles interpretaron que etanercept es el fármaco biológico que presenta el mejor perfil para efectuar terapia intermitente.
Hubo consenso en que infliximab y ustekinumab no presentan el mejor perfil en esta estrategia, mientras que no lo hubo cuando se consideró adalimumab (mediana de 2, IIC 1-5) (tabla 1).
Paciente con psoriasis moderada-grave de años de evolución con antecedentes de ineficacia o efectos adversos con fototerapia, metotrexato y ciclosporina. Se inició tratamiento biológico hace 2 años con respuesta completa mantenida durante este período de tiempo. Se plantea una desintensificación de su terapia biológica (reducir dosis/alargar el intervalo de administración).
La reducción de dosis para limitar la exposición al fármaco puede considerarse en el contexto de un tratamiento eficaz, aunque hay un riesgo teórico de que esta acción pueda disminuir la eficacia, y cierta evidencia de que intervalos más alargados de administración pueden incrementar el riesgo de formación de anticuerpos antifármaco31. La estrategia de minoración consistente en el inicio sin dosis de inducción y de la reducción de dosis se ha ensayado con etanercept, aunque la experiencia no es amplia32–34(NE 1+). Algunos autores consideran que se puede considerar la posibilidad de reducción de dosis en pacientes con buena respuesta, especialmente en tratamientos combinados con fármacos convencionales, aunque puede existir riesgo de fallo del tratamiento31.
Resultados del consensoEl panel acordó en primera ronda que la minoración (reducción de dosis y/o alargamiento del intervalo de administración) es una alternativa en la optimización de costes en terapia biológica. El fármaco que presentó en la votación un mejor perfil para realizar esta minoración en terapia biológica fue etanercept. Ustekinumab y adalimumab estuvieron cerca del consenso para esta estrategia (ambos con medianas de 7, IIC 3-8 y 5-7 respectivamente). Sí hubo consenso en que infliximab no es el fármaco con mejor perfil para la desintensificación (tabla 1).
Paciente con psoriasis moderada-grave tratada previamente con ciclosporina (con aumento de tensión arterial) y fototerapia (que se mostró ineficaz). En tratamiento con metotrexato desde hace 2 años; muestra un control parcial de su enfermedad. Se plantea asociar un tratamiento biológico a metotrexato.
La combinación de tratamientos biológicos con los tratamientos sistémicos clásicos puede mejorar los resultados terapéuticos3. En algunos casos además podría disminuir los costes al reducirse las dosis del tratamiento biológico, o no necesitar incrementarlas por disminución de la eficacia, aunque los datos que apoyan esta estrategia son escasos12,35–37. El uso combinado no está aprobado formalmente para ningún biológico según consta en la ficha técnica de los distintos fármacos.
Existe evidencia de la eficacia y seguridad de etanercept asociado a tratamientos clásicos como metotrexato38–40 (NE 1++), fototerapia36,41–45 (NE 1+), acitretina35,46 (NE 1+) o ciclosporina47 (NE 3). En las guías españolas de tratamiento de la psoriasis con agentes biológicos se considera que etanercept es un fármaco especialmente apropiado para el tratamiento combinado2. Además, hay estudios que han demostrado su eficacia sin necesidad de inducción cuando se combina con acitretina35 (NE 1+) o con fototerapia36 (NE 2+).
La experiencia publicada del uso de adalimumab en combinación con tratamientos clásicos en psoriasis moderada y su combinación con metotrexato48 (NE 2–), fototerapia49 (NE 2–), acitretina50 (NE 3) y en menor medida ciclosporina50 (NE 3) han mostrado resultados favorables en estudios basados en series de casos a dosis estándar.
La combinación de infliximab con metotrexato es una práctica clínica frecuente2, aunque la evidencia de la eficacia de su uso combinado en psoriasis es escasa y se basa en series de casos37,51,52 (NE 2+). Podría ser eficaz a dosis menores de la estándar en tratamientos combinados según la experiencia en una serie en 11 pacientes en los que se usaron dosis de 3mg/kg junto con metotrexato37 (NE 2+). Ustekinumab también parece seguro y eficaz a dosis estándar en terapia combinada, aunque la evidencia es escasa53,54 (NE 3).
Resultados del consensoLos panelistas consideraron que la combinación terapéutica de terapia clásica y biológica es una alternativa en la optimización de costes en terapia biológica. Se llegó a un acuerdo en que el fármaco biológico que presenta mejor perfil para usar en combinación con un fármaco sistémico clásico es etanercept. Adalimumab (mediana 7, IIC 4-7) e infliximab (mediana 7, IIC 3-8) estuvieron cerca del consenso por un estrecho margen. Tampoco el uso de ustekinumab en este contexto alcanzó el consenso (mediana 5, IIC 2-6) (tabla 1).
Escenario 2. Artritis psoriásica y psoriasis activa tras fallo a fármacos modificadores de la enfermedadPaciente con psoriasis en placas con afectación ungueal severa. Los signos de la enfermedad son bien controlados mediante tratamiento con acitretina, a excepción de la afectación ungueal. En la última visita se queja de dolor generalizado que en ocasiones predomina en la espalda y las nalgas de forma alternativa. El paciente es visitado de forma conjunta por reumatología y dermatología, y es diagnosticado de artropatía periférica, dactilitis y entesitis. Presenta fallo al tratamiento con metotrexato y se plantea iniciar un tratamiento biológico. Se cuestiona qué procedimiento es más adecuado para descartar artropatía psoriásica (APs) en este tipo de pacientes, quién debe tratar la APs y cuál es el tratamiento más adecuado tras el fracaso del tratamiento con metotrexato.
La APs es una artropatía progresiva que puede dar lugar a un daño articular irreversible4 y cuya prevalencia aumenta con la duración de la psoriasis55. Hasta el 30% de los pacientes con psoriasis atendidos en unidades de dermatología pueden padecer de APs56 (NE 2++) y más de un tercio de ellos podrían no estar diagnosticados56 (NE 2++). Por todo ello es importante un diagnóstico y un tratamiento precoz de la APs.
Las herramientas diseñadas para el cribado de pacientes con psoriasis con el fin de detectar la APs (PASE, PEST, ToPAS) tienen limitaciones, pues tienen una baja sensibilidad y especificidad cuando se excluyen la formas poliarticulares57. Además, estos cuestionarios de cribado para el diagnóstico de sospecha de APs se usan muy poco en la práctica clínica58 (NE 4). La APs ya establecida se clasifica de acuerdo a los criterios CASPAR, sin embargo estos criterios no están diseñados para el cribado de la enfermedad59.
Debido a todo esto se han desarrollado algoritmos para el cribado de la APs en la consulta de dermatología4,60 (NE 4) basados en una anamnesis y una exploración física específica. En la anamnesis dirigida se recomienda preguntar sobre la presencia de dolor inflamatorio o tumefacción articular actual, con especial énfasis en las rodillas, los tobillos y las pequeñas articulaciones de las manos. Además debe preguntarse si existe dolor inflamatorio o nocturno en el esqueleto axial y en zonas de inserción tendinosa, especialmente en los talones y las fascias plantares. La exploración física específica incluye la inspección (buscando enrojecimiento) y exploración (calor, limitación de movilidad, dolor) de articulación/es dolorosas o tumefactas, y muy especialmente de las inserciones tendinosas del tendón de Aquiles y fascias plantares. Además hay que realizar la inspección de las extremidades en busca de alteraciones ungueales como distrofia ungueal, onicólisis, pitting e hiperqueratosis y dactilitis.
Dadas las dificultades en el diagnóstico y manejo de la APs se considera que una atención multidisciplinar reumatólogo/dermatólogo puede facilitar el diagnóstico de la afectación articular y puede ofrecer un tratamiento global a los pacientes con psoriasis y APs61. Por ello, las directrices nacionales e internacionales coinciden en que dermatólogos y reumatólogos deben trabajar en estrecha colaboración para manejar a los pacientes con afectación grave de las articulaciones y la piel8,60,62–64 (NE 4).
Las recomendaciones para el tratamiento con terapia biológica de los pacientes con APs de las guías españolas59 señalan que la terapia biológica está indicada en pacientes con enfermedad activa y refractarios a la terapia convencional (AINE, infiltraciones, fármacos modificadores de la enfermedad [FAME]), excepto en circunstancias particulares en las que la gravedad de la APs (extensión de la psoriasis, dactilitis, entesitis, monoartritis, uveítis, etc.) limiten de modo claro la calidad de vida, las capacidades de ocio o laborales del individuo, haciendo que se pueda indicar la terapia biológica sin necesidad de agotar las posibilidades del tratamiento convencional.
De los tratamientos disponibles en la actualidad para la APs los anti-TNF han demostrado eficacia en los 5 dominios clave de la enfermedad: artritis periférica, enfermedad de piel y uñas, afectación axial, dactilitis y entesitis65 (NE 1+).
Los anti-TNF aprobados para tratar la psoriasis (adalimumab, etanercept e infliximab) tienen indicación para el tratamiento de la APs activa y progresiva en adultos cuando la respuesta al tratamiento previo con FAME no es adecuada4. Se ha comprobado que estos tratamientos inhiben la progresión radiológica de la APs66–69.
Ustekinumab también ha demostrado ser eficaz en el tratamiento de la APs70 (NE 1+). Integrando los datos de los estudios PSUMITT 1 y 2, se ha comprobado que puede inhibir la progresión radiológica de la APs, aunque este efecto no se observó con claridad, analizando solo los datos del estudio PSUMMIT-2 con 312 pacientes71. Actualmente ha sido autorizada su indicación de tratamiento de la APs por la Agencia Europea del Medicamento, con una indicación de uso similar a la de los anti-TNF72. En algunas directrices como las guías del National Institute for Health and Care Excellence (NICE) del Reino Unido solo se recomienda esta opción en pacientes en los que hayan fracasado o no estén indicados los fármacos anti-TNF73. Hay que tener en cuenta que las recomendaciones de las guías NICE, aunque se basan en modelos farmacoeconómicos sustentados en estudios de coste-utilidad y años ajustados por calidad de vida, son criterios de reembolso, no recomendaciones clínicas. En otros modelos farmacoeconómicos, aunque etanercept es el fármaco que ha demostrado ser más coste-efectivo en pacientes con APs y psoriasis leve a moderada, todos los biológicos con indicación en esta enfermedad tendrían una probabilidad similar de ser coste efectivos en la APs y la psoriasis moderada a severa74.
Respecto a cuál es la mejor opción terapéutica en el tratamiento de la dactilitis/entesitis, no hay estudios comparativos directos que comparen las distintas opciones en este sentido. Etanercept75 (NE 1++), infliximab76,77 (NE 1+) ustekinumab70,78 (NE 1+), golimumab79 (NE 1+) han demostrado ser eficaces en el tratamiento de la dactilitis y entesitis, mientras que adalimuab también ha demostrado ser eficaz en el tratamiento de estas patologías80 (NE 2+) en buena parte de los estudios realizados, aunque no en todos81.
Resultados del consensoRespecto al cribado de la APs, aunque no se exploró ninguna estrategia diagnóstica clínica en concreto, sí que hubo acuerdo en considerar que el dermatólogo debe llevar a cabo en su práctica clínica una anamnesis y una exploración dirigida al diagnóstico de sospecha de la APs. No hubo consenso ante la cuestión que exploraba si es adecuado que el dermatólogo trate a pacientes con APs aunque, por el contrario, sí hubo acuerdo en considerar que es adecuado que el dermatólogo colabore con el reumatólogo en el tratamiento de los pacientes con APs. En esta línea también se consensuó que las visitas conjuntas dermatólogo-reumatólogo representan un buen instrumento para el manejo de los pacientes con psoriasis y APs.
Respecto al tratamiento, los panelistas asumieron por consenso que el tratamiento de elección en pacientes con artritis psoriásica y psoriasis tras fallo a FAME son los anti-TNF. En concreto, consideraron en primera ronda que en un paciente con dactilitis/entesitis persistente que no responde a FAME (por ejemplo metotrexato) con psoriasis cutánea controlada con metotrexato la mejor opción de tratamiento es etanercept. Adalimumab e infliximab estuvieron en el límite del consenso (ambos con medianas de 7 e IIC 5-8).
Escenario 3. Switching entre fármacos biológicos en pacientes con psoriasis que han presentado fallo primario/secundarioPaciente con falta de respuesta a un primer tratamiento con terapia biológica (fallo primario de tratamiento) o con una buena respuesta inicial pero que presenta una pérdida de respuesta posterior (fallo secundario). Se plantea cuál es el tratamiento óptimo para realizar un cambio de tratamiento biológico tras un fallo primario o secundario.
La tasa de pacientes que alcanzan una respuesta PASI 75 con el primer tratamiento biológico es del 50-80%2,82. Un 75-85% de ellos mantendrá la respuesta a largo plazo83. La decisión referente al fracaso/éxito de tratamiento se realiza habitualmente para todos los tratamientos biológicos entre las semanas 16 y 24, una vez transcurrida la fase de inducción terapéutica2.
Por otra parte, se considera un fallo secundario de un tratamiento biológico cuando existe una respuesta inicial adecuada y se produce el fracaso terapéutico posteriormente, o cuando un tratamiento biológico no se tolera o aparece alguna contraindicación84.
Ante un fallo primario o secundario las posibilidades terapéuticas serían: cambiar de biológico, intensificar del tratamiento o realizar combinaciones de tratamientos2. Respecto al cambio de biológico no hay evidencias sólidas que indiquen cuál es el mejor tratamiento para empezar una terapia biológica y cuál es la secuencia de tratamientos óptima en caso de fallo primario o secundario12,84,85 (NE 4).
No se conocen bien los mecanismos que llevan al fallo primario o secundario de un tratamiento biológico, pero en ocasiones podrían estar relacionados con el desarrollo de anticuerpos antifármaco (antidrug antibodies [ADA])82,84. Todos los agentes biológicos pueden potencialmente inducir una respuesta inmune no deseada, tanto los anticuerpos monoclonales quiméricos humano-murinos (infliximab), como las proteínas de fusión (etanercept) o los anticuerpos totalmente humanos (adalimumab, ustekinumab)85. La presencia de ADA puede condicionar los niveles y la función del fármaco, y por tanto el efecto terapéutico, y también el perfil de seguridad, principalmente y en concreto en el caso de infliximab28 por la posibilidad de reacciones infusionales83,85 (NE 1+).
Por ello se ha recomendado que ante un paciente con pérdida de respuesta o fallo secundario de un tratamiento biológico se tenga en cuenta la determinación de niveles de fármaco y la formación de ADA. También es importante saber que los ADA pueden ser neutralizantes y no neutralizantes5. Los ADA frente a anticuerpos quiméricos (infliximab) y humanos (adalimumab, ustekinumab) son con gran probabilidad, aunque no siempre, neutralizantes, ya que interfieren de forma directa en la acción terapéutica del fármaco5. Los ADA neutralizantes no suponen necesariamente la ausencia de acción terapéutica final del fármaco, pues dependerá del equilibrio entre los niveles del fármaco y de los ADA, y de los niveles necesarios de fármaco para obtener los resultados terapéuticos5.
En la práctica clínica las implicaciones del desarrollo de ADA sobre la seguridad y eficacia de los diferentes tratamientos biológicos en psoriasis son muy diferentes. La eficacia y seguridad de etanercept es independiente de la presencia de ADA en ensayos clínicos aleatorizados83,86,87 (NE 1+) y en extensiones de estudios a largo plazo88 (NE 2+). Aunque se han detectado ADA anti-etanercept en el 18,5% de los pacientes tratados hasta 96 semanas, no se ha comprobado que este hallazgo se acompañe de variaciones en la perspectiva de respuesta. Estos resultados serían coherentes con la naturaleza aparentemente no neutralizante de los ADA observada en estudios de laboratorio33.
En el caso de adalimumab, la aparición de ADA es frecuente, está correlacionada con las concentraciones de fármaco y podría tener influencia en la respuesta clínica83,87,89–91 (NE 2+). Para infliximab además de la pérdida de respuesta clínica, la presencia de ADA se correlaciona de manera positiva con la posibilidad de desarrollar reacciones infusionales28 (NE 1+). La presencia de ADA neutralizantes se ha detectado en alrededor del 5% de pacientes tratados con ustekinumab, aunque no existe evidencia de que tengan repercusión clínica83,87,92 (NE 1+). En cualquier caso se ha visto que el uso de metotrexato puede disminuir la aparición de ADA, no solo en el tratamiento de la psoriasis, sino también de la artritis reumatoide, las espondiloartropatías y la enfermedad inflamatoria intestinal93 (NE 2+).
Para facilitar las decisiones clínicas se han desarrollado algoritmos sobre cómo actuar en casos de fallo primario o secundario del tratamiento que tienen en cuenta la concentración del fármaco y la presencia o no de ADA85 (NE 4). Aunque por el momento no se trata de propuestas firmes y estandarizadas, en particular la evidencia disponible permite aportar recomendaciones en el caso de pacientes no respondedores.
En particular, cuando los niveles de fármaco y los títulos de ADA son bajos, se debe aumentar la dosis o acortar el intervalo de administración. Si los niveles de fármaco son bajos y los de ADA son medio-altos, se podría sustituir el fármaco anti-TNF. Cuando los niveles de fármaco son altos se recomienda cambiar directamente la diana terapéutica85,94(NE 2++, 4).
Resultados del consensoLos panelistas estuvieron de acuerdo en que la formación de ADA es uno de los factores a tener en cuenta ante un paciente con pérdida de respuesta o fallo secundario de un tratamiento biológico, y que la determinación de niveles de fármaco y de ADA debería incluirse de rutina en el seguimiento de los pacientes psoriásicos tratados con terapia biológica. Se aceptó en primera ronda que el fármaco que presenta un mejor perfil inmunogénico es etanercept. También hubo consenso en que infliximab no es el fármaco con mejor perfil inmunogénico83,87, mientras que no se alcanzó el consenso cuando se preguntó sobre adalimumab (mediana 3, IIC 2-5). Ustekinumab estuvo cerca de alcanzar el consenso como fármaco con mejor perfil inmunogénico, con una mediana de 7, IIC 5-8.
En este bloque además se hicieron preguntas para tratar de validar el algoritmo propuesto para el manejo del fallo del tratamiento según los niveles de fármaco y la presencia de ADA85. En línea con este algoritmo, según los miembros del panel en un paciente no respondedor, la detección de niveles bajos de fármaco y altos de ADA es indicativa de inmunogenicidad y haría conveniente un cambio dentro del mismo grupo terapéutico y no a una intensificación o combinación terapéutica (tabla 3).
Escenario 4. Pacientes ancianosPaciente de 69 años con psoriasis moderada-grave mal controlada con FAME. Se plantea la seguridad y eficacia de los tratamientos biológicos en pacientes ancianos.
La población anciana habitualmente no se incluye en ensayos clínicos, por lo que no hay recomendaciones expresas para su tratamiento en las guías de práctica clínica95. Además, el gran número de comorbilidades y la mayor susceptibilidad a infecciones95, la polimedicación, que aumenta el riesgo de interacciones medicamentosas, y las peculiaridades farmacocinéticas y farmacodinámicas de estos pacientes pueden complicar su manejo.
En las fichas técnicas de los distintos tratamientos biológicos se indica que los pacientes ancianos no requieren ajustes de dosis y advierten de un posible riesgo aumentado de infecciones en esta población72,96–98. En la ficha técnica de etanercept además se indica que en los estudios de fase 3 con este fármaco en artritis reumatoide, artritis psoriásica y espondilitis anquilosante no hubo diferencias significativas en la frecuencia de efectos adversos (graves o no graves) ni en la frecuencia de infecciones graves entre pacientes mayores de 65 años comparados con pacientes más jóvenes, sin diferencias en estudios farmacocinéticos, volumen de distribución o aclaramiento97.
La evidencia científica sobre la seguridad y la eficacia de los tratamientos biológicos en población anciana es escasa. Respecto a etanercept, en un análisis post hoc de 2 ensayos clínicos aleatorizados no se encontraron diferencias significativas en la eficacia entre los pacientes ancianos o jóvenes, afirmación refrendada en pequeñas series (NE 3)99. También fueron similares los cambios en la calidad de vida medida por DLQI. La tasa de efectos adversos graves fue significativamente mayor en los pacientes ancianos, pero no estuvieron asociados al tratamiento100 (N.E. 1+).
En un estudio con etanercept y adalimumab en 89 pacientes mayores de 65 años los datos de eficacia y seguridad fueron buenos, sin diferencias en eficacia y seguridad entre ambos tratamientos101 (NE 2–). Con adalimumab, en un subestudio del estudio REVEAL en pacientes con psoriasis, se encontró una tendencia a una menor eficacia en mayores de 65 años, en el límite de la significación estadística (p=0,052)102 (NE 1+).
Un metaanálisis reciente ha analizado la seguridad del tratamiento con biológicos de los pacientes ancianos95 (NE 1+). Este estudio concluye que los pacientes ancianos tienden a tener una tasa de efectos adversos más alta que los pacientes jóvenes, salvo en las reacciones locales a la inyección, cefalea, rinitis, reacciones alérgicas e infecciones respiratorias altas, que son más frecuentes en jóvenes. En cuanto a neoplasias, se describen más en ancianos, pero con una frecuencia similar a las esperadas por edad. Algunos estudios incluídos en este metaanálisis describen en ancianos una tasa más alta de infecciones que requieren hospitalización. Finalmente, en pacientes con artritis reumatoide se ha encontrado una mayor tasa de efectos adversos en ancianos con respecto a jóvenes en los tratados con infliximab o adalimumab, sin encontrar diferencias entre estos 2 grupos en el caso de etanercept103 (NE 2).
Etanercept se ha considerado en un reciente consenso internacional como el tratamiento de elección de la psoriasis en pacientes ancianos, principalmente por su vida media más corta, lo que facilita el manejo en caso de que sea necesaria una suspensión rápida del tratamiento (por vacunas, intervenciones quirúrgicas, etc.)104.
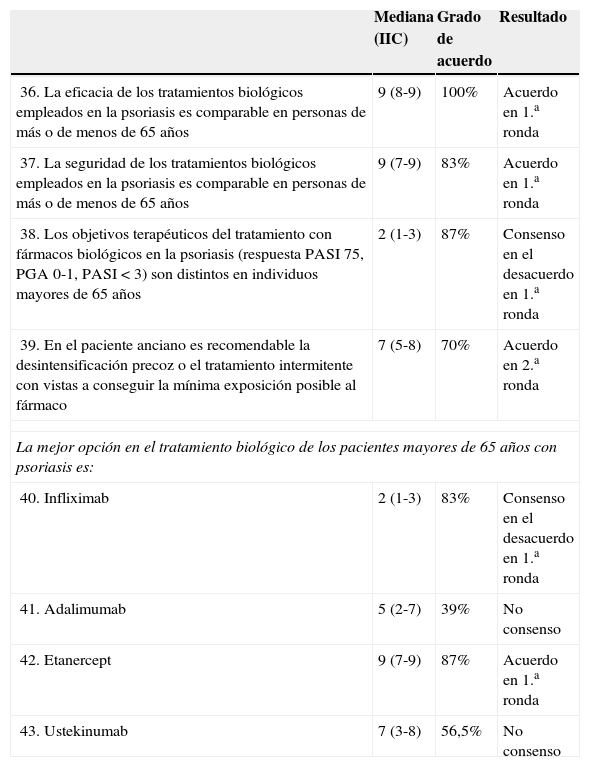
Resultados del consensoLos miembros del panel consensuaron en primera ronda que la eficacia y la seguridad de los tratamientos biológicos empleados en la psoriasis es comparable en personas de más de 65 años o menores, y que los objetivos terapéuticos deben ser los mismos.
Además, en segunda ronda se acordó que en el paciente anciano es recomendable la desintensificación precoz o el tratamiento intermitente con vistas a conseguir la mínima exposición posible al fármaco. La mejor opción en el tratamiento biológico de los pacientes mayores de 65 años con psoriasis fue etanercept, fundamentalmente por su vida media corta. Hubo consenso en no considerar infliximab como la mejor opción, mientras que con adalimumab no se alcanzó el consenso. Ustekinumab estuvo cerca de alcanzar el consenso como mejor tratamiento (mediana 7, IIC 3-8) (tabla 4).
Escenario 5. Otras situaciones especialesPaciente con psoriasis grave y antecedentes de hígado graso, múltiples factores de riesgo cardiovascular (diabetes mellitus, hipertensión arterial, obesidad) y enfermedad cardiovascular (infarto agudo de miocardio). Se plantea el mejor tratamiento con biológicos teniendo en cuenta sus antecedentes.
La psoriasis se asocia a un incremento de los factores de riesgo cardiovascular y a un mayor riesgo de eventos cardiovasculares105 (NE 1++). Los tratamientos anti-TNF podrían disminuir el riesgo de infarto agudo de miocardio106,107 (NE 2++) y el riesgo de otros eventos cardiovasculares108 (NE 2+) en pacientes con psoriasis. Igualmente, los tratamientos continuados con agentes anti-TNF podrían disminuir la arterioesclerosis en los pacientes con artritis psoriásica109,110 (NE 2+). Los agentes anti-IL-12/23 (ustekinumab y briakinumab) se han asociado a un incremento del riesgo de eventos cardiovasculares en algún estudio111, aunque esta asociación no se ha encontrado en otros112,113 (NE 1+).
También es conocida la relación entre la psoriasis y enfermedades como el hígado graso no alcohólico (HGNA)3, la obesidad114–118, la diabetes mellitus3 o la hipertensión arterial (HTA)3, y también con biomarcadores de riesgo cardiovascular119,120.
Se ha descrito una prevalencia mayor de HGNA en pacientes con psoriasis3. El HGNA se encuentra asociado con obesidad, diabetes mellitus, resistencia a la insulina, HTA, hiperlipidemia y síndrome metabólico3. En pacientes diagnosticados de HGNA se debe extremar la precaución en el tratamiento de la psoriasis con fármacos potencialmente hepatotóxicos3. Según la ficha técnica, la elevación de las enzimas hepáticas es común con infliximab (frecuencia≥1/100 a<1/10 pacientes)96, muy común con adalimumab (≥1/10)98 y rara con etanercept (≥1/10.000 a <1/1.000)97 Sin embargo, este dato no se registra en la ficha técnica de ustekinumab72.
La obesidad es un factor limitante en la respuesta de todos los tratamientos biológicos. En el caso de infliximab su dosificación según el peso ofrece la posibilidad de obtener resultados similares en pacientes obesos y no obesos121 (NE 1+), sin embargo en algún estudio en psoriasis moderada-grave la obesidad se ha asociado a un retraso en la respuesta y a una menor eficacia del tratamiento122 (NE 1–). Para etanercept la dosificación no se ajusta al peso de manera estándar, y el sobrepeso podría influir en la respuesta. Los pacientes con un índice de masa corporal (IMC) dentro de la normalidad pueden obtener una respuesta superior a etanercept que los pacientes muy obesos (con IMC>40)123 (NE 1–). Sin embargo, hay estudios en los que no se ha visto la influencia del IMC en la respuesta114,124 (NE 2+). Adalimumab no ajusta su dosificación al peso de manera estándar y el sobrepeso podría influir en la respuesta125 (NE 1+). En los subanálisis de los estudios REVEAL, BELIEVE y CHAMPION la respuesta al tratamiento también disminuyó en función del peso, aunque a menudo no de forma significativa102,126,127 (NE 1+). También se ha observado peor respuesta en pacientes con sobrepeso en el caso de ustekinumab128,129 (NE 1+). En su ficha técnica se recomiendan dosis mayores en pacientes de más de 100kg. Además, adalimumab, etanercept e infliximab pueden asociarse a incrementos en el peso de los pacientes114–117 (NE 2+), aunque este hecho no se ha observado con ustekinumab118 (NE 2+).
En numerosos estudios se ha encontrado una asociación entre diabetes mellitus y psoriasis3. En pacientes con artritis reumatoide o con psoriasis, el uso de anti-TNF (adalimumab, etanercept e infliximab) se ha asociado a un menor riesgo de desarrollar diabetes mellitus130 (NE 2++) y a una mejoría de la resistencia a la insulina131 (NE 2++).
En pacientes obesos con síndrome metabólico el tratamiento con etanercept mejora la glucemia en ayunas comparado con placebo132 (NE 1–). En la ficha técnica de etanercept se advierte del riesgo de hipoglucemias, por lo que algunos pacientes diabéticos pueden necesitar una reducción de la dosis de hipoglucemiantes97. La hiperglucemia es un efecto secundario común de adalimumab según su ficha técnica98, aunque es infrecuente que esta circunstancia condicione su empleo en la práctica clínica.
Aunque los estudios son escasos, probablemente los anti-TNF no tienen influencia sobre el metabolismo lipídico131 (NE 2+). En la ficha técnica de adalimumab el incremento de lípidos figura como una reacción adversa muy frecuente, si bien no hace mención a diferencias significativas con el grupo placebo98.
En algunos estudios se ha encontrado una asociación significativa entre HTA y psoriasis, siendo el riesgo de HTA mayor cuando la psoriasis es más grave3. La HTA es una reacción adversa frecuente con adalimumab según su ficha técnica98.
La mayor evidencia de la influencia positiva de un tratamiento biológico sobre marcadores de riesgo cardiovascular se ha obtenido con etanercept. Se ha demostrado que disminuye los niveles de PCR y algunos otros biomarcadores de riesgo cardiovascular en pacientes con psoriasis y artritis psoriásica119,120 (NE 1+). Sin embargo, la relevancia clínica de estos cambios se desconoce.
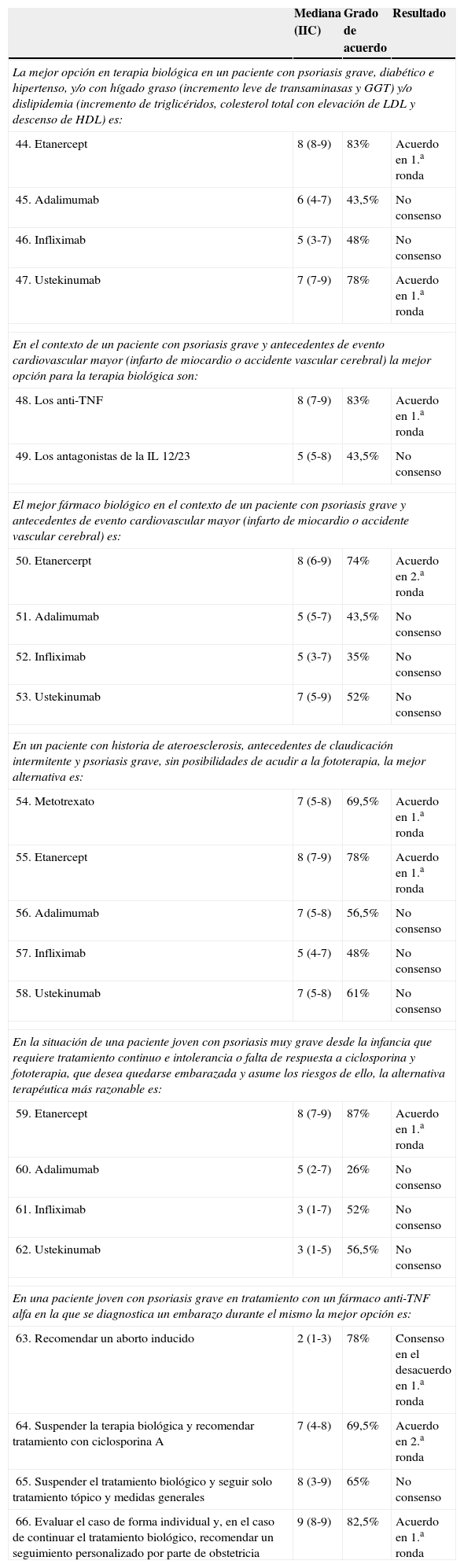
Resultados del consensoEn la situación planteada en el caso clínico, es decir, un paciente con psoriasis grave, diabético e hipertenso, con HGNA y dislipidemia los panelistas consideraron que tanto etanercept como ustekinumab eran las mejores opciones. Sin embargo, en el contexto de un paciente con psoriasis grave y antecedentes de evento cardiovascular mayor (infarto de miocardio o accidente vascular cerebral) la mejor opción por consenso fue para los anti-TNF y no para los antagonistas de la IL 12/23, donde se incluye ustekinumab (mediana de 7, IIC 5-9).
En un paciente con historia de ateroesclerosis, antecedentes de claudicación intermitente y psoriasis grave, sin posibilidades de acudir a la fototerapia, las mejores alternativas de tratamiento fueron etanercept y metotrexato. Adalimumab y ustekinumab estuvieron cerca de alcanzar el consenso, con unas medianas de 7, IIC 5-8 en ambos casos (tabla 5).
Escenario 5. Otras situaciones especiales
| Mediana (IIC) | Grado de acuerdo | Resultado | |
|---|---|---|---|
| La mejor opción en terapia biológica en un paciente con psoriasis grave, diabético e hipertenso, y/o con hígado graso (incremento leve de transaminasas y GGT) y/o dislipidemia (incremento de triglicéridos, colesterol total con elevación de LDL y descenso de HDL) es: | |||
| 44. Etanercept | 8 (8-9) | 83% | Acuerdo en 1.a ronda |
| 45. Adalimumab | 6 (4-7) | 43,5% | No consenso |
| 46. Infliximab | 5 (3-7) | 48% | No consenso |
| 47. Ustekinumab | 7 (7-9) | 78% | Acuerdo en 1.a ronda |
| En el contexto de un paciente con psoriasis grave y antecedentes de evento cardiovascular mayor (infarto de miocardio o accidente vascular cerebral) la mejor opción para la terapia biológica son: | |||
| 48. Los anti-TNF | 8 (7-9) | 83% | Acuerdo en 1.a ronda |
| 49. Los antagonistas de la IL 12/23 | 5 (5-8) | 43,5% | No consenso |
| El mejor fármaco biológico en el contexto de un paciente con psoriasis grave y antecedentes de evento cardiovascular mayor (infarto de miocardio o accidente vascular cerebral) es: | |||
| 50. Etanercerpt | 8 (6-9) | 74% | Acuerdo en 2.a ronda |
| 51. Adalimumab | 5 (5-7) | 43,5% | No consenso |
| 52. Infliximab | 5 (3-7) | 35% | No consenso |
| 53. Ustekinumab | 7 (5-9) | 52% | No consenso |
| En un paciente con historia de ateroesclerosis, antecedentes de claudicación intermitente y psoriasis grave, sin posibilidades de acudir a la fototerapia, la mejor alternativa es: | |||
| 54. Metotrexato | 7 (5-8) | 69,5% | Acuerdo en 1.a ronda |
| 55. Etanercept | 8 (7-9) | 78% | Acuerdo en 1.a ronda |
| 56. Adalimumab | 7 (5-8) | 56,5% | No consenso |
| 57. Infliximab | 5 (4-7) | 48% | No consenso |
| 58. Ustekinumab | 7 (5-8) | 61% | No consenso |
| En la situación de una paciente joven con psoriasis muy grave desde la infancia que requiere tratamiento continuo e intolerancia o falta de respuesta a ciclosporina y fototerapia, que desea quedarse embarazada y asume los riesgos de ello, la alternativa terapéutica más razonable es: | |||
| 59. Etanercept | 8 (7-9) | 87% | Acuerdo en 1.a ronda |
| 60. Adalimumab | 5 (2-7) | 26% | No consenso |
| 61. Infliximab | 3 (1-7) | 52% | No consenso |
| 62. Ustekinumab | 3 (1-5) | 56,5% | No consenso |
| En una paciente joven con psoriasis grave en tratamiento con un fármaco anti-TNF alfa en la que se diagnostica un embarazo durante el mismo la mejor opción es: | |||
| 63. Recomendar un aborto inducido | 2 (1-3) | 78% | Consenso en el desacuerdo en 1.a ronda |
| 64. Suspender la terapia biológica y recomendar tratamiento con ciclosporina A | 7 (4-8) | 69,5% | Acuerdo en 2.a ronda |
| 65. Suspender el tratamiento biológico y seguir solo tratamiento tópico y medidas generales | 8 (3-9) | 65% | No consenso |
| 66. Evaluar el caso de forma individual y, en el caso de continuar el tratamiento biológico, recomendar un seguimiento personalizado por parte de obstetricia | 9 (8-9) | 82,5% | Acuerdo en 1.a ronda |
IIC: intervalo intercuartílico.
Mujer en edad fértil con psoriasis grave que requiere tratamiento con biológicos y desea quedarse embarazada y mujer en tratamiento con anti-TNF que se queda embarazada. Se plantea cuál es el manejo más adecuado en la mujer en edad fértil y en la mujer embarazada con psoriasis grave.
El tratamiento de la psoriasis en la mujer en edad fértil con deseo gestacional y en la mujer embarazada supone un auténtico reto por la necesidad de realizar una contracepción fiable con algunos tratamientos, por la posible relación directa entre psoriasis y nacimientos de bebés de bajo peso y prematuros133, y porque pueden darse complicaciones en el embarazo por la relación entre psoriasis y diversas enfermedades como obesidad, HTA, depresión, alcoholismo o tabaquismo134.
La evolución de la psoriasis durante el embarazo es muy desigual135: un 50% de las pacientes mejora de su psoriasis, un 25% no experimenta cambios y otro 25% experimenta un empeoramiento de la enfermedad.
Entre los tratamientos tópicos los corticosteroides y los derivados de la vitamina D (calcipotriol) podrían usarse; el uso de tacrolimus también se podría considerar, mientras que tazaroteno estaría contraindicado136. Entre las opciones de tratamiento sistémico se podría considerar la fototerapia (ultravioleta B [UVB] o ultravioleta B de banda estrecha [UVB-BE]), mientras que metotrexato y acitretina estarían contraindicados. La ciclosporina entra en la categoría C de la FDA (en la experimentación animal ha mostrado un efecto adverso sobre el feto, pero no existen estudios adecuados en la mujer embarazada), aunque un gran número comunicaciones sugiere que es relativamente seguro en el embarazo137.
Los tratamientos biológicos usados en psoriasis entran dentro de la categoría B: estudios en animales no han demostrado capacidad teratogénica, pero no hay estudios en mujeres embarazadas. Se ha sugerido que durante el primer y el segundo trimestre del embarazo es poco probable que atraviesen la placenta humana y, por lo tanto, se considera que no representan un riesgo para el embrión o el feto durante los 2 primeros trimestres del embarazo138.
Uno de los condicionantes en la elección de la terapia biológica en una paciente en edad fértil puede ser la vida media del fármaco. El biológico de vida media más corta es etanercept con 3 días97 frente a 10 días de infliximab96, los 15 días de adalimumab98 y las 3 semanas de ustekinumab72. Se recomiendan medidas anticonceptivas durante el tratamiento y hasta 3 semanas después de la suspensión de etanercept97, 15 semanas tras la suspensión de ustekinumab72, 5 meses tras las suspensión de adalimumab98 y 6 meses tras la suspensión de infliximab96.
Resultados del consensoRespecto a las mujeres en edad fértil, el panel consideró que en el caso de una paciente joven con psoriasis muy grave desde la infancia, que requiere tratamiento continuo y presenta intolerancia o falta de respuesta a ciclosporina y fototerapia, que desea quedarse embarazada y asume los riesgos que ello conlleva en la evolución de su enfermedad, la alternativa terapéutica más razonable es etanercept, ya que su corta vida media facilitaría su discontinuación.
En el caso de una paciente joven con psoriasis grave en tratamiento con un fármaco anti-TNF en la que se diagnostica un embarazo durante el mismo, el panel consideró en primera ronda que la mejor opción sería evaluar el caso de forma individual y, en el supuesto de continuar el tratamiento biológico, recomendar un seguimiento personalizado por parte de obstetricia. Otra opción que alcanzó el acuerdo en segunda ronda fue suspender la terapia biológica y recomendar tratamiento con ciclosporina A. También hubo acuerdo en no recomendar el aborto inducido en estos casos.
DiscusiónLa evaluación de la opinión de los expertos en los escenarios planteados (optimización de costes, artropatía psoriásica, fracasos primario y secundario, pacientes ancianos, comorbilidades y embarazo) refleja cómo la experiencia clínica puede constituir un elemento de valor en la toma de decisiones en la clínica diaria.
La terapia intermitente podría ser una alternativa en la optimización de recursos en una estrategia terapéutica con un alto impacto económico como es la terapia biológica12. En el caso del tratamiento intermitente fue etanercept el fármaco considerado idóneo a partir de la evidencia clínica disponible para esta opción, tal vez por la mayor experiencia en adultos18–22 y niños23, aunque adalimumab26,27 y ustekinumab30 también podrían ser, aun a falta de mayor evidencia científica, una opción válida. La mayor incidencia de efectos adversos para infliximab en este supuesto28 podría haber pesado a la hora de considerar de forma consensuada esta opción como inadecuada en el tratamiento intermitente.
A pesar de que la evidencia con respecto a la disminución de dosis que aparece en la ficha técnica es muy limitada31, y de que no están bien establecidas las contraprestaciones en seguridad y eficacia, estas opciones se reconocieron como válidas por la mayoría de los expertos consultados. Aunque se detectaron algunas diferencias en la priorización, tanto etanercept, adalimumab como ustekinumab se consideraron buenas alternativas. No fue el caso de infliximab, quizás relacionado por su perfil inmunogénico que puede verse favorecido por niveles infraterapéuticos31. También las combinaciones terapéuticas se consideran una alternativa válida en la optimización de costes, como se contempla en algunas guías2. Los 3 fármacos anti-TNF se evaluaron por el panel de expertos como una opción plausible, con variaciones presumiblemente relacionadas con la evidencia disponible y la experiencia personal de los expertos. Y también es probable que la escasa experiencia publicada al respecto para ustekinumab pesase a la hora de considerar esta opción como menos recomendable53,54. Debe tenerse en cuenta que aunque los discusores del Delphi consideraron que la estrategia intermitente o la minoración podría ser una acción adecuada en la reducción de costes en un escenario económico complicado, no existe evidencia firme de que sea así, con lo que estas opiniones deben ponderarse con prudencia. Tampoco se consideró el coste asociado a las combinaciones terapéuticas o los posibles efectos secundarios. En cualquier caso, refleja una inquietud clínica que valdría la pena desarrollar con un estudio prospectivo.
La trascendencia de la artropatía psoriásica y su peso en la toma de decisiones parece bien integrada, según los datos recogidos, en la rutina del dermatólogo experto en psoriasis. En esta línea van la afirmación consensuada de incluir su detección en la anamnesis habitual y el trabajo conjunto con el reumatólogo. A pesar de la aprobación reciente de ustekinumab como alternativa en las formas articulares de la enfermedad67, los dermatólogos consultados prefieren en el momento actual los anti-TNF como alternativa de primera elección en estos pacientes.
A pesar de la falta de estandarización en el momento actual, los expertos consideraron adecuada la incorporación de la determinación de los niveles de fármaco y de ADA en el manejo habitual y la toma de decisiones en terapia biológica, en particular en el caso de fracaso secundario, circunstancia que hace prever su empleo generalizado en cuanto la disponibilidad técnica lo haga posible. Las opiniones reflejadas indican a etanercept como fármaco menos inmunogénico83,86,87 y, por el contrario, infliximab como terapia biológica con mayor capacidad de desarrollo de anticuerpos antifármaco83,87.
Si bien la opinión coincidente de los miembros del panel fue la de considerar que las perspectivas y objetivos de la terapia biológica en pacientes por encima de los 65 años no debía diferir de la esperada y buscada en los pacientes de edad inferior, hubo también consenso a la hora de priorizar la seguridad y de considerar oportunas las estrategias de tratamiento intermitente y disminución de dosis con respecto a la ficha técnica. Tanto ustekinumab como etanercept —este último presumiblemente debido a su vida media corta y su buen perfil de seguridad— se consideraron las mejores alternativas en este escenario.
La introducción de la terapia biológica representa, en su conjunto, una ventaja con respecto a la terapia clásica con respecto a la interacción de las comorbilidades que forman parte del síndrome metabólico que a menudo acompaña a la psoriasis131. En el caso de la morbilidad cardiovascular, los potenciales beneficios antiinflamatorios en la ateroesclerosis y claudicación intermitente119,120 se reflejan en la elección de la terapia biológica (etanercept, seguido de ustekinumab y adalimumab) junto a metotrexato en este escenario. Sin embargo, los resultados de los metaanálisis publicados al respecto105,111 condicionan probablemente la predilección de los expertos por los fármacos anti-TNF por delante de ustekinumab ante el antecedente de un infarto de miocardio.
Con un creciente número de pacientes en tratamiento biológico, el escenario que contempla el impacto de la gestación en la terapia biológica debe ser previsto cada vez más como una opción plausible. La contraindicación explícita en la ficha técnica al uso de biológicos en este contexto72,96–98 y la escasez de bibliografía disponible podrían estar detrás de la respuesta del panel y la recomendación en cuanto al empleo de fototerapia o ciclosporina. En el supuesto de que sea imprescindible el empleo de un fármaco biológico, la posibilidad de empleo de una opción de vida media corta como etanercept97 podría aportar ventajas en el supuesto de diagnóstico de embarazo durante el tratamiento.
Las limitaciones del presente trabajo son las propias del consenso Delphi, entre las que destaca la dificultad para aclarar o matizar las opiniones individuales de los miembros del panel. La posible influencia de los dermatólogos del comité científico que contribuyeron a desarrollar la revisión de la literatura en las votaciones fue limitada al no participar en la votación Delphi. Las opiniones desarrolladas y aportadas por el panel de expertos, aunque notables en número y por la calidad y representatividad de sus integrantes, no necesariamente reflejan la opinión mayoritaria de los dermatólogos de todo el territorio.
El documento desarrollado representa una propuesta destinada a mejorar el conocimiento con respecto al empleo de la terapia biológica en los escenarios propuestos, aunados por un interés clínico y por la ausencia en muchos aspectos de evidencia firme. En este punto la opinión estructurada de los expertos puede considerarse un elemento más en la búsqueda de la estandarización y la excelencia en el manejo de los pacientes.
FinanciaciónEste consenso Delphi fue patrocinado por Laboratorios Pfizer, que financió el soporte on line del cuestionario y las reuniones presenciales y telefónicas. Los empleados de laboratorios Pfizer no participaron en ninguna de las discusiones del panel de expertos ni en la redacción del texto.
Conflicto de interesesLos siguientes autores declaran haber recibido ayudas y pagos relacionados con la investigación, por el asesoramiento como experto, por la participación en ensayos clínicos y/o por impartir conferencias de las siguientes compañías: Abbvie (José Manuel Carrascosa Carrillo, Isabel Belinchón, Pablo de la Cueva Dobao, Rosa Izu Belloso, Jesús Luelmo Aguilar y Ricardo Ruiz-Villaverde), Almirall (Isabel Belinchón y Pablo de la Cueva Dobao), Celgene (José Manuel Carrascosa Carrillo), Janssen-Cilag (José Manuel Carrascosa Carrillo, Isabel Belinchón, Pablo de la Cueva Dobao, Rosa Izu Belloso, Jesús Luelmo Aguilar y Ricardo Ruiz-Villaverde), Leo Pharma (Isabel Belinchón y Pablo de la Cueva Dobao), Lilly (José Manuel Carrascosa Carrillo y Pablo de la Cueva Dobao), MEDA (Pablo de la Cueva Dobao), MSD (José Manuel Carrascosa Carrillo, Isabel Belinchón, Pablo de la Cueva Dobao, Jesús Luelmo Aguilar y Ricardo Ruiz-Villaverde), Novartis (José Manuel Carrascosa Carrillo, Isabel Belinchón, Pablo de la Cueva Dobao, Rosa Izu Belloso y Jesús Luelmo Aguilar) y Pfizer (José Manuel Carrascosa Carrillo, Isabel Belinchón, Pablo de la Cueva Dobao, Rosa Izu Belloso, Jesús Luelmo Aguilar y Ricardo Ruiz-Villaverde).
Todos los autores del manuscrito consideran que han actuado con total independencia en su elaboración.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Los autores quieren hacer una mención especial y mostrar su agradecimiento a los panelistas que participaron en la votación según la metodología Delphi, todos ellos dermatólogos, para realizar el presente documento: Mariano Ara Martín, Susana Armesto Alonso, Xavier Bordas Orpinell, Gregorio Carretero Hernández, Carlos de la Torre Fraga, Emilia Fernández López, Marta Ferrán Farres, Manuel Galán Gutierrez, Carmen García Donoso, Francisco Guimera Martín-Neda, Enrique Jiménez Carpio, Rafael Jiménez Puya, Enrique Jorquera Barquero, Leandro Martínez Pilar, Jaime Notario Rosa, Raquel Rivera Díaz, Cristina Rubio Flores, Jose Carlos Ruiz Carrascosa, Diana Patricia Ruiz Genao, Jose Luis Sanchez Carazo, M Caridad Soria Martínez, David Vidal Sarro e J Ignacio Yanguas Bayona. Así mismo, los autores agradecen el soporte editorial en la redacción de este artículo a Nature Publishing Group Iberoamérica y a los Dres. Marta Díaz y Pablo Rivas.