En pacientes con melanoma los factores pronósticos utilizados en muchas ocasiones no permiten una predicción precisa de la evolución de la enfermedad, lo que hace evidente la necesidad de búsqueda de nuevos factores pronósticos. Existe una evidencia científica cada vez más sólida de que los vasos linfáticos tumorales desempeñam un papel importante en la producción de metástasis linfáticas y también hematógenas en pacientes con melanoma. En este trabajo expondremos el estado actual del conocimiento y las implicaciones del proceso de linfangiogénesis en el diagnóstico, tratamiento y pronóstico de los pacientes con melanoma.
Disease course in melanoma often cannot be accurately predicted by means of the prognostic factors usually considered in patients with melanoma; therefore, new factors are clearly needed. Increasingly robust scientific evidence shows that tumor lymph vessels play a key role in melanoma that metastasizes by lymphatic and hematogenous pathways. We review current knowledge and examine the implications of lymphangiogenesis in the diagnosis, treatment, and prognosis of patients with melanoma.
El melanoma representa menos del 10% de todos los cánceres de piel; sin embargo, es responsable de más del 90% de las muertes por neoplasias cutáneas1. Las estadísticas de los últimos años son alarmantes, apreciándose un incremento constante en la incidencia de melanoma en la mayoría de los países, y de manera llamativa entre la población joven, factores que en conjunto obligan a considerarlo como un problema de salud pública en aumento2. La base de su tratamiento es la extirpación quirúrgica, que ofrece una alta tasa de curación si se realiza de forma precoz. Sin embargo, una vez que el tumor se ha extendido más allá del control quirúrgico locorregional, el pronóstico empeora notablemente. Afortunadamente, en la actualidad disponemos de fármacos que tienen impacto sobre la supervivencia en pacientes con melanoma3–6.
Los factores pronósticos utilizados en la práctica clínica diaria en pacientes con melanoma son el índice de Breslow, la presencia de ulceración, el índice mitósico y el estado del ganglio centinela7–12. Sin embargo, la valoración de estos parámetros no permite establecer una predicción precisa de la evolución de la enfermedad en un porcentaje nada despreciable de pacientes. Así, más del 15% de los enfermos con índice de Breslow menor de 1mm desarrollarán enfermedad metastásica13, mientras que una proporción importante de pacientes con tumores cuyo Breslow supera los 4mm presentarán una supervivencia libre de enfermedad relativamente larga (58% más de 5 años)14.
Uno de los procesos que se consideran clave en la progresión y diseminación de los tumores malignos es la angiogénesis. Se trata de la formación de nuevos capilares sanguíneos a partir de los vasos preexistentes, lo que facilita su diseminación y, en definitiva, las metástasis. La utilización como factor pronóstico de los diferentes parámetros que reflejan el nivel de angiogénesis tumoral se ha investigado en diferentes tipos de neoplasias15–18, incluyendo el melanoma19–22. Sin embrago, estos estudios no han aportado resultados homogéneos de forma concluyente y unitaria23–27. Así, los resultados del metaanálisis publicado recientemente por nuestro grupo apuntan a que la densidad de vasos sanguíneos es muy similar entre pacientes que han desarrollado metástasis y aquellos sin evidencia de enfermedad metastásica28. Por el contrario, sí parece existir una diferencia significativa en la densidad y frecuencia de invasión de vasos linfáticos entre los 2 grupos28.
Es de resaltar que, a diferencia de la angiogénesis, el proceso de linfangiogénesis no ha sido estudiado en profundidad hasta hace relativamente poco tiempo, debido a la falta de marcadores específicos del endotelio linfático. Con el objetivo de clarificar el papel de los vasos linfáticos en la progresión y diseminación del melanoma, nos ha parecido de interés revisar lo conocido hasta el momento, valorando las posibles implicaciones del proceso de linfangiogénesis en el diagnóstico y tratamiento de este tipo de tumor. Nos ha parecido importante hacer referencia, además, a los aspectos más técnicos, por lo que describiremos los diferentes métodos de cuantificación del proceso de linfangiogénesis en tumores sólidos y mencionaremos las principales características de los marcadores del endotelio linfático.
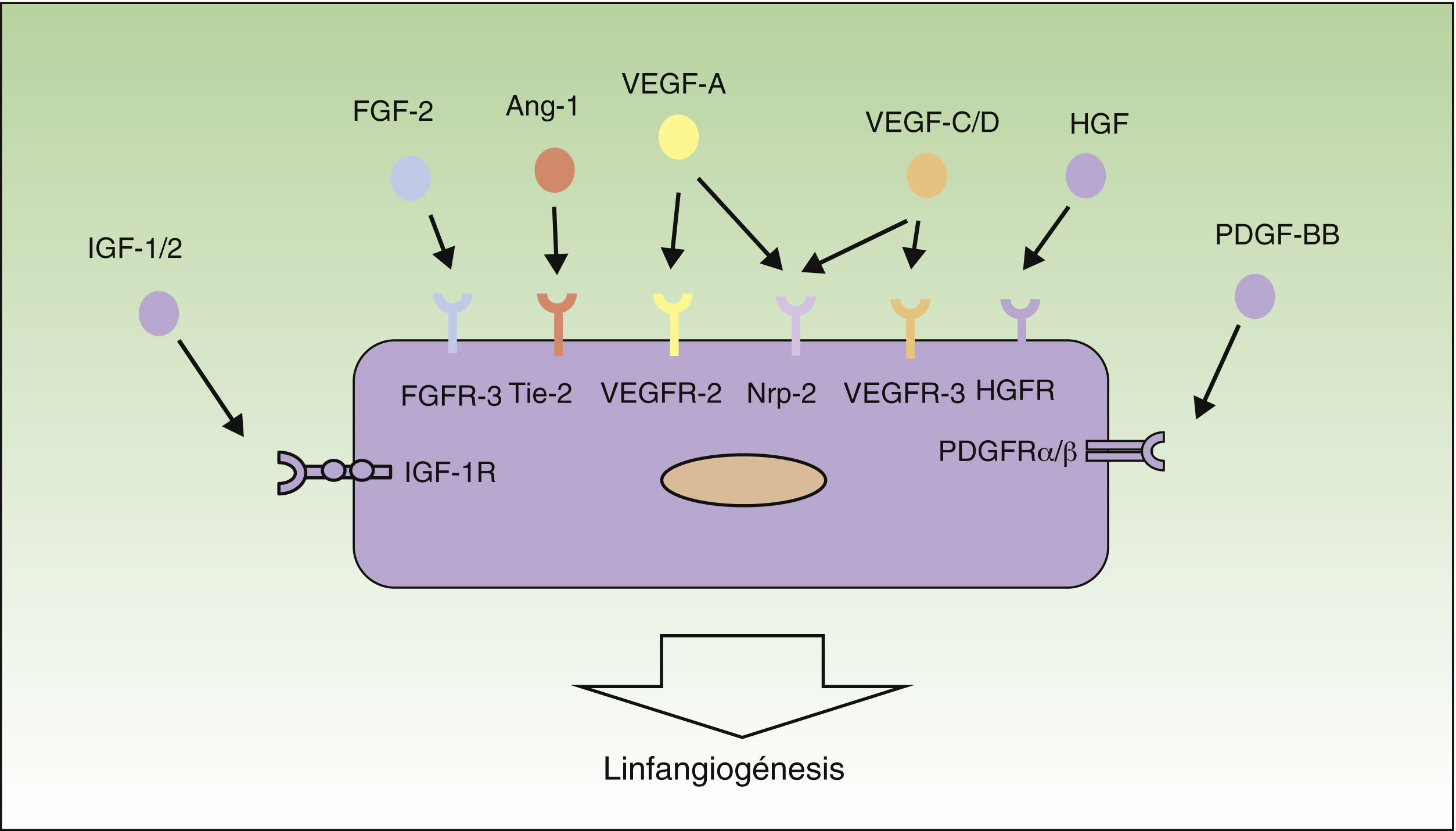
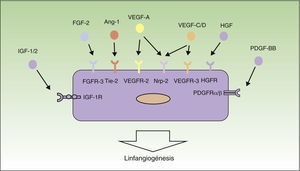
Mecanismos de linfangiogénesisEn la última década las investigaciones en el campo de la linfangiogénesis tumoral han conseguido identificar muchos de los factores implicados en el crecimiento, proliferación, migración y supervivencia de las células del endotelio linfático. Los primeros factores que se han descrito como responsables del proceso de linfangiogénesis han sido el factor de crecimiento endotelial vascular (VEGF)-C y -D, y su receptor VEGF-receptor (VEGFR)-329–32. Por otra parte, VEGF-A, conocido como uno de los factores proangiogénicos más importantes, también ha demostrado ser capaz de inducir la proliferación de los vasos linfáticos33.
Los factores VEGF-A, -C y -D ejercen su acción a través de receptores específicos en el endotelio linfático (VEGFR). Sin embargo, también son capaces de unirse a la neurolipina-2 (Nrp-2), receptor de semaforinas descubierto inicialmente en el sistema nervioso, detectándose posteriormente su expresión también en las células del endotelio linfático. Se piensa que la Nrp-2 actúa como correceptor del VEGFR-334. Recientemente se han identificado otros nuevos inductores del crecimiento y proliferación de los vasos linfáticos, entre ellos el factor de crecimiento de los hepatocitos35, el factor de crecimiento de fibroblastos (FGF)-236, el factor de crecimiento derivado de plaquetas37, el factor de crecimiento insulina-like38 y el factor de crecimiento epidérmico (EGF)39 (fig. 1). Tanto las células tumorales como los macrófagos son capaces de liberar factores inductores de linfangiogénesis40.
Control molecular del proceso de linfangiogénesis. En el siguiente esquema están representados los principales factores de crecimiento implicados en el proceso de linfangiogénesis y sus receptores en el endotelio linfático. Ang-1: angiopoyetina 1; HGF: factor de crecimiento de hepatocitos; HGFR: receptor de HGF; IGF: factor de crecimiento insulina-like; IGFR: receptor de IGF; PDGF: factor de crecimiento derivado de plaquetas; PDGFR: receptor de PDGF; VEGF: factor de crecimiento endotelial vascular; VEGFR: receptor de VEGF.
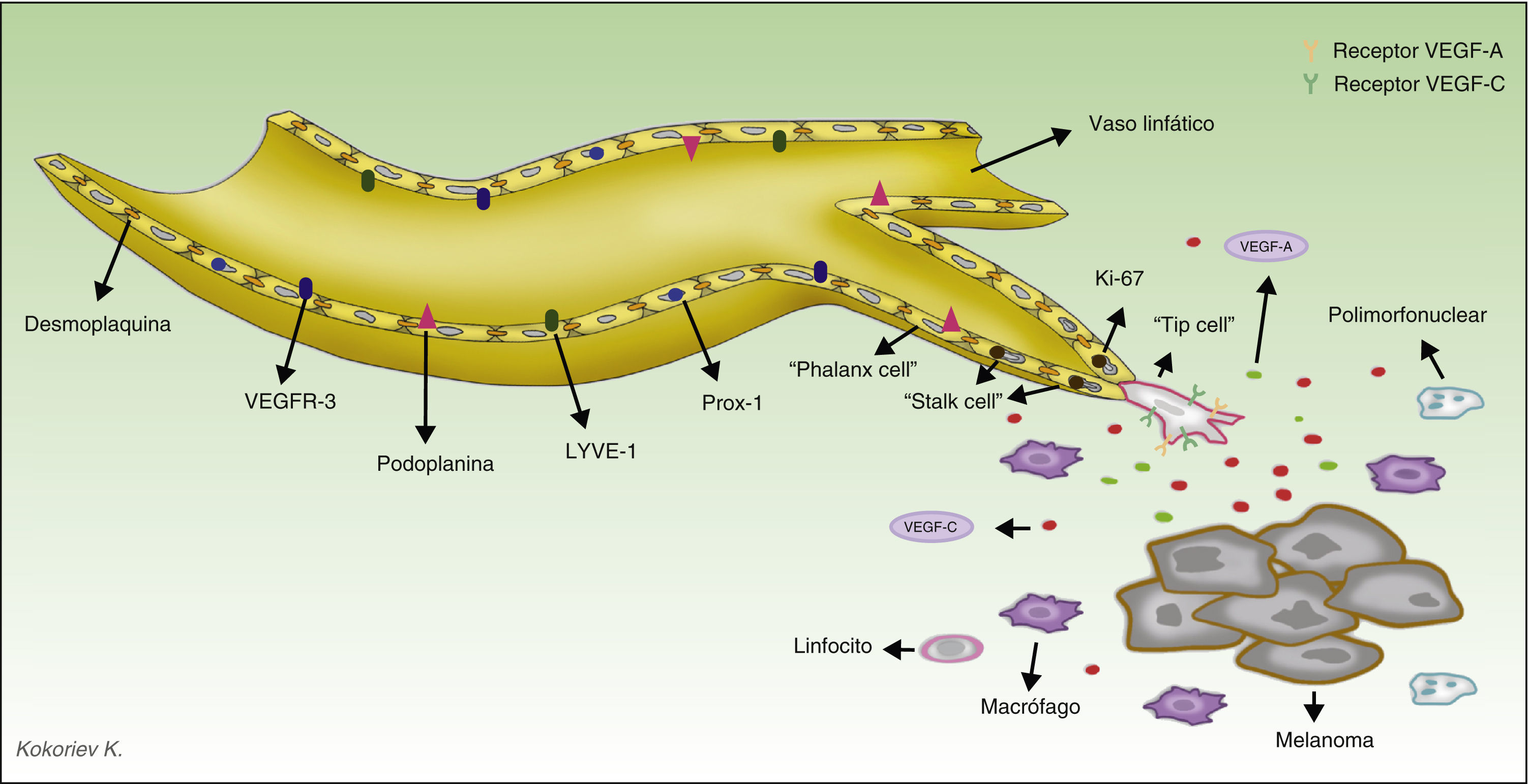
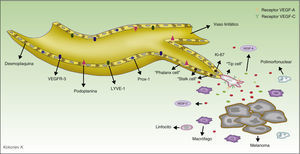
El descubrimiento y manejo de los marcadores específicos permite actualmente diferenciar los vasos sanguíneos de los linfáticos, lo que ha supuesto un avance trascendental de la investigación en el campo de la linfangiogénesis tumoral. Los marcadores más ampliamente utilizados son LYVE-1, una proteína de membrana y función desconocida, que se expresa en las células del endotelio linfático y en los macrófagos activados41, y D2-40, anticuerpo que reconoce una glucoproteína transmembrana del endotelio linfático, denominada podoplanina42,43. En la tabla 1 resumimos las principales características de los anticuerpos disponibles en el mercado, y en la figura 2 representamos el proceso de linfangiogénesis y la localización de los marcadores en las células del endotelio linfático.
Resumen de las principales características de los marcadores del endotelio linfático
| Proteína | Anticuerpo | Sensibilidad | Especificidad | Reactividad | |
|---|---|---|---|---|---|
| TFC | TIP | ||||
| VEGFR-3 | Anti-VEGF3 (FTL-4) | Células endotelio linfático y capilares fenestrados de médula ósea, sinusoides de hígado y páncreas, glomérulos renales y glándulas endocrinas | No | + | + |
| Desmoplaquina | Anti-desmoplakin | Unión intercelular del endotelio linfático, epitelio, urotelio, hepatocitos | No | + | + |
| Receptor D6 de la beta-quimioquina | Anti-beta-chemokine receptor D6 | Células del endotelio linfático de piel, mucosa y submucosa, intestino y apédice | ¿Sí? | + | + |
| Prox-1 | Anti-Prox-1 | Células endotelio linfático, corazón, hígado, páncreas, sistema nervioso | No | + | + |
| LYVE-1 | Anti-LYVE-1 | Células endotelio linfático, endotelio, vasos sinusoidales de hígado y páncreas | Sí | + | + |
| Podoplanina | D2-40 | Es un anticuerpo monoclonal que reconoce específicamente la podoplanina humana | Sí | + | + |
TFC: tejido fresco congelado; TIP: tejido incluido en parafina.
Representación del proceso de linfangiogénesis tumoral y marcadores de los vasos linfáticos. Las células del melanoma y los macrófagos tumorales secretan diversos factores capaces de activar el proceso de linfangiogénesis. Durante la proliferación de los vasos linfáticos se diferencian 3 tipos de células implicadas. La célula guía (tip cell en la terminología anglosajona) expresa en su superficie numerosos receptores de factores prolinfangiogénicos, tales como VEGF-A y VEGF-C, y a través de sus filopodios escanea el entorno y guía el brote linfático en la dirección de la mayor concentración de dichos factores. Las células del tallo (stalk cells en la terminología anglosajona) se localizan detrás de la célula guía, no tienen filopodios ni expresan altas concentraciones de receptores de los factores prolinfangiogénicos en su superficie. Estas células proliferan a una gran velocidad (obsérvese en el esquema que estas células son positivas para Ki-67, marcador de proliferación), comienzan el proceso de formación de la luz vascular y participan en la elaboración de la membrana basal. Durante el proceso de maduración las células del tallo se transforman en las células falange (phalanx cells en la terminología anglosajona). Se denominan así porque se disponen formando una monocapa ordenada de células endoteliales linfáticas, recordando a la organización de los soldados en la antigua Grecia (phálanx). Las células falange comparten las características morfológicas de las células endoteliales quiescentes, pero a deferencia de estas continúan participando en la formación de la membrana basal.
Entre las características clínico-evolutivas del melanoma está la de provocar las metástasis linfáticas, como ocurre en otros tipos de cánceres. Basándose en una cohorte de 431 pacientes con melanoma, Essner et al. hallaron una prevalencia de metástasis linfáticas del 21% de los pacientes en el momento de su diagnóstico44. Por otra parte, la presencia de células tumorales en el ganglio centinela es uno de los factores pronósticos desfavorables más importantes45. Sin embargo, hasta un 22% de los enfermos con negatividad en el estudio del ganglio centinela presentarán recurrencia de su enfermedad y un 15% de mortalidad antes de los 5 años46.
En 1997 de Waal et al., con el fin de valorar la linfangiogénesis en el melanoma, desarrollaron una técnica para la detección selectiva de los vasos linfáticos, que se basaba en una doble tinción de las muestras histopatológicas con CD31 (anticuerpo que reacciona con todos los tipos de microvasos) y PAL-E (marcador específico del endotelio vascular sanguíneo). Los autores dedujeron que aquellos vasos que tenían resultado positivo para CD31y negativo para PAL-E serían los linfáticos47. Sin embargo, aunque se pudo evidenciar una llamativa diferencia en la densidad de los vasos sanguíneos en los melanomas en fase de crecimiento horizontal y los de crecimiento vertical, los autores no detectaron ningún cambio en el número de los vasos linfáticos, concluyendo que las células del melanoma no eran capaces de inducir la linfangiogénesis.
Durante los 5 años posteriores a la publicación de este primer estudio sobre linfangiogénesis en melanoma no hubo ningún otro intento de cuantificar los vasos linfáticos en este tumor, hasta la aparición en el mercado de los anticuerpos específicos. Utilizando dichos marcadores la mayoría de los autores fueron capaces de confirmar la presencia de vasos linfáticos intra y peritumorales en preparaciones de melanoma. Sin embargo, no ha existido unanimidad en la interpretación de los resultados según los datos publicados. Así, mientras que para la mayoría de autores existe una correlación significativa entre la presencia de metástasis y una menor supervivencia en pacientes con melanoma, para otros no se cumple esta hipótesis-esperada, lo que dio lugar a interpretaciones diversas, como la de que aunque existan vasos linfáticos en la periferia e interior del parénquima tumoral no serían funcionantes48.
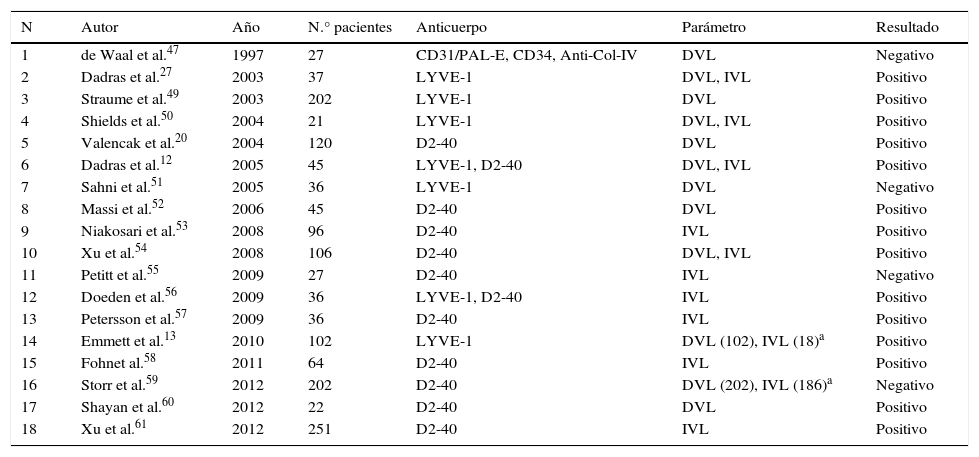
En la tabla 2 resumimos las principales características de los estudios que evalúan el papel de los vasos linfáticos en pacientes con melanoma. La búsqueda se realizó en la base de datos PubMed con las siguientes palabras clave (MeSH): «melanoma» and («lymphangiogenesis» OR «lymphatic vessels»), resultando en 226 trabajos. Se seleccionaron aquellos estudios que evaluaban la densidad o la presencia de invasión de los vasos linfáticos en preparaciones histológicas de melanomas humanos mediante técnicas de inmunohistoquímica. Asimismo, hemos revisado las referencias bibliográficas de los trabajos seleccionados con el fin de identificar aquellos estudios no detectados por la búsqueda.
Resumen de los estudios publicados sobre el valor pronóstico de la densidad o invasión de vasos linfáticos en pacientes con melanoma
| N | Autor | Año | N.° pacientes | Anticuerpo | Parámetro | Resultado |
|---|---|---|---|---|---|---|
| 1 | de Waal et al.47 | 1997 | 27 | CD31/PAL-E, CD34, Anti-Col-IV | DVL | Negativo |
| 2 | Dadras et al.27 | 2003 | 37 | LYVE-1 | DVL, IVL | Positivo |
| 3 | Straume et al.49 | 2003 | 202 | LYVE-1 | DVL | Positivo |
| 4 | Shields et al.50 | 2004 | 21 | LYVE-1 | DVL, IVL | Positivo |
| 5 | Valencak et al.20 | 2004 | 120 | D2-40 | DVL | Positivo |
| 6 | Dadras et al.12 | 2005 | 45 | LYVE-1, D2-40 | DVL, IVL | Positivo |
| 7 | Sahni et al.51 | 2005 | 36 | LYVE-1 | DVL | Negativo |
| 8 | Massi et al.52 | 2006 | 45 | D2-40 | DVL | Positivo |
| 9 | Niakosari et al.53 | 2008 | 96 | D2-40 | IVL | Positivo |
| 10 | Xu et al.54 | 2008 | 106 | D2-40 | DVL, IVL | Positivo |
| 11 | Petitt et al.55 | 2009 | 27 | D2-40 | IVL | Negativo |
| 12 | Doeden et al.56 | 2009 | 36 | LYVE-1, D2-40 | IVL | Positivo |
| 13 | Petersson et al.57 | 2009 | 36 | D2-40 | IVL | Positivo |
| 14 | Emmett et al.13 | 2010 | 102 | LYVE-1 | DVL (102), IVL (18)a | Positivo |
| 15 | Fohnet al.58 | 2011 | 64 | D2-40 | IVL | Positivo |
| 16 | Storr et al.59 | 2012 | 202 | D2-40 | DVL (202), IVL (186)a | Negativo |
| 17 | Shayan et al.60 | 2012 | 22 | D2-40 | DVL | Positivo |
| 18 | Xu et al.61 | 2012 | 251 | D2-40 | IVL | Positivo |
DVL: densidad de vasos linfáticos; IVL: invasión de vasos linfáticos; Negativo: no se encontró asociación estadísticamente significativa; Positivo: asociación estadísticamente significativa.
El hecho de que algunos autores hayan sido capaces de demostrar el valor pronóstico de la densidad de vasos linfáticos (DVL) y/o de la presencia de invasión de vasos linfáticos (IVL) en pacientes con melanoma, mientras que otros no, podría deberse en parte a la falta del acuerdo en la metodología utilizada hasta el año 2006, año en el que se publicó el primer consenso internacional sobre la metodología de cuantificación de linfangiogénesis en tumores sólidos62. En este trabajo se revisan los aspectos más relevantes del proceso de cuantificación de los vasos linfáticos tumorales y se dan una serie de recomendaciones a seguir, con el objetivo de conseguir resultados homogéneos y comparables entre los diferentes estudios.
Varios estudios experimentales en animales han confirmado el papel activo de la linfangiogénesis tumoral, así como el de los factores VEGF-C y VEGF-D en la diseminación del tumor hacia los ganglios linfáticos63. Una sobreexpresión constante de estos factores por las células tumorales incrementa de forma llamativa el crecimiento de los vasos linfáticos del parénquima tumoral, favoreciendo la diseminación metastásica64,65. En el modelo animal de melanoma la sobreexpresión del VEGF-C condujo al incremento en el número de los vasos linfáticos intratumorales y al aumento del diámetro de los vasos peritumorales66. De forma similar, en muestras de melanoma humano, los niveles del VEGF-C se han correlacionado tanto con la densidad de los vasos linfáticos en el tumor primario27 como en las metástasis ganglionares en estos pacientes21,67,68.
Importancia de la linfangiogénesis en el ganglio centinelaLa mayoría de las publicaciones sobre el papel de la linfangiogénesis en la progresión y diseminación de melanoma se han centrado en el estudio de la morfología y de la funcionalidad de los vasos linfáticos asociados al tumor primario en la piel. Sin embargo, el grupo dirigido por Michael Detmar33 describió un concepto nuevo que creemos que tiene gran trascendencia para la clínica y las investigaciones futuras. Así, los investigadores demostraron en el modelo animal de cáncer cutáneo que el proceso de linfangiogénesis en el ganglio centinela está activado, incluso antes de que se produzcan las metástasis. Dicho de otro modo, los hallazgos de Detmar et al. sugieren que las células tumorales son capaces de «acondicionar» el lugar donde van a metastatizar. Estos resultados son altamente intrigantes y modifican la imagen estática sobre el cáncer que se ha mantenido durante décadas, al intuir o sospechar la capacidad que tienen los tumores malignos de producir diversos efectos, a distancia del tumor primario, antes de que se produzca la dispersión de las células malignas por el organismo.
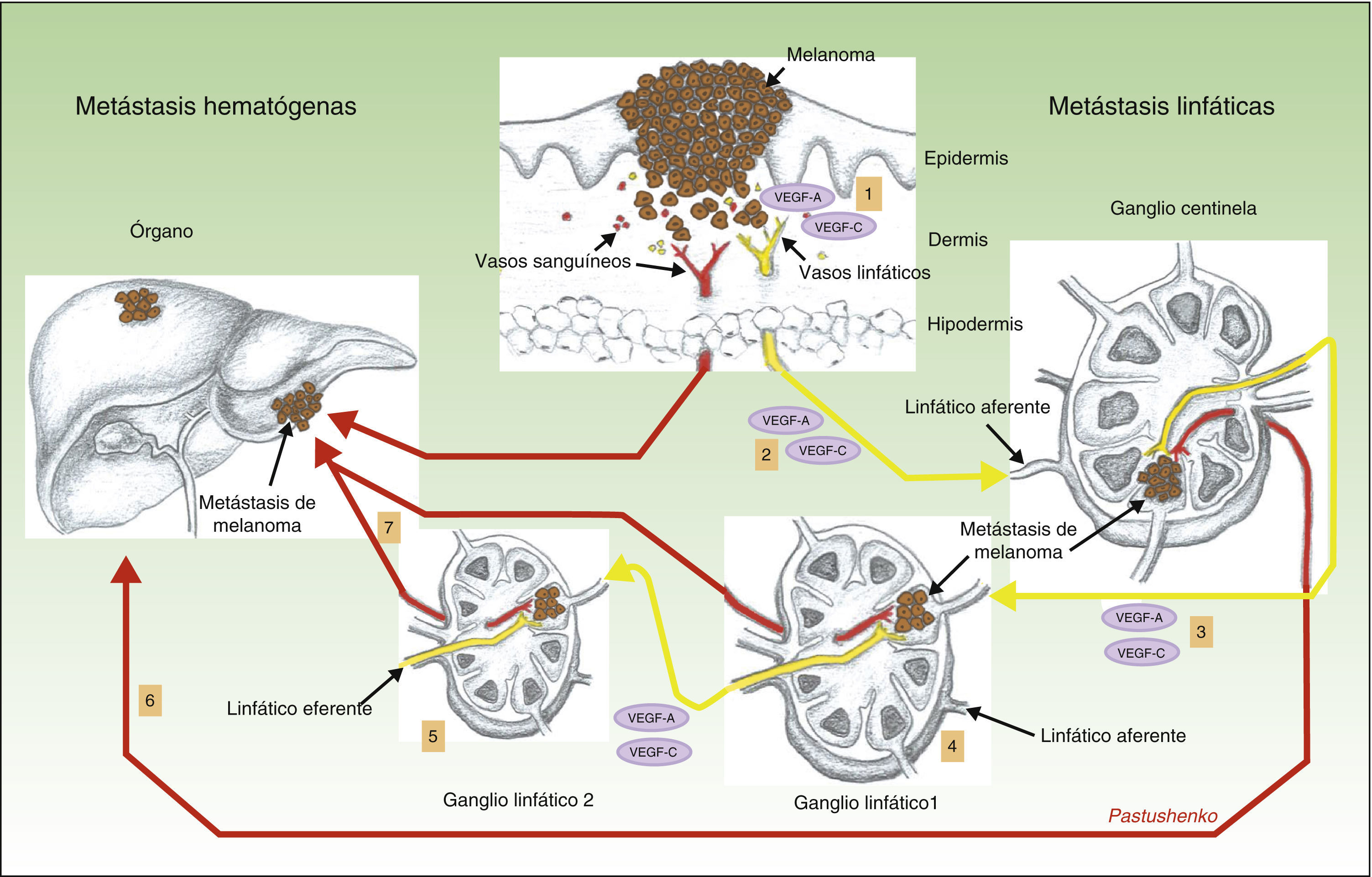
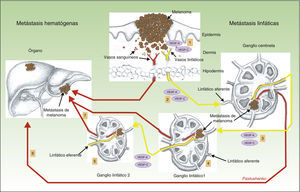
Otro hallazgo sorprendente del mismo grupo fue que la presencia de linfangiogénesis en el ganglio centinela se asociaba a una mayor frecuencia de metástasis en los ganglios linfáticos lejanos, y también a una mayor incidencia de metástasis hematógenas69. De nuevo, se trata de un hallazgo de gran trascendencia, pues nos habla de que las metástasis linfáticas y las hematógenas no son 2 procesos independientes, sino que están íntimamente relacionados entre sí. El mecanismo que se considera responsable de este fenómeno está ilustrado en la figura 3.
Papel de la linfangiogénesis en la diseminación a distancia de las células neoplásicas. Representa esquemáticamente el papel de la linfangiogénesis en el desarrollo de las metástasis linfáticas y hematógenas. Las células tumorales liberan VEGF-A y VEGF-C, induciendo la proliferación de los vasos linfáticos en tejido conectivo peritumoral (1). Al mismo tiempo, los factores VEGF-A y -C son transportados hacia el ganglio centinela (2), induciendo la proliferación de los vasos sanguíneos y linfáticos en el mismo (nicho pre-metastásico). Una vez que las células tumorales llegan al primer ganglio se produce un incremento de los factores VEGF-A y C, y de nuevo estos son transportados hacia los ganglios distantes (3), facilitando la producción de metástasis hacia los ganglios distantes (4 y 5), así como metástasis hematógenas a distancia, a través del conducto torácico o sistema vascular sanguíneo (6 y 7).
La hipótesis interpretativa permite pensar que, aparentemente, las células tumorales liberan VEGF-A33 y VEGF-C69, que son transportados hacia el ganglio centinela, donde inducen el proceso de linfangiogénesis, proporcionando de esta manera un nicho premetastásico para las células tumorales. Una vez que las células tumorales llegan al primer ganglio se produce un incremento de la concentración del VEGF-A y VEGF-C y, de nuevo, estos factores son transportados a través de los vasos linfáticos hacia los ganglios distantes, produciéndose en ellos una expansión de su red vascular linfática, hallazgos comprobados también en el melanoma70. Recordemos que el VEGF-A es un potente factor inductor de la angiogénesis, lo que podría explicar el incremento en la incidencia de las metástasis a distancia observado en tumores con linfangiogénesis activada en el ganglio centinela.
Metodología de cuantificación de los vasos linfáticos en tumores sólidosLa cuantificación de la linfangiogénesis se ha visto dificultada durante años por la falta de marcadores específicos del endotelio linfático. Afortunadamente, en la última década se han identificado y comercializado varios marcadores que se unen de forma selectiva a las células del endotelio linfático, permitiendo diferenciar los vasos linfáticos de los hemáticos en las muestras de tejidos tumorales.
La cuantificación del proceso de linfangiogénesis, al igual que ocurre en el caso de la angiogénesis, es una tarea compleja al tratarse de un proceso dinámico. Por analogía con la angiogénesis, la mayoría de los estudios que evalúan el valor pronóstico de la linfangiogénesis en pacientes con distintos tipos de cáncer se centran en el producto final de la linfangiogénesis, o lo que es lo mismo, la DVL. Para este propósito se han desarrollado diferentes métodos de cuantificación de vasos tumorales, que inicialmente fueron descritos para la cuantificación de los vasos sanguíneos, pero posteriormente fueron aplicados también en los de linfangiogénesis. Entre estos métodos cabría mencionar los siguientes:
Técnica de WeidnerConsiste en cuantificar los vasos linfáticos en los puntos calientes (hot spots), definidos como áreas de mayor densidad de vasos71. Se piensa que la formación de dichos puntos calientes se debe a los cambios locales en los niveles de oxígeno (hipoxia), que inducen la liberación focal de factores prolinfangiogénicos62. Los hot spots se consideran áreas de importancia biológica, puesto que se originan a partir de células tumorales con un alto potencial angiogénico, células que tendrán mayor facilidad para entrar en la circulación sanguínea o linfática y por tanto producir metástasis por esas vías72.
Según la descripción de Weidner (1991) las preparaciones histológicas de los tumores se examinan en primer lugar a bajo aumento (×10), con el fin de identificar los puntos calientes, y posteriormente a mayor aumento (×40), para cuantificar el número de microvasos en dichos puntos calientes, considerándose como microvaso cualquier célula o grupo de células teñidas con el anticuerpo, claramente separados entre sí. Para definir un microvaso no es necesaria la presencia de luz vascular. En varios estudios se ha encontrado una asociación significativa entre el número de vasos linfáticos en el melanoma primario y un pronóstico evolutivo desfavorable19.
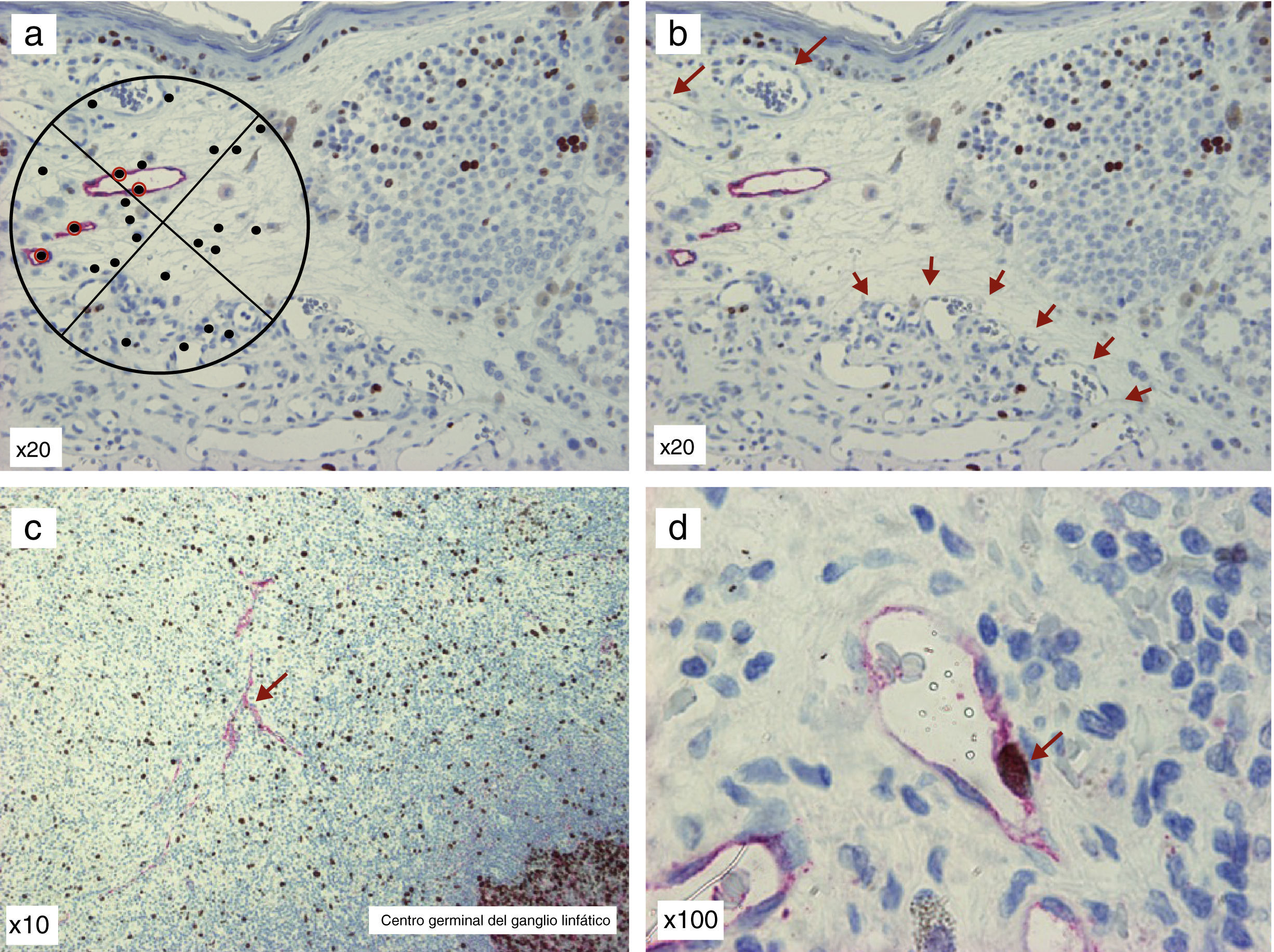
Método de ChalkleyEste método se basa en la utilización de la gratícula de Chalkley, que contiene 25 puntos distribuidos de forma aleatoria73. Una vez seleccionados los puntos calientes (de forma similar a la descrita por Weidner) se introduce la gratícula en el ocular del microscopio y se va girando, hasta conseguir que un mayor número de puntos se encuentre posicionado sobre las células teñidas con el anticuerpo, o sobre las luces de aquellos vasos cuyas paredes están claramente teñidas con el marcador endotelial (fig. 4A). En lugar de cuantificar el número de vasos, como en la técnica descrita por Weidner, se cuantifican los puntos de la gratícula situados sobre las estructuras descritas. La puntuación obtenida refleja el área relativa ocupada por los vasos linfáticos62. Este método se considera más objetivo y reproducible, puesto que evita uno de los pasos más subjetivos en el recuento de los vasos, como es el de decidir si 2 estructuras adyacentes se deben cuantificar como 2 microvasos independientes o si forman parte de una misma estructura vascular72.
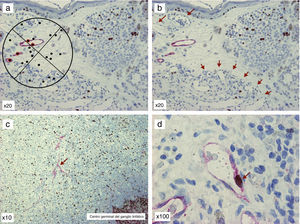
Doble tinción D2-40/Ki-67 de preparaciones de melanoma y su metástasis ganglionar. A. Gratícula de Chalkley: nótese que aquellos puntos marcados con halo rojo son los que se consideran positivos. B. Obsérvese los vasos linfáticos positivos para D2-40 en el tumor primario y múltiples vasos sanguíneos D2-40 (-), que se distribuyen en hot spot en la parte inferior de la imagen (flechas). C. Metástasis de melanoma en ganglio centinela, donde se pueden objetivar vasos linfáticos positivos para D2-40 (flecha). D. Metástasis de melanoma en ganglio centinela, pudiéndose observar, a mayor aumento, un vaso linfático en proliferación: fíjese en las paredes del vaso, que son claramente D2-40 positivas (patrón citoplásmico, cromógeno fast red, Dako) y el núcleo es positivo para Ki-67 (patrón nuclear, cromógeno DAB, Dako; flecha).
El análisis automatizado mediante los sistemas computarizados evidentemente ofrece una valoración de la red vascular tumoral más objetiva y reproducible, además la mayoría de los programas diseñados para este fin permiten obtener información adicional importante, como por ejemplo el área y el perímetro de la luz vascular. Sin embargo, la aplicación generalizada de estos sistemas se ve obstaculizada por la necesidad de equipos especiales con coste económico elevado. Otra limitación de la técnica es la de la observación de que algunos anticuerpos tiñen de forma inespecífica otras estructuras, fácilmente distinguibles de los vasos por el patólogo experto, pero que sin embargo pueden ser confundidas por los sistemas automatizados que captan la señal lumínica, sin tener en cuenta la estructura y morfología62.
Cálculo de la fracción de células endoteliales linfáticas en proliferaciónSe realiza mediante la doble tinción del tejido tumoral con anticuerpos contra endotelio linfático (anti-podoplanina y anti-LYVE-1) y el marcador de células en proliferación (Ki-67 o anti-PCNA). En el melanoma se ha constatado la presencia de vasos linfáticos con núcleos en proliferación27,49, lo que sugiere que existe linfangiogénesis tumoral activa en este tipo de tumor. En la figura 4B-C se ofrecen ejemplos de imágenes de la doble tinción D2-40/Ki-67.
Perspectivas futurasExiste evidencia científica cada vez más sólida y mejor definida sobre la importancia de la linfangiogénesis en la progresión y diseminación de los tumores malignos en general y del melanoma cutáneo en particular. Probablemente, la principal razón por la que los parámetros relacionados con la linfangiogénesis tumoral no hayan podido ser incluidos en el análisis rutinario de las preparaciones de melanoma ha sido la falta de consenso en la metodología utilizada en los estudios publicados hasta la fecha, por lo que resulta de gran importancia y trascendencia para los trabajos futuros seguir las recomendaciones de los expertos internacionales62.
Un supuesto hipotético de gran relevancia en el futuro de estas investigaciones sería que la linfangiogénesis pudiese ser determinada a través de los marcadores en suero de los pacientes que padecen esta enfermedad tumoral. Sería el caso, por ejemplo, de la monitorización del los niveles del VEGF-C en suero. Avalando este supuesto, en un estudio publicado recientemente se han encontrado niveles más bajos del VEGF-C en suero de los pacientes con satelitosis o metástasis subcutáneas próximas a la lesión primaria de melanoma, en comparación con aquellos con metástasis a distancia68. Esta hipotética posibilidad de estudio tiene sus dificultades de valoración, ya que los niveles del VEGF-C circulantes son muy diferentes de unos individuos a otros74, por lo que aún no se dispone de datos concluyentes que permitan con garantías la utilización del VEGF-C u otros factores prolinfangiogénicos en suero, como indicadores pronósticos en pacientes con melanoma.
Estas hipótesis de futuro permiten plantearse casi inevitablemente la pregunta de si inhibiendo los factores VEGF-C, VEGF-D o su receptor VEGFR-3 conseguiríamos un efecto terapéutico en pacientes con melanoma. Estudios experimentales en diferentes tipos de neoplasias (carcinoma gástrico, carcinoma de mama), parecen apuntar en el sentido de que los anticuerpos neutralizantes frente al VEGF-D75 y al VEGFR-376–78 son capaces de inhibir la linfangiogénesis tumoral y las metástasis en modelos animales. Por lo tanto, el proceso de linfangiogénesis tumoral merece ser tomado en consideración tanto como marcador pronóstico, como una posible futura diana terapéutica.
Finalmente, la importancia de la linfangiogénesis tumoral en el ganglio centinela, incluso previa a la aparición de metástasis, sugiere que su determinación podría tener valor en el diagnóstico precoz o incluso en la prevención de metástasis, detectándose mediante técnicas de imagen en pacientes a los que se les ha extirpado un melanoma79.
En este trabajo hemos expuesto una serie de hipótesis y dudas razonables sobre el estado del conocimiento actual de la linfangiogénesis tumoral relativo al melanoma, basándonos en la revisión de los datos bibliográficos y en la experiencia propia sobre algunos parámetros manejados por nosotros, que esperamos nos permitan, en un futuro medio-próximo, aportar algunos resultados de interés general en el campo de la dermatología.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Los autores de este trabajo quieren expresar su agradecimiento a K. Kokoriev e Y. Pastushenko por su inestimable ayuda en la elaboración de los esquemas.