Las metástasis cutáneas son relativamente raras en la práctica clínica. Su diagnóstico requiere un alto índice de sospecha, pues los hallazgos clínicos pueden ser sutiles. Las metástasis cutáneas ponen de manifiesto la presencia de un tumor maligno diseminado y pueden permitir el diagnóstico de neoplasias internas no conocidas, o indicar la diseminación o recurrencia de otras ya diagnosticadas. Su reconocimiento temprano puede llevar a un diagnóstico preciso y rápido, con el consiguiente tratamiento oportuno, aunque en la mayoría de los casos son indicativas de un pronóstico infausto. Algunos tumores tienen predilección por metastatizar en áreas específicas. El reconocimiento de esos patrones es esencial para dirigir la búsqueda del tumor subyacente.
Cutaneous metastases are relatively rare in clinical practice and their diagnosis requires a high index of suspicion because clinical findings can be subtle. These metastases reveal the presence of disseminated malignant disease and can lead to the diagnosis of unsuspected internal tumors or the spread or recurrence of an already diagnosed tumor. Early recognition of cutaneous metastases can facilitate prompt and accurate diagnosis resulting in early treatment; however, they are generally indicative of a poor prognosis. Some tumors have a predilection to metastasize to specific areas. Recognition of these patterns provides essential information that can guide the search for the underlying tumor.
La presencia de metástasis es una de las características de los tumores malignos que amenaza la vida del paciente, e implica indefectiblemente la existencia de un proceso sistémico1. En los últimos años se ha avanzado considerablemente en el conocimiento de cómo las células tumorales circulantes en la sangre y en el sistema linfático son capaces de interactuar con el endotelio para extravasarse y alcanzar los sitios secundarios, y en las propiedades que determinan si las células de esos tumores diseminados son capaces de sobrevivir, y permanecerán en estado latente o serán capaces de formar macrometástasis2. Los nuevos descubrimientos con respecto a la siembra temprana de metástasis, la progresión paralela, la autosiembra de células tumorales circulantes de los tumores primarios y la inducción de nichos premetastásicos en órganos distantes de los tumores primarios han pasado a primer plano3.
Las metástasis cutáneas (MC) son el resultado de la infiltración de la piel por proliferaciones de células procedentes de tumores malignos situados a distancia4,5. La detección temprana de la mayoría de las metástasis requiere de pruebas complementarias sofisticadas; por el contrario, las MC son fácilmente observables en una exploración física dirigida y cuidadosa en la mayoría de los casos. Hasta un tercio de las MC se diagnostican de forma previa o simultánea al tumor de origen, por ello el papel del dermatólogo para establecer una sospecha clínica6,7 adecuada es esencial8. Su reconocimiento clínico precoz es imprescindible, pues puede permitir el diagnóstico de un tumor maligno primario no previamente conocido, poner de manifiesto la diseminación de un tumor primario ya conocido, o ser un signo precoz de recurrencia tumoral de un tumor maligno en aparente remisión. Por tanto, el diagnóstico de las MC puede suponer un cambio en la estadificación de la enfermedad tumoral, con implicaciones terapéuticas y pronósticas9. Su presencia, a menudo, varía drásticamente la actitud terapéutica, especialmente cuando las metástasis implican la persistencia de una neoplasia en aparente remisión10, además permite obtener fácilmente muestras de tumor que pueden ser de utilidad para analizar la sensibilidad del tumor primario a tratamientos específicos, como inhibidores del factor de crecimiento epidérmico (EGF), o de c-kit/CD11711.
Algunos tumores parecen tener predilección por metastatizar en áreas específicas. El reconocimiento de estos patrones puede ser útil para dirigir la búsqueda de un tumor subyacente no conocido12.
La presentación reciente de varios estudios retrospectivos sobre la aparición de MC en multitud de países refleja el interés internacional que suscita el tema en la actualidad13.
EtiopatogeniaLas metástasis surgen cuando las células neoplásicas se desprenden de un tumor primario y se diseminan a otros lugares14,15. El mecanismo de producción de las metástasis es variable, y se han implicado varías vías en su desarrollo16,17. Las vías hematógena y linfática son las más frecuentes, aunque la diferenciación entre ambas es difícil debido a que están interconectadas. La diseminación linfática es la vía más frecuente de propagación inicial de la mayoría de los tumores malignos y su papel en la determinación de los patrones metastásicos está de actualidad18. La difusión regional se produce más a menudo a través de las cavidades corporales, especialmente la cavidad peritoneal. El trasplante de células tumorales puede producirse por el transporte mecánico de fragmentos tumorales mediante los instrumentos quirúrgicos durante la cirugía u otros procedimientos invasivos, pero rara vez ocurre19,20.
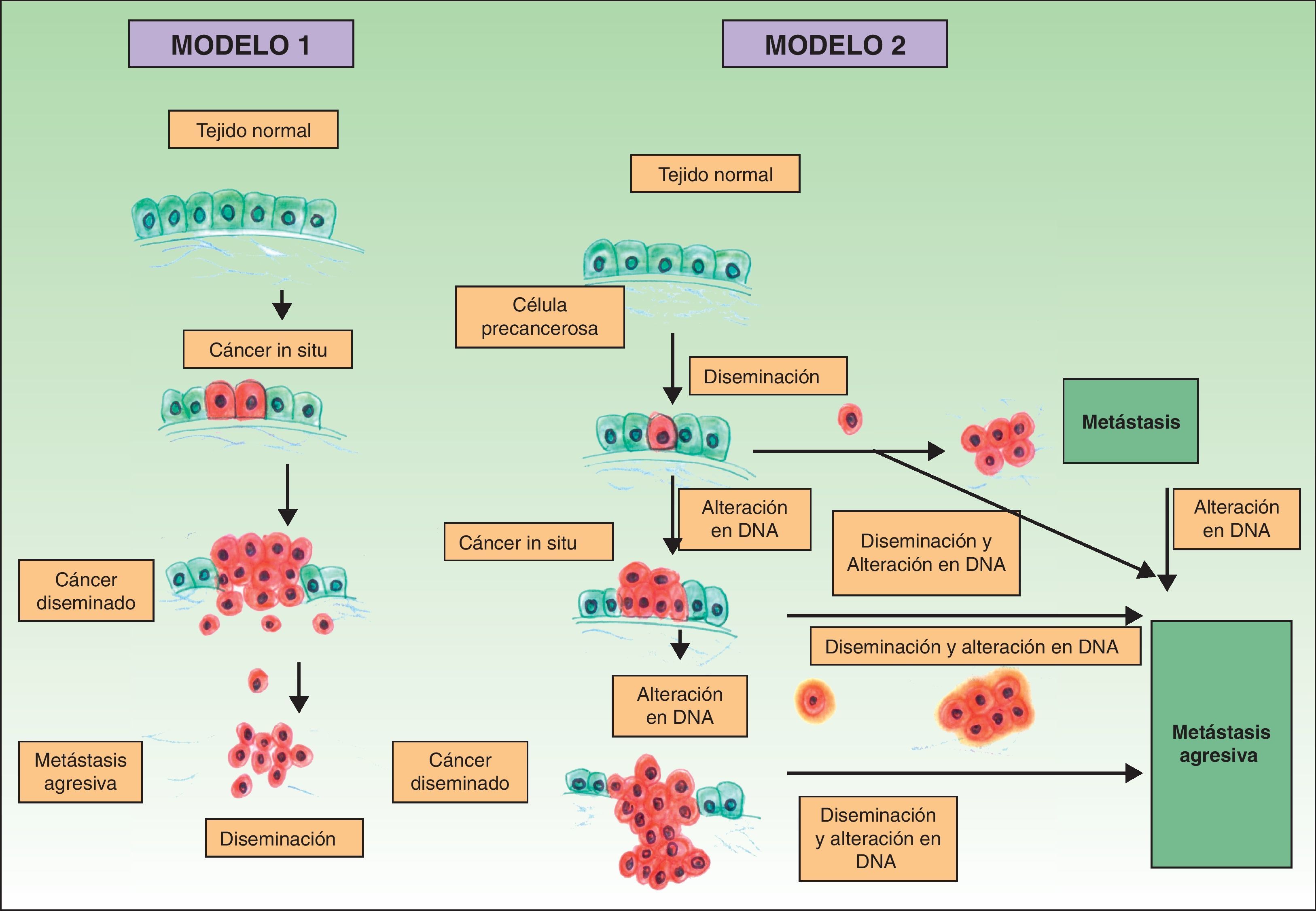
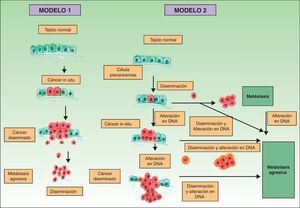
Clásicamente se postulaba que debían cumplirse una serie de pasos para que se produjera una metástasis. En primer lugar el tumor primario debe ser lo bastante grande como para liberar una cantidad suficiente de células neoplásicas al sistema circulatorio o linfático. La mayoría de las células neoplásicas libres son destruidas por el sistema inmune, mientras que los grupos de 6 o 7 células parecen tener una mayor probabilidad de metastatizar21. Estas células, a su vez, precisarían poseer ciertas propiedades, como la suspensión celular y un adecuado índice mitótico para sobrevivir22. El desarrollo de un clon metastásico se ve ayudado inicialmente por la activación de oncogenes específicos23,24 y la pérdida de genes supresores tumorales25,26. Para establecerse, las células neoplásicas que se encuentran en el sistema circulatorio deben penetrar a través de las paredes de los vasos. Una vez que se produce la adhesión se forma un trombo alrededor de las células neoplásicas por lesión de las células endoteliales. Este trombo sirve de protección a las células neoplásicas. La metástasis se establece y obtiene inicialmente la nutrición a través de fenómenos de difusión27, y posteriormente forma sus propios vasos (angiogénesis)28,29. En este modelo clásico descrito para el desarrollo del cáncer las metástasis corresponden a la etapa final de la cascada metastásica. Sin embargo, estudios recientes apoyan un modelo diferente, que predice que la expresión de proteínas que regulan la transición epitelio-mesenquimal promueve la oncogénesis, concomitantemente con la diseminación metastásica. En este modelo alternativo la difusión celular del tumor primario se puede producir en cualquier momento durante el desarrollo del cáncer30 (fig. 1).
Patogénesis de las metástasis cutáneas. Esquema comparativo del modelo clásico de producción de metástasis y una de las hipótesis más recientemente descritas. Fuente: Sánchez-García I30.
La incidencia real de las MC se desconoce; no obstante, parece existir un aumento de su incidencia en algunos estudios recientes, con respecto a las series históricas, aunque es posible que se deba no a un aumento real de la incidencia, sino a que se diagnostican o se biopsian más31. Suponen un hallazgo infrecuente en la práctica clínica, y su incidencia varía entre el 0,7 y el 9% de los pacientes con neoplasias internas, según las series32.
En teoría, cualquier neoplasia maligna puede extenderse a la piel. Sin embargo, en la práctica se ha comprobado que existe una relación directa entre la frecuencia de los distintos tumores malignos y el origen de las MC. En general, los tumores malignos más frecuentes en cada sexo son los que producen MC con mayor frecuencia, y por ello el cáncer de mama en la mujer, el de pulmón en el varón y los adenocarcinomas digestivos en ambos sexos son los orígenes más frecuentes de las MC33.
En 2003 un metaanálisis que reunió 1.080 casos de MC, en un total de 20.380 pacientes con cáncer, estimó una tasa de MC del 5,3%34. En un estudio clásico de 1972, en el que se reunieron 724 pacientes, Brownstein y Helwig examinaron la distribución de las MC en ambos sexos. En los hombres los orígenes más comunes de los tumores malignos que metastatizaron en la piel fueron el carcinoma de pulmón (24%), el carcinoma colorrectal (19%), el melanoma (13%) y el carcinoma oral de células escamosas (12%), mientras que en las mujeres fueron el cáncer de mama (69%), el carcinoma colorrectal (9%), el melanoma (5%) y el carcinoma de ovario (4%). La cara anterior del tronco fue el sitio más comúnmente afectado, mientras que las extremidades inferiores fueron la localización menos frecuente. En los hombres alrededor del 75% de las MC se observaron en la cabeza y el cuello, mientras que en las mujeres el 75% de los casos se localizaron en la cara anterior del tórax y el abdomen. En general, la espalda es una localización poco frecuente de las MC35.
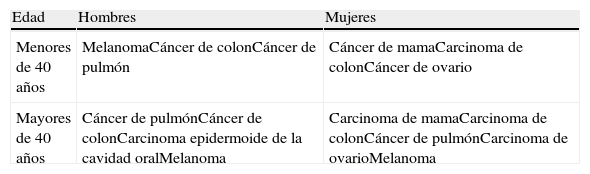
En la mujer la localización más frecuente de las MC es el tórax, seguida por el abdomen, la espalda, las extremidades superiores, el cuero cabelludo, el cuello, y en el varón el tórax es igualmente la localización preferencial, seguido, en orden decreciente de frecuencia, por el abdomen, la espalda, el cuero cabelludo, el cuello, la cara, las extremidades superiores e inferiores y la pelvis. La incidencia de MC en función de la edad y el sexo se resume en la tabla 1. Su presentación en la infancia es muy rara, siendo las causas más frecuentes el rabdomiosarcoma y el neuroblastoma36.
Incidencia de las metástasis cutáneas en función de la edad y el sexo (en orden decreciente de frecuencia)
| Edad | Hombres | Mujeres |
| Menores de 40 años | MelanomaCáncer de colonCáncer de pulmón | Cáncer de mamaCarcinoma de colonCáncer de ovario |
| Mayores de 40 años | Cáncer de pulmónCáncer de colonCarcinoma epidermoide de la cavidad oralMelanoma | Carcinoma de mamaCarcinoma de colonCáncer de pulmónCarcinoma de ovarioMelanoma |
En la mayoría de los casos las MC se desarrollan después del diagnóstico inicial del tumor primario. En un porcentaje destacable de pacientes (hasta un tercio de los casos), las metástasis pueden ser descubiertas de forma previa37 o simultánea al diagnóstico de un tumor primario38.
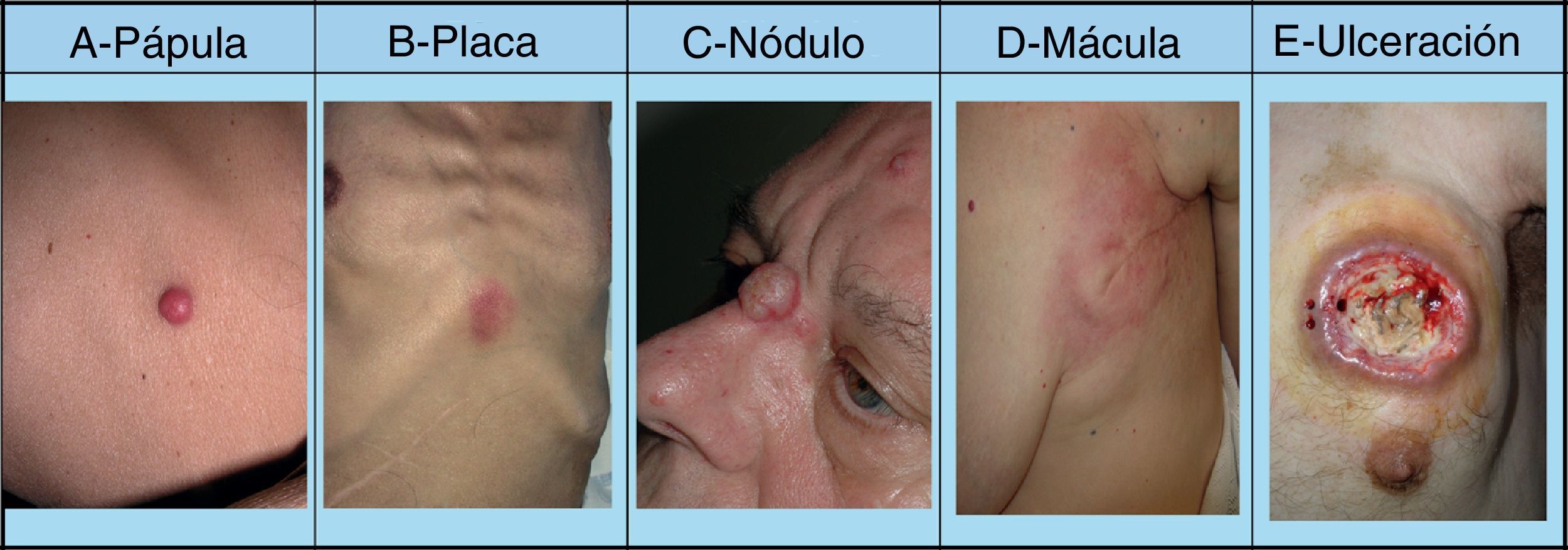
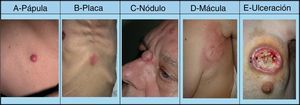
La mayoría de las MC se producen en una región corporal próxima al tumor primario. La presentación más habitual es a modo de nódulos de rápido crecimiento39, que suelen ser redondos u ovalados, móviles y de textura firme o elástica, pudiendo ulcerarse40, aunque pueden presentarse como cualquier lesión elemental41 (fig. 2). Generalmente son del color de la piel, aunque los nódulos metastásicos procedentes de los carcinomas de células renales y tiroideos con frecuencia muestran una coloración rojiza o violácea característica42,43 (fig. 3). Algunos estudios resaltan que las metástasis cutáneas suelen manifestarse actualmente en forma de una lesión nodular única, mientras que en estudios más antiguos la forma de presentación más frecuente son nódulos múltiples44, quizás porque en la actualidad las metástasis suelen diagnosticarse más precozmente.
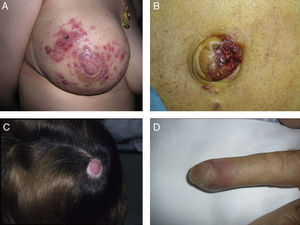
Lesiones cutáneas elementales en la manifestación clínica de las metástasis cutáneas. A. Metástasis de adenocarcinoma gástrico. Pápula de 7mm en abdomen. B. Metástasis de adenocarcinoma de ovario en forma de placa. C. Metástasis de carcinoma urotelial vesical en forma de nódulo. D. Metástasis de adenocarcinoma de mama que comenzó como una mácula sobre la cicatriz de una mastectomía previa. E. Placa infiltrada ulcerada correspondiente a una metástasis de un adenocarcinoma pulmonar.
Aunque en la mayoría de los casos las lesiones son asintomáticas los pacientes pueden referir dolor, sobre todo en determinadas localizaciones, como es el caso de las metástasis subungueales45.
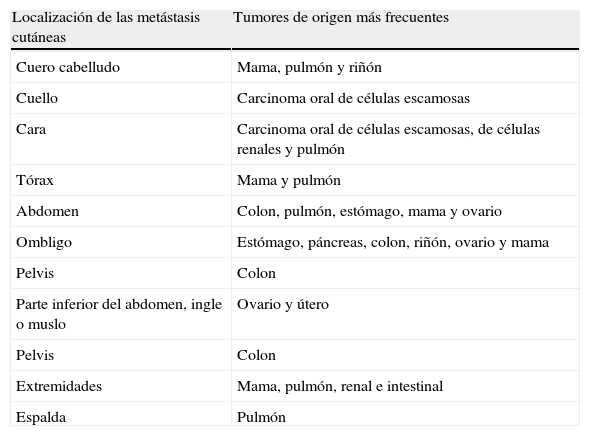
Los cánceres gastrointestinales (en concreto el carcinoma colorrectal y el gástrico) con frecuencia originan metástasis en el abdomen y la pelvis. Los carcinomas gastrointestinales pueden extenderse a lo largo del uraco y producir nódulos en el ombligo, denominados «nódulos de la hermana María José»46. Las MC del carcinoma de células escamosas de la cavidad oral suelen permanecer en la misma región corporal, y con mayor frecuencia afectan al cuello y la cara. El carcinoma de células renales, entre otros, suele metastatizar en el cuero cabelludo, y debido a la importante vascularización de esta neoplasia las lesiones pueden confundirse con hemangiomas o granulomas piógenos. Las MC del hepatocarcinoma con frecuencia se localizan en los dedos, las palmas, las plantas y la espalda y las del gástrico en la cabeza y el cuello47. Asimismo, la localización de las MC puede indicar el posible origen (tabla 2).
Tumores de origen de las metástasis cutáneas más frecuentes en función de la localización de las mismas
| Localización de las metástasis cutáneas | Tumores de origen más frecuentes |
| Cuero cabelludo | Mama, pulmón y riñón |
| Cuello | Carcinoma oral de células escamosas |
| Cara | Carcinoma oral de células escamosas, de células renales y pulmón |
| Tórax | Mama y pulmón |
| Abdomen | Colon, pulmón, estómago, mama y ovario |
| Ombligo | Estómago, páncreas, colon, riñón, ovario y mama |
| Pelvis | Colon |
| Parte inferior del abdomen, ingle o muslo | Ovario y útero |
| Pelvis | Colon |
| Extremidades | Mama, pulmón, renal e intestinal |
| Espalda | Pulmón |
Se han descrito multitud de formas clínicas peculiares de MC. El carcinoma erisipeloide o inflamatorio, que se observa con frecuencia en pacientes con adenocarcinoma de mama, no es raro en otros tipos de cáncer (páncreas, recto, pulmón, ovario y parótida)48,49. Se presentan como lesiones eritematosas, calientes, sensibles, bien delimitadas, similares a la erisipela50. El bloqueo linfático por el infiltrado neoplásico puede originar un linfedema localizado que da una apariencia de piel de naranja50. La piel puede llegar a adquirir, como consecuencia de dicho linfedema, un color amarillento y una textura fibrosa, que se superpone con el aspecto de las metástasis en coraza51 o carcinoma escirro. Esta forma clínica se presenta como placas eritematosas con induración e infiltración en la pared torácica. Suele observarse en metástasis de cáncer de mama, aunque puede ser una forma clínica de presentación de un tumor mamario primitivo o de metástasis cutáneas de otro origen52. En estos casos el diagnóstico diferencial se plantea fundamentalmente con cuadros infecciosos. Cuando la inflamación es aguda y se localiza en la mama puede ser difícil de distinguir de una mastitis. Por tanto, cualquier inflamación persistente y sin respuesta a la terapéutica convencional debe ser cuidadosamente evaluada para descartar una infiltración metastásica, especialmente en ausencia de fiebre y leucocitosis53.
El carcinoma telangiectásico, descrito por Weber en 193354 en una paciente con un cáncer de mama metastático, se caracteriza por la aparición de nódulos, pápulas o placas purpúricas55 en la pared del tórax, por lo general asociados a una cicatriz posquirúrgica56,57.
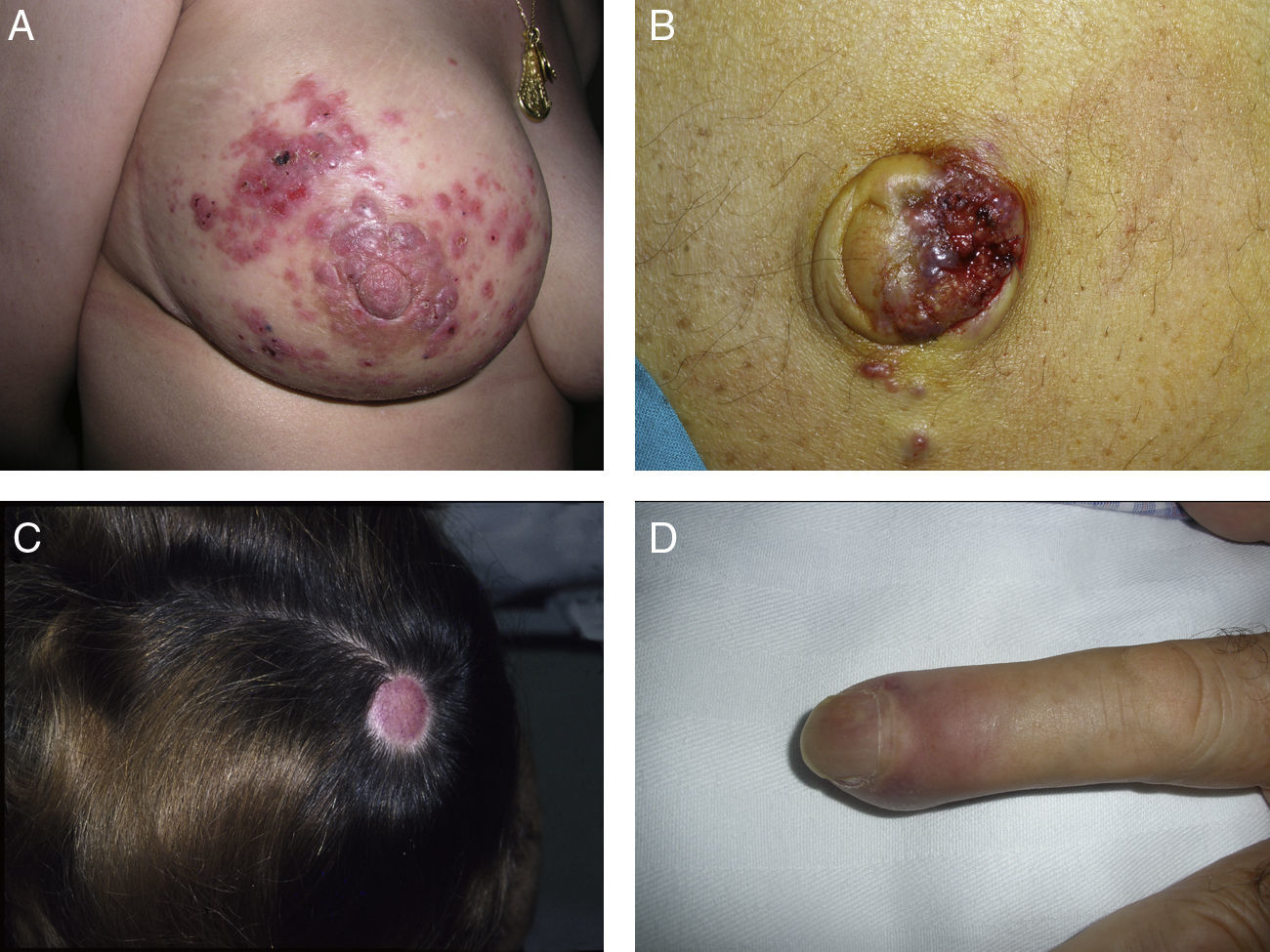
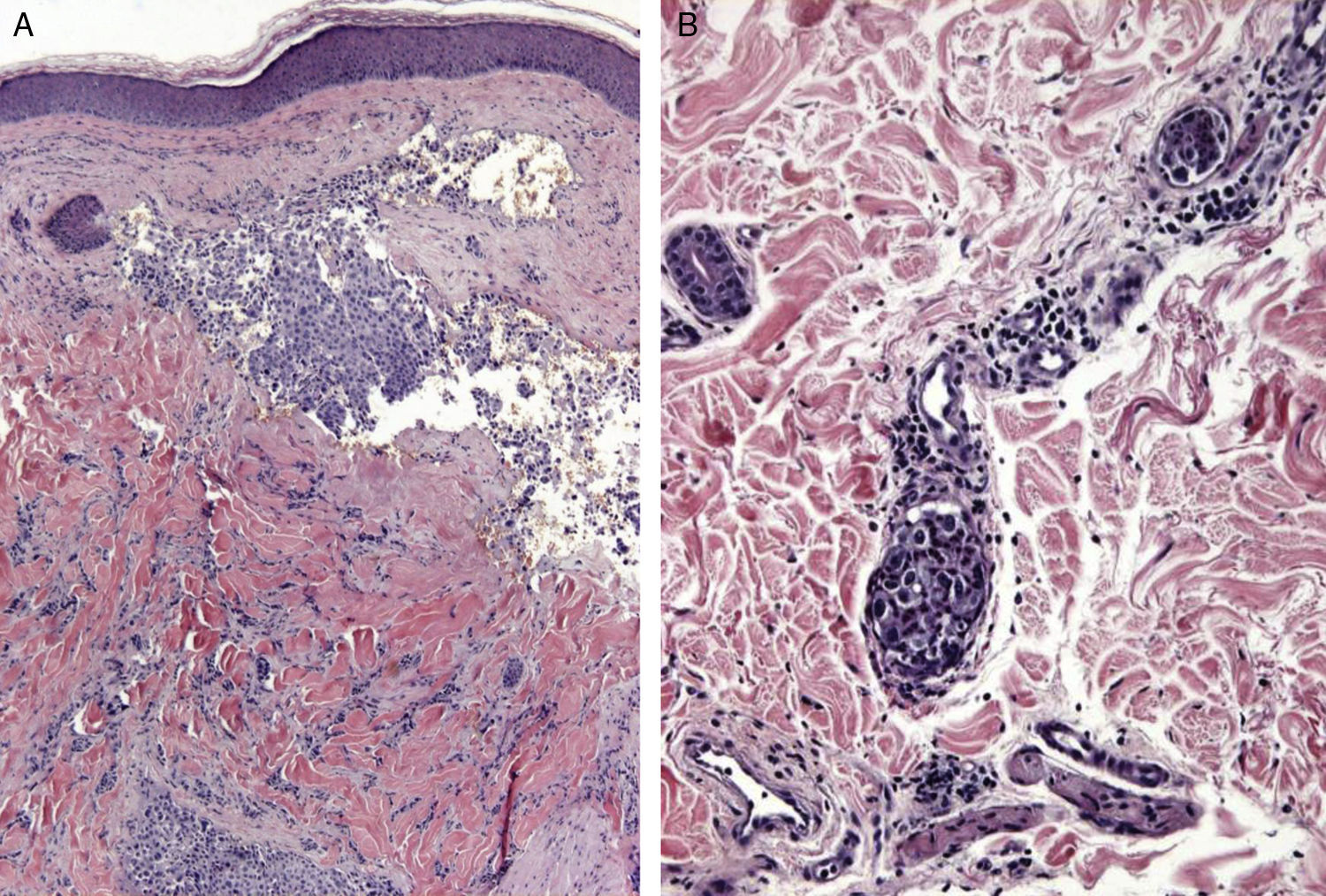
Las metástasis zosteriformes o herpetiformes se presentan como papulovesículas, nódulos, o vesiculoampollas que se distribuyen a lo largo de dermatomas58,59 simulando la presentación de un herpes zóster60,61 (fig. 4). Aunque su etiopatogenia no ha sido aclarada, la mayoría de las hipótesis apuntan a que se producirían por la difusión de las células tumorales desde los vasos linfáticos cutáneos a los nervios sensitivos, y desde estos a los ganglios de la raíz dorsal62,63.
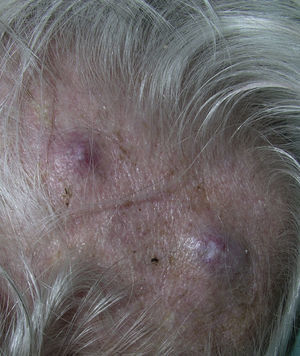
Metástasis cutáneas peculiares. A. Metástasis zosteriforme de un adenocarcinoma ductal de mama. Pápulas infiltradas, agrupadas en racimo y confluentes, algunas ulceradas con distribución metamérica. B. Metástasis umbilical (nódulo de la hermana María José). Múltiples pápulas y nódulos, confluentes, con ulceración en la región umbilical y periumbilical. C. Metástasis alopécica. Placa alopécica en una mujer, correspondiente a una metástasis de adenocarcinoma ductal mamario. D. Metástasis subungueal. Nódulo inflamatorio doloroso, con deformidad en la región de la falange distal, en el segundo dedo de la mano izquierda, correspondiente a una metástasis de carcinoma epidermoide pulmonar.
La «nariz de payaso» se ha descrito como resultado de la aparición de MC en la punta de la nariz, generalmente proveniente de un carcinoma de pulmón o de mama64.
La alopecia neoplásica se define como la pérdida de pelo derivada de la invasión del cuero cabelludo por células tumorales. Puede presentarse como una o varias placas de alopecia cicatricial, frecuentemente induradas y con una coloración violácea-azulada, y puede plantear inicialmente el diagnóstico diferencial con la alopecia areata65 (fig. 4). Las células neoplásicas pueden destruir los folículos pilosos por la fibroplasia inducida a través de la liberación de mediadores de la inflamación, atrayendo células inflamatorias y/o mediante la sustitución de las células normales66. El cáncer de mama es el tumor maligno primario en el 84% de los pacientes con alopecia neoplásica67.
La enfermedad de Paget del pezón y la areola es la manifestación cutánea de un adenocarcinoma de mama subyacente en el 100% de los casos. Se trata de MC epidermotropas por extensión de un tumor intraductal a través de los conductos galactóforos a la piel suprayacente68.
Las metástasis subungueales merecen una especial consideración. Estas lesiones metastásicas suelen ser dolorosas y a menudo plantean el diagnóstico diferencial con procesos infecciosos, sobre todo como paroniquia aguda, o con tumores glómicos69 (fig. 4). Se han descrito casos que se presentan como dactilitis indolora70.
El nódulo de la hermana de María José o metástasis umbilical se ha descrito ampliamente en la literatura. Se presenta como nódulos aislados o múltiples, indurados a la palpación, que pueden ulcerarse o mostrar un aspecto friable en algunos casos, localizados en el ombligo y en la región periumbilical (fig. 4). Aunque el origen específico del tumor primario se desconoce en aproximadamente el 29% de los casos71, las neoplasias más comunes que metastatizan en el ombligo son las originadas en el estómago, el ovario, la región colorrectal y el páncreas72. Como patogénesis de la propagación a la región umbilical se ha propuesto que puede ser tanto por contigüidad como por vía hematógena o linfática73.
Finalmente las metástasis clínicamente ocultas son aquellas que se presentan como hallazgos incidentales en un examen histopatológico llevado a cabo por otro motivo, sin hallazgos clínicamente detectables74.
Diagnóstico diferencialEl diagnóstico diferencial de las MC es muy amplio y se plantea, además de con las entidades ya comentadas con otras muchas. En primer lugar con múltiples tumores primariamente cutáneos75, tanto benignos (dermatofibroma, granuloma piógeno76, quiste epidérmico77, tumores anexiales78) como malignos (carcinoma basocelular o epidermoide, melanoma, carcinoma de células de Merkel, angiosarcoma79), así como con otras dermatosis (eccema, eritema anular centrífugo80, eritema multiforme [MC en diana]) o vasculitis81.
DiagnósticoUna anamnesis detallada y una exploración física completas son esenciales para poder establecer una sospecha clínica inicial.
La histopatología de las MC puede mostrar las mismas características del tumor de origen, o tener un aspecto más anaplásico. En el caso de los tumores indiferenciados los estudios de inmunohistoquímica pueden ayudar a definir el posible origen. La biopsia cutánea, tanto incisional como excisional, es esencial para el diagnóstico. La citología por punción-aspiración con aguja fina puede ser útil en determinadas circunstancias82,83. El patrón observado y la apariencia microscópica del tejido a menudo sugieren su origen84.
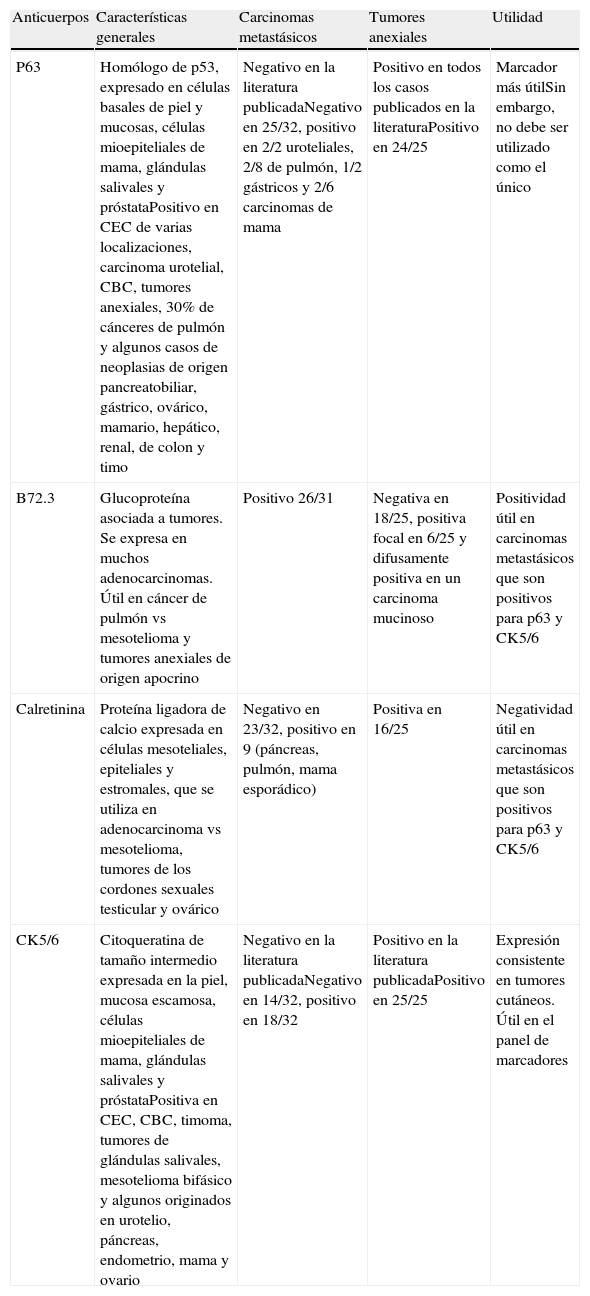
En determinados casos, como el carcinoma de células renales, el tumor primario puede ser identificado a través de los hallazgos histológicos característicos, pero por lo general la mayoría de las metástasis solo se clasifican en términos generales como adenocarcinoma, carcinoma de células escamosas o carcinoma indiferenciado. Asimismo, resulta esencial la diferenciación entre las lesiones cutáneas metastásicas y las neoplasias primariamente cutáneas. Los marcadores inmunohistoquímicos son de gran utilidad a este respecto, dado que en muchas ocasiones ambos tipos de lesiones pueden ser morfológicamente muy similares. En la tabla 3 se resumen los resultados y la revisión de la literatura publicados por Sarya et al. en 200785.
Resumen de los marcadores inmunohistoquímicos útiles en el diagnóstico diferencial entre metástasis cutáneas y tumores cutáneos primarios, y resumen de los datos obtenidos en la serie de Sarya D et al
| Anticuerpos | Características generales | Carcinomas metastásicos | Tumores anexiales | Utilidad |
| P63 | Homólogo de p53, expresado en células basales de piel y mucosas, células mioepiteliales de mama, glándulas salivales y próstataPositivo en CEC de varias localizaciones, carcinoma urotelial, CBC, tumores anexiales, 30% de cánceres de pulmón y algunos casos de neoplasias de origen pancreatobiliar, gástrico, ovárico, mamario, hepático, renal, de colon y timo | Negativo en la literatura publicadaNegativo en 25/32, positivo en 2/2 uroteliales, 2/8 de pulmón, 1/2 gástricos y 2/6 carcinomas de mama | Positivo en todos los casos publicados en la literaturaPositivo en 24/25 | Marcador más útilSin embargo, no debe ser utilizado como el único |
| B72.3 | Glucoproteína asociada a tumores. Se expresa en muchos adenocarcinomas. Útil en cáncer de pulmón vs mesotelioma y tumores anexiales de origen apocrino | Positivo 26/31 | Negativa en 18/25, positiva focal en 6/25 y difusamente positiva en un carcinoma mucinoso | Positividad útil en carcinomas metastásicos que son positivos para p63 y CK5/6 |
| Calretinina | Proteína ligadora de calcio expresada en células mesoteliales, epiteliales y estromales, que se utiliza en adenocarcinoma vs mesotelioma, tumores de los cordones sexuales testicular y ovárico | Negativo en 23/32, positivo en 9 (páncreas, pulmón, mama esporádico) | Positiva en 16/25 | Negatividad útil en carcinomas metastásicos que son positivos para p63 y CK5/6 |
| CK5/6 | Citoqueratina de tamaño intermedio expresada en la piel, mucosa escamosa, células mioepiteliales de mama, glándulas salivales y próstataPositiva en CEC, CBC, timoma, tumores de glándulas salivales, mesotelioma bifásico y algunos originados en urotelio, páncreas, endometrio, mama y ovario | Negativo en la literatura publicadaNegativo en 14/32, positivo en 18/32 | Positivo en la literatura publicadaPositivo en 25/25 | Expresión consistente en tumores cutáneos. Útil en el panel de marcadores |
Fuente: Sarya D et al.85. CBC: carcinoma basocelular; CEC carcinoma espinocelular.
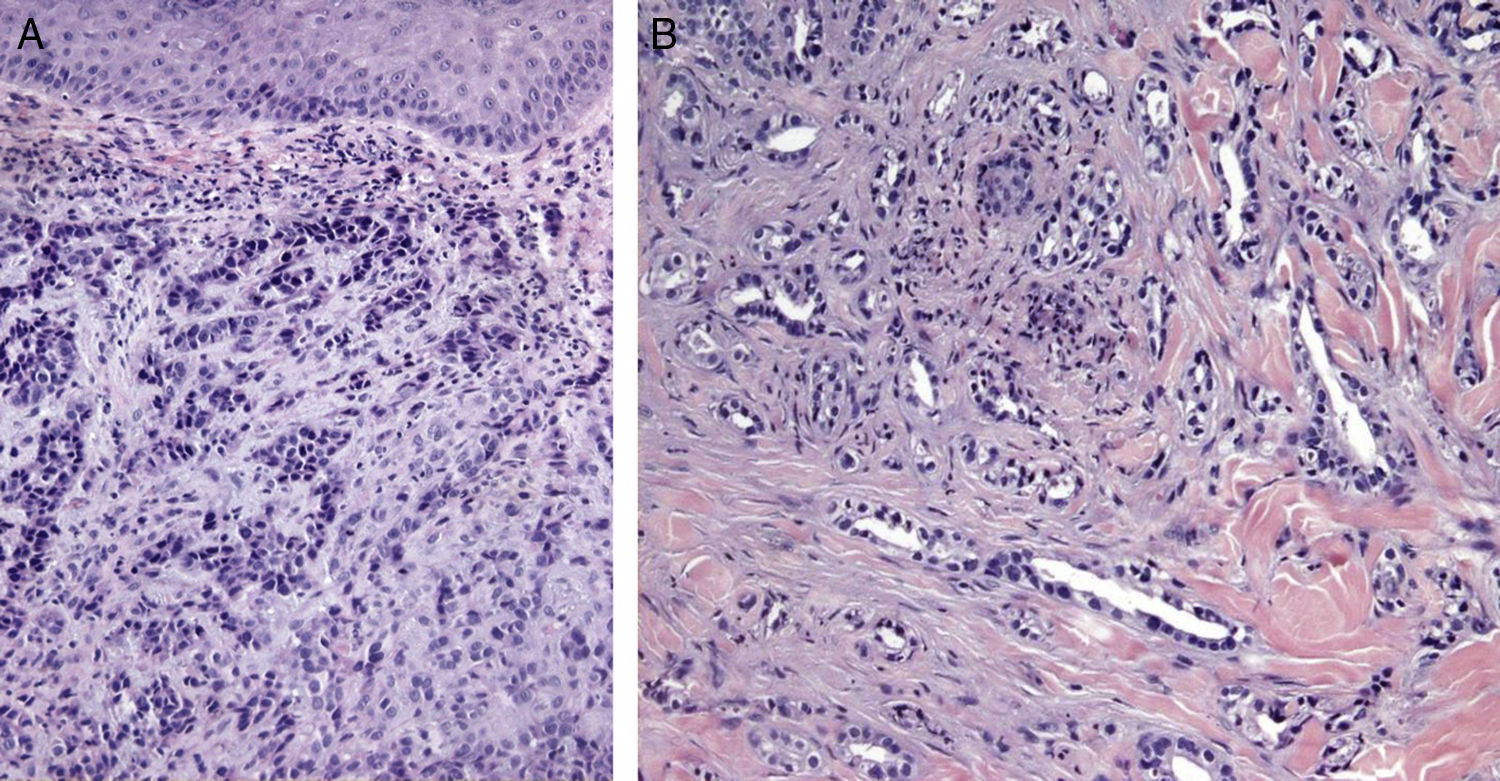
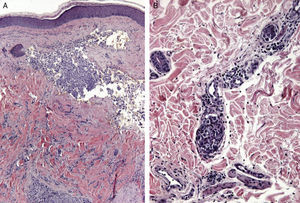
Ciertos hallazgos histológicos distinguen las metástasis de los tumores primarios. Algunas características de las MC incluyen la presencia de células neoplásicas en el interior de los vasos linfáticos y sanguíneos, la localización en la dermis reticular profunda e hipodermis y la presencia de células neoplásicas alineadas entre los haces de colágeno. Los tumores metastásicos son generalmente lóbulos redondeados, localizados en la dermis o la hipodermis, y generalmente no están relacionados con la epidermis. La presencia de esta zona Grenz se observa con mucha frecuencia en las lesiones metastásicas. La fibrosis y la inflamación pueden estar presentes86 (figs. 5 y 6).
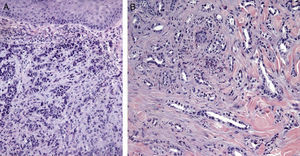
Imágenes histológicas de metástasis cutáneas. A. Metástasis dérmica por carcinoma pobremente diferenciado de origen desconocido. Infiltración de la dermis por cordones y nidos de células epitelioides (H-E x10). B. Metástasis dérmica por adenocarcinoma pancreático moderadamente diferenciado. Luces glandulares tapizadas por una capa de células epiteliales entre los haces colágenos dérmicos (H-E x10).
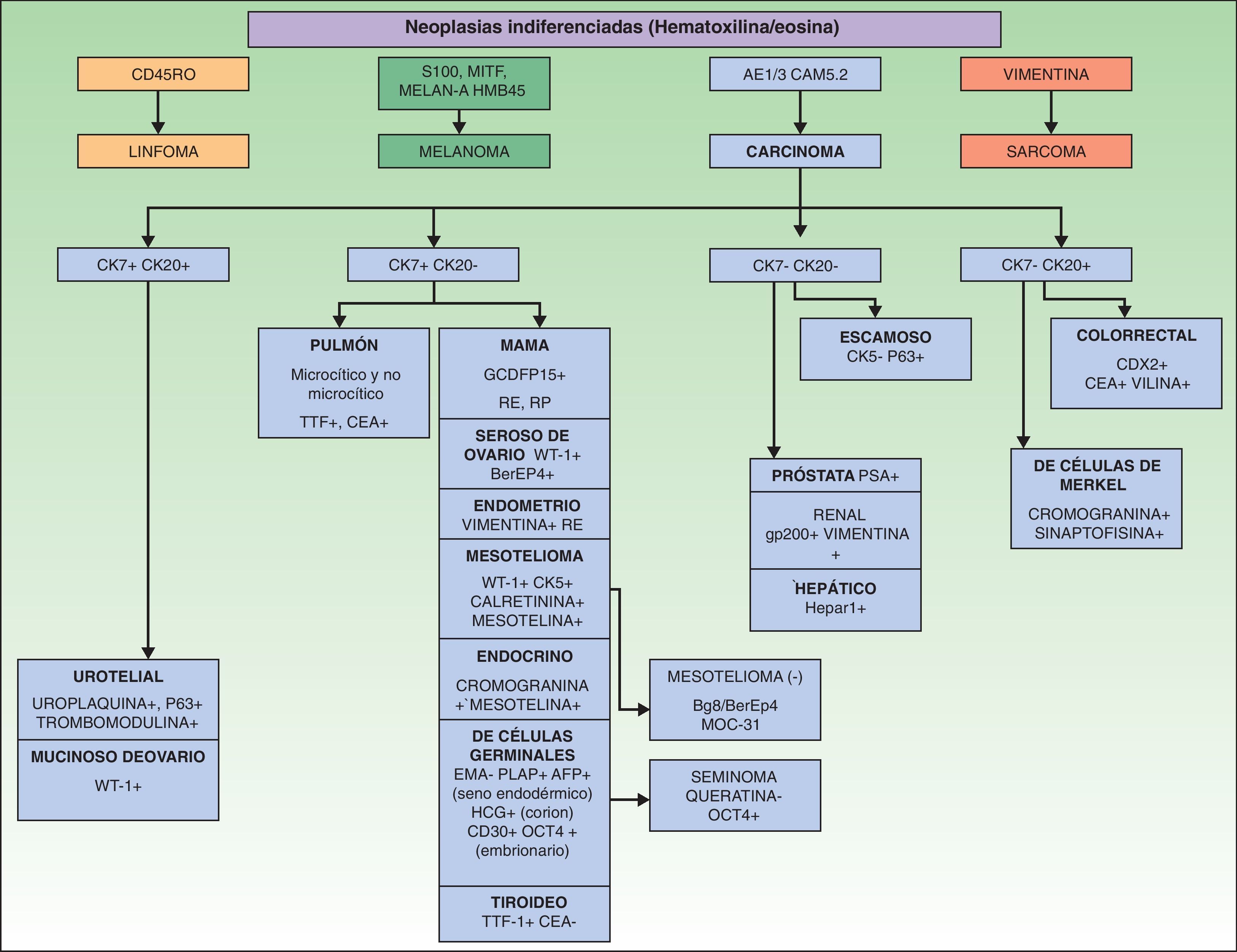
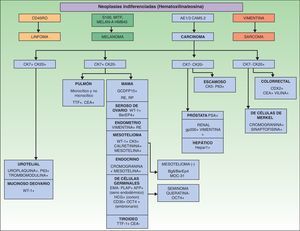
Los marcadores inmunohistoquímicos y algunas veces los estudios ultraestructurales son una valiosa herramienta para la determinación del origen de las MC87. En la figura 7 se muestra el algoritmo diagnóstico a llevar a cabo en las MC indiferenciadas. El panel básico recomendado de marcadores incluye CD45 (para neoplasias linfoides), AE1/AE3 pancitoqueratina (la mayoría de los carcinomas), S100 (melanoma) y CD34 (neoplasias vasculares y leucemias). El segundo panel recomendado de marcadores incluye los marcadores linfoides (CD3 y CD20), los marcadores epiteliales como el antígeno de membrana epitelial y el antígeno carcinoembrionario, la cromogranina (tumores neuroendocrinos), el antígeno prostático específico y la fosfatasa ácida (carcinoma de próstata), el factor de transcripción tiroideo (carcinoma de pulmón), proteína del tumor de Wilms para carcinoma de ovario, CDX288 (carcinomas intestinales) y Hep Par189 (carcinoma hepatocelular)90. Los inmunofenotipos de las principales neoplasias que pueden metastatizar en la piel se resumen en la tabla 4.
Inmunofenotipos de las metástasis de los principales carcinomas
| Tumor primario | Marcadores inmunohistoquímicos |
| Mama | CK7 (+), CAM 5.2 (+), vimentina (−), TTF-1 (−), Ber-EP4 (+), WT-1 (−), DPC4 (−) |
| Adenocarcinoma de pulmón | CK7 (+), CAM 5.2 (+), CEA (+), Ber-EP4 (+), WT-1 (−), DPC4 (−) |
| Colorrectal | CK20 (+), CAM 5.2 (+), CK17 (−), CK19 (+), CEA (+), TTF-1 (−), Ber-EP4 (+), S100 (−), WT-1 (−), DPC4 (−) |
| Gástrico | CAM 5.2 (+), vimentina (−), TTF-1 (−), ER (−), Ber-EP4 (+), WT-1 (−), DPC4 (−) |
| Próstata | CK7 (−), CK20 (−), CAM 5.2 (+), CD5/6 (−), CK17 (−), CEA (−), vimentina (−), TTF-1 (−), ER (−), Ber-EP4 (+), S100 (−), WT-1 (−), DPC4 (−) |
| Páncreas | CK7 (+), CAM 5.2 (+), vimentina (−), TTF-1 (−), ER (−), Ber-EP4 (+), S100 (−), WT-1 (−), DPC 4 (+) |
| Renal | CK7 (−), CK20 (−), CAM 5.2 (+), CEA (−), TTF-1 (−), Ca-125 (−), ER (−), CD10 (+), WT-1 (−), DPC4 (−) |
| Neuroendocrino | CK20 (−), CK5/6 (−), Ca-125 (−), ER (−), Ber-EP4 (−), WT-1 (−), DPC4 (−) |
| Carcinoma de células escamosas | CK7 (−), CK20 (−), CK5/6 (+), CK17 (+), TTF-1 (−), CA19.9 (−), Ca-125 (−), ER (−), Ber-EP4 (−), CD10 (−), S100 (−), WT-1 (−), DPC4 (−) |
(+) indica «siempre positivo» y (−) «negativo, con raras excepciones». Ber-EP4: antígeno epitelial humano; CA: antígeno carcinoide; CEA: antígeno carcinoembrionario; CK: citoqueratina; ER: receptor de estrógeno; TTF: factor de transcripción tiroideo; WT-1: proteína del tumor de Wilms.
Los estudios ultraestructurales pueden ser útiles en la identificación de ciertos tumores no diferenciados. La presencia de desmosomas en los carcinomas, lúmenes citoplasmáticos en los adenocarcinomas, melanosomas en el melanoma, y gránulos neurosecretores en los tumores neuroendocrinos puede ayudar a resolver el diagnóstico. No obstante, son técnicas largas, costosas, que no están disponibles en la mayoría de centros clínicos y que requieren un personal altamente especializado, por lo que habitualmente resulta más útil en la práctica clínica los estudios inmunohistoquímicos.
La tomografía por emisión de positrones (PET) posee un alto número de falsos positivos91, por lo que la PET-tomografía axial computarizada es más útil92. No obstante, la utilización de la PET en la estadificación de las neoplasias puede fallar en algunos casos como en el diagnóstico de metástasis de pequeño tamaño o cerebrales93.
PronósticoLa presencia de enfermedad metastásica en la piel suele implicar una enfermedad sistémica y generalizada con una alta tasa de mortalidad, aunque el pronóstico varía considerablemente en función del tipo de tumor primario94,95. Solo del 6,4 al 7,8% de las MC se diagnostican en ausencia de otras metástasis a distancia96. No obstante, parece que los avances recientes en las opciones de quimioterapia han aumentado considerablemente la supervivencia97.
Se estima que la supervivencia media tras el diagnóstico de las MC es del 50% a los 6 meses. Se han publicado varios análisis de supervivencia de los pacientes con MC, entre los que destacan los de Benmously et al.98 y Schoenlaub et al.99. Todos indican una mejor tasa de supervivencia en los casos cáncer de mama, en comparación con otros tipos de cáncer100,101.
El intervalo entre el diagnóstico del tumor primario y la aparición de las MC oscila de media entre 2 y 3 años, pero se ha descrito de hasta 22 años. Recientes estudios indican que este intervalo varía en función del tumor primario102,103. De 141 pacientes analizados por Hu et al. la media de los intervalos de tiempo entre la aparición de MC tras la escisión o el tratamiento del tumor primario fue más alta en los casos de cáncer de mama (47,2 meses) que en las demás neoplasias, como por ejemplo el cáncer de pulmón (15,7 meses), el cáncer colorrectal (16,5 meses) y el cáncer gástrico (19,8 meses)104. El cáncer de pulmón es, según algunos estudios, la neoplasia que más rápidamente metastatiza en la piel105,106.
TratamientoEl abordaje terapéutico de las MC se basa en el adecuado manejo del tumor primario, siempre que sea conocido107. Dada la diseminación que implica la presencia de MC y que en la mayoría de los casos coexisten con otras lesiones metastásicas, la quimioterapia dirigida al tumor de origen suele ser la única alternativa susceptible de lograr la remisión completa108. Dada la accesibilidad de la mayoría de las lesiones metastásicas en la piel, la cirugía y la radioterapia se emplean frecuentemente, aunque no han demostrado claramente aumentar la supervivencia, y muchas veces la finalidad de estos procedimientos es exclusivamente paliativa109. Se propuso que la cirugía podría aumentar la supervivencia en los casos de MC de cáncer de pulmón110 y gástrico111,112. La radioterapia ha conseguido respuestas completas y la paliación duradera en algunos casos de metástasis de carcinomas de células renales113. En un estudio la braquiterapia pulsada consiguió el control local en 41 de 46 casos (89%) de MC de cáncer de mama114. La aplicación tópica de solución de miltefosina al 6% sobre las MC de carcinoma de mama logró un buen control de las MC, en comparación con el placebo, en un estudio aleatorizado115. Diez pacientes con MC de cáncer de mama o de colon fueron tratados con inyecciones intratumorales de anticuerpos recombinantes de cadena simple dirigidos contra ErbB2/HER2, con remisión completa en 4 de los 10 casos116.
La inmunoterapia intralesional con interferón-alfa o IL-2117 se ha aplicado con resultados ambiguos118,119. Asimismo se han comunicado casos de metástasis de melanoma tratados con imiquimod120.
También se han descrito respuestas exitosas a otros procedimientos destructivos locales como la electroquimioterapia121, la electrocoagulación, la electroporación y la electrovaporización122. En especial, la electroquimioterapia con bleomicina ofrece una opción para MC y subcutáneas múltiples. Ciento setenta y cuatro nódulos tumorales de 52 pacientes con cáncer de mama fueron incluidos en un protocolo con dicho tratamiento, y se obtuvieron tasas de respuesta completa del 80% y parcial del 20% después de la aplicación repetida123. La electroquimioterapia con cisplatino también se ha probado en el tratamiento de las MC de cáncer de mama, aunque con menos éxito124.
Ningún quimioterápico específico ha demostrado mayor eficacia en el tratamiento sistémico de las MC. Las observaciones de las MC con regresión inducida por la quimioterapia sistémica se limitan a casos aislados, como en el caso de las MC de cáncer de páncreas tratadas con gemcitabina125 o de carcinoma urotelial de vejiga tratadas con ciclofosfamida, metotrexato y 5-fluorouracilo126. También está descrito el tratamiento de casos aislados de MC de carcinomas de origen desconocido con cisplatino, gemcitabina, vinorelbina y paclitaxel127,128. La expresión de algunas moléculas como el EGF, Her- cinasas 2/neu, y c-kit tirosina tiene gran importancia, pues suponen posibles dianas para las terapias sistémicas. También los fármacos dirigidos contra la función del estroma y la angiogénesis podrían ser considerados129.El tratamiento de las MC, en términos paliativos, incluye el manejo adecuado del dolor, del prurito, de la posible sobreinfección bacteriana y en algunos casos del olor desagradable que puede producirse130–133.
ConclusionesLa mayoría de recidivas tumorales se diagnostican gracias a una anamnesis detallada y un examen físico completo, junto con la realización de las pruebas de imagen pertinentes. Dado que en la mayoría de los casos las MC son asintomáticas es esencial el despistaje activo de las mismas.
Las MC pueden ser la clave que indique la recurrencia de un tumor o incluso el primer signo de un tumor no previamente conocido. La localización y distribución de las lesiones cutáneas puede orientarnos hacia el órgano de origen.
El estudio histológico e inmunohistoquímico de las MC es fundamental para establecer el tumor de origen.
Es esencial lograr una detección precoz de las MC para iniciar el tratamiento oportuno. Aunque no hay evidencia científica clara de que esto mejore el pronóstico vital, esta hipótesis cobra cada vez más fuerza por los informes de casos individuales y por algunas publicaciones preliminares.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a la Dra. Concepción Román Curto, autora de la tesis doctoral Tumores cutáneos metastásicos. Estudio clínico, histológico y ultraestructural la ayuda prestada, y al Dr. Jesús Millán Núñez-Cortés, catedrático de Medicina (Hospital General Universitario Gregorio Marañón, Facultad de Medicina, Universidad Complutense) su imprescindible colaboración.
Esta revisión es una parte de la introducción de la Tesis Doctoral Metástasis cutáneas: estudio descriptivo clínico-histopatológico de las metástasis cutáneas de neoplasias viscerales.