alitretinoína (ácido 9-cis-retinoico) es un derivado endógeno de la vitamina A, panagonista de ambas familias de receptores nucleares (RAR-α, -β, -γ, RXR-α, -β, -γ) estudiado en el eczema crónico de manos en diversos trabajos durante los últimos años con resultados prometedores.
Objetivosevaluar la eficacia y seguridad de alitretinoína oral en el tratamiento del eczema crónico de manos refractario al tratamiento con corticoides tópicos potentes, y su respuesta mantenida a largo plazo.
Material y métodosllevamos a cabo un estudio prospectivo, descriptivo y observacional. Se reclutaron un total de 15 pacientes con eczema crónico de manos refractarios al tratamiento con corticoides tópicos potentes, a los que se les administró una dosis de alitretinoína oral de 30mg/día durante tres meses, con un seguimiento posterior de 6 meses.
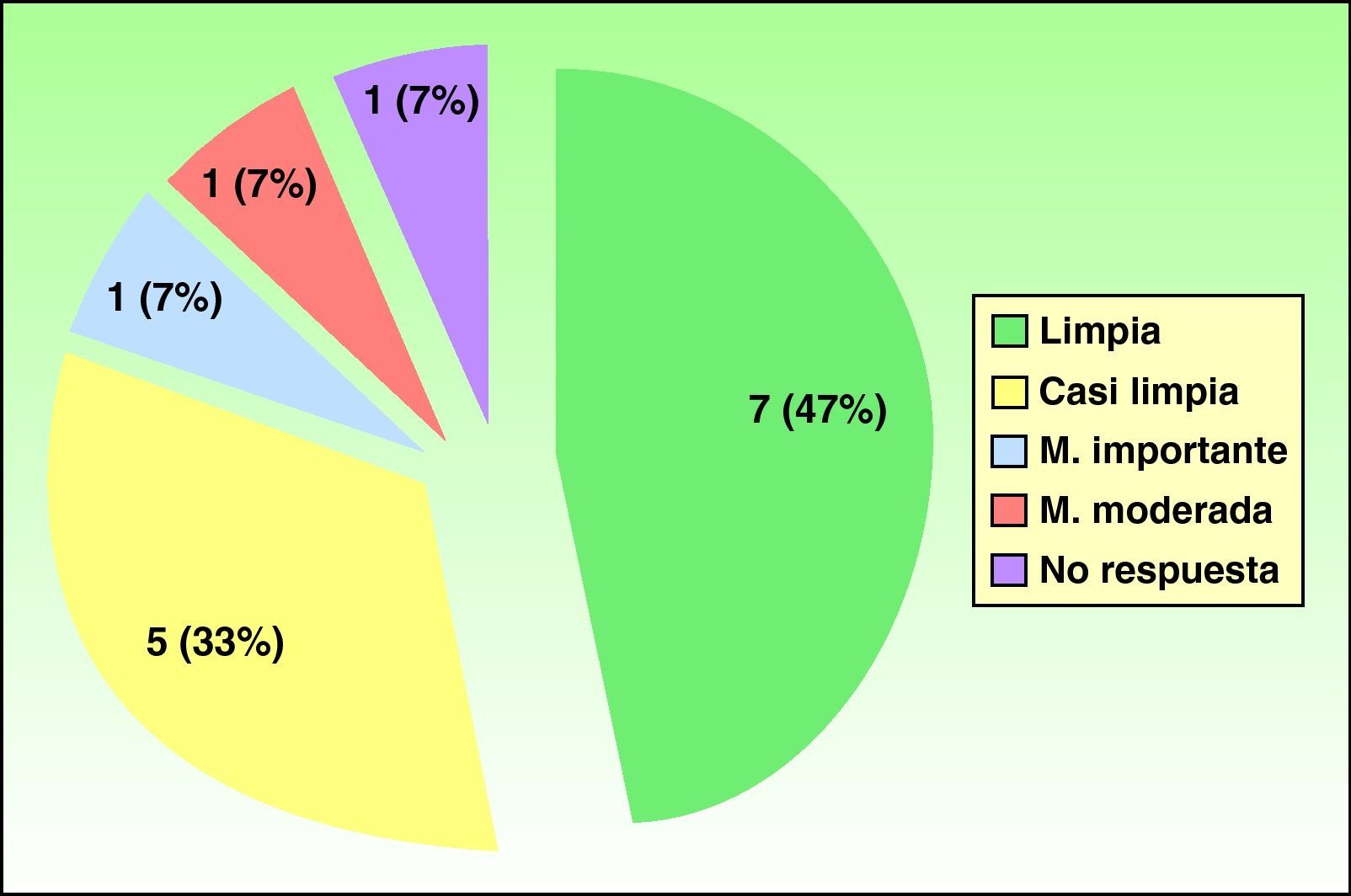
Resultadosun total de 7 pacientes (47%) obtuvo respuesta completa con «manos limpias» al finalizar el tratamiento, 5 pacientes (33%) alcanzaron una respuesta parcial «manos casi limpias», un paciente (7%) obtuvo mejoría importante, otro paciente (7%) evidenció mejoría moderada y sólo un paciente (7%) no respondió al tratamiento. El porcentaje de recaída durante los 6 meses después de haber terminado el tratamiento fue del 54%. El tratamiento fue bien tolerado con efectos colaterales en el 50% de los pacientes, considerados leves (cefalea, hiperlipidemias, aumento leve de transaminasas, epigastralgias), excepto un paciente, que presentó una disminución importante de la hormona estimulante del tiroides.
Conclusioneslos resultados presentados son coherentes con la propuesta de alitretinoína como un medicamento eficaz y seguro para el tratamiento a corto y medio plazo del eczema crónico de manos en pacientes refractarios a tratamiento con corticoides tópicos potentes.
Alitretinoin (9-cis-retinoic acid) is an endogenous derivative of vitamin A and functions as an agonist of both families of nuclear receptors (retinoic acid receptor-α, -β, -γ; retinoid X receptor-α, -β, -γ). It has been investigated in the treatment of chronic hand eczema in many studies in recent years and the results have been promising.
ObjectivesTo evaluate the efficacy and safety of oral alitretinoin in the treatment of chronic hand eczema that is refractory to treatment with potent topical corticosteroids and to analyze the long-term response to treatment.
Materials and methodsA prospective, observational, descriptive study was undertaken in 15 patients with chronic hand eczema that was refractory to treatment with potent topical corticosteroids. Patients were administered oral alitretinoin 30mg/d for 3 months followed by 6 months of follow-up.
ResultsA complete response, with “clear” hands was obtained in 7 patients (47%), 5 patients (33%) achieved a partial response (almost clear hands), 1 patient (7%) showed substantial improvement, 1 (7%) showed moderate improvement, and 1 patient (7%) did not respond to treatment. Relapse occurred within 6 months of treatment suspension in 54% of cases. The treatment was well tolerated. Side effects, observed in 50% of cases, were mild (headache, elevated lipid levels, slightly elevated transaminase levels, and epigastric pain), except in 1 patient, who had a substantial reduction in thyroid stimulating hormone levels.
ConclusionsThe results of our study support the proposal of alitretinoin as an effective and safe short-term and medium-term treatment for chronic hand eczema in patients whose disease is refractory to treatment with potent topical corticosteroids.
El eczema crónico de manos (ECM) es la dermatosis más frecuente que afecta a las manos. Se estima que la prevalencia anual del ECM es del 7-12% en la población general del Norte de Europa, y posiblemente la cifra es aún mayor en EE.UU.1–3. Desde un punto de vista epidemiológico, el ECM predomina en las mujeres (ratio mujeres/varones de 2:1) y en la franja de los adultos jóvenes (20-50 años), que incluye la mayoría de la población laboralmente activa. El impacto del eczema de las manos en el ámbito laboral es considerable. Se ha estimado que este constituye un 10-25% de las enfermedades ocupacionales4, aunque la prevalencia real podría ser 30-50 veces más alta, teniendo en cuenta que no todos los casos se notifican5.
Aunque las opciones de tratamiento para los pacientes con ECM son amplias, la eficacia es en su conjunto muy limitada. Los tratamientos actuales incluyen en primer lugar cambios en el estilo de vida, evitar el alergeno responsable y diversos tratamientos tópicos. Entre estos últimos los corticoides tópicos6 representan el tratamiento de primera línea. Entre otras alternativas se incluyen los inhibidores de la calcineurina7, el bexaroteno en gel8, la toxina botulínica9 o la fototerapia localizada10.
En los casos refractarios al tratamiento tópico se recurre a terapia sistémica con corticoides orales, ciclosporina, metotrexato, retinoides y, de forma esporádica, azatioprina, micofenolato mofetilo e incluso infliximab11–14. Sin embargo, estos tratamientos sistémicos no son adecuados para el manejo crónico de estos pacientes debido a su importante toxicidad sistémica y al frecuente empeoramiento de la enfermedad al suspender estos tratamientos. Existe por lo tanto la necesidad de nuevas opciones terapéuticas en esta enfermedad.
Desde la óptica de las mutuas de accidentes de trabajo y las enfermedades profesionales en España, los brotes de ECM representan el 97,8% de las bajas laborales y el coste total anual por cada paciente con ECM asciende a 42.000 euros15.
El grupo EDEN (European Dermato-Epidemiology Network) analizó los trabajos publicados entre 1977 y 200316, hallando un total de 90 estudios, de los cuales tan sólo 31 eran aleatorizados y controlados, con un número total de participantes escaso, alrededor de 1.200. Hasta entonces los pacientes con ECM severo refractario a corticoides tópicos potentes contaban con limitadas opciones de tratamiento adecuadas para su uso crónico. Los últimos estudios apuntan a la alitretinoína (ácido 9-cis-retinoico), derivado endógeno de la vitamina A, panagonista de ambas familias de receptores nucleares (RAR-α, -β, -γ. RXR-α, -β, -γ) como el tratamiento de elección en pacientes con ECM refractario, siendo el mecanismo de acción desconocido, aunque estarían implicados factores inmunomoduladores, antiinflamatorios, junto a efectos en la angiogénesis y en la queratinización17–19.
ObjetivosEvaluar la eficacia y seguridad del tratamiento con alitretinoína oral en pacientes con ECM refractario al tratamiento con corticoides tópicos potentes, valorando además la respuesta mantenida a largo plazo y comparar nuestros resultados con los ya publicados en la bibliografía existente.
Material y métodosSe realizó un estudio prospectivo, descriptivo, abierto y observacional en el que se seleccionaron pacientes con ECM refractario al tratamiento con corticoides tópicos potentes, que acudieron a la Unidad de Eczema del Hospital Ramón y Cajal. Se consideraron criterios de inclusión:
- 1.
Edades comprendidas entre 18 a 75 años.
- 2.
Pacientes con diagnóstico clínico correcto de ECM de cualquier etiología.
- 3.
Refractariedad a tratamiento con corticoides tópicos potentes de al menos 6 meses de duración.
- 4.
Pacientes que aceptaron ser tratados y firmaron consentimiento informado.
Por el contrario, se consideraron criterios de exclusión:
- 1.
Pacientes con infecciones bacterianas, micóticas o virales activas.
- 2.
Pacientes con otras enfermedades que recibieran tratamientos sistémicos que pudieran interferir en la interpretación del estudio.
- 3.
Pacientes que hayan utilizado tratamientos con fototerapia, corticoides orales o inmunosupresores los dos meses previos al inicio del estudio.
- 4.
Pacientes con concentraciones de transaminasas > 250% del limite superior de la normalidad, triglicéridos > 200% del limite superior de la normalidad, colesterol total > 200% del limite superior de la normalidad.
A todos los pacientes se les realizaron pruebas epicutáneas estándar del Grupo Español de Investigación en Dermatitis de Contacto y Alergia cutánea (GEIDAC) y analíticas (incluyendo bioquímica sanguínea, hemograma, perfil de hormonas tiroideas, perfil metabólico y hepático) previo al inicio del estudio. Se realizaron test de embarazo a las mujeres en edad fértil antes del tratamiento, durante el mismo y 5 semanas posteriores a la finalización del tratamiento. Se tomaron fotografías digitales previas al inicio, durante el tratamiento y al finalizar el mismo. Se administró una dosis de 30mg/día de alitretinoína oral con revisiones periódicas a la semana y posteriormente mensuales hasta finalizar los tres meses de tratamiento con controles analíticos. No se permitieron reducciones de la dosis, pero sí interrupción en caso de acontecimientos graves. Los pacientes seguían recibiendo tratamiento coadyuvante con emolientes tópicos únicamente.
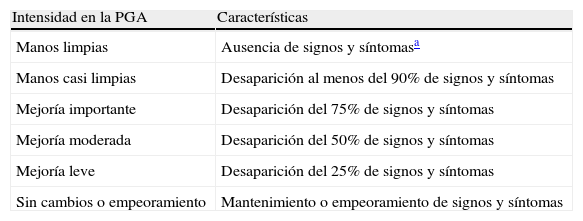
La respuesta clínica fue evaluada mediante la PGA (Patient Global Assessment) (tabla 1), de mejoría de signos y síntomas (eritema, descamación, hiperqueratosis, vesiculaciones, edema, fisuras, prurito o dolor), realizada en el momento de la selección, a la semana y mensualmente durante el tratamiento, definiendo la respuesta como «manos limpias» o «casi limpias», incluyendo las que presentaban una reducción media de hasta el 75% de los signos y síntomas iniciales de la enfermedad. Al finalizar el tratamiento se realizó seguimiento mensual de los mismos hasta los 6 meses posteriores, evaluando la recaída como la reaparición del 75% de signos y síntomas iniciales. Se recogieron además los efectos colaterales del tratamiento.
Criterios de eficacia: evaluación global del médico
| Intensidad en la PGA | Características |
| Manos limpias | Ausencia de signos y síntomasa |
| Manos casi limpias | Desaparición al menos del 90% de signos y síntomas |
| Mejoría importante | Desaparición del 75% de signos y síntomas |
| Mejoría moderada | Desaparición del 50% de signos y síntomas |
| Mejoría leve | Desaparición del 25% de signos y síntomas |
| Sin cambios o empeoramiento | Mantenimiento o empeoramiento de signos y síntomas |
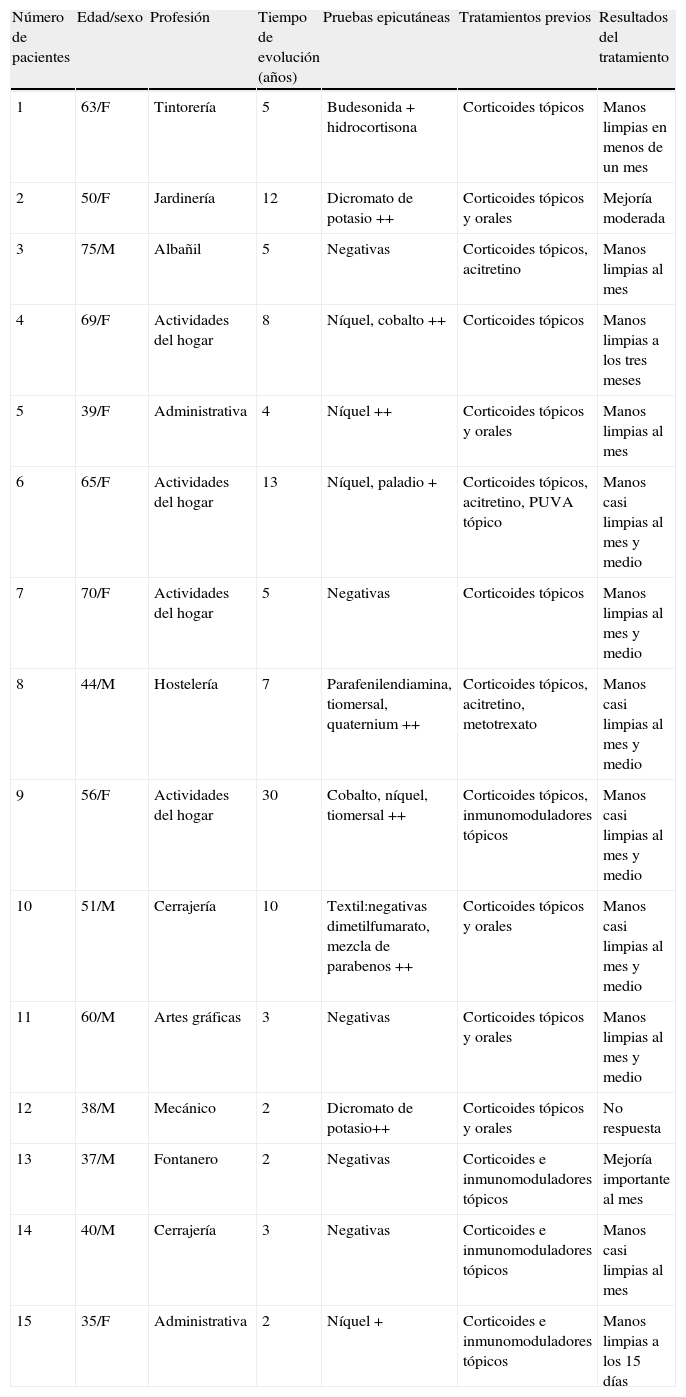
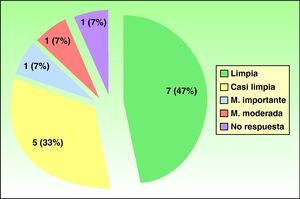
Se trató a un total de 15 pacientes (tabla 2), 7 varones y 8 mujeres. La media de edad fue de 53 años (rango de 35 a 75 años). El tiempo medio de evolución de las lesiones previo al tratamiento fue de 7,4 años, siendo las pruebas epicutáneas positivas en el 67% de los pacientes, aunque sólo se consideraron relevantes para la dermatitis en el 14% de los mismos. La forma clínica más frecuente de ECM en nuestra serie fue el eczema de manos irritativo, con discreta mayoría en el sexo femenino. La mitad de los pacientes había requerido tratamiento sistémico previo (corticoides orales, fototerapia, acitretino, metotrexato) debido a la falta de respuesta a corticoides tópicos. Un total de 7 pacientes (47%) obtuvo respuesta completa con «manos limpias» al finalizar el tratamiento, 5 pacientes (33%) alcanzaron respuesta parcial «manos casi limpias», un paciente (7%) obtuvo mejoría importante, otro paciente (7%) evidenció mejoría moderada y sólo un paciente (7%) no respondió al tratamiento (fig. 1). El 92% respondió antes de los dos meses de iniciar el tratamiento (rango de 15 días a 3 meses). La tasa de recaída (reaparición del 75% de signos y síntomas iniciales de la enfermedad) fue del 54% durante los 6 meses después de haber finalizado el tratamiento con alitretinoína. El tratamiento fue bien tolerado. Aunque la mitad de los pacientes presentaron efectos colaterales, estos fueron leves y no requirieron suspensión del tratamiento con alitretinoína ni terapéutica específica adicional.
Resumen de las características de los pacientes y los resultados obtenidos
| Número de pacientes | Edad/sexo | Profesión | Tiempo de evolución (años) | Pruebas epicutáneas | Tratamientos previos | Resultados del tratamiento |
| 1 | 63/F | Tintorería | 5 | Budesonida + hidrocortisona | Corticoides tópicos | Manos limpias en menos de un mes |
| 2 | 50/F | Jardinería | 12 | Dicromato de potasio ++ | Corticoides tópicos y orales | Mejoría moderada |
| 3 | 75/M | Albañil | 5 | Negativas | Corticoides tópicos, acitretino | Manos limpias al mes |
| 4 | 69/F | Actividades del hogar | 8 | Níquel, cobalto ++ | Corticoides tópicos | Manos limpias a los tres meses |
| 5 | 39/F | Administrativa | 4 | Níquel ++ | Corticoides tópicos y orales | Manos limpias al mes |
| 6 | 65/F | Actividades del hogar | 13 | Níquel, paladio + | Corticoides tópicos, acitretino, PUVA tópico | Manos casi limpias al mes y medio |
| 7 | 70/F | Actividades del hogar | 5 | Negativas | Corticoides tópicos | Manos limpias al mes y medio |
| 8 | 44/M | Hostelería | 7 | Parafenilendiamina, tiomersal, quaternium ++ | Corticoides tópicos, acitretino, metotrexato | Manos casi limpias al mes y medio |
| 9 | 56/F | Actividades del hogar | 30 | Cobalto, níquel, tiomersal ++ | Corticoides tópicos, inmunomoduladores tópicos | Manos casi limpias al mes y medio |
| 10 | 51/M | Cerrajería | 10 | Textil:negativas dimetilfumarato, mezcla de parabenos ++ | Corticoides tópicos y orales | Manos casi limpias al mes y medio |
| 11 | 60/M | Artes gráficas | 3 | Negativas | Corticoides tópicos y orales | Manos limpias al mes y medio |
| 12 | 38/M | Mecánico | 2 | Dicromato de potasio++ | Corticoides tópicos y orales | No respuesta |
| 13 | 37/M | Fontanero | 2 | Negativas | Corticoides e inmunomoduladores tópicos | Mejoría importante al mes |
| 14 | 40/M | Cerrajería | 3 | Negativas | Corticoides e inmunomoduladores tópicos | Manos casi limpias al mes |
| 15 | 35/F | Administrativa | 2 | Níquel + | Corticoides e inmunomoduladores tópicos | Manos limpias a los 15 días |
F: femenino; M: masculino.
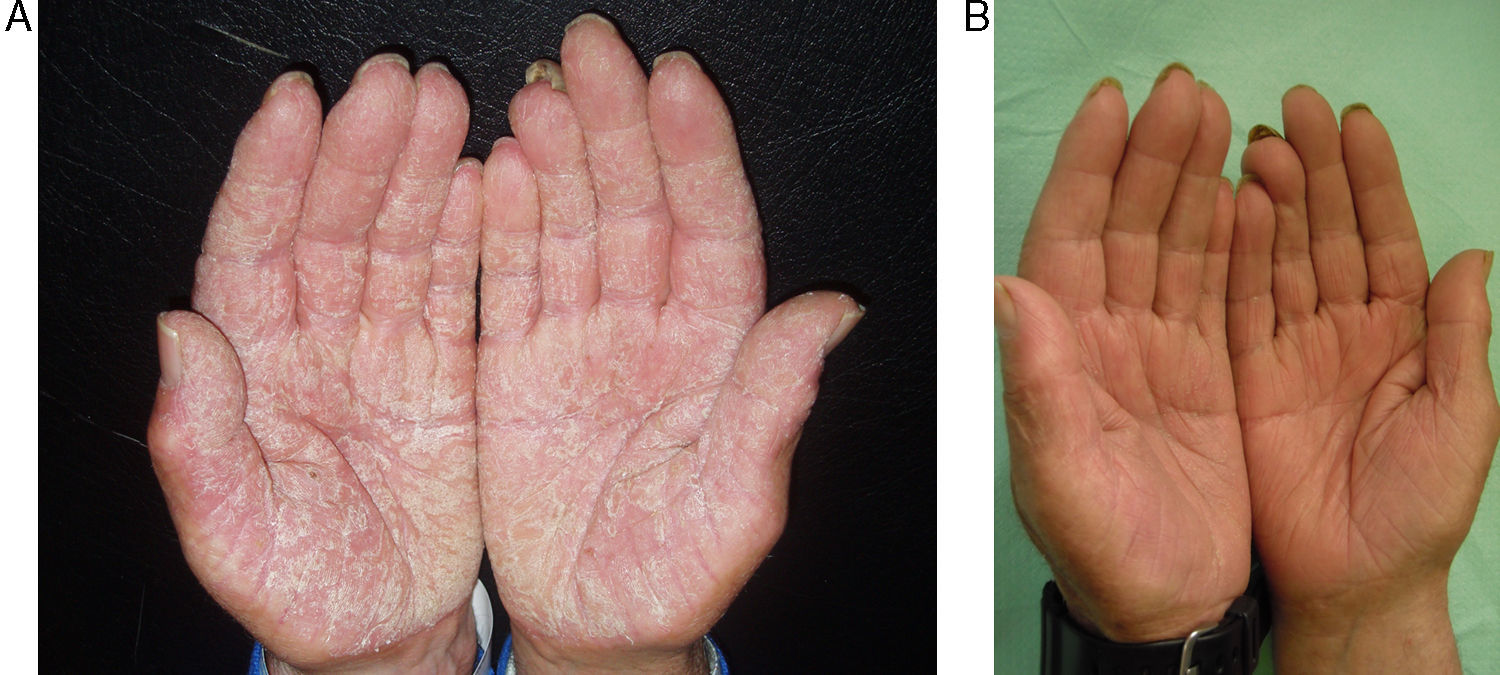
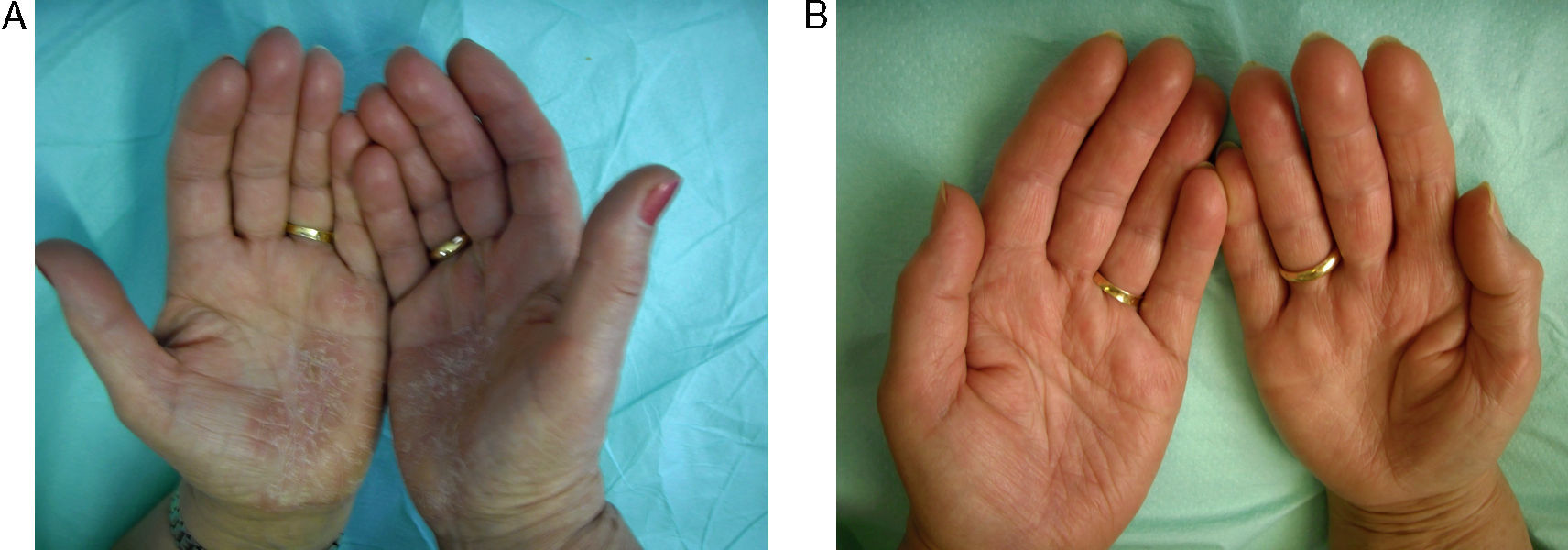
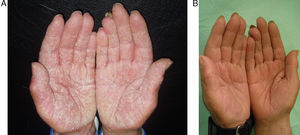
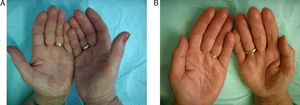
Los efectos colaterales más frecuentes fueron aumento leve de colesterol (40%), seguido de cefalea (13%), aumento leve de transaminasas (7%) y epigastralgia (7%). Un paciente (7%) presentó una disminución importante de la hormona estimulante de tiroides (TSH) (tabla 3). En las figuras 2 y 3 pueden verse ejemplos de pacientes tratados con alitretinoína oral con muy buena respuesta.
Desde el año 1999 un total de 1.635 pacientes con ECM y 364 voluntarios sanos han sido tratados con alitretinoína en los ensayos clínicos realizados hasta la fecha con, en su conjunto, buenos resultados, tal y como comprobaremos en la presente serie18,19.
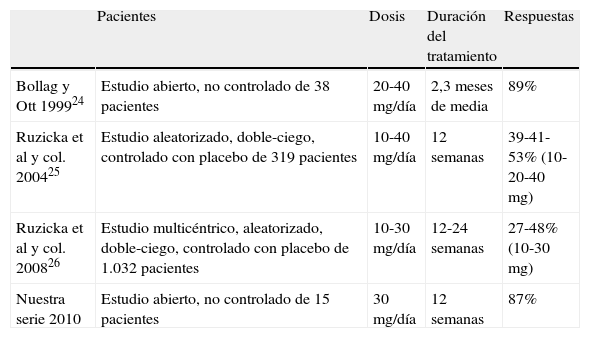
Nuestra experiencia con alitretinoína ha sido satisfactoria, con tasas de buena respuesta de hasta el 87% (reducción media de hasta el 75% de los signos y síntomas iniciales de la enfermedad), destacando que el 47% (7 casos) alcanzaron la respuesta definida como «manos limpias» al finalizar el tratamiento. Estos resultados, si bien son coherentes con los aportados por series limitadas, resultan superiores a los obtenidos en dos grandes estudios controlados, publicados previamente17–19. Estas diferencias en cuanto a tasas de eficacia se deberían al pequeño número de pacientes incluidos en nuestra serie, más acorde al estudio de Bollag y Ott17.
En la tabla 4 se resumen los resultados de los principales estudios publicados, comparándolos con los datos obtenidos en nuestro trabajo, indicando tasas de respuesta del 27 al 89%, dependiendo de la dosis y la duración del tratamiento. Sólo un paciente no respondió al tratamiento en nuestra serie (7%), de forma similar a lo observado en el estudio señalado anteriormente de Bollag y Ott, en el que un total del 5,5% de los pacientes no respondió al tratamiento17.
Resultados de los principales estudios clínicos publicados de alitretinoína oral para el ECM refractario a corticoides tópicos en comparación con nuestros datos
| Pacientes | Dosis | Duración del tratamiento | Respuestas | |
| Bollag y Ott 199924 | Estudio abierto, no controlado de 38 pacientes | 20-40 mg/día | 2,3 meses de media | 89% |
| Ruzicka et al y col. 200425 | Estudio aleatorizado, doble-ciego, controlado con placebo de 319 pacientes | 10-40 mg/día | 12 semanas | 39-41-53% (10-20-40 mg) |
| Ruzicka et al y col. 200826 | Estudio multicéntrico, aleatorizado, doble-ciego, controlado con placebo de 1.032 pacientes | 10-30 mg/día | 12-24 semanas | 27-48% (10-30 mg) |
| Nuestra serie 2010 | Estudio abierto, no controlado de 15 pacientes | 30 mg/día | 12 semanas | 87% |
En relación con el tiempo medio de respuesta desde el inicio del tratamiento, nuestro estudio arroja datos interesantes debido a la rapidez de acción, siendo de tan sólo 40 días, cerca de la mitad del tiempo con respecto a estudios previos19.
En cuanto a los efectos adversos, estos fueron similares a los publicados en los estudios anteriores con cefalea, hiperlipemia, epigastralgias, aumentos leves de transaminasas, sin requerir tratamientos específicos para estos eventos. Únicamente un paciente presentó disminución importante de la TSH, que se regularizó en los controles siguientes sin disminución de la dosis de alitretinoína. No hemos observado ninguna alteración mucocutánea durante el tratamiento. Ninguno de los efectos adversos requirió la suspensión del tratamiento, a diferencia de los estudios publicados, en los que la principal causa de retirada del paciente del ensayo se debía a cefalea importante18,19.
En relación con la eficacia mantenida a largo plazo, el 46% de nuestros pacientes no presentó recaída después de 6 meses de seguimiento. Estos resultados son algo inferiores a los informados en estudios previos, en los que hasta un 65% de los pacientes mantienen su buena respuesta a los 6 meses de seguimiento19. Como dato interesante cabe destacar además que dos pacientes de nuestra serie, que habían alcanzado el estado de «manos limpias» durante el tratamiento, sufrieron un rebrote de la enfermedad en el transcurso de los tres meses del tratamiento, que se atribuyó a cambios estacionales que, sin embargo, no condicionó el resultado final de buena respuesta de estos pacientes.
La principal limitación de nuestro estudio es el tamaño de la muestra y no contar con grupo de control, por lo que estas pequeñas diferencias en cuanto a tasas de respuesta, tiempo medio de respuesta y eficacia mantenida a largo plazo con respecto a los grandes estudios publicados previamente, podrían justificarse por este dato. Se carece además de otros estudios publicados en nuestro medio con los cuales comparar nuestros resultados. Sin embargo, nuestros datos son coherentes en mostrar la eficacia de alitretinoína a corto plazo, con aceptable duración de eficacia a largo plazo, aun suspendido el tratamiento.
También habría sido interesante comparar qué tipo de eczema es el que mejor responde, debido a que en varios estudios se informa de que el que presenta mejor respuesta es la variante hiperqueratósica. Esta consideración no fue posible en nuestro estudio, teniendo en cuenta el limitado número de pacientes.
Un estudio reciente20 informa además de que se puede realizar un segundo ciclo de tratamiento con alitretinoína 30mg/día con respuesta de hasta el 80% en los pacientes retratados con buena tolerancia. Cabe señalar que hasta el momento contamos con tres pacientes que tuvieron buena respuesta a alitretinoína oral en un primer ciclo, con posterior recaída y buena respuesta a un segundo ciclo de tratamiento.
Finalmente, en otro estudio realizado recientemente en Suiza21, que compara la relación coste-eficacia del tratamiento con alitretinoína frente a medidas de soporte en pacientes con ECM refractario, los autores encuentran tasas de respuesta tres veces superiores en el primer grupo, concluyendo que la terapia con alitretinoína es una alternativa coste-efectiva.
En julio de 2008 la Agencia Europea de Medicamentos aprobó la comercialización de alitretinoína oral en varios países europeos para su uso en ECM severo que no responde al tratamiento con corticoides tópicos potentes22,23. En España, a partir del año 2009, la Agencia Española de Medicamentos y productos sanitarios permitió la prescripción sólo como medicamento de uso compasivo para esta misma indicación.
ConclusionesEn nuestra experiencia, y en concordancia con los últimos estudios publicados, alitretinoína oral es un medicamento eficaz y seguro en pacientes con ECM refractario al tratamiento con corticoides tópicos potentes, siendo además un medicamento bien tolerado, con inicio de acción rápido y efectos colaterales leves, por lo que se perfila como una alternativa terapéutica de interés en estos pacientes. Sin embargo, la recaída ocurre en el margen de los 6 meses después de suspender el tratamiento en la mayoría de los casos, circunstancia que obligaría a plantear pautas de retratamiento no establecidas en la actualidad.
Esperamos que nuestros datos sirvan como base para la realización de estudios más amplios en nuestro medio, incluyendo trabajos de coste/eficacia que favorezcan una mayor disponibilidad del fármaco en beneficio de nuestros pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.