El melanoma cutáneo (MC) es el tumor cutáneo que más muertes provoca, con un aumento importante de la incidencia y la mortalidad en las últimas décadas, especialmente en el paciente anciano. Existen evidencias del diferente comportamiento biológico, así como de las diferencias en el manejo del MC en este subgrupo de pacientes con respecto al resto de otras franjas de edad, evidentemente condicionadas por unas limitadas expectativas de supervivencia y calidad de vida ajenas al melanoma y una elevada incidencia de comorbilidades. El presente artículo revisa los datos actuales más relevantes de la epidemiología, etiopatogenia e inmunología, clínica, prevención y manejo del MC en el anciano.
Cutaneous melanoma (CM) causes more deaths than any other skin tumor, and incidence and mortality rates have risen in recent years, especially in patients of advanced age. There are differences in the biological behavior of CM tumors in the elderly as well as differential management of the disease, evidently influenced by such factors as limited life expectancy, the high incidence of concomitant conditions in older patients, and issues of quality of life unrelated to CM itself. We review relevant current literature on the epidemiology, etiology, pathogenesis, and immunology of CM as well as research on the clinical features, prevention, and management of these tumors in the elderly.
La población en nuestro medio, al igual que en todo el mundo occidental, muestra una tendencia al envejecimiento. La edad avanzada se ha asociado con una mayor incidencia de melanoma y una mayor mortalidad relacionada1. Por lo tanto, mejorar la evaluación y el tratamiento del melanoma en los pacientes ancianos es imprescindible2. El MC presenta un comportamiento biológico diferente en el anciano, lo que potencialmente puede condicionar diferencias en el manejo y el tratamiento en este grupo, en el que existe una limitación natural de la esperanza y calidad de vida por causas ajenas al melanoma y una alta incidencia de comorbilidades. Esta revisión se centra en los aspectos más relevantes de la epidemiología, etiopatogenia y sistema inmunitario, clínica, manejo quirúrgico y tratamiento sistémico del MC en el anciano.
Material y métodoPara la revisión bibliográfica se realizó una búsqueda en Pubmed, EMBASE y Google Académico. La estrategia utilizada fue («elderly» OR «older age» OR «aged» OR «aged 80 and over») AND «cutaneous melanoma», añadiendo diferentes términos en función del subapartado estudiado (anexo, tabla 1 suplementaria). Se revisaron, además, las referencias de los artículos elegidos para identificar artículos relevantes.
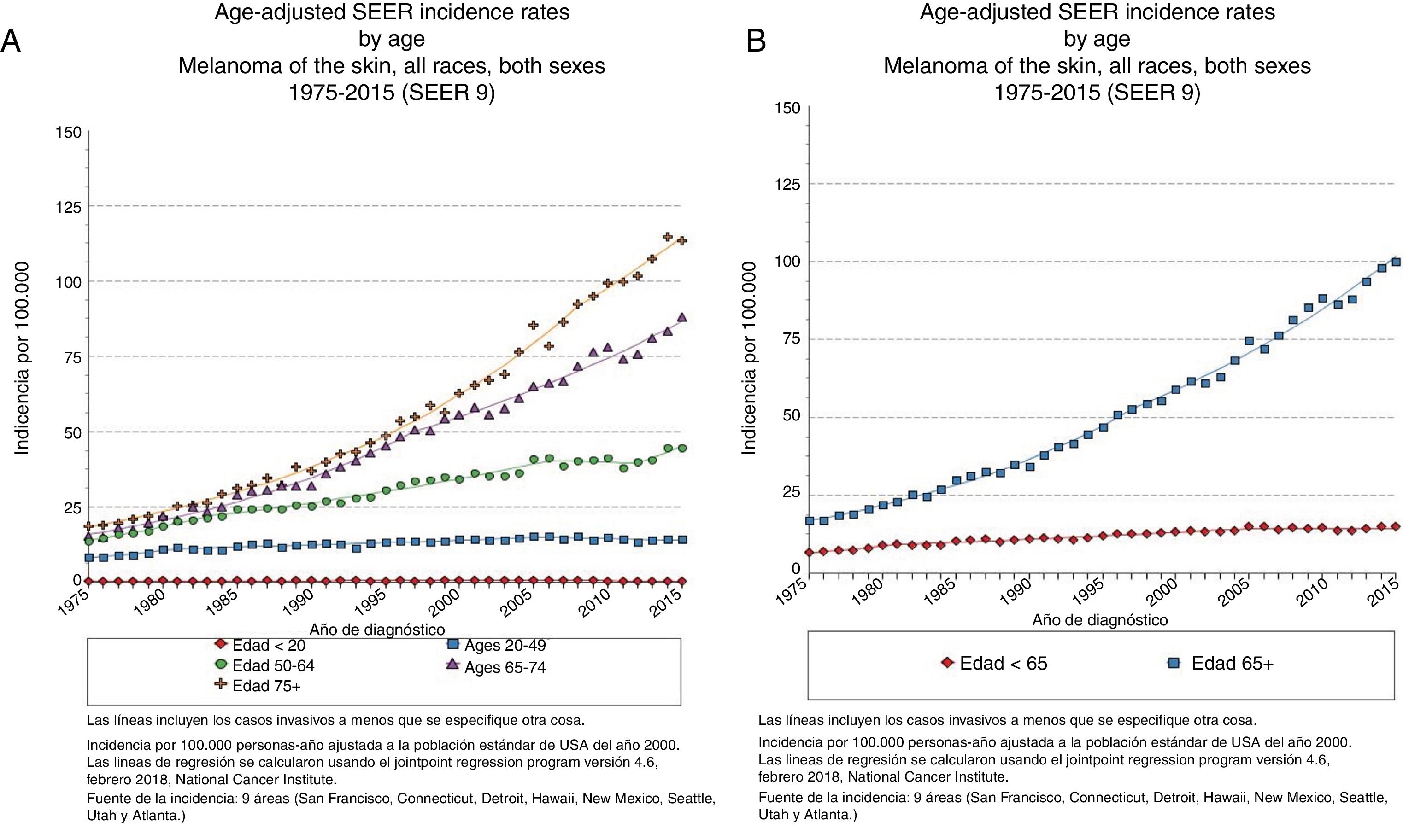
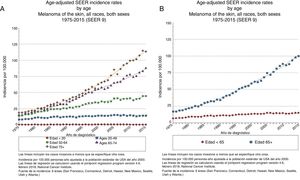
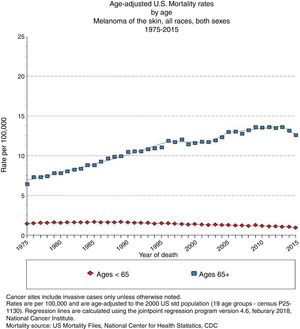
EpidemiologíaEdad avanzada y frecuencia del melanomaEl registro epidemiológico más amplio que existe —Programa de Vigilancia, Seguimiento y Resultados Finales de Estados Unidos (National Cancer Institute's Surveillance, Epidemiology and End Results [SEER])— registró en 2015 una incidencia de melanoma de 14,4 casos/100.000 habitantes para los menores de 65 años y de 101,7/100.000 habitantes para los mayores de 65 años, alcanzando los 114,7 casos/100.000 habitantes para los mayores de 75 años3 (fig. 1) y con un incremento porcentual anual más rápido para los varones de más de 65 años4.
En España, un reciente metaanálisis de Tejera-Vaquerizo et al.5 describe una tasa de incidencia global cruda de 8,82 (IC del 95%: 7,59-10,04)/100.000 personas-año, con diferencias entre los estudios realizados hace varias décadas (3-4/100.000 personas-año) y los realizados a partir de los años 90, con tasas por encima de 7/100.000 personas-año y que refleja el posible aumento de la incidencia de melanoma.
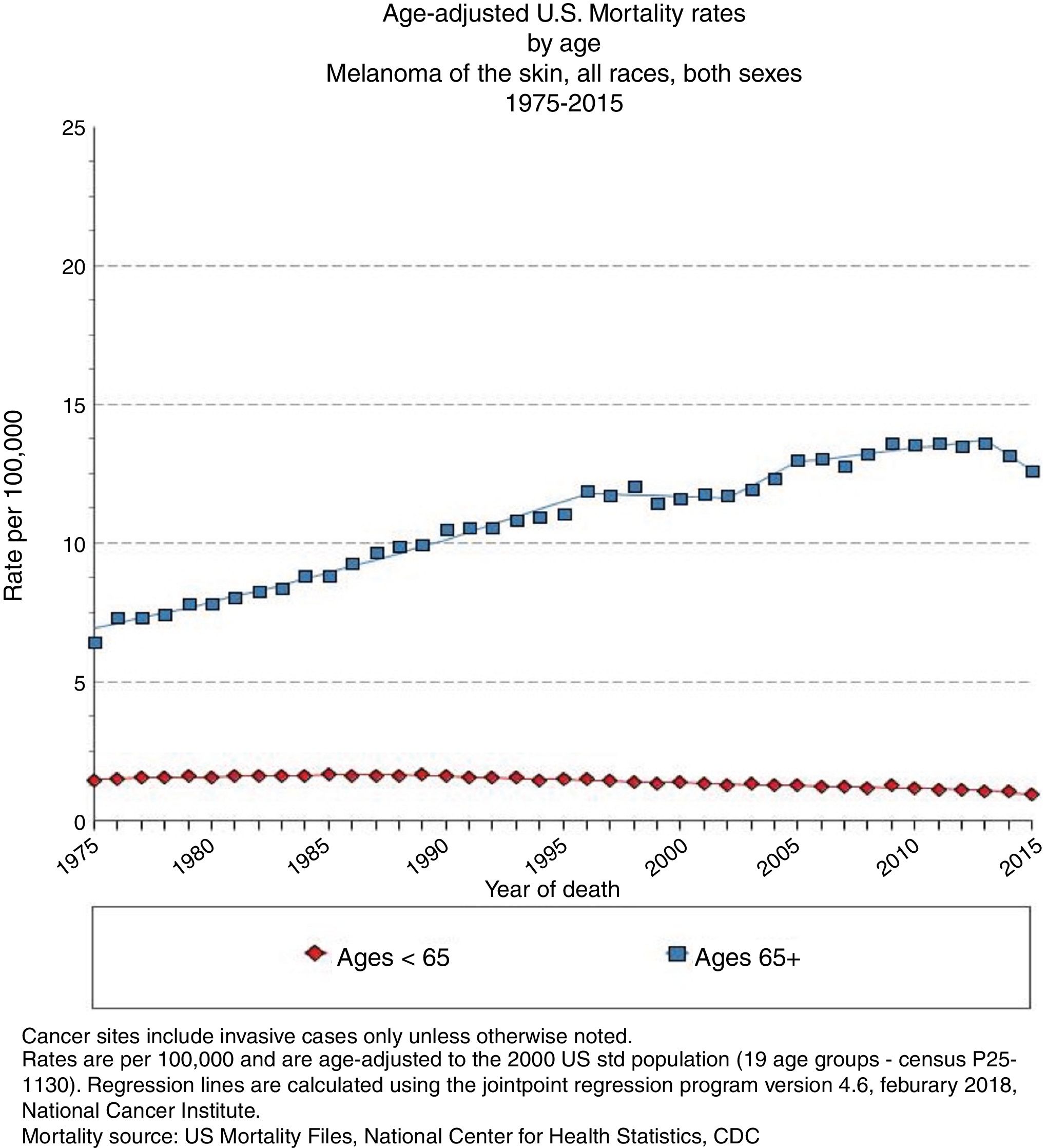
Edad avanzada y pronóstico del melanomaLos pacientes ancianos tienen más posibilidades de fallecer por melanoma que los jóvenes6, con un incremento anual del 1,7%4 (fig. 2). Pese a que los melanomas en el anciano suponen el 40% de los melanomas diagnosticados, acaban provocando el 60,2% de las muertes por la enfermedad7.
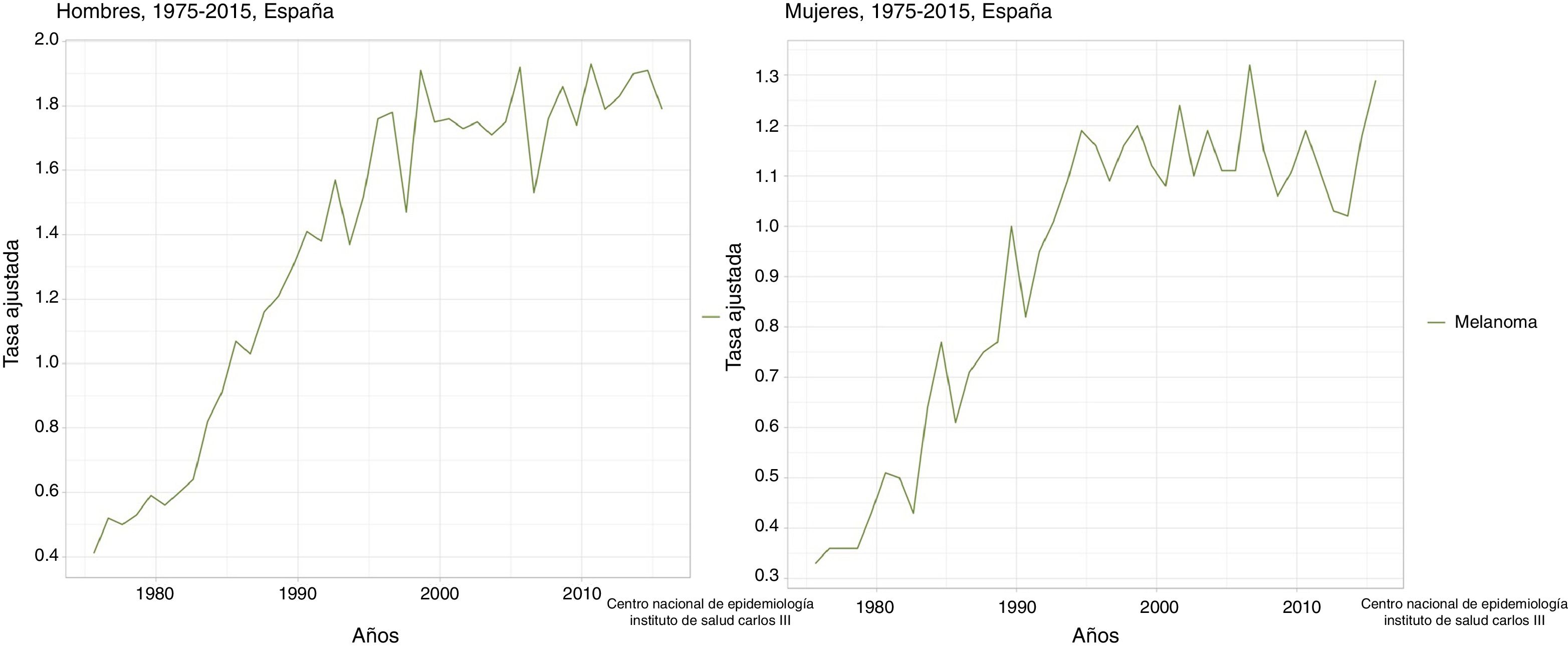
En España se dispone del Servidor Interactivo de Información Epidemiológica ARIADNA, dependiente del Instituto de Salud Carlos III8, donde se puede observar un aumento de la mortalidad para el melanoma en hombres y mujeres, tanto en la tasa bruta como en la ajustada a la población mundial9 (fig. 3).
Los datos del SEER sugieren que la incidencia de melanoma grueso es significativamente mayor en pacientes mayores de 60 años y que su mortalidad es más alta que en otros grupos de edad. El grupo de edad con mayor porcentaje de muerte por melanoma es el que comprende a los pacientes entre 75 y 84 años10. Un estudio que analizó 3 cohortes diferentes —incluyendo la del SEER— con más de 300.000 pacientes, determinó que la edad predice una peor supervivencia específica de melanoma (SEM)11.
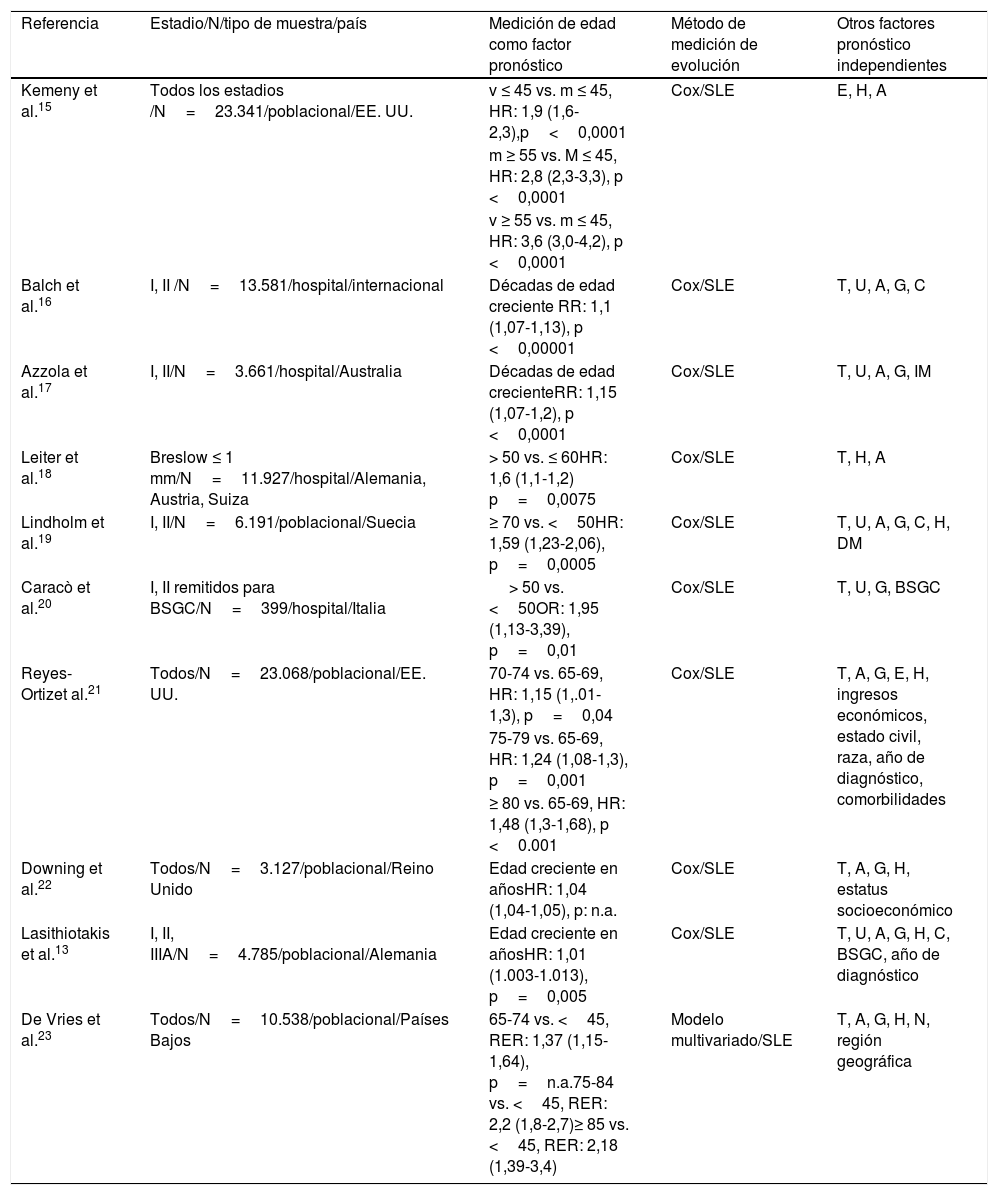
En un estudio multicéntrico12, que analizó a más de 7.000 pacientes con MC, se identificó la edad como un factor pronóstico independiente en pacientes con estadio i-iii. Se vio que en los pacientes de edad avanzada el melanoma se localizaba más frecuentemente en la cabeza y el cuello, y tenía un mayor grosor, índice mitótico y tasa de ulceración. En pacientes con afectación ganglionar regional (estadio iii), la edad seguía siendo un factor pronóstico importante cuando se incluían variables como el número de ganglios centinela positivos, la carga tumoral y la ulceración del tumor primario. Además, se observó una disminución progresiva de la supervivencia global a 5 años con la edad, de tal forma que los pacientes en la 7.ª década de la vida tenían una supervivencia un 20% mayor que a partir de la 9.ª década.
En un estudio retrospectivo13 de 4.785 pacientes se demostró que la edad creciente y el sexo masculino se asociaban con un mayor grosor tumoral y ulceración. La SEM a 10 años era un 10% menor a partir de los 65 años. El hecho de que la edad avanzada se mantuviese como un factor independiente de mal pronóstico tras ajustar por las características histológicas del tumor, el nivel socioeconómico y la comorbilidad sugiere que las diferencias observadas en la supervivencia global no solo dependen de un retraso en el diagnóstico (tabla 1)14.
Estudios con análisis multivariante que incluyen la edad como factor pronóstico en el melanoma cutáneo
| Referencia | Estadio/N/tipo de muestra/país | Medición de edad como factor pronóstico | Método de medición de evolución | Otros factores pronóstico independientes |
| Kemeny et al.15 | Todos los estadios /N=23.341/poblacional/EE. UU. | v ≤ 45 vs. m ≤ 45, HR: 1,9 (1,6-2,3),p<0,0001 | Cox/SLE | E, H, A |
| m ≥ 55 vs. M ≤ 45, HR: 2,8 (2,3-3,3), p <0,0001 | ||||
| v ≥ 55 vs. m ≤ 45, HR: 3,6 (3,0-4,2), p <0,0001 | ||||
| Balch et al.16 | I, II /N=13.581/hospital/internacional | Décadas de edad creciente RR: 1,1 (1,07-1,13), p <0,00001 | Cox/SLE | T, U, A, G, C |
| Azzola et al.17 | I, II/N=3.661/hospital/Australia | Décadas de edad crecienteRR: 1,15 (1,07-1,2), p <0,0001 | Cox/SLE | T, U, A, G, IM |
| Leiter et al.18 | Breslow ≤ 1 mm/N=11.927/hospital/Alemania, Austria, Suiza | > 50 vs. ≤ 60HR: 1,6 (1,1-1,2) p=0,0075 | Cox/SLE | T, H, A |
| Lindholm et al.19 | I, II/N=6.191/poblacional/Suecia | ≥ 70 vs. <50HR: 1,59 (1,23-2,06), p=0,0005 | Cox/SLE | T, U, A, G, C, H, DM |
| Caracò et al.20 | I, II remitidos para BSGC/N=399/hospital/Italia | > 50 vs. <50OR: 1,95 (1,13-3,39), p=0,01 | Cox/SLE | T, U, G, BSGC |
| Reyes-Ortizet al.21 | Todos/N=23.068/poblacional/EE. UU. | 70-74 vs. 65-69, HR: 1,15 (1,.01-1,3), p=0,04 | Cox/SLE | T, A, G, E, H, ingresos económicos, estado civil, raza, año de diagnóstico, comorbilidades |
| 75-79 vs. 65-69, HR: 1,24 (1,08-1,3), p=0,001 | ||||
| ≥ 80 vs. 65-69, HR: 1,48 (1,3-1,68), p <0.001 | ||||
| Downing et al.22 | Todos/N=3.127/poblacional/Reino Unido | Edad creciente en añosHR: 1,04 (1,04-1,05), p: n.a. | Cox/SLE | T, A, G, H, estatus socioeconómico |
| Lasithiotakis et al.13 | I, II, IIIA/N=4.785/poblacional/Alemania | Edad creciente en añosHR: 1,01 (1.003-1.013), p=0,005 | Cox/SLE | T, U, A, G, H, C, BSGC, año de diagnóstico |
| De Vries et al.23 | Todos/N=10.538/poblacional/Países Bajos | 65-74 vs. <45, RER: 1,37 (1,15-1,64), p=n.a.75-84 vs. <45, RER: 2,2 (1,8-2,7)≥ 85 vs. <45, RER: 2,18 (1,39-3,4) | Modelo multivariado/SLE | T, A, G, H, N, región geográfica |
A: localización anatómica; BSGC: biopsia selectiva de ganglio centinela; C: nivel de Clark; Cox: análisis de riesgos proporcionales de supervivencia de Cox; E: estadio; G: sexo; H: subtipo histológico; HR: cociente de riesgos (intervalo de confianza del 95%); RR: riesgo relativo; m: mujeres; M: presencia de metástasis a distancia; N: presencia de metástasis ganglionares; n.a.: no disponible; RER: exceso relativo en supervivencia (intervalo de confianza del 95%); SLE: supervivencia libre de enfermedad; T: índice de Breslow tumoral; U: ulceración; v: varones.
Adaptado de Lasithiotakis et al.14.
Balch et al.16 observaron que los pacientes ancianos tienen menos frecuencia en la afectación del ganglio centinela aun con melanomas con un fenotipo más agresivo, fenómeno observable en otros estudios24-28. Se cree que la atrofia de los vasos linfáticos cutáneos podría contribuir a una disminución de la respuesta inmunitaria y explicaría esta baja tasa de positividad de la biopsia selectiva de ganglio centinela (BSGC)14. Conway et al.29 demostraron que la función linfática, evaluada por el tránsito y la captación de radiocoloides dentro del ganglio centinela, disminuye con la edad. Algunos autores concluyen que esa disfunción linfática condicionaría otros patrones de diseminación metastásica, con un predominio de diseminación por vía hematógena30.
Papel del sistema inmunitario en el paciente anciano con melanoma cutáneoCon la edad, la función del sistema inmunitario cambia, resultando en una respuesta diferente frente a infecciones y tumores, menor capacidad de defensa frente a las infecciones y tumores31,32. Los linfocitos infiltrantes de tumor (TIL) se consideran una variable de buen pronóstico relacionada con la respuesta inmunitaria del huésped. Weiss et al.11 observaron que la intensidad de los TIL en el tumor primario se correlacionó de forma positiva con la SEM y este efecto parece ser superior en los pacientes mayores de 45 años.
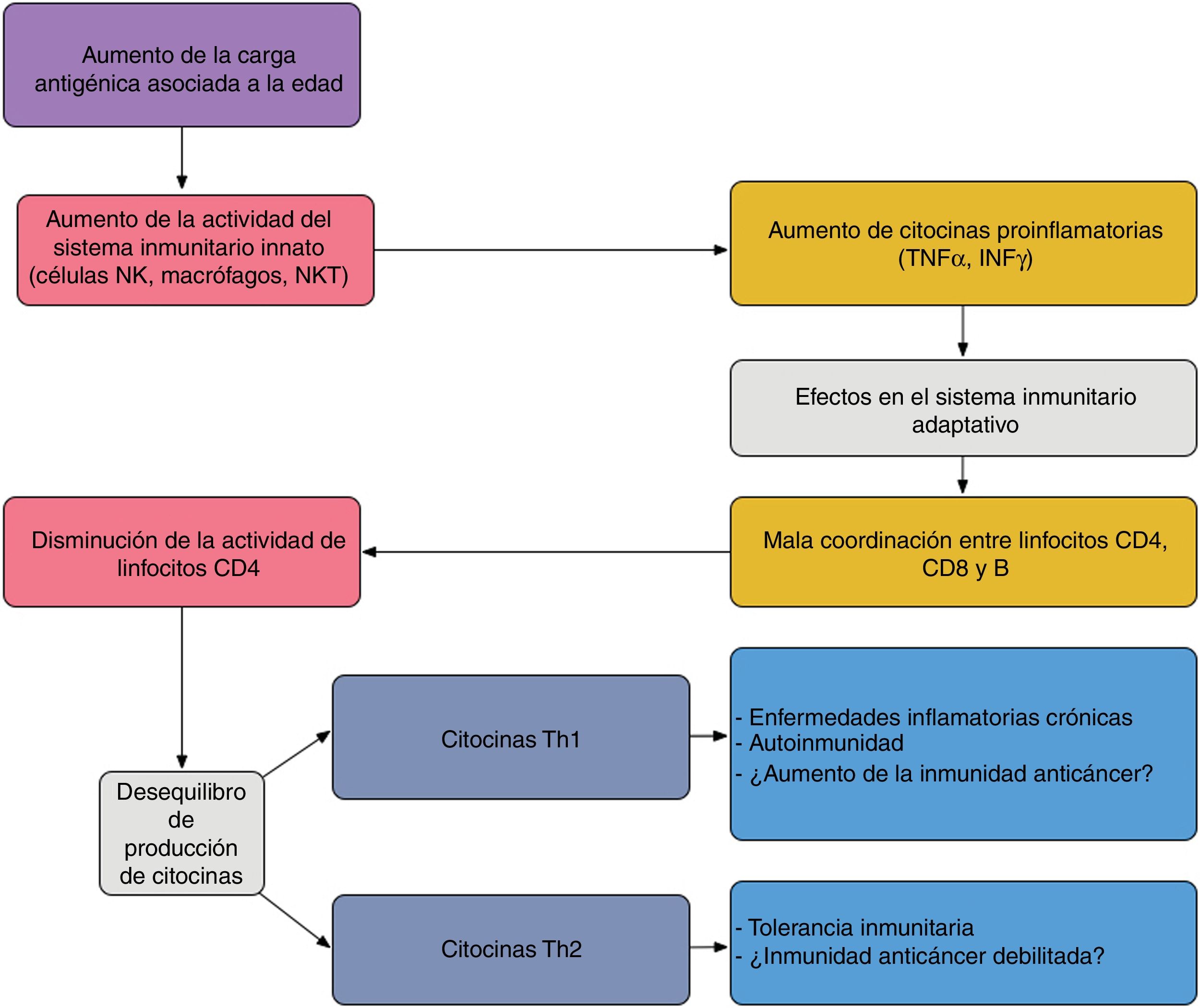
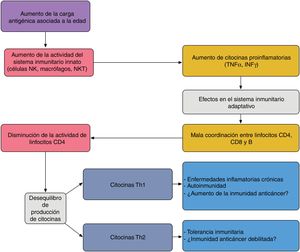
En el paciente anciano existe una serie de desequilibrios entre los componentes efector y regulador de la respuesta inmunitaria, lo que se conoce como inmunosenescencia32. Esta se produce debido la estimulación antigénica crónica a lo largo de la vida y al estrés oxidativo33. El aumento de linfocinas proinflamatorias debido a la estimulación antigénica crónica produce un aumento de respuesta Th1 y la muerte de células tumorales. Este efecto es amplificado cuando los antígenos tumorales se generan por muerte celular producida por quimioterapia (fig. 4).
Interacción propuesta entre el sistema inmunitario innato y adaptativo en el paciente anciano: el aumento de carga antigénica asociado a la edad produce una sobreestimulación del sistema innato aumentando las citocinas proinflamatorias, que afecta al sistema inmunitario adquirido, dando lugar a una pobre coordinación entre linfocitos CD4, CD8 y B, y un desequilibrio entre la producción de citocinas Th1 y Th2. La actividad de los linfocitos T citotóxicos bajo condiciones Th1 favorecen la autoinmunidad y las enfermedades inflamatorias crónicas; bajo Th2, la tolerancia inmunitaria.Adaptado de Hegde et al.33.
Pese a que se dan las mismas formas de presentación clínica de MC en el anciano que en pacientes más jóvenes, es frecuente que los melanomas en los ancianos se diagnostiquen en estadios más avanzados. Esto es explicable por múltiples factores.
Con respecto al subtipo histológico, el melanoma de extensión superficial es el más frecuente, pero existe una tendencia en los pacientes ancianos al diagnóstico de melanomas más gruesos y ulcerados que en los más jóvenes, debido a la mayor proporción del subtipo clinicopatológico nodular34,35.
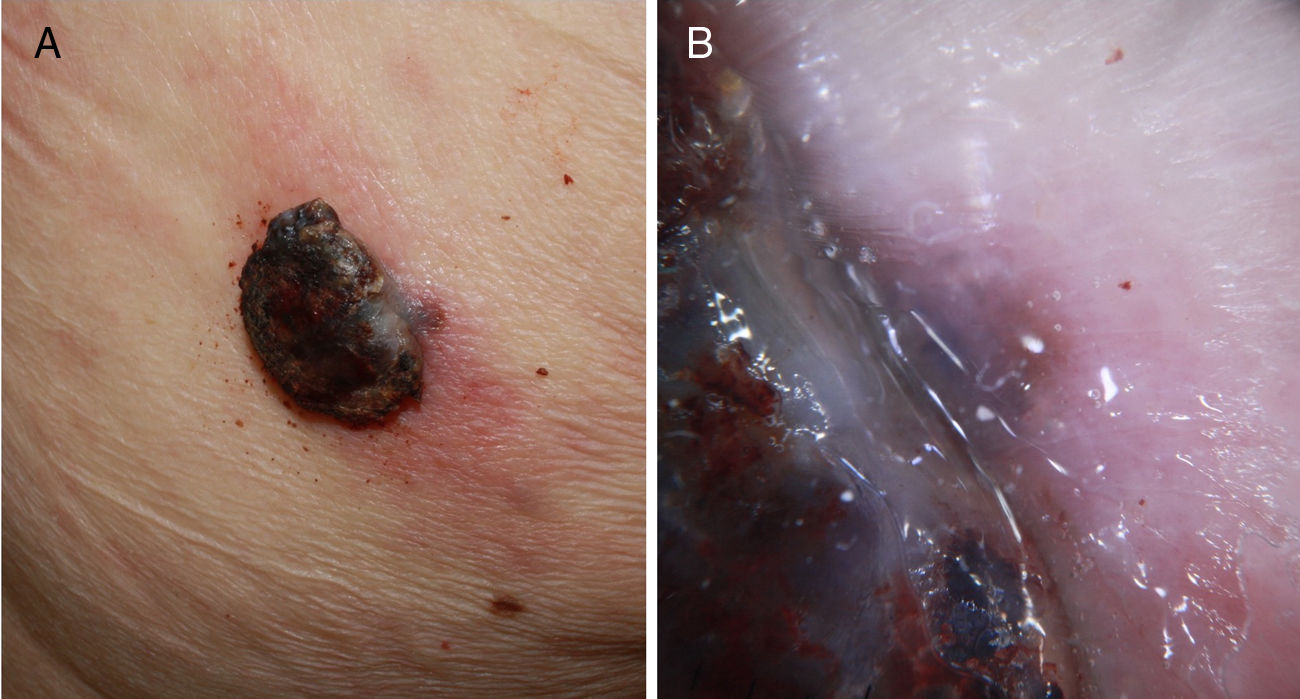
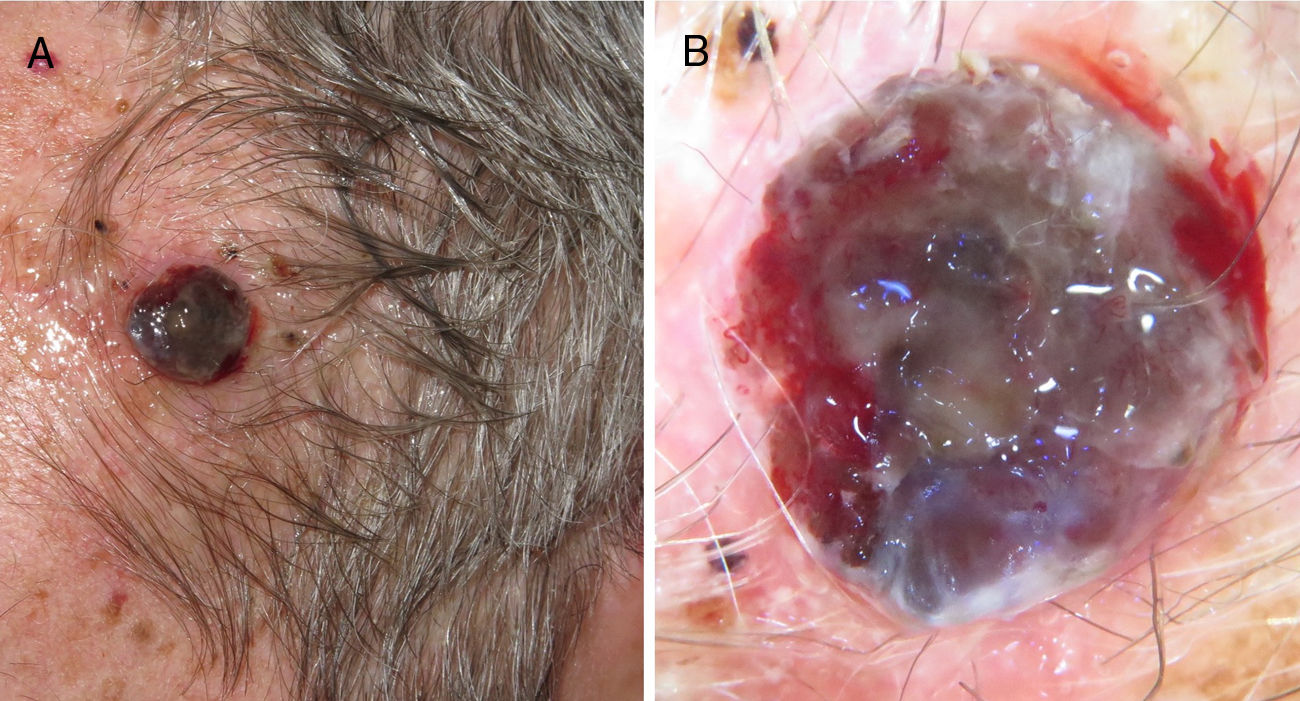
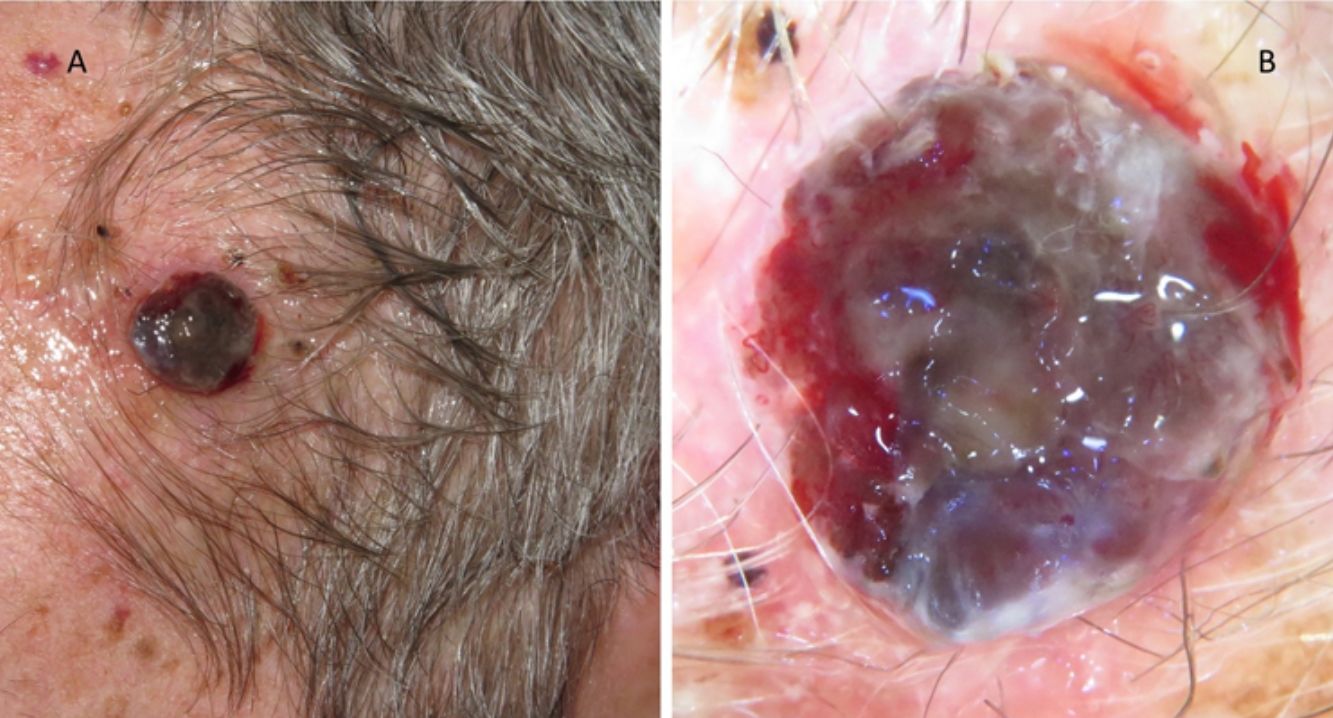
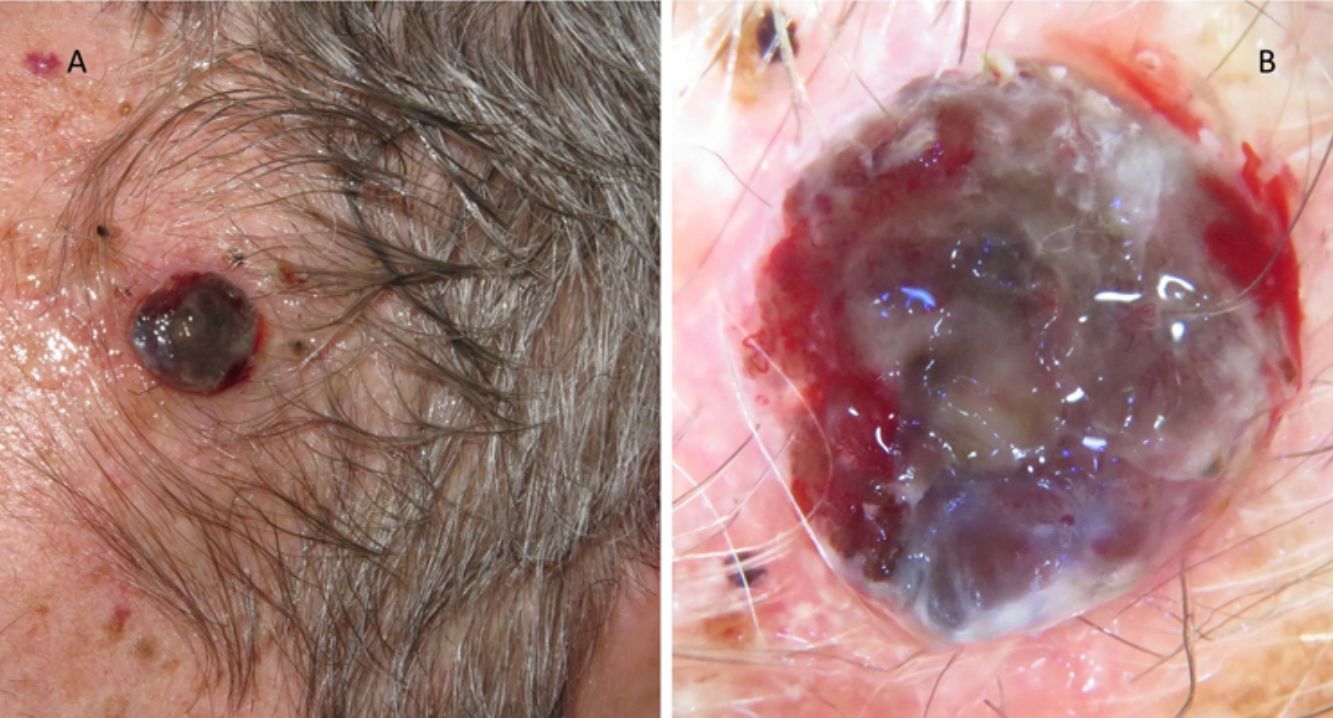
A esto se le añade que en los pacientes ancianos existe una mayor proporción de melanomas de rápido crecimiento36,37, muchos de ellos nodulares y amelanóticos38, lo que dificulta su diagnóstico precoz, ya que no suelen seguir los parámetros clásicos de descripción clínica de asimetría, bordes, color y diámetro (regla ABCD). Por ello, se aboga por añadir a esta clásica regla el término «E», para incluir el término inglés «evolving», que hace referencia no solo a la elevación de la lesión, sino a los cambios evolutivos en el seguimiento39. Otros autores propugnan añadir el acrónimo EFG34 (Elevado, Firme y Creciendo más de un mes [del inglés, «growing»]) para ayudar a identificar estas lesiones (figs. 5 y 6).
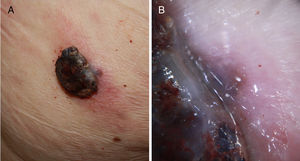
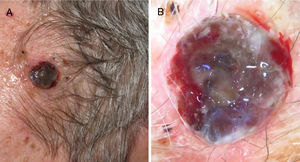
A) Melanoma nodular de rápido crecimiento en 3meses en la zona escapular derecha sobre una lesión plana previa de años de evolución. Mostró un índice de Breslow de 4mm, no ulcerado y presencia de 5 mitosis por mm2. Presencia de melanoma in situ perilesional en el estudio histopatológico. B) Detalle de la base de la lesión donde se observa pigmentación correspondiente al componente in situ de la lesión previa.
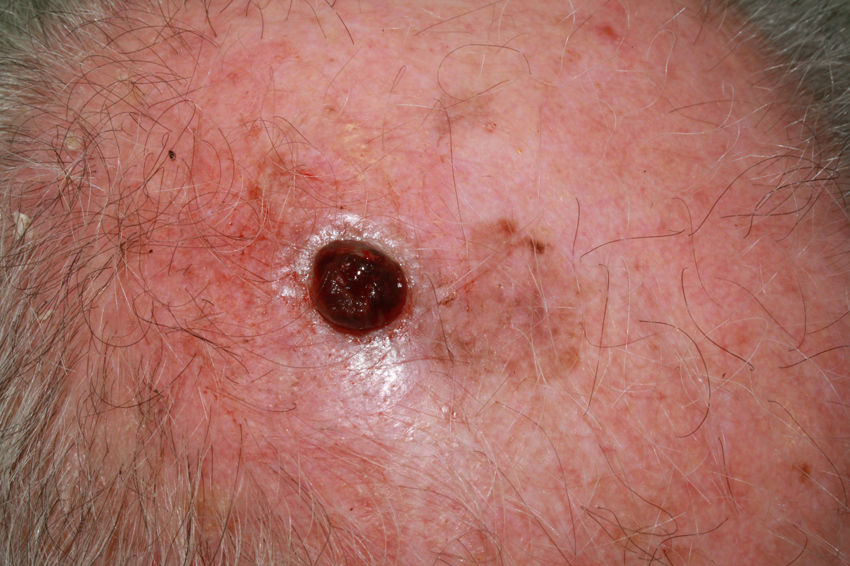
Clínicamente, en la dermatoscopia de estas lesiones nodulares se han descrito como típicos glóbulos y puntos periféricos múltiples o irregulares, velo azul-blanquecino, pigmentación azul homogénea, más de 5 colores y color negro40. Con frecuencia, estos melanomas son completamente amelanóticos clínicamente. Para ayudar en su diagnóstico, se ha descrito en la dermatoscopia una relación con la presencia de áreas rojas-lechosas y patrón vascular atípico, pero son criterios que a veces resultan insuficientes para realizar el diagnóstico de melanoma nodular amelanótico41 (fig. 7). La variante de rápido crecimiento parece que es más propensa a presentar estos hallazgos anteriores de forma conjunta42.
En el paciente anciano también es más frecuente el subtipo histológico melanoma sobre lentigo maligno, con una localización preferentemente en cabeza y cuello43. Entre los criterios dermatoscópicos descritos para su diagnóstico se encuentran la presencia de puntos grises, imagen en isobaras (círculo dentro de un círculo), estructuras romboidales pigmentadas, patrón en diana, oclusión folicular y áreas grises-blancas similares a cicatriz44. Las lesiones de lentigo maligno en mejillas serían más frecuentes en el sexo femenino y las localizadas en la nariz y el cuero cabelludo en el masculino. Pero la diferencia más notable con respecto a la edad sería que en los pacientes más ancianos la lesión de lentigo maligno estaría localizada en un área con lesiones de daño solar crónico, a diferencia de lo que sucede en personas más jóvenes, donde no se observa tanto daño cutáneo44.
Otra característica descrita recientemente es la baja frecuencia de asociación del melanoma con nevus, tanto comunes como atípicos45.
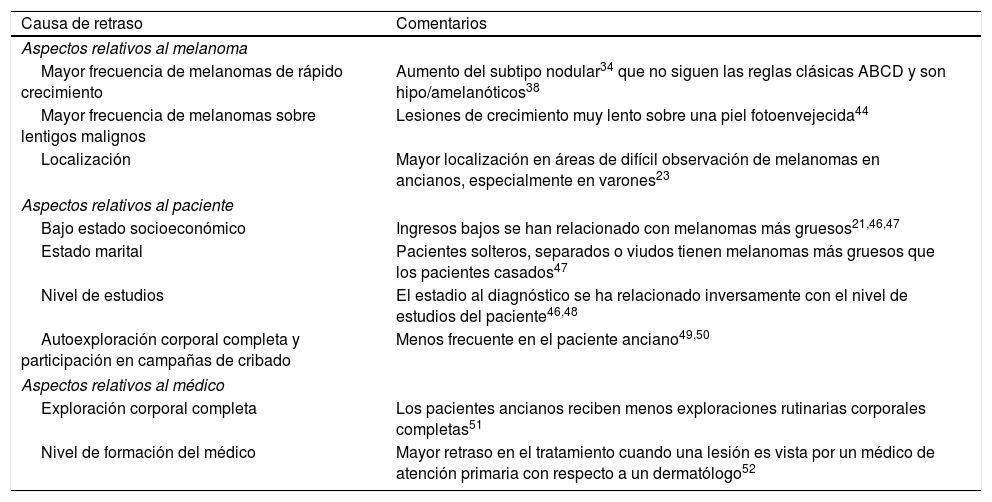
Posibles causas del retraso en el diagnóstico en los pacientes ancianosAdemás de las características clínicas fenotípicas del melanoma en el anciano que se han descrito previamente, existen otras posibles causas de retraso en el diagnóstico del melanoma (tabla 2) y que condicionan el aumento de grosor de los melanomas en el anciano.
Causas relacionadas con un retraso en el diagnóstico de melanoma en el anciano
| Causa de retraso | Comentarios |
| Aspectos relativos al melanoma | |
| Mayor frecuencia de melanomas de rápido crecimiento | Aumento del subtipo nodular34 que no siguen las reglas clásicas ABCD y son hipo/amelanóticos38 |
| Mayor frecuencia de melanomas sobre lentigos malignos | Lesiones de crecimiento muy lento sobre una piel fotoenvejecida44 |
| Localización | Mayor localización en áreas de difícil observación de melanomas en ancianos, especialmente en varones23 |
| Aspectos relativos al paciente | |
| Bajo estado socioeconómico | Ingresos bajos se han relacionado con melanomas más gruesos21,46,47 |
| Estado marital | Pacientes solteros, separados o viudos tienen melanomas más gruesos que los pacientes casados47 |
| Nivel de estudios | El estadio al diagnóstico se ha relacionado inversamente con el nivel de estudios del paciente46,48 |
| Autoexploración corporal completa y participación en campañas de cribado | Menos frecuente en el paciente anciano49,50 |
| Aspectos relativos al médico | |
| Exploración corporal completa | Los pacientes ancianos reciben menos exploraciones rutinarias corporales completas51 |
| Nivel de formación del médico | Mayor retraso en el tratamiento cuando una lesión es vista por un médico de atención primaria con respecto a un dermatólogo52 |
Adaptado de Lasithiotakis et al.14.
Con respecto a la localización, existen algunas características relevantes. Una de ellas es la localización del melanoma en áreas anatómicas poco visibles. De esta forma, en un estudio epidemiológico holandés se describió una mayor propensión de los melanomas en el tronco en varones de casi el doble con respecto a las mujeres, lo que puede contribuir a un mayor grosor23. También es más frecuente la localización en cuero cabelludo en este grupo de riesgo de hombres de edad avanzada, con las mismas características de fenotipo más agresivo53.
Existe una serie de factores demográficos relacionados con un mayor retraso en el diagnóstico. El hecho de percibir ingresos bajos en pacientes mayores se ha relacionado como factor independiente con el diagnóstico de melanomas más gruesos21,46,47,54.
El estado marital también ha sido relacionado con el grosor de los melanomas. De esta forma, los pacientes solteros, separados o viudos —con predominio en los varones— presentan melanomas más gruesos con respecto a los casados. Parece que la pareja contribuye al reconocimiento de lesiones sospechosas que de otra manera pasarían desapercibidas47.
Dentro de las causas que dependen del paciente, los ancianos son menos propensos a participar en las campañas de prevención50, así como a realizarse autoexploraciones de cuerpo entero49.
Por último, se han descrito causas de un posible retraso diagnóstico que dependen de la atención sanitaria recibida. Entre ellas existen datos contradictorios con respecto a la frecuencia de exploraciones de cuerpo entero por parte del médico de atención primaria. En algún trabajo se ha descrito que en los ancianos se realizan menos exploraciones de cuerpo entero que los más jóvenes51,54, mientras que en otro estudio sobre la población de Queensland no se objetivó esta diferencia. Es más, hasta un tercio de la población mayor de 50 años al menos había tenido una exploración parcial de su piel en el último año55.
Manejo quirúrgico locorregional del melanoma en el paciente ancianoTratamiento de la lesión primariaLa exéresis primaria del melanoma se considera un procedimiento de cirugía menor que se puede realizar generalmente bajo anestesia local56. Sin embargo, los pacientes ancianos muchas veces no son considerados candidatos a tratamiento quirúrgico, lo cual repercute en una menor tasa de exéresis de lesiones pigmentadas sospechosas e incumplimiento de las recomendaciones para el manejo del tumor6.
De esta forma, Marks et al.57 demostraron que la relación entre nevus y melanoma en las lesiones pigmentadas extirpadas era de 27:2 en los pacientes entre 21 y 40 años, y de 1:4 en los pacientes mayores de 60.
Existe, además, una mayor tendencia a realizar biopsia incisional en las lesiones pigmentadas de gran tamaño que se encuentran frecuentemente en ancianos, pero esta técnica dificulta el estudio histopatológico y debe ser evitada, excepto si —como para el resto de grupos de edad— el diagnóstico es dudoso y la biopsia escisional requiere una reconstrucción compleja58.
Por último, los pacientes ancianos tienen una mayor proporción de melanomas en cabeza y cuello59,60, que afectan a áreas funcional y estéticamente complejas, como la nariz y los párpados. La tendencia a reducir el margen quirúrgico, combinada con la dificultad de establecer los márgenes de las lesiones lentiginosas —más frecuentes a esta edad— conlleva una mayor proporción de resecciones peritumorales o con márgenes inadecuados14. Aunque este hecho puede no afectar la supervivencia global61, sí podría ser significativo para determinar el riesgo de recidiva local.
Al analizar más de 18.000 pacientes con melanoma recogidos en la SEER62, se vio que en los ≥ 65 años era más frecuente la exéresis con márgenes inadecuados (RR 1,37) que en los menores de 65, y esa diferencia era aun mayor para los de ≥ 75 años (RR 2,38). En un estudio retrospectivo63 realizado en Francia, en el que se valoraron las variaciones en el tratamiento de pacientes con melanoma en estadios i-iii, se observó que los factores asociados a la exéresis con márgenes inadecuados según las recomendaciones de las guías eran la edad> 60 años, el mayor grosor tumoral y la localización en cabeza y cuello. Esos 2últimos factores son, además, más frecuentes en pacientes ancianos.
Realización de la biopsia selectiva del ganglio centinelaEn cuanto a la realización de la BSGC, aunque en el estudio anterior63 la edad no influyó en su realización, hay otros estudios en los que sí se demuestra que se indica menos frecuentemente en pacientes con una edad ≥ 75 años59,64,65, independientemente de su comorbilidad.
Moreno-Ramírez et al.66 demostraron que el factor de decisión principal para la realización de la BSGC fue el índice de Breslow, de tal forma que el 71,6% de los pacientes con tumores de 1,01-4,00mm se sometieron a BSGC. En este grupo, el índice de Karnofsky y la edad fueron los factores de decisión más significativos en pacientes con tumores con un grosor superior a 4mm, la edad fue el determinante más relevante para la no indicación de la BSGC, realizándose en el 64,1% de los pacientes menores de 70 años y tan solo en el 8,7% de los mayores de 70 años.
Al contrario que para la exéresis del tumor primario, la BSGC puede requerir anestesia raquídea o general, por lo que, en esos casos, su realización debe quedar supeditada al riesgo anestésico. Ese riesgo puede calcularse con escalas generales de comorbilidad o con escalas más específicas, como el sistema de clasificación ASA (American Society of Anesthesiologists Physical Status System)67. Estos pacientes requieren un estudio preoperatorio (que incluya análisis con coagulación, radiografía simple de tórax y electrocardiograma), un adecuado conocimiento de su situación clínica general, función cardiorrespiratoria y de su medicación habitual, una planificación quirúrgica meticulosa, una monitorización intraoperatoria y un seguimiento posoperatorio correcto56,67. El ensayo clínico más importante sobre BSGC en melanoma —el Multicenter Selective Lymphadenectomy Trial-I (MSLT-I)— excluyó a los pacientes mayores de 75 años68; sin embargo, existen otros trabajos69 que demuestran el incuestionable valor pronóstico de esta prueba en ancianos y lo factible de su realización en pacientes con expectativa de vida razonable.
LinfadenectomíaTambién la linfadenectomía tras BSGC positiva (linfadenectomía completa inmediata [LCI]) se indica con menos frecuencia en los pacientes ancianos70,71. Además, la edad superior a 75 años ha sido identificada como un factor predictor de no cumplimiento de las recomendaciones en cuanto a la realización de LCI, con un número medio de ganglios linfáticos extraídos durante las disecciones inferior en los pacientes de edad más avanzada71.
Algunos autores consideran este menor intervencionismo en los pacientes de edad avanzada como una posible explicación de la mayor mortalidad observada en este grupo de edad1. Sin embargo, la menor frecuencia de metástasis en la BSGC y los resultados del ensayo Multicenter Selective Lymphadenectomy Trial-II (MSLT-II)72, en los que se demuestra una ausencia de beneficio de supervivencia en los pacientes con BSGC positiva y LCI (con respecto a la observación y disección ganglionar terapéutica una vez que el paciente desarrolla metástasis ganglionar identificable), estarían inicialmente en contra de la posible asociación entre infratratamiento y mortalidad. En cualquier caso, debe destacarse que el rango de edad establecido como criterio de inclusión en el MSLT-II fue desde los 18 a los 75 años. Aunque la consistencia de los resultados del ensayo hace pensar en la reproducibilidad de estos en la población de edad avanzada, continuamos sin evidencia de calidad en cuanto a la LCI en estos pacientes. Por otra parte, hubiera tenido el máximo interés para la toma de decisiones comprobar en los pacientes con edad avanzada la ventaja en el control regional observada en los pacientes tratados mediante LCI en el MSLT-II1.
Tratamiento de la enfermedad locorregional avanzada y metastásicaEnfermedad locorregional avanzadaEn cuanto a la administración de quimioterapia intraarterial con melfalán (± factor de necrosis tumoral alfa o actinomicina) en hipertermia mediante perfusión de miembro aislado, varios estudios73-76 demostraron que en pacientes ≥ 75 años tenía una eficacia similar en el tratamiento del MC localmente avanzado (lesiones irresecables, con metástasis en tránsito) que en pacientes más jóvenes. Además, no se acompañó de un aumento en la morbilidad perioperatoria y la mayoría fueron casos de toxicidad locorregional.
Tratamiento sistémicoLa población anciana tiene unas particularidades (mayor presencia de otras enfermedades, coexistencia de varios tratamientos farmacológicos con sus potenciales interacciones, posibilidad de deterioro cognitivo y del estado general del paciente) que hacen especialmente importante la valoración de la relación beneficio-riesgo de cada tratamiento77. Existe evidencia de que una evaluación geriátrica previa a un plan terapéutico oncológico puede ayudar a conseguir resultados más satisfactorios en cuanto a supervivencia, calidad de vida, estado funcional y riesgo de hospitalización de los pacientes ancianos con cáncer78.
Antes del año 2010, el tratamiento del melanoma metastásico se limitaba al tratamiento quimioterápico clásico con dacarbacina o a la utilización de interleucina-2 en altas dosis. Ambos tratamientos tenían una baja eficacia y una alta toxicidad que limitaban su uso en la población anciana14. En 2010 se publicaron los resultados de los primeros ensayos clínicos con vemurafenib e ipilimumab, con lo que el tratamiento del melanoma avanzado entraba en una nueva era. La información de su utilidad en población anciana proviene mayoritariamente del análisis por subgrupos de la esta población que participó en los ensayos clínicos, con las limitaciones que esto supone.
Terapia dianaLa utilidad clínica del tratamiento con inhibidores de BRAF (vemurafenib y dabrafenib) solos o, actualmente, en combinación con inhibidores de MEK (cobimetinb y trametinib), se limita a los melanomas portadores de mutación en la cinasa BRAF. Varios trabajos señalan como la frecuencia de aparición de mutaciones en BRAF se correlaciona inversamente con la edad79,80. En una cohorte australiana de más de 300 pacientes con melanoma metastásico, todos los pacientes menores de 30 años presentaban mutación en BRAF, mientras que solo el 25% de los mayores de 70 años la presentaba. Curiosamente, en la población anciana disminuye la proporción de la mutación más frecuente en BRAF, V600E, mientras que otras mutaciones de BRAF menos frecuentes, como BRAF, V600K, aumentan su frecuencia80.
Aunque la baja representación en los ensayos clínicos de los pacientes ancianos es un problema global de la oncología81, en los ensayos con terapia diana esta diminución en la frecuencia de la mutación en BRAF seguro que también contribuye a ello.
Actualmente, el régimen de terapia diana más utilizado es la combinación de un inhibidor de BRAF y uno de MEK, que ofrecen tanto una mayor efectividad como una limitación de los efectos adversos cutáneos. En los análisis por subgrupos etarios no se han evidenciado diferencias en la eficacia82,83.
En cuanto a la seguridad de estos tratamientos en la población anciana, parece ser que la frecuencia global de efectos adversos es similar a la de la población más joven. Sin embargo, los efectos adversos más graves (grado iii-iv), así como las posibilidades de tener que retirar el tratamiento, son mayores en la población senil84.
InmunoterapiaEl ipilimumab, un inhibidor de CTLA-4, que fue el primer tratamiento inmunoterápico aprobado para el melanoma metastásico. Con su uso se obtuvo una respuesta en el 10-15% de los pacientes85. Posteriormente, en 2015, aparecieron los fármacos anti-PD-1 (nivolumab y pembrolizumab), con un perfil de eficacia y seguridad mejores que ipilimumab. Con los fármacos anti-PD-1 en monoterapia se obtienen respuestas en el 33-40% de los casos86. La combinación de ipilimumab con un fármaco anti-PD-1 es la combinación más eficaz de tratamiento inmunoterápico, con una respuesta en el 61% de los pacientes. Sin embargo, esta combinación también es la que genera mayor toxicidad87.
Existe actualmente controversia sobre si la población anciana es especialmente sensible a la inmunoterapia. Si bien en algunos trabajos no se han encontrado diferencias entre la eficacia de la inmunoterapia en varios grupos etarios88, algunos otros sugieren una mayor respuesta, especialmente de los fármacos anti-PD1 en los ancianos. En un reciente estudio de cohortes retrospectivo, donde se revisa a todos los pacientes tratados con los nuevos fármacos inmunoterápicos del Hospital de Lyon89, encontraron que los pacientes mayores de 65 tuvieron una mayor supervivencia libre de enfermedad y supervivencia global respecto al grupo de pacientes menores de 65 años. Otro reciente trabajo multicéntrico encuentra que las posibilidades de progresar bajo el tratamiento con pembrolizumab disminuyen un 13% por cada década de vida del paciente al iniciar el tratamiento90. Los mecanismos que explicarían este posible beneficio aún no son bien comprendidos, pero se centrarían en el potencial de la inmunoterapia para revertir los cambios en el sistema inmunitario que se producen durante la vejez91.
Debido al particular mecanismo de acción de la inmunoterapia, los deterioros de la función de varios órganos, propios del envejecimiento, tienen menor relevancia. No existe, por ejemplo, contraindicación para el uso de la inmunoterapia en pacientes con insuficiencia renal o cardíaca. En cambio, resulta de vital importancia que los pacientes y sus cuidadores conozcan los potenciales efectos indeseables de la inmunoterapia, sobre todo aquellos como la astenia y las artralgias que podrían atribuirse también al envejecimiento. La mejor opción para minimizar la toxicidad de la inmunoterapia pasa por un diagnóstico y manejo precoz de sus efectos adversos. No parece que exista una mayor toxicidad de la inmunoterapia con la edad85,89,90.
En nuestro medio, el único tratamiento adyuvante aprobado para el melanoma de alto riesgo es el interferón alfa- 2b en altas dosis. Este tratamiento, debido a su importante perfil de toxicidad y a sus limitados beneficios, hace que no suela administrarse en la población anciana92.
Actualmente, se considera que el tratamiento de la enfermedad metastásica con terapia diana e inmunoterapia tiene un efecto comparable en pacientes ancianos en la supervivencia global, sin un incremento importante de la toxicidad en los pacientes ancianos93. No obstante, es necesario realizar estudios de práctica clínica real en pacientes ancianos tratados con estos nuevos fármacos, dada la exclusión de estos pacientes en los ensayos clínicos y la escasez de datos acerca de esta población cada vez más numerosa.
En la tabla 3 se recoge el nivel de evidencia para cada procedimiento terapéutico en el paciente con melanoma.
Estadificación y tratamiento del melanoma cutáneo en el anciano
| Intervención | Comentarios | Nivel de evidencia y grado de recomendación (USPSTF) |
| Exéresis primaria | Misma recomendación que en otros grupos de edadMLM requiere establecer adecuadamente márgenes de la lesión, idealmente mediante cirugía controlada al microscopio | III A |
| BSGC | Estadificación, no beneficio terapéutico.Tasa de positividad menor (¿menor sensibilidad, tasa de micrometástasis o diseminación linfática?)Valorar riesgo anestésico | II-2 B |
| Linfadenectomía | Morbilidad (linfedema, daño nervioso, complicaciones herida quirúrgica)No demostrado impacto en supervivencia.Tratamiento paliativo si metástasis ganglionar clínicamente relevante | III C |
| Tratamiento adyuvante | Poca información disponible sobre el riesgo-beneficio¿Respuesta favorable a inmunoterapia por desequilibrio del sistema inmunitario? | III I |
| Quimioterapia intraarterial en hipertermia mediante perfusión de miembro aislado | Valorar en melanoma localmente avanzado (irresecable, metástasis en tránsito) | III-2 B |
| Tratamiento del melanoma metastásico (inmunoterapia, terapia dirigida) | Misma aproximación terapéutica que en pacientes jóvenesValorar evaluación geriátrica previa | III B |
Niveles de evidencia (USPSTF): ii, al menos un ensayo clínico controlado y aleatorizado diseñado de forma apropiada; ii-1, ensayos clínicos controlados bien diseñados, pero no aleatorizados; ii-2: estudios de cohortes o de casos y controles bien diseñados, preferentemente multicéntricos; ii-3, múltiples series comparadas en el tiempo, con o sin intervención, y resultados sorprendentes en experiencias no controladas; iii, opiniones basadas en experiencias clínicas, estudios descriptivos, observaciones clínicas o informes de comités de expertos.
A: extremadamente recomendable (buena evidencia de que la medida es eficaz y los beneficios superan ampliamente a los perjuicios); B: recomendable (al menos moderada evidencia de que la medida es eficaz y los beneficios superan a los perjuicios); BSGC: biopsia selectiva de ganglio centinela; C: ni recomendable ni desaconsejable (al menos moderada evidencia de que la medida es eficaz, pero los beneficios son muy similares a los perjuicios y no puede justificarse una recomendación general); D: desaconsejable (al menos moderada evidencia de que la medida es ineficaz o de que los perjuicios superan a los beneficios); I: evidencia insuficiente, de mala calidad o contradictoria, y el balance entre beneficios y perjuicios no puede ser determinado; MLM: melanoma sobre lentigo maligno; USPSTF: United States Preventive Services Task Force.
Adaptado de Lasithiotakis et al.14.
Los autores declaran no tener ningún conflicto de intereses.