La fotoféresis extracorpórea (FEC) es una terapia inmunomoduladora indicada para la enfermedad injerto contra huésped (EICH) en adultos y niños, no obstante, existen pocos estudios en esta última población.
ObjetivoDescribir las características demográficas, la respuesta clínica, los efectos adversos y la evolución de los pacientes pediátricos con EICH aguda (EICH-a) y EICH crónica (EICH-c) tratados con FEC.
Materiales y métodosSe incluyeron todos los pacientes con EICH-a y EICH-c sometidos a tratamiento con FEC entre enero de 2012 y diciembre de 2018 en el Servicio de Dermatología del Hospital Italiano de Buenos Aires. Se utilizó el sistema UVAR-XTS™ en 2 pacientes y el CELLEX™ en el resto, con 2 sesiones por semana y reevaluación al mes en EICH-a, 2 sesiones cada 2 semanas con reevaluación a los 3 meses en EICH-c, y en ambos finalización según respuesta.
ResultadosEvaluamos 9 pacientes pediátricos con EICH refractaria, dependiente y/o resistente a corticoides sistémicos tratados con FEC. Siete pacientes fueron respondedores y 2 no respondedores. La piel presentó respuesta completa (RC) en 1/9 y respuesta parcial en 7/9 pacientes, el hígado, el sistema gastrointestinal y las mucosas presentaron RC en 3/5, 1/2 y 4/5 pacientes, respectivamente. Dos pacientes fallecieron durante el periodo estudiado.
ConclusiónLa FEC es una buena opción terapéutica para los pacientes pediátricos con EICH aguda y crónica.
Extracorporeal photopheresis (ECP) is an immunomodulatory therapy used to treat graft-vs-host disease (GVHD) in adults and children. Few studies have examined its use in children.
ObjectiveTo describe demographic characteristics, clinical response, adverse effects, and outcomes in a series of pediatric patients with acute or chronic GVHD treated with ECP.
Material and methodsWe included all pediatric patients with acute or chronic GVHD treated with ECP by the Dermatology Department of Hospital Italiano de Buenos Aires between January 2012 and December 2018. We used the UVAR-XTS™ system (2 patients) and the CELLEX system (7 patients). Patients with acute GVHD received 2 sessions a week and were reassessed at 1 month, while those with chronic GVHD received 2 sessions every 2 weeks and were reassessed at 3 months. Treatment duration in both scenarios varied according to response.
ResultsWe evaluated 9 pediatric patients with corticosteroid-refractory, -dependent, and/or -resistant GVHD treated with ECP. Seven responded to treatment and 2 did not. Response was complete in 1 of the 9 patients with skin involvement and partial in 7. Complete response rates for the other sites of involvement were 60% (3/5) for the liver, 50% (1/2) for the gastrointestinal system, and 80% (4/5) for mucous membranes. Two patients died during the study period.
ConclusionECP is a good treatment option for pediatric patients with acute or chronic GVHD.
La enfermedad injerto contra huésped (EICH) es una complicación grave y frecuente del trasplante alogénico de médula ósea (TAMO), y la principal causa de morbimortalidad en estos pacientes. Los órganos principalmente afectados son la piel, el hígado y el sistema gastrointestinal1.
Los tratamientos de primera línea son los corticoides y los inhibidores de la calcineurina. La fotoféresis extracorpórea (FEC) es una terapia inmunomoduladora indicada para la EICH aguda (EICH-a) y la EICH crónica (EICH-c) tanto para adultos como niños, y se considera un tratamiento de segunda línea en la EICH resistente, dependiente o intolerante a corticoides o inmunosupresores sistémicos. La FEC es muy bien tolerada en todos los grupos etarios, aunque la población pediátrica es más vulnerable a los cambios pequeños de volumen que la población adulta. Por ello, en los niños el volumen extracorpóreo, el acceso venoso, el peso (menor a 30kg) y el uso de anticoagulantes dentro del procedimiento son factores que revisten un desafío importante para el tratamiento2–6.
Hay pocos estudios publicados exclusivamente de pacientes en edad pediátrica. El presente trabajo describe nuestra experiencia con FEC en 9 pacientes con EICH en niños y los objetivos del mismo fueron identificar las características clínicas de dichos pacientes con EICH-a y EICH-c que realizaron tratamiento con FEC, determinar la respuesta clínica, efectos adversos y la evolución.
Materiales y métodosSe diseñó un estudio observacional y descriptivo en el que se incluyeron todos los pacientes menores de 18 años, con un diagnóstico de EICH-a y EICH-c sometidos a tratamiento con FEC entre enero de 2012 y diciembre de 2018 en el Servicio de Dermatología del Hospital Italiano de Buenos Aires.
Criterios de inclusión- -
Edad: 18 años o menos
- -
EICH-a grado II-IV (según Rowlings et al. 1997)7
- -
EICH-c moderada a grave según la clasificación de Jagasia et al. 20141
- -
Pacientes que hubieran realizado el tratamiento durante al menos un mes en EICH-a y 3 meses en EICH-c
- -
Diagnóstico confirmado de EICH refractaria, dependiente o intolerante a los corticoides (tabla 1)
Tabla 1.Definición de respuesta a corticoides4,12,20:
EICH-a refractaria: falta de respuesta a prednisona después de una semana de tratamiento a dosis de 2-5mg/kg/día EICH-c refractaria: falta de respuesta clínica a dosis de 1mg/kg/día de prednisona por 2 semanas o enfermedad estable con al menos 0,5mg/kg/día por 4 a 8 semanas Dependencia: dificultad de disminuir la prednisona por debajo de 0,5mg/kg/día Intolerancia: presentación de efectos adversos a los corticoides como hiperglucemia, osteopenia, hipertensión arterial, entre otros EICH: enfermedad injerto contra huésped; EICH-a: EICH aguda; EICH-c: EICH crónica.
La evaluación de la respuesta se realizó según los criterios de Greinix et al. 19988 (tabla 2)
Valoración de los objetivos de estudio según los criterios de Greinix et al
| RC: resolución completa de las manifestaciones orgánicas |
| RP: mayor del 50% de respuesta en los órganos involucrados |
| EE: menor del 50% de respuesta en los órganos involucrados |
| EP: sin respuesta o incapacidad para disminuir los inmunosupresores o aparición de nuevas lesiones en los órganos involucrados |
| Respondedores: pacientes con RC o RP |
| No respondedores: pacientes con EE o EP |
EE; enfermedad estable; EP: enfermedad progresiva; RC: respuesta completa; RP: respuesta parcial.
Fuente: Greinix et al.8.
En EICH-a se realizaron 2 sesiones por semana durante 4 semanas, con una reevaluación al mes y la finalización a los 3 meses o hasta máxima respuesta. En EICH-c, se realizaron 2 sesiones cada 2 semanas con una reevaluación a los 3 meses y la finalización según la respuesta. Se utilizó el sistema Therakos UVAR-XTS™ en 2 pacientes y, debido al cambio de tecnología durante el periodo de estudio, el equipo Therakos CELLEX™ en el resto.
Análisis estadísticoPara el análisis estadístico se utilizó el paquete de software STATA versión 14.0. Se describieron las variables continuas con mediana e intervalo intercuartílico según distribución observada. Se describieron las variables categóricas como frecuencia absoluta y proporción.
El estudio fue aprobado por el Comité de Ética del Hospital Italiano de Buenos Aires (protocolo n.°: 5.309), y el adulto responsable de cada paciente pediátrico firmó el correspondiente consentimiento informado.
ResultadosDesde enero de 2012 a diciembre de 2018, se incluyeron 9 pacientes pediátricos, 5 de los cuales eran niñas/adolescentes, con una mediana de edad y peso al inicio de la FEC de 15 años (RIC: 12-16 años) y 43kg, respectivamente (RIC: 39-53,5kg). En cuanto al acceso vascular, 5 pacientes requirieron catéter venoso central (CVC) y en 4 se utilizó la vía periférica.
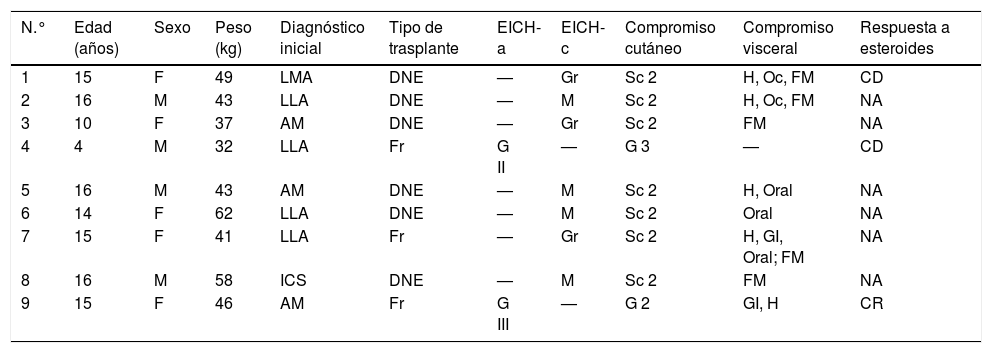
La enfermedad de base más frecuente por la que se trasplantaron fue la leucemia linfoide aguda, seguida de la aplasia medular, y el tipo de trasplante más frecuente fue el de donante no emparentado (6/9). Siete pacientes presentaron EICH-c, uno de los cuales fue corticodependiente, y 2 pacientes presentaron EICH-a, uno de ellos dependiente y el otro resistente a corticoides. De los 2 pacientes con EICH-a, ambos presentaron compromiso cutáneo, uno hepático y uno gastrointestinal (GI). De los pacientes con EICH-c, los 7 presentaron compromiso cutáneo, 5 compromiso fascio-muscular (FM), 5 compromiso mucoso (oral y ocular), 4 compromiso hepático y uno compromiso GI (tabla 3).
Características clínicas de los pacientes bajo tratamiento con FEC
| N.° | Edad (años) | Sexo | Peso (kg) | Diagnóstico inicial | Tipo de trasplante | EICH-a | EICH-c | Compromiso cutáneo | Compromiso visceral | Respuesta a esteroides |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 15 | F | 49 | LMA | DNE | — | Gr | Sc 2 | H, Oc, FM | CD |
| 2 | 16 | M | 43 | LLA | DNE | — | M | Sc 2 | H, Oc, FM | NA |
| 3 | 10 | F | 37 | AM | DNE | — | Gr | Sc 2 | FM | NA |
| 4 | 4 | M | 32 | LLA | Fr | G II | — | G 3 | — | CD |
| 5 | 16 | M | 43 | AM | DNE | — | M | Sc 2 | H, Oral | NA |
| 6 | 14 | F | 62 | LLA | DNE | — | M | Sc 2 | Oral | NA |
| 7 | 15 | F | 41 | LLA | Fr | — | Gr | Sc 2 | H, GI, Oral; FM | NA |
| 8 | 16 | M | 58 | ICS | DNE | — | M | Sc 2 | FM | NA |
| 9 | 15 | F | 46 | AM | Fr | G III | — | G 2 | GI, H | CR |
AM: aplasia medular; CD: corticodependiente; CR: corticorresistente; DNE: donante no emparentado; FM: fascio/muscular; Fr: familiar relacionado; G: grado; GI: gastrointestinal; Gr: grave; H: hepático; ICS: insuficiencia combinada severa; LLA; leucemia linfoide aguda; LMA: leucemia mieloide aguda; M: moderado; NA: no aplica; Oc: ocular; Sc: score.
En cuanto a la respuesta a la FEC, 7 pacientes fueron respondedores (R) y 2 no respondedores (NR), estos 2 con EICH-a. La respuesta cutánea fue parcial (RP) en 7 pacientes, estable (EE) en uno y completa (RC) en uno. De los 5 pacientes con compromiso mucoso (todos con EICH-c), 4 presentaron RC y uno RP. De los 5 pacientes con compromiso FM, 3 tuvieron RC y 2 RP. En cuanto a los 5 pacientes con compromiso hepático (uno EICH-a y 4 EICH-c), 3 presentaron RC, uno RP y uno EP. De los 2 pacientes con compromiso GI (uno EICH-a y uno EICH-c) uno presentó RC y uno EP. La mediana de duración de la FEC fue de 7 meses (RIC: 3-17,5 meses), 24 sesiones (RIC: 19-59 sesiones) y la mediana de procedimientos para obtener respuesta fue de 12 sesiones (RIC: 8-18 sesiones), 7 meses (RIC: 3-17,5 meses) (tabla 4).
Resultados de Fotoféresis extracorpórea en pacientes pediátricos
| N.° | Duración tratamiento (meses) | Mediana procedimientos (sesiones) | Tratamiento asociado | EICH-a | EICH-c | Respuesta a la FEC | Respuesta por órgano | Mortalidad | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Piel | FM | Hepático | GI | Oral | Ocular | ||||||||
| 1 | 22 | 90 | FK 506, C, Et | — | Gr | R | RP | RP | RP | — | — | RP | m |
| 2 | 3 | 22 | FK 506, C | — | M | R | RP | RC | RC | — | — | RC | V |
| 3 | 8 | 36 | FK 506, Et, MFF | — | Gr | R | RP | RP | — | — | — | — | V-FEC |
| 4 | 2 | 11 | r, S, MMF, C | G II | — | NR | EE | — | — | — | — | — | V-FEC |
| 5 | 5 | 16 | FK 506 | — | M | R | RP | — | RC | — | RC | — | V-FEC |
| 6 | 7 | 23 | FK 506, I | — | M | R | RP | — | — | — | RC | — | V |
| 7 | 13 | 48 | FK 506, I | — | Gr | R | RP | RC | RC | RC | RC | — | V |
| 8 | 41 | 70 | FK 506 | — | M | R | RC | RC | — | — | — | — | V |
| 9 | 5 | 10 | C, MMF | G III | — | NR | RP | — | EP | EP | — | — | m |
C: corticoides; EE: enfermedad estable; EP: enfermedad progresiva; Et: etanercept; FK 506: tacrolimus; FM: fascio/muscular; G: grado; GI: gastrointestinal; Gr: grave; I: infliximab; M: moderado; m: muerto; MMF: mofetil micofenolato; NR: no respondedor; R: respondedor; r: rituximab; RC: respuesta completa; RP: respuesta parcial; S: sirolimus; V: vivo; V-FEC: vivo en fotoféresis.
Todos los pacientes recibieron algún tratamiento inmunosupresor durante el estudio (tacrolimus, mofetil micofenolato, sirolimus, entre otros), y 4 pacientes, además, se encontraban en tratamiento con corticoides sistémicos. De los 4 pacientes que recibieron corticoides, 2 lograron disminuir la dosis, el 33 y el 90% de la dosis inicial (los 2 corticodependientes) a los 2 y 4 meses de iniciar la FEC, respectivamente. Un paciente pudo suspender el inmunosupresor a los 12 meses de FEC y otro lo suspendió a los 11 meses de haberlo iniciado. Respecto a los efectos adversos durante el estudio, la mayoría se relacionaron con infecciones del CVC (n: 3), y solo 2 pacientes presentaron hipotensión leve corregible con hidratación y maniobras posturales.
De los 9 pacientes, 2 fallecieron durante el periodo de estudio, uno por una infección oportunista no asociada al CVC y uno por la progresión de la enfermedad de base.
DiscusiónEl TAMO es un tratamiento cuya frecuencia ha aumentado significativamente en los últimos años ya que ofrece un incremento en la esperanza de vida de los pacientes con enfermedades linfoproliferativas. Esto ha elevado la incidencia de EICH convirtiéndola en un gran desafío diagnóstico y terapéutico donde la FEC juega un rol preponderante3,9.
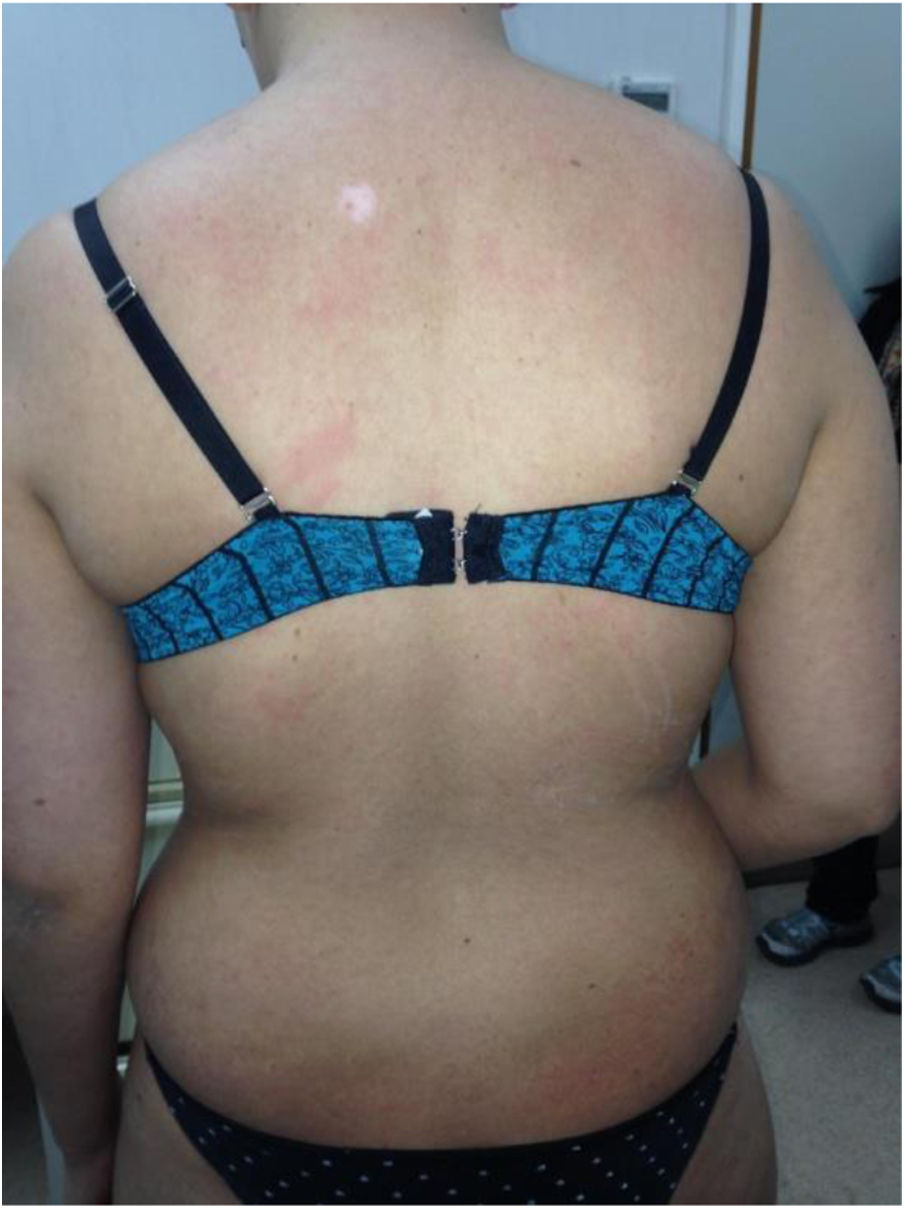
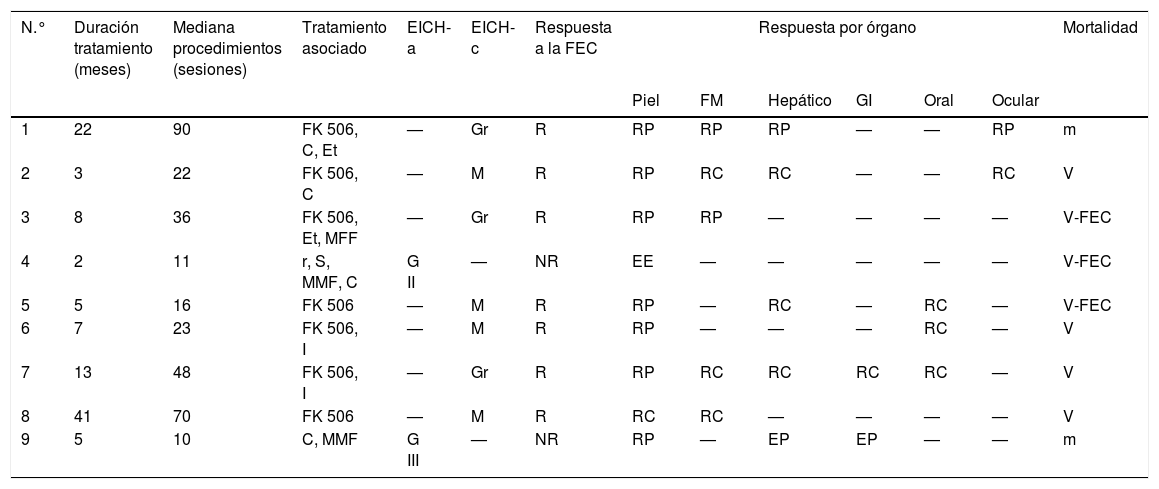
La EICH clínicamente puede presentarse como una forma aguda o crónica, independientemente de los días transcurridos desde el trasplante. La forma aguda (fig. 1), se caracteriza por el compromiso cutáneo que se manifiesta como una erupción eritematosa, maculopapular y con lesiones en las mucosas. Un porcentaje pequeño puede presentar una eritrodermia o la formación de ampollas con la presencia del signo de Nikolsky. Pueden encontrarse también manifestaciones extra cutáneas como una alteración hepática y GI. Su estadificación varía de 1 a 4 en función de la clínica y del porcentaje de superficie corporal afectada. A nivel hepático y GI, se modifica en función del nivel de bilirrubina sérica y la cuantificación de la diarrea, respectivamente7,10,11.
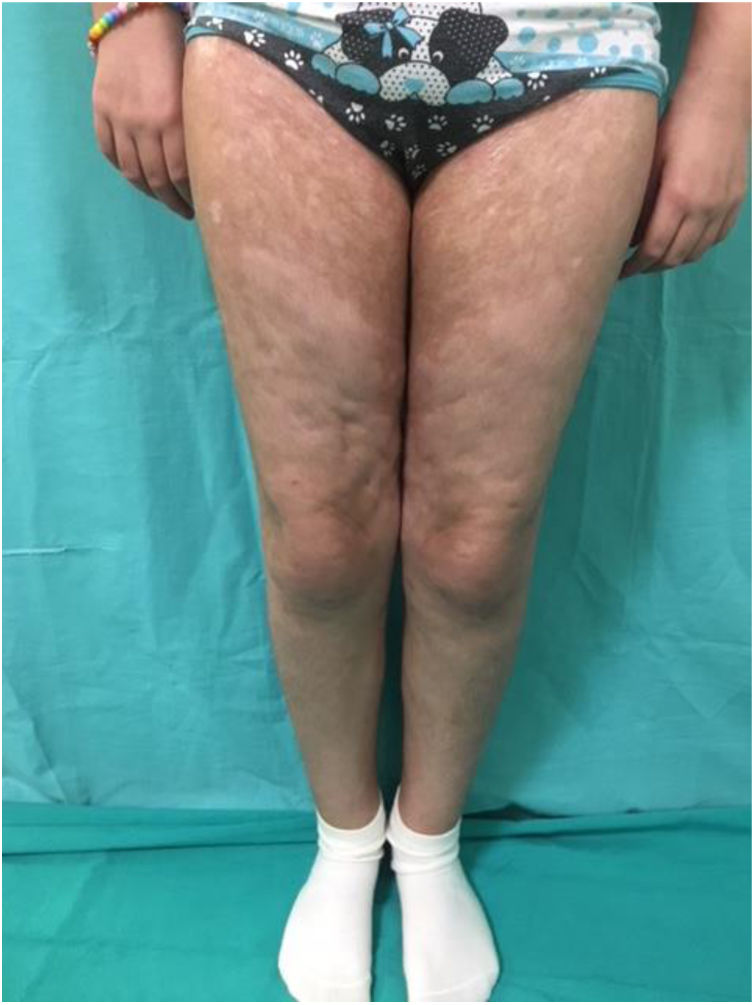
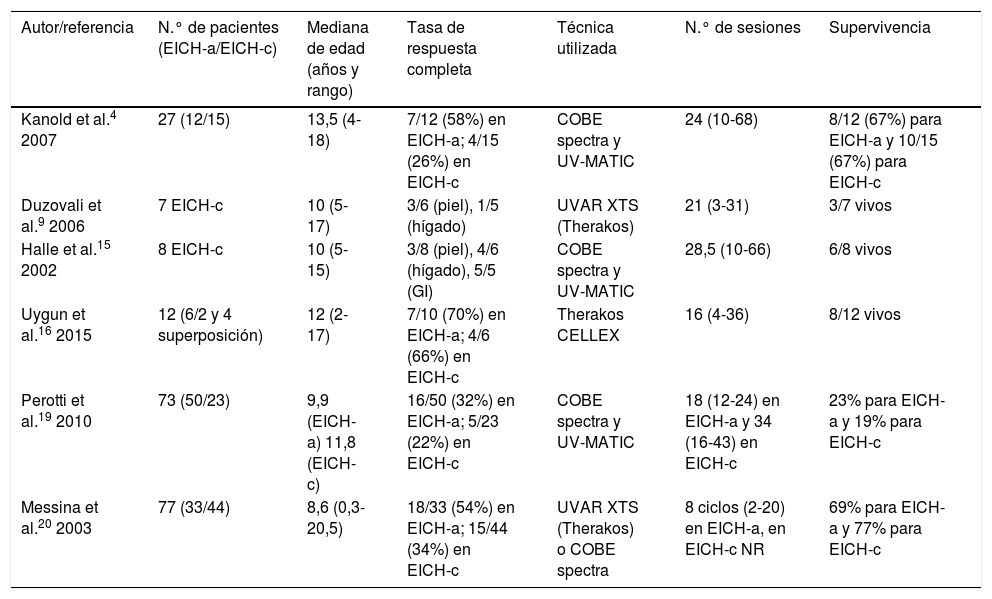
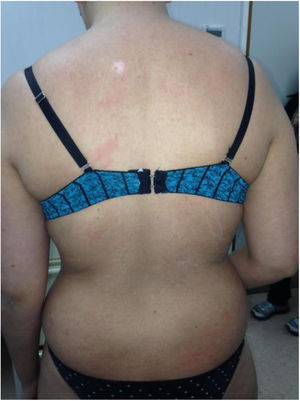
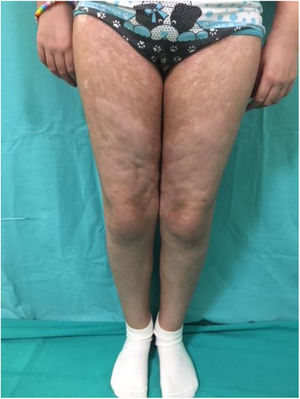
Por su parte la EICH-c (fig. 2), es una enfermedad multisistémica y presenta manifestaciones clínicas diversas, similares a las observadas en los síndromes autoinmunes, en donde las lesiones cutáneas pueden ser de tipo liquenoide o esclerodermiforme, puede haber compromiso mucoso, GI, hepático, pulmonar y FM, este último es causante de secuelas físicas discapacitantes. Su gravedad se determina con el grado de afectación de cada órgano comprometido (leve, moderado y grave). El sistema de gradación más utilizado es el de National Institutes of Health (NIH), el cual describe la gravedad según la repercusión funcional de los órganos afectados, y varía de 0 a 3 para cada uno1,10,11.
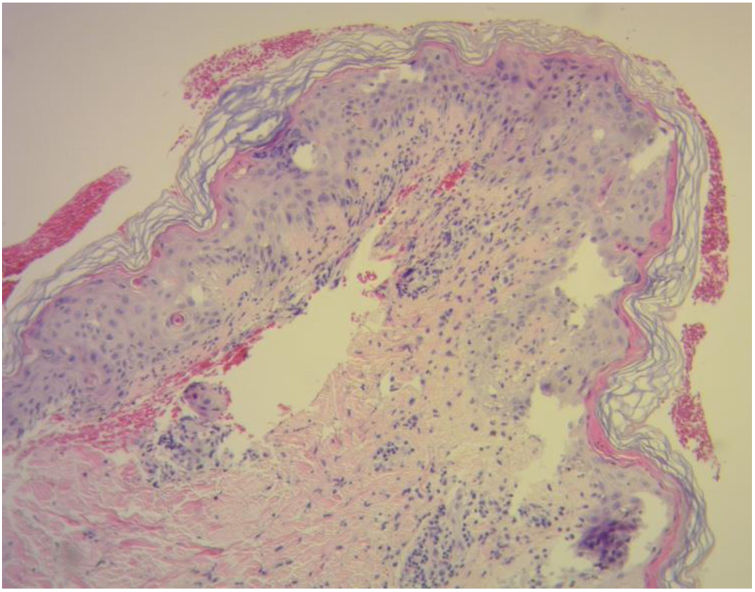
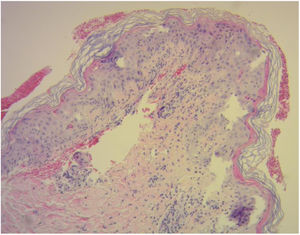
El diagnóstico de la EICH cutánea se basa en el examen clínico y se apoya en el estudio histopatológico. En este último, se observa una infiltración por linfocitos en la dermis superficial, cambios citopáticos en los queratinocitos y la presencia de linfocitos satélite alrededor de estos. Se reconocen cuatro grados en función de la afectación dermo-epidérmica (fig. 3)10,11.
El tratamiento estándar de primera línea de la EICH son los corticoides (la respuesta a estos es un importante factor de supervivencia) y los inhibidores de la calcineurina, mientras que en la enfermedad refractaria se utilizan otras terapias inmunosupresoras. A pesar de estos tratamientos agresivos, la EICH no logra ser controlada en un porcentaje importante de pacientes. Existe, por lo tanto, una necesidad urgente de desarrollar estrategias más selectivas en el manejo de la EICH como lo sería la FEC2–5.
La FEC es una terapia inmunomoduladora, basada en la leucoaféresis, en donde se extraen por un sistema de aféresis las células mononucleares de la sangre periférica del paciente, que son expuestas a los efectos de la luz ultravioleta A en presencia de un fotosensibilizante (8-metoxipsoraleno) que induce la apoptosis de los leucocitos y genera una respuesta inmune5,12,13.
La FEC en niños es de gran utilidad, y las principales dificultades para su realización son el tipo de acceso venoso necesario para mantener una buena dinámica de tratamiento, la tolerancia hemodinámica y los trastornos hematológicos subyacentes. Existen 2 métodos para realizar la FEC: 1) el off-line que se lleva a cabo en 2 etapas (separación y fotoactivación), en el que el tipo de separador celular más usado en pediatría es el sistema de flujo continuo COBE Spectra, y 2) el método on-line en una etapa, el cual tiene dos sistemas de separador celular, uno de flujo discontinuo Therakos UVAR XTS™ y uno de flujo continuo CELLEX™ Therakos3,5,12.
Kapadia et al. 201514, en su estudio demostraron que en la población pediátrica el sistema CELLEX™ parece haber sido mejor tolerado que el UVAR-XTS™, al acortar el tiempo de tratamiento y reducir las complicaciones hemodinámicas. En nuestro estudio utilizamos el UVAR-XTS™ en 2 pacientes y el CELLEX™ en el resto, debido a la mayor versatilidad de este último dado que puede utilizarse con doble vía en pacientes de peso menor a 30kg y con bajo hematocrito. Para ello es indispensable disponer de doble acceso venoso, en nuestra casuística la mitad de los pacientes requirieron catéter venoso central. Cabe señalar que dichos catéteres deben ser no colapsables, de doble vía y con un diámetro preferentemente mayor o igual a 8F. A su vez hemos detectado que el menor tiempo de tratamiento requerido por este equipo favoreció la tolerancia al mismo en los niños. Respecto al procedimiento también es importante saber que el circuito extracorpóreo debe ser anticoagulado, la selección y dosis del anticoagulante no están estandarizadas. Los fabricantes recomiendan heparina y el protocolo utilizado fue de 250U/kg diluida en 500ml de solución salina normal, infundida a una proporción que fue de 8:1 a 16:1 según el recuento de plaquetas del paciente.
El esquema y la duración del tratamiento de la FEC en los pacientes pediátricos con EICH tampoco se encuentran estandarizados. Kanold et al. 20074 recomiendan realizar 3 sesiones por semana tanto para EICH-a como para EICH-c hasta lograr la respuesta máxima y luego individualizar y disminuir progresivamente según respuesta. Halle et al. 200215 en su serie de EICH-c realizaron 2 sesiones una vez por semana por 2 semanas y luego cada 2 semanas por 3 meses, con reducción gradual en los pacientes que mostraron mejoría o se estabilizaron. Uygun et al.16 realizaron un régimen igual para EICH-a y EICH-c, 2 sesiones cada semana durante 2 meses, luego cada 2 semanas por 2 meses, y finalmente cada mes durante al menos un año. En nuestra experiencia en EICH-a realizamos 2 sesiones por semana por 4 semanas, con reevaluación al mes y finalización a los 3 meses o hasta máxima respuesta, obteniéndose esta en 2 a 5 meses (10 sesiones). En EICH-c realizamos 2 sesiones cada 2 semanas, con reevaluación a los tres meses y finalización según respuesta, con una duración variable entre 3 y 41 meses (10-90 sesiones). Es importante destacar que la finalización del tratamiento se define en forma interdisciplinaria, por lo general tras haber reducido o suspendido los inmunosupresores, y en forma individual en cada paciente.
Las contraindicaciones en la edad pediátrica son similares a las de los adultos: fiebre, sepsis, inestabilidad hemodinámica y la recomendación es que el paciente tenga al momento del tratamiento un hematocrito >28%, recuento de plaquetas >20.000/mm3 y neutrófilos >1.000/mm33,17,18.
No existen ensayos clínicos de FEC en pediatría, los estudios son en su mayoría reporte de casos (tabla 5).
Experiencia publicada de FEC en la población pediátrica
| Autor/referencia | N.° de pacientes (EICH-a/EICH-c) | Mediana de edad (años y rango) | Tasa de respuesta completa | Técnica utilizada | N.° de sesiones | Supervivencia |
|---|---|---|---|---|---|---|
| Kanold et al.4 2007 | 27 (12/15) | 13,5 (4-18) | 7/12 (58%) en EICH-a; 4/15 (26%) en EICH-c | COBE spectra y UV-MATIC | 24 (10-68) | 8/12 (67%) para EICH-a y 10/15 (67%) para EICH-c |
| Duzovali et al.9 2006 | 7 EICH-c | 10 (5-17) | 3/6 (piel), 1/5 (hígado) | UVAR XTS (Therakos) | 21 (3-31) | 3/7 vivos |
| Halle et al.15 2002 | 8 EICH-c | 10 (5-15) | 3/8 (piel), 4/6 (hígado), 5/5 (GI) | COBE spectra y UV-MATIC | 28,5 (10-66) | 6/8 vivos |
| Uygun et al.16 2015 | 12 (6/2 y 4 superposición) | 12 (2-17) | 7/10 (70%) en EICH-a; 4/6 (66%) en EICH-c | Therakos CELLEX | 16 (4-36) | 8/12 vivos |
| Perotti et al.19 2010 | 73 (50/23) | 9,9 (EICH-a) 11,8 (EICH-c) | 16/50 (32%) en EICH-a; 5/23 (22%) en EICH-c | COBE spectra y UV-MATIC | 18 (12-24) en EICH-a y 34 (16-43) en EICH-c | 23% para EICH-a y 19% para EICH-c |
| Messina et al.20 2003 | 77 (33/44) | 8,6 (0,3-20,5) | 18/33 (54%) en EICH-a; 15/44 (34%) en EICH-c | UVAR XTS (Therakos) o COBE spectra | 8 ciclos (2-20) en EICH-a, en EICH-c NR | 69% para EICH-a y 77% para EICH-c |
En los estudios reportados en la literatura, la mayoría de los pacientes presentaron RC en piel a diferencia de lo observado en nuestro estudio, donde todos los pacientes salvo uno desarrollaron RP. Esto podría deberse a las diferencias en los protocolos de evaluación de respuesta. En el presente protocolo la RC en piel solo fue consignada si todos los signos cutáneos mejoraban 100% y, de ellos, la hiperpigmentación fue la que mejoró en primer lugar, seguida de la esclerosis y la induración. Estos cambios favorables contribuyeron a una notable recuperación de la movilidad de los pacientes. La respuesta en otros órganos fue similar a la documentada por otras publicaciones.
Dentro de los estudios más recientes, Uygun et al. 16 en 2015 evaluaron a 12 pacientes en tratamiento con FEC. Este grupo de pacientes presentaba un número de casos similar al nuestro, podemos destacar que las respuestas cutáneas son comparables entre ambos, aunque en nuestra experiencia obtuvimos mejor respuesta a nivel hepático. Existen también otros reportes de series con pocos casos como los de Duzovali et al. 20079 con 7 pacientes y Halle et al. 200215 con 8, aunque sin pacientes con EICH-a. Al compararlos con nuestro trabajo, la respuesta global en piel e hígado que obtuvimos fue superior.
En general la FEC fue bien tolerada, con pocos efectos adversos. La literatura ha reportado fiebre, dolor abdominal, episodios de hipotensión transitoria e infecciones relacionadas al catéter3,5,13,15,17. Estos dos últimos fueron los únicos observados en nuestra experiencia.
En conclusión, la FEC es un tratamiento muy bien tolerado y seguro para la EICH en pacientes con edad pediátrica, con una importante tasa de respuesta clínica, principalmente en la piel y las mucosas, y que permite disminuir la dosis de corticoides y de otros tratamientos inmunosupresores coadyuvantes.
A partir de estas observaciones y conociendo los múltiples efectos adversos de los fármacos utilizados para esta patología, se podría inferir que en los pacientes pediátricos con EICH, la FEC sería de utilidad para disminuir la morbimortalidad y mejorar su calidad de vida.
Este es el primer estudio descriptivo de EICH-a y EICH-c tratados con FEC en una población pediátrica latinoamericana, por lo que consideramos que serían necesarios más estudios en esta línea de investigación, principalmente evaluando el impacto de este tratamiento sobre la supervivencia y la calidad de vida de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.