La aftosis oral recidivante es una enfermedad inflamatoria crónica de la mucosa oral. Se caracteriza por presentar úlceras dolorosas en la cavidad oral sin que se encuentre una enfermedad subyacente que lo justifique. Ante la aparición de úlceras recidivantes en la mucosa oral habrá que realizar un correcto diagnóstico diferencial y descartar otras causas antes de llegar al diagnóstico de aftosis oral recidivante. Se trata de una enfermedad frecuente; según la población estudiada, se han documentado prevalencias entre el 5 y el 60%. Su patogenia es desconocida, pero se considera multifactorial. El tratamiento no está estandarizado y no es curativo, se pretende disminuir el dolor durante el brote, acortar la duración del mismo y evitar la aparición de nuevas lesiones.
Recurrent aphthous stomatitis is a chronic inflammatory disease of the oral mucosa. It is characterized by painful mouth ulcers that cannot be explained by an underlying disease. Recurrent oral mucosal ulcers require a proper differential diagnosis to rule out other possible causes before recurrent aphthous stomatitis is diagnosed. The condition is common, with prevalence rates ranging from 5 to 60% in different series. Its pathogenesis is unknown, but multiple factors are considered to play a part. There are no standardized treatments for this condition and none of the treatments are curative. The goal of any treatment should be to alleviate pain, reduce the duration of ulcers, and prevent recurrence.
La aftosis oral recidivante (AOR) se caracteriza por la aparición recurrente de úlceras dolorosas, redondeadas, bien definidas, de borde eritematoso y fondo pseudomembranoso amarillo-grisáceo en la cavidad oral, en pacientes que por lo demás están sanos. Las úlceras pueden ir precedidas de una sensación de ardor de 2 a 48h antes1.
EpidemiologíaLa AOR es la causa más frecuente de aparición de úlceras en la mucosa oral. Afecta a entre el 5 y el 25% de la población general2, aunque la prevalencia puede variar según los estudios desde el 5 al 60%3 en función de la población estudiada, los criterios diagnósticos del estudio o factores ambientales.
El pico de inicio de la enfermedad se sitúa entre los 10 y los 19 años, y aunque es menos frecuente en la edad adulta, la AOR puede persistir a lo largo de toda la vida. No se han visto diferencias en la prevalencia por género4.
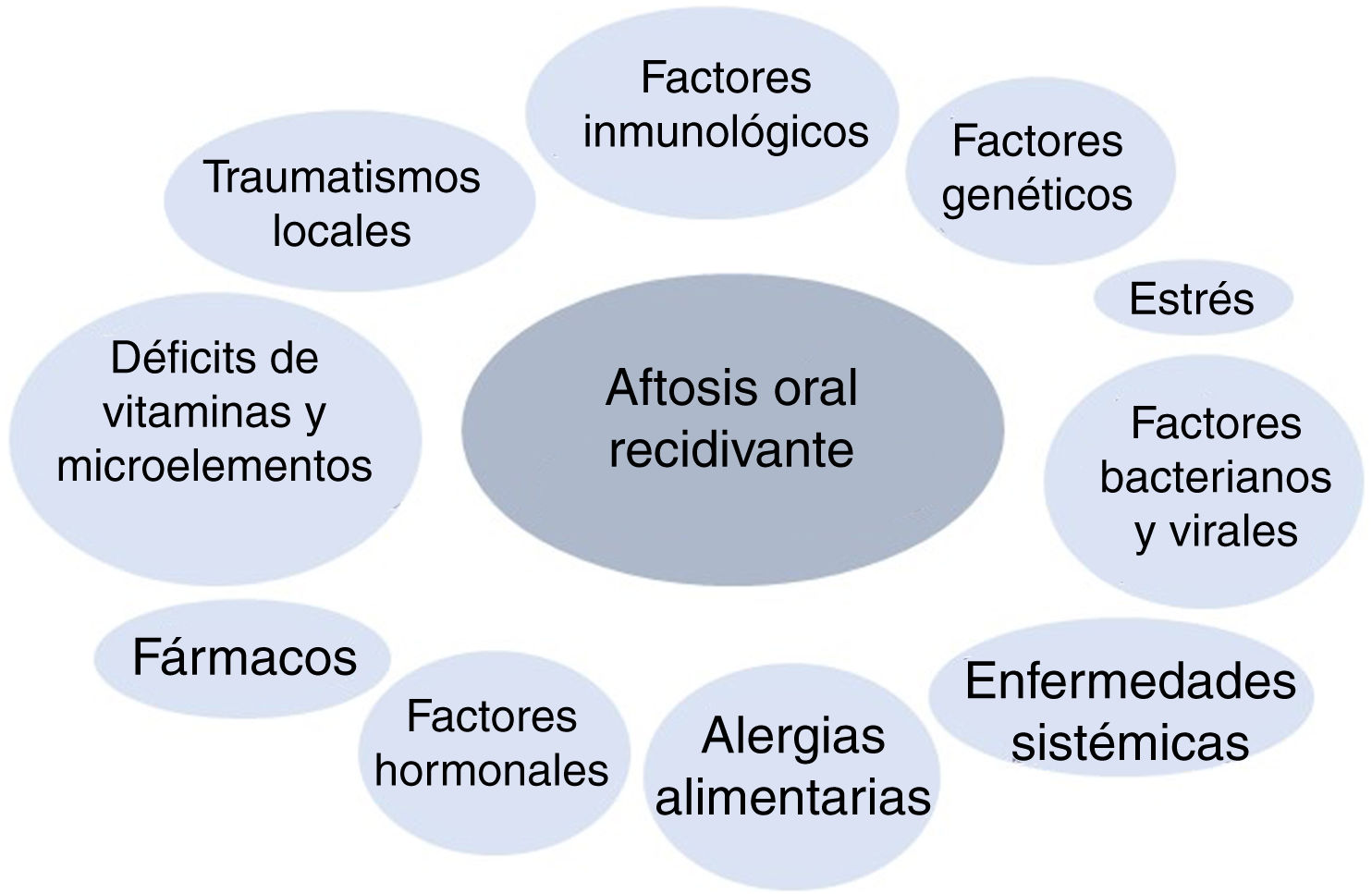
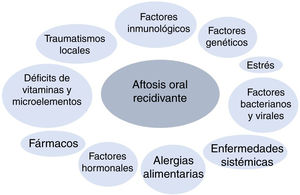
PatogeniaLa AOR pertenece al grupo de las enfermedades inflamatorias crónicas de la mucosa oral. Su etiopatogenia es desconocida, pero se considera una enfermedad multifactorial. Se han descrito diferentes factores desencadenantes de la enfermedad (fig. 1). Se ha propuesto que, en pacientes genéticamente predispuestos, el efecto de determinados factores inicia una cascada de citocinas proinflamatorias dirigidas contra áreas concretas de la mucosa oral5.
Factores genéticos: la herencia genética juega un papel importante en el desarrollo de AOR. La probabilidad de padecer AOR está aumentada si uno o ambos padres padecen la enfermedad, existiendo hasta en un 24-46% de los pacientes antecedentes familiares6,7. Además, los pacientes con antecedentes familiares tienen recurrencias con más frecuencia y presentan cuadros más severos8–10.
En los pacientes con AOR, hay una mayor incidencia de HLA-A33, HLA-B35, HLA-B81, HLA-B12, HLA-B51, HLA-DR7 y HLA-DR5 en comparación con controles sanos5.
Por otro lado, existen factores de riesgo genéticos que modifican la susceptibilidad individual a la AOR, como varios polimorfismos de ADN distribuidos por el genoma humano, sobre todo relacionados con el metabolismo de las interleucinas (IL-1beta, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12), el interferón-gamma y el factor de necrosis tumoral (TNF)-alfa11–20.
Traumatismos locales: se consideran un agente causal en individuos genéticamente predispuestos21,22. Los traumatismos predisponen a la AOR produciendo edema e inflamación celular temprana junto con un aumento de la viscosidad de la matriz extracelular de la submucosa oral23. No todos los traumatismos locales llevan a una AOR, ya que los portadores de dentadura no tienen un aumento del riesgo de AOR24. Por otro lado, se ha relacionado el tabaco como un factor protector en el desarrollo de la AOR25,26.
Factores bacterianos y virales: se han intentado asociar diferentes microorganismos con la AOR. Hay estudios llevados a cabo para relacionar la AOR con bacterias del género Streptococcus, sobre todo con el S. sanguinis 2A27, con Helicobacter pylori28, con Lactobacillus29 o con el virus de Epstein-Barr30, pero los resultados hasta la fecha no han demostrado una relación causal clara.
Estrés: los acontecimientos estresantes pueden desencadenar nuevas lesiones en pacientes predispuestos. Un estudio llegó a la conclusión de que el estrés psicológico se asocia más a episodios de AOR que el estrés físico, y que este se asociaba más con la aparición de los episodios que con la duración de los mismos31. Así mismo, se han publicado casos que cursan con aftas orales, como la enfermedad de Behçet, que empeoraron tras un estrés emocional fuerte32.
Alergias alimentarias: se ha propuesto la alergia como una causa de AOR. La hipersensibilidad a determinadas sustancias, microorganismos orales como el S. sanguinis o proteínas de choque térmico se han planteado como factores causales, pero hasta la fecha no hay evidencias concluyentes de que sean una causa mayor de la enfermedad33,34.
Déficits vitamínicos y de microelementos: hay un 5-10% de pacientes con niveles bajos de hierro, ácido fólico, cinc o vitaminas B1, B2, B6 y B1235. A veces estas deficiencias se pueden asociar a otras enfermedades subyacentes, como malabsorción o enteropatía por gluten.
Factores inmunológicos: se ha encontrado que en pacientes con AOR, la función del sistema inmune se modifica en respuesta a algún tipo de factor desencadenante todavía no muy bien conocido (como podrían ser antígenos bacterianos/virales o el estrés). Se cree que los 2 tipos de respuesta inmune, innata y adquirida (humoral y celular), se ven alterados en los pacientes con AOR. Muchos autores creen que la respuesta Th1 es la que juega el papel más importante en el desarrollo de la enfermedad15,36.
Enfermedades sistémicas subyacentes: la AOR aparece con mayor frecuencia en pacientes con enfermedad inflamatoria intestinal (enfermedad de Crohn y colitis ulcerosa) y en enfermedad celíaca6,37,38. Esta relación podría ser el resultado de déficits nutricionales, complicación frecuente en estas enfermedades. La AOR es también más frecuente en pacientes con infección por el VIH, probablemente en relación con la alteración del cociente CD4/CD8 y la disminución del recuento de neutrófilos39,40.
Factores hormonales: se ha visto una relación entre la aparición de las aftas y los ciclos menstruales en las mujeres, siendo más frecuentes las úlceras en la fase lútea del ciclo o en la menopausia, y menos frecuentes en el embarazo y en tratamientos anticonceptivos hormonales41.
Fármacos: ha habido publicaciones de aftosis oral desencadenada por fármacos. Hay un estudio de casos y controles en el que se asoció un aumento de riesgo de AOR con la toma de medicamentos, sobre todo de antiinflamatorios no esteroideos y betabloqueantes43. También el nicorandil, la calcineurina y los inhibidores de mTOR se han asociado a úlceras orales severas44–46.
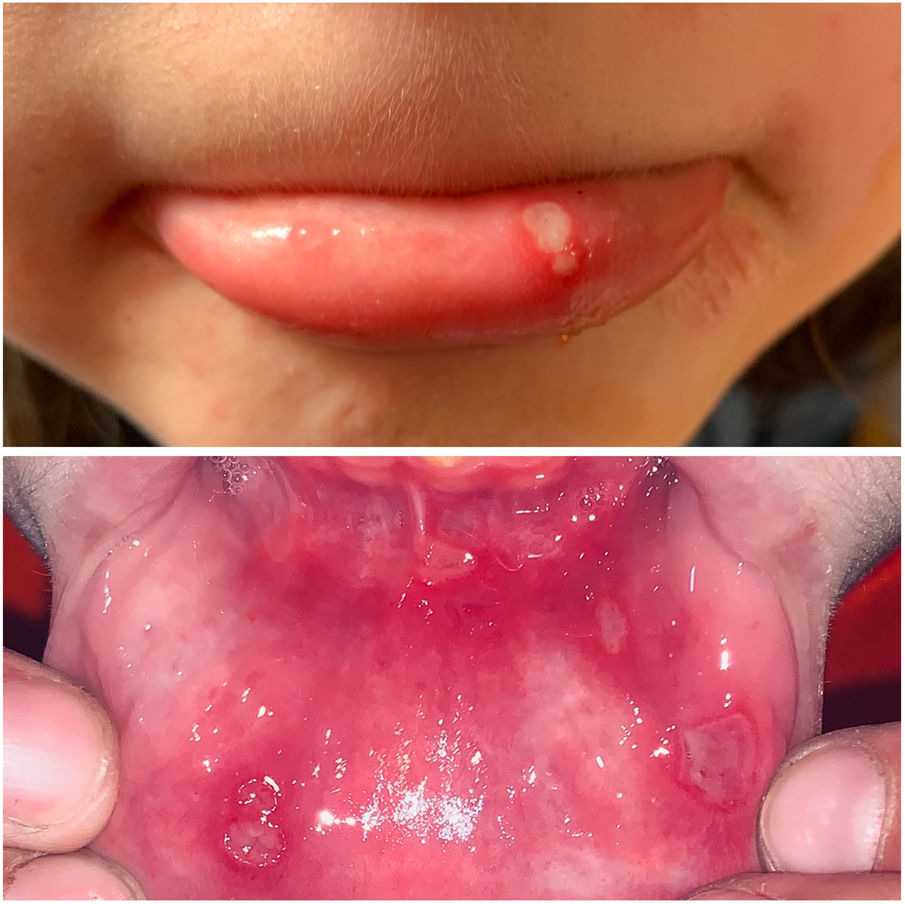
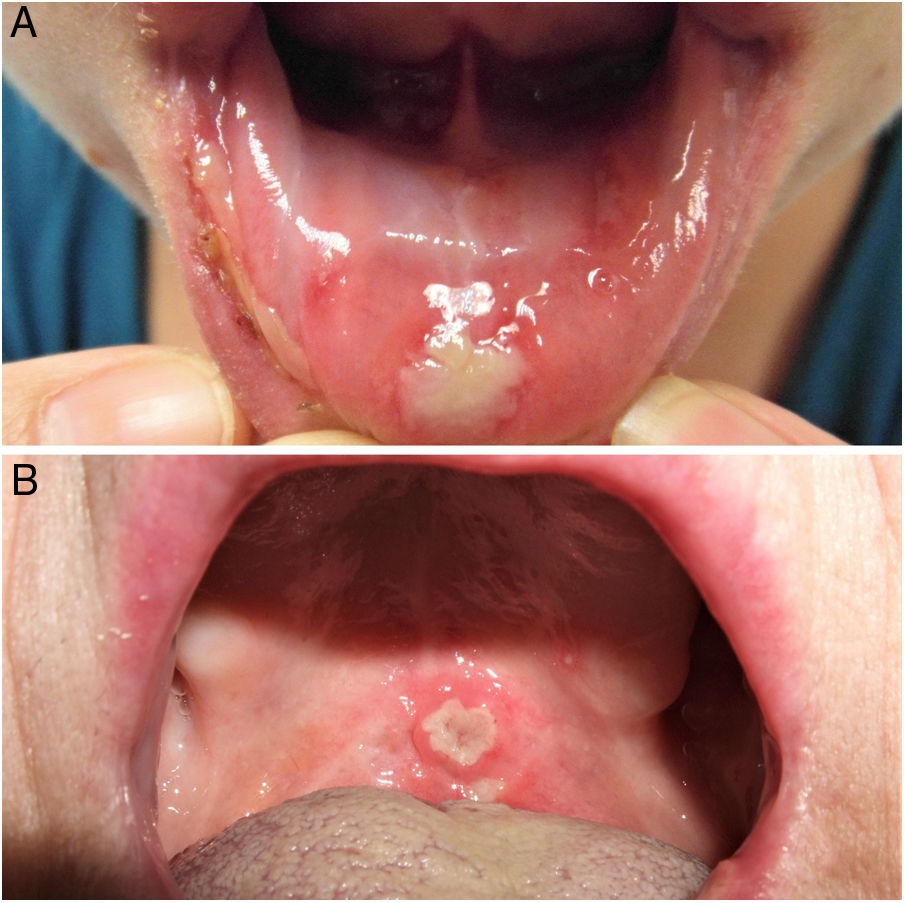
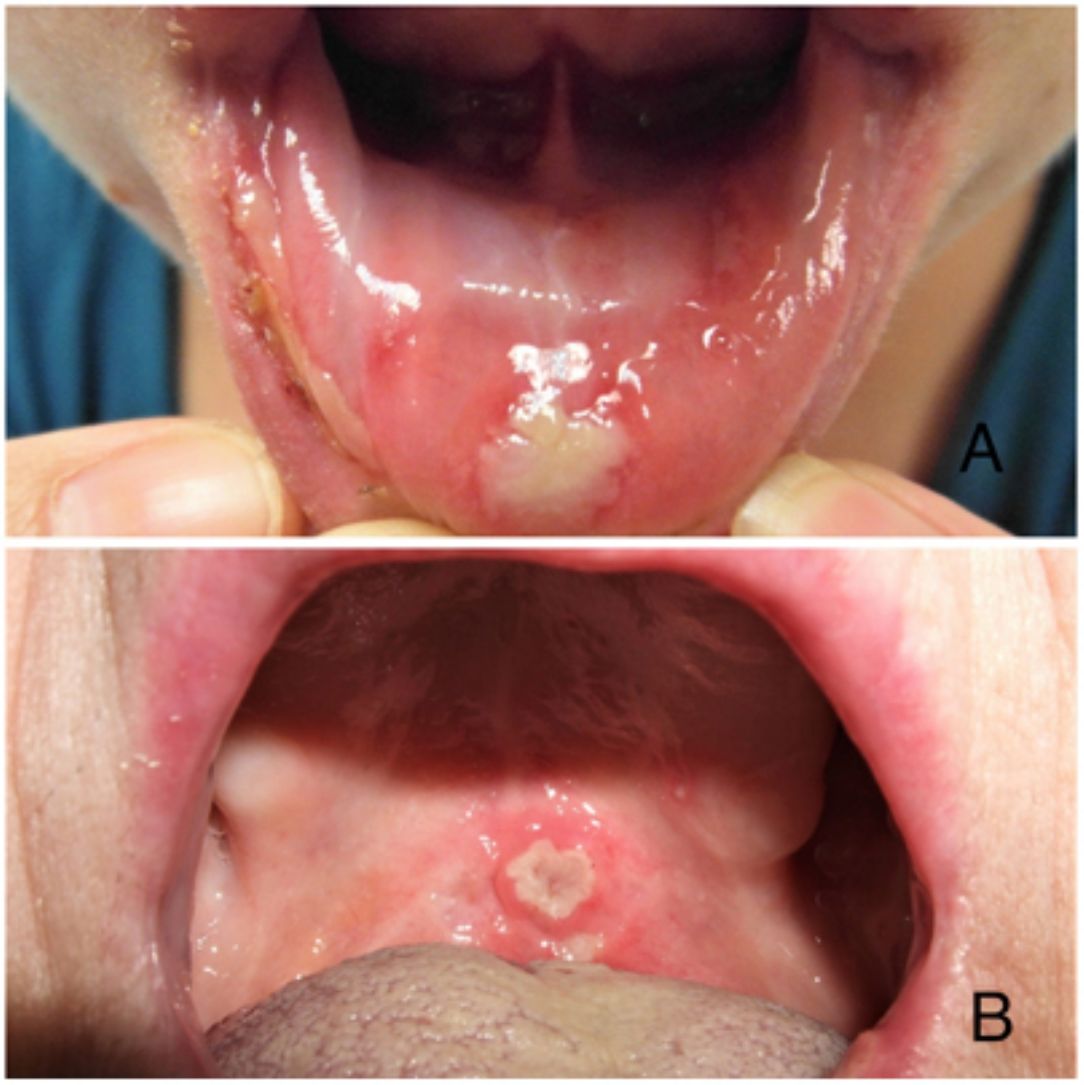
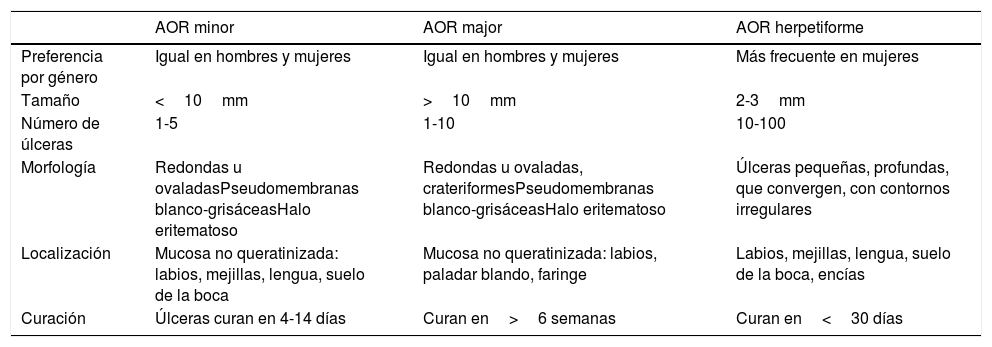
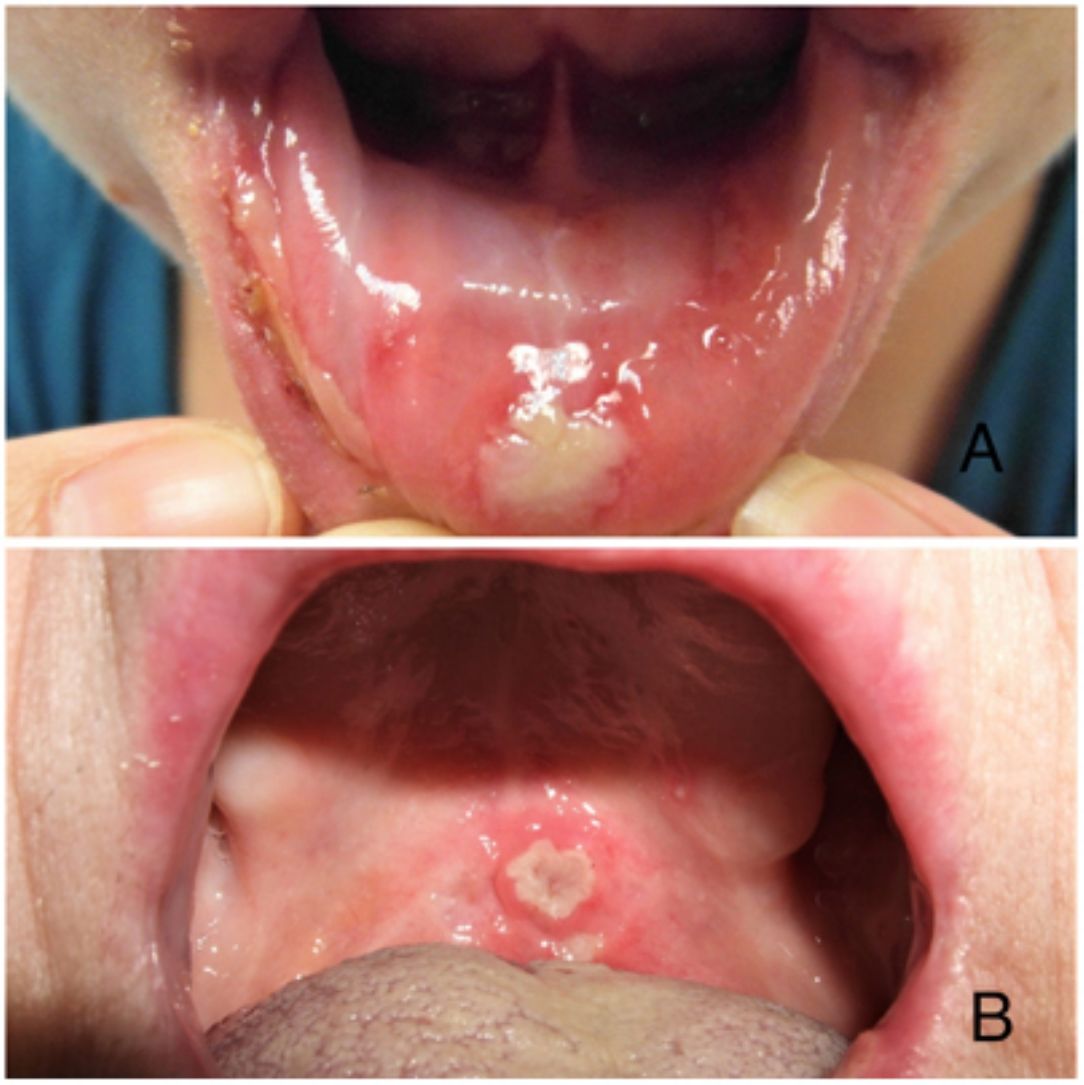
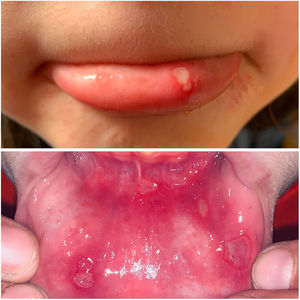
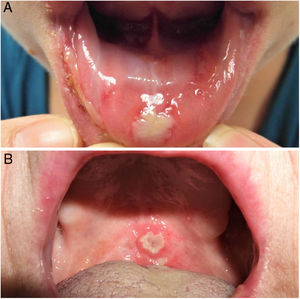
ClínicaExisten 3 formas clínicas de AOR: major, minor y herpetiforme. Los 3 tipos de presentación clínica difieren en la morfología, la distribución, la severidad y el pronóstico. En la tabla 1 se resumen las principales diferencias. A pesar de estas, todos los tipos de AOR provocan un impacto significativo en la calidad de vida de los pacientes e interfieren con las actividades de la vida diaria47. La AOR minor (fig. 2) es la forma de presentación más frecuente, afectando al 80% de los pacientes. La evolución de la AOR minor cursa sin secuelas cicatriciales, a diferencia de la AOR major (fig. 3), en la que las úlceras tardan más tiempo en curar y suele evolucionar dejando cicatrices e incluso sinequias residuales. La AOR herpetiforme es el tipo menos frecuente de AOR; puede haber hasta 100 úlceras a la vez, que pueden confluir, apreciándose entonces úlceras de mayor tamaño y bordes irregulares.
Clasificación clínica
| AOR minor | AOR major | AOR herpetiforme | |
|---|---|---|---|
| Preferencia por género | Igual en hombres y mujeres | Igual en hombres y mujeres | Más frecuente en mujeres |
| Tamaño | <10mm | >10mm | 2-3mm |
| Número de úlceras | 1-5 | 1-10 | 10-100 |
| Morfología | Redondas u ovaladasPseudomembranas blanco-grisáceasHalo eritematoso | Redondas u ovaladas, crateriformesPseudomembranas blanco-grisáceasHalo eritematoso | Úlceras pequeñas, profundas, que convergen, con contornos irregulares |
| Localización | Mucosa no queratinizada: labios, mejillas, lengua, suelo de la boca | Mucosa no queratinizada: labios, paladar blando, faringe | Labios, mejillas, lengua, suelo de la boca, encías |
| Curación | Úlceras curan en 4-14 días | Curan en>6 semanas | Curan en<30 días |
En la tabla 2 se recogen las principales causas de úlceras tanto crónicas como agudas de la mucosa oral.
Diagnóstico diferencial de las úlceras orales agudas y crónicas
| Aftosis oral recidivante |
| Traumáticas: aparatos dentales, sialometaplasia necrosante |
| Déficits nutricionales: hierro, ácido fólico, cinc, B1, B2, B6, B12 |
| InfeccionesVirales: virus del herpes simple, Coxsackie A, virus herpes zóster, citomegalovirus, Epstein-Barr, VIHBacterianas: tuberculosis, sífilisFúngicas: Coccidioides immitis, Cryptococcus neoformans, Blastomyces dermatitidis |
| Farmacológicas: exantema fijo medicamentoso, dermatosis IgA lineal, penfigoide ampolloso inducido por fármacos, eritema multiforme, síndrome de Stevens-Johnson, necrolisis epidérmica tóxica |
| Enfermedades autoinmunes: enfermedad de Crohn, Behçet, enfermedad celíaca, lupus eritematoso sistémico, liquen plano erosivo, granulomatosis de Wegener |
| Hematológicas: anemia, neutropenia, síndrome hipereosinofílico |
| Síndromes asociados a fiebre: neutropenia cíclica, síndrome PFAPA, síndrome de Sweet, fiebre mediterránea familiar, síndrome de hiperinmunoglobulinemia D |
| Enfermedades vesiculoampollosas: pénfigo vulgar, enfermedad IgA lineal |
| Enfermedades hereditarias: epidermolisis ampollosa, enfermedad crónica granulomatosa |
| Otras: síndrome MAGIC, enfermedad relacionada con IgG4, tumores, tabaco |
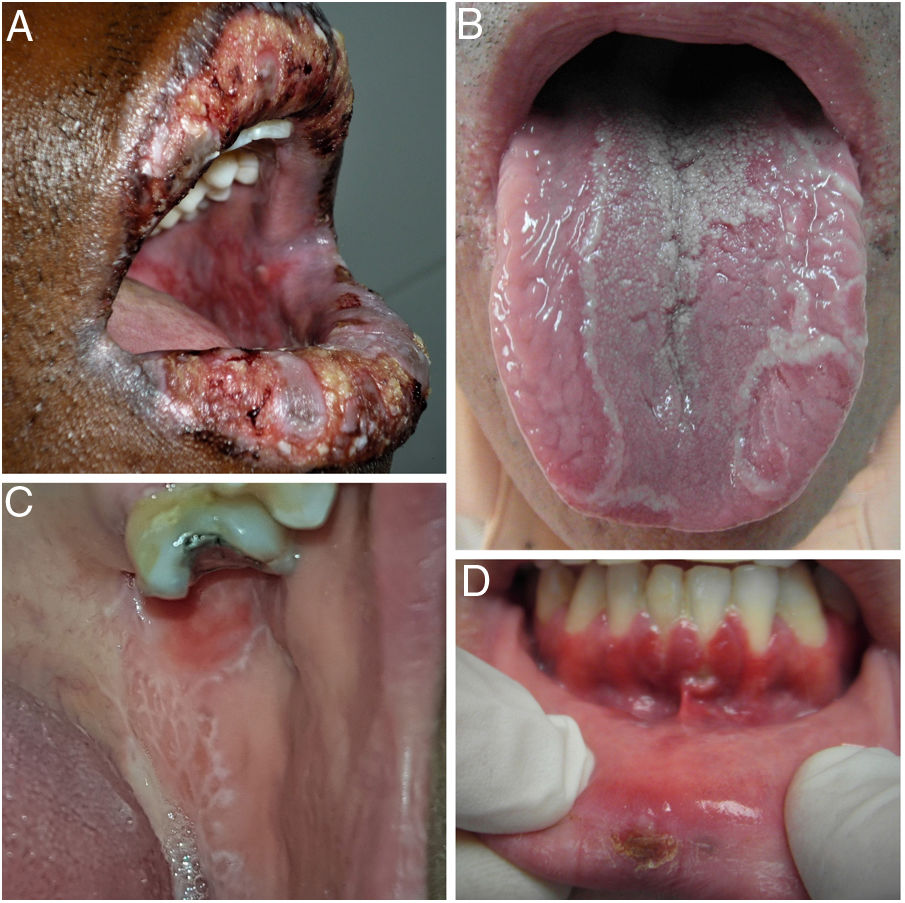
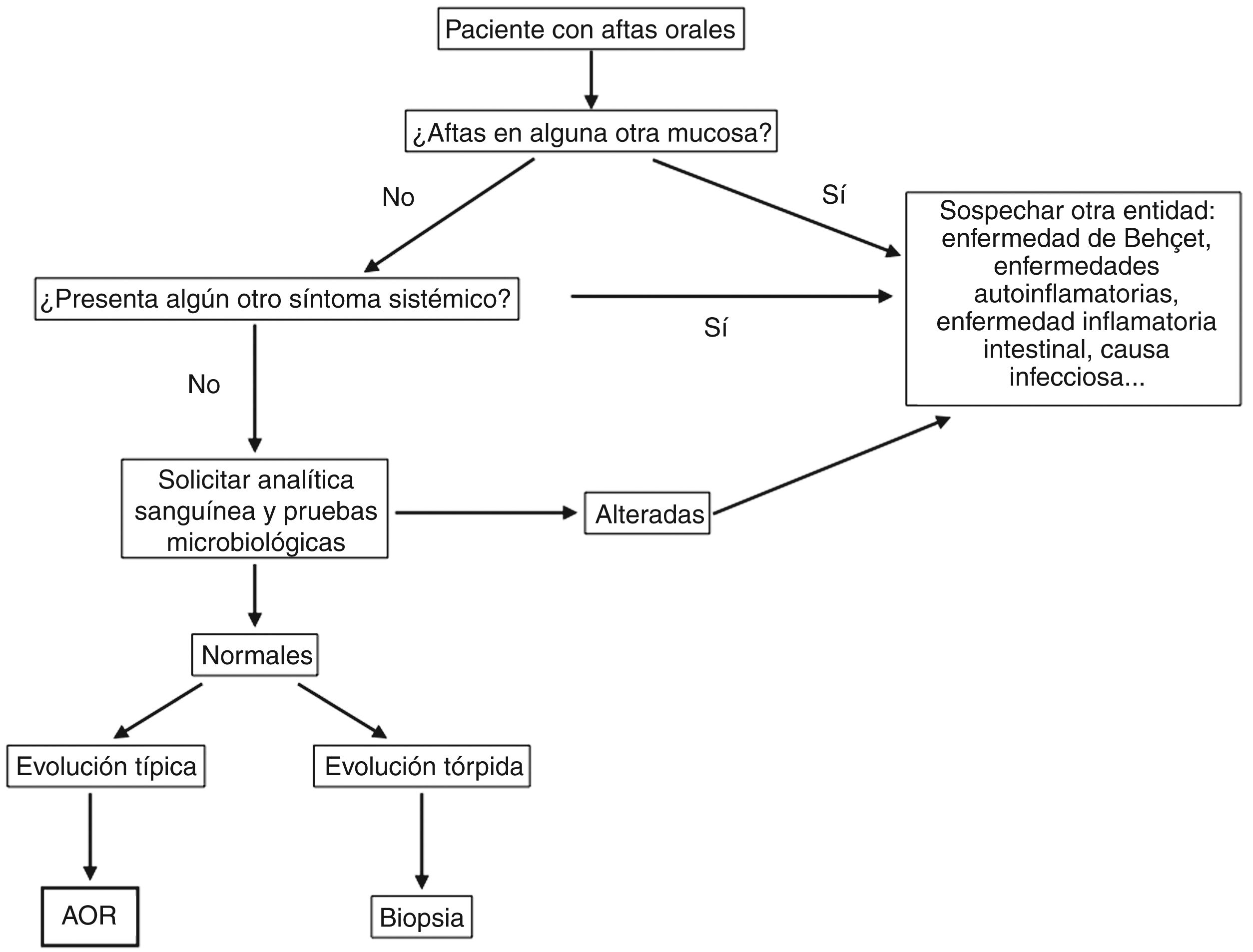
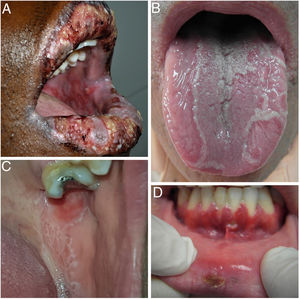
Dado el complejo diagnóstico diferencial de la AOR, es necesario realizar una anamnesis minuciosa para poder orientar correctamente el diagnóstico y, antes de llegar al mismo, debemos descartar otros cuadros en los que las úlceras orales son uno de sus signos frecuentes (fig. 4).
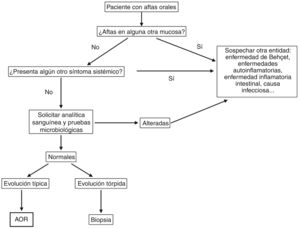
DiagnósticoEl diagnóstico de AOR se basa en la historia clínica y la exploración física. Sin embargo, siempre hay que descartar una causa sistémica subyacente cuando aparecen las úlceras por primera vez, sobre todo en personas adultas48,49. En la figura 5 se propone un algoritmo diagnóstico a seguir ante un paciente con aftas orales.
Las pruebas complementarias que se recomienda hacer son:
Pruebas hematológicas: hemograma completo, niveles de hierro, ferritina, ácido fólico, cinc, magnesio, vitaminas B1, B2, B6 y B12. También se recomienda solicitar anticuerpos antitransglutaminasa y antiendomisio para descartar enfermedad celíaca, así como anticuerpos antinucleares. Por otra parte, hay estudios en los que se ha visto una relación de la AOR con positividad de anticuerpos contra células parietales gástricas, anticuerpos antitiroglobulina y anticuerpos antiperoxidasa tiroidea50.
Pruebas microbiológicas: citodiagnóstico de Tzanck o PCR de virus herpes, cultivo de hongos y bacterias.
Biopsia cutánea: hay 3 indicaciones de biopsia cutánea51:
- a.
Úlcera de origen desconocido que permanece más de 2 semanas sin signos de que se esté resolviendo.
- b.
Úlcera de etiología probable (tras hacer las pruebas diagnósticas correspondientes) que no responde tras 2 semanas de tratamiento adecuado.
- c.
Úlcera que se achaca a factores desencadenantes, que tras 2 semanas de haber suprimido esos factores no cura.
Biopsia punch o incisional: debe realizarse del borde de la lesión, incluyendo el área de la úlcera y la mucosa perilesional.
Estudio histopatológico de las aftas: se puede apreciar una infiltración por leucocitos, que puede variar en función de la duración y la severidad de la enfermedad. En fases iniciales, que preceden a la formación de las úlceras, predomina un infiltrado inflamatorio de linfocitos T y monocitos, junto con mastocitos aislados y células plasmáticas, que se acumulan bajo la capa basal. En estadios más avanzados predominan los leucocitos polimorfonucleares en el centro de la úlcera y células mononucleares en la periferia5. De acuerdo con Poulter y Lehner52, este tipo de inflamación no es específica de la AOR y se puede apreciar en otras úlceras como las del eritema multiforme, la enfermedad de Behçet, el lupus eritematoso o las úlceras traumáticas.
TratamientoA día de hoy no existe una terapia curativa definitiva para la AOR, por lo que el tratamiento tiene como objetivos primarios aliviar el dolor, acelerar la curación de las úlceras y disminuir la frecuencia y la gravedad de los episodios de AOR53.
Como ya hemos comentado previamente, ante la aparición de aftas recurrentes en la mucosa oral, debemos realizar un correcto diagnóstico diferencial y descartar enfermedades sistémicas asociadas y otras causas tratables, antes de llegar al diagnóstico de AOR y plantearnos el tratamiento de la misma.
El enfoque terapéutico debe realizarse según la gravedad clínica, la frecuencia y duración de los brotes, el historial médico del paciente y su capacidad para tolerar la medicación. En aquellos pacientes que presentan episodios aislados de AOR simple que duran solo unos pocos días, bastaría con tratamientos tópicos para aliviar el dolor y una serie de medidas generales, entre las que destaca mantener una buena higiene bucal. La terapia sistémica está indicada en pacientes que sufren múltiples episodios de AOR y/o casos severos que presentan dolor intenso, dificultad para alimentarse, y que no responden a la medicación tópica53,54.
A pesar de la frecuencia de esta dolencia, se han publicado escasos estudios de calidad que evalúen adecuadamente el tratamiento de la AOR, por lo que no existe una terapia estandarizada53. Por ello, se han empleado múltiples tratamientos tópicos y sistémicos con un éxito variable.
Medidas generalesHigiene bucal: es importante mantener una adecuada higiene bucal y evitar los traumatismos, ya que se ha demostrado que inducen la aparición de aftas32,55. Se recomienda usar un cepillo de dientes suave, pasta de dientes que no contenga lauril sulfato de sodio (Grado de recomendación [GR] A, Nivel de evidencia [NE] 1B)56,57 y el empleo de un enjuague bucal sin alcohol32,56,58.
Alimentación: no existen estudios relevantes que aborden adecuadamente el papel de la dieta en el manejo de la AOR. Por lo general, se deberían evitar aquellos productos que más frecuentemente se relacionan como desencadenantes de brotes, especialmente si el paciente refiere asociación con los mismos55,58.
Suplementos: es necesario descartar déficits nutricionales (vitamina B12, ácido fólico, hierro, cinc, etc.) en pacientes con AOR, ya que, en estos casos, los pacientes mejoran al recibir el tratamiento adecuado (GR C, NE 4). Además, un estudio evidencia que la vitamina B12 en pauta de 1.000μg sublinguales al día durante 6 meses podría disminuir el número de brotes y aliviar el dolor en todos los pacientes con AOR, independientemente de los niveles previos de la misma (GR B, NE 2B)57–59. También se han realizado estudios que muestran mejoría con la toma de 1.000mg diarios de omega-3 durante 6 meses (GR B, NE 2B)60. En cambio, el suplemento con otros complejos vitamínicos en pacientes sin déficits nutricionales no ha mostrado mejoría de la clínica ni disminución del número de lesiones (GR B, NE 2B)53,58,60,61.
Tratamientos tópicosAnestésicos tópicos y agentes barrera: proporcionan alivio del dolor. Se recomienda aplicarlos varias veces al día, preferentemente media hora antes de las comidas y de la higiene dental, para facilitar las mismas, y antes de acostarse. Se pueden usar en combinación con otros tratamientos, como corticoides tópicos o amlexanox. Entre los principales agentes anestésicos y protectores se encuentran:
- -
Lidocaína en crema al 1%, en gel al 2% o en espray: aplicado directamente sobre la superficie de las úlceras o en forma de enjuagues (GR B, NE 2A)61.
- -
Benzocaína en gel al 20%: anestésico local que alivia el dolor y disminuye la inflamación (GR B, NE 2A)62.
- -
Suspensión de sucralfato: complejo sacarosa-sulfato-hidróxido de aluminio que forma una barrera protectora en las úlceras. Varios estudios indican que la realización de enjuagues orales con 5ml, durante 1-2min, 4 veces al día (después de la higiene dental y antes de acostarse), alivia el dolor, acelera la curación y espacia los brotes (GR B, NE 2A)63,64.
Antisépticos y antiinflamatorios tópicos: ayudan a prevenir la sobreinfección por bacterias y hongos, y mejoran la higiene bucal.
- -
Triclosán al 0,15% en etanol y sulfato de cinc: en un estudio, aplicado en forma de enjuagues 3 veces al día, redujo el número de aftas y la intensidad del dolor, y aumentó el intervalo sin úlceras (GR A, NE 1B)64.
- -
Clorhexidina al 0,12-0,2% en enjuague oral: 5ml en forma de enjuagues durante 1-2min, 4 veces al día (después de la higiene dental y antes de acostarse)61. Algunos estudios parecen mostrar una menor eficacia frente a la suspensión de sucralfato (GR B, NE 2B)63.
- -
Diclofenaco al 3% en gel de ácido hialurónico al 2,5%: en un estudio demostró superioridad frente a lidocaína en gel en la reducción del dolor tras 2-6h (GR B, NE 2A)61,64.
Corticoides tópicos: son el tratamiento de primera línea en la AOR61 y se pueden combinar con anestésicos tópicos, antisépticos y agentes barrera. Proporcionan alivio del dolor y disminuyen la duración y la frecuencia de los brotes, aunque tardan varios días en hacer efecto. Son más efectivos si se empiezan a usar al principio del episodio y se aplican varias veces al día, preferentemente tras la higiene bucal y antes de acostarse, indicando al paciente que no debe comer ni beber al menos durante la siguiente media hora63,65. Existen varias opciones:
- -
Acetónido de triamcinolona al 0,1% en Orabase®: se aplica sobre las lesiones 3-4 veces al día, demostrando ser un tratamiento eficaz y seguro (GR B, NE 2B)61.
- -
Dexametasona solución (0,5mg/5cc) o pomada: realizar enjuagues de 5min, 3-4 veces al día, o aplicar la pomada en las úlceras 3 veces al día ha demostrado ser un tratamiento eficaz y seguro (GR A, NE 1B)60,65.
- -
Clobetasol al 0,05% en gel, pomada o en Orabase®: se aplica sobre las lesiones 2-3 veces al día. Es el corticoide de más potencia, por lo que se reserva para casos más severos61.
Amlexanox 5%: agente antiinflamatorio tópico que, aplicado en forma de pasta al 5% en las lesiones 4 veces al día (después de las comidas y antes de acostarse), ha demostrado eficacia en el manejo del dolor y la aceleración de la curación de las úlceras en varios estudios (GR B, NE 2B)53,57,62,66, siendo uno de los tratamientos tópicos más coste-eficaces, junto al acetónido de triamcinolona62.
Cauterización: mediante aplicación de solución de peróxido de hidrógeno al 0,5% o nitrato de plata al 1-2%, se consigue disminuir el dolor y acelerar la curación (GR B, NE 2B)57,58.
Otros tratamientos tópicos: se han empleado otros muchos tratamientos tópicos, como tetraciclinas en enjuague, doxiciclina en adhesivo para dentaduras, chicles de nicotina, difenhidramina líquida enjuagues o destilado de espina de camello, la mayoría descritos en estudios de poca calidad y con resultados dispares, no existiendo evidencia suficiente para recomendar su uso53,58,67,68.
Tratamientos sistémicosEn pacientes con episodios graves y/o frecuentes de AOR, refractarios a los cuidados generales y tratamientos tópicos descritos, se debe plantear añadir algún tratamiento sistémico, seleccionado en función de la gravedad clínica, las comorbilidades del paciente, su tolerancia y sus preferencias.
Primera líneaCorticoides orales: se han empleado con eficacia tanto en pautas largas a menor dosis, como prednisona oral 5mg/día durante 3 meses (GR B, NE 2A)68, como en pautas más cortas, con dosis de 20 a 40mg diarios durante 4 a 7 días, con posterior disminución progresiva de la dosis, consiguiendo alivio del dolor, aceleración de la curación de las aftas y disminución del número de episodios (GR B, NE 2A)53,55,57,58.
Segunda líneaEn aquellos pacientes que no responden al tratamiento intermitente con corticoides sistémicos, en aquellos que requieran cursos de corticoide frecuentes o más prolongados, o en los que no se puede realizar tratamiento con corticoide por otros motivos, se deben considerar otros agentes sistémicos alternativos.
Colchicina: fármaco antimitótico con ciertos efectos inmunomoduladores y antifibróticos. Se ha empleado a dosis de 0,5 a 2mg al día con diversos resultados53,57,58. En algunas publicaciones se considera uno de los fármacos sistémicos de elección, a dosis de 1 a 2mg diarios durante periodos largos, según la gravedad de la clínica y la tolerancia al medicamento57,58,69. En cambio, en la revisión Cochrane de 201253, tras revisar los estudios publicados, se llega a la conclusión de que no se trata de un fármaco útil al compararlo con los corticoides orales para el tratamiento de la AOR, ya que tiene unas tasas de eficacia iguales o menores que estos, pero con una mayor tasa de efectos secundarios, sobre todo gastrointestinales (GR B, NE 2A)53,70,71.
Talidomida: se ha empleado a dosis de 50 a 100mg al día durante varios meses con buenos resultados57,58,71. En un estudio realizado en Brasil, demostró ser más efectiva y mejor tolerada que dapsona, colchicina y pentoxifilina72. Es importante recordar que se trata de un fármaco teratógeno y que puede causar somnolencia, parestesias y neuropatía periférica irreversible, por lo que hay que informar y seleccionar correctamente a los pacientes, y sería recomendable que en todas las consultas de revisión se realizara una anamnesis y exploración para descartar signos de neuropatía periférica, y en caso de sospecharla, suspender el tratamiento y solicitar un electromiograma (GR B, NE 2B)57,58,71.
Dapsona: reduce el número y el tamaño de las aftas64. Se suele iniciar a 25-50mg al día, aumentando la dosis hasta un máximo de 150mg diarios según respuesta y tolerancia. Se recomienda realizar previamente una determinación de glucosa-6-fosfato deshidrogenasa (GR B, NE 2A)61,68.
Montelukast: inhibidor de leucotrienos que, en algunos ensayos, ha mostrado que puede mejorar el dolor y acelerar la curación de las úlceras orales, además de disminuir la aparición de nuevas lesiones, cuando se toma a una dosis de 10mg al día durante un mes, seguido de 10mg cada 2 días durante otro mes73. Presenta menor eficacia que prednisona, pero con menos efectos adversos y muy buena tolerancia, por lo que puede ser una buena opción en tratamientos a largo plazo (GR B, NE 2B)53,57,73.
Clofazimina: agente antimicrobiano. Se ha empleado en pauta de 100mg diarios durante 30 días, seguido por 100mg en días alternos durante 6 meses, con mejoría clínica y disminución del número de brotes frente a colchicina, en un estudio con alto riesgo de sesgos (GR B, NE 2B)53,70.
Beta-glucanos: variedad de polisacáridos que se encuentran en algunas bacterias, plantas y hongos. Se han empleado a dosis de 10mg de 1,3-1,6 beta-glucanos 2 veces al día, con mejoría de la escala de severidad de la úlcera en comparación con placebo53,74. No hay pruebas suficientes para apoyar o refutar su uso para el tratamiento de AOR (GR B, NE 2B)53.
Pentoxifilina: inhibidor no selectivo de la fosfodiesterasa con propiedades hemorreológicas. Inhibe particularmente la producción del TNF-alfa y posiblemente la producción de algunas otras células T-helper 1 y citocinas proinflamatorias, como la IL-1beta, que se cree que son importantes en el proceso de la AOR. Se ha empleado en pauta de 400mg cada 8h, con mejoría de las lesiones, pero con recidivas al suspenderlo. No existe evidencia suficiente para recomendar o no su uso (GR B, NE 2A)53,64.
Levamisol: fármaco antihelmíntico e inmunomodulador61. Se han publicado numerosos ensayos con dosis de 50mg cada 8h durante 3 a 11 días por brote, durante al menos 6 meses, con resultados de eficacia dispares, sin existir evidencia suficiente para recomendar o no su uso (GR B, NE 2A)53,63.
Doxiciclina: a dosis de 20mg cada 12h no mostró diferencias frente a placebo en un estudio con alto riesgo de sesgos (GR B, NE 2A)53.
Tratamientos biológicosAnti-TNF-alfa: se han publicado algunas series de casos en las que se emplean varios anti-TNF (etanercept, adalimumab, infliximab y golimumab) con éxito para el tratamiento de AOR grave y recalcitrante63,75. En estas publicaciones, parece que existe un efecto específico de clase, sin diferencias significativas entre los diferentes anti-TNF. Además, parece que el fallo a uno de ellos no implicaría falta de respuesta a otros anti-TNF (GR C, NE 4)63,75. La selección de estos fármacos debe basarse en la gravedad de la enfermedad, la eficacia, los posibles efectos adversos y el coste.
Otros tratamientosTerapia con láser CO2, Nd:YAG y láser diodo: en algunos estudios, la terapia con láser tuvo una eficacia similar o superior a la de los corticoides tópicos68, con disminución inmediata del dolor y aceleración de la curación de las aftas (GR B, NE 2A)54,58,76.
Apremilast: inhibidor de fosfodiesterasa-4 oral. Se ha publicado un caso de AOR major, refractaria a múltiples tratamientos tópicos y sistémicos, con desaparición completa de las lesiones tras 6 semanas de tratamiento con apremilast (inicio de dosis a 10mg diarios, con aumento progresivo hasta 30mg cada 12h), sin recidivas tras un año de tratamiento (GR C, NE 4)77.
Propóleo o própolis: material tipo resina producido por las abejas que se obtiene de los brotes del álamo y de las coníferas. En un estudio con alto riesgo de sesgos, con una cápsula diaria de 500mg durante 6 meses, los pacientes presentaron disminución del número de brotes, sin existir suficiente evidencia para recomendar o no su uso (GR B, NE 2A)53,78
Homeopatía: un estudio con alto riesgo de sesgos concluye que la homeopatía puede mejorar el dolor y acelerar la curación de las úlceras, sin existir suficiente evidencia para recomendar o no su uso (GR B, NE 2A)53,79.
Medicina china tradicional: algunas de estas terapias tradicionales se emplean desde hace cientos de años. En una revisión reciente se han tratado de evaluar los trabajos científicos al respecto, valorando varios de estos tratamientos como las pastillas Liuwei Dihuang (compuestas por Cornus officinalis, Rehmannia glutinosa, Rhizoma dioscoreae, Cortex moutan radicis, Poria cocos y Alisma plantago-aquatica), la bergamota, el polvo de Qingwei o las cápsulas Yiqingy, concluyendo que algunos tratamientos tradicionales de medicina china pueden ser efectivos y seguros en el tratamiento de la AOR, aunque sería necesario realizar estudios de calidad que lo confirmaran, no existiendo suficiente evidencia para recomendar su uso (GR B, NE2B)80.
Existen numerosas publicaciones de fármacos empleados en el tratamiento de las aftas orales que se manifiestan en enfermedades sistémicas, como la enfermedad de Behçet, pero no en la AOR propiamente dicha, como azatioprina, metotrexato, ciclosporina o interferón-alfa. Como no se ha comprobado su eficacia en la etiopatogenia de la formación de aftas ni estudiado su papel en casos de AOR, hemos decidido no incluir estos fármacos para evitar confusiones81–84.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.