La psoriasis suele preceder a la aparición de la artritis psoriásica (APs), por lo que los dermatólogos suelen enfrentarse al reto de identificar precozmente los signos de APs en pacientes con psoriasis. El objetivo fue validar la versión española del cuestionario PURE-4 como herramienta de cribado para la APs, evaluando su rendimiento en términos de sensibilidad, especificidad, viabilidad, fiabilidad y validez de constructo.
MétodosSe realizó un estudio transversal, observacional y multicéntrico en pacientes adultos con psoriasis. Inicialmente, los pacientes fueron evaluados por un dermatólogo y completaron dos versiones autoadministradas (en papel y electrónica) del cuestionario PURE-4. Después, el reumatólogo, ciego a los resultados del PURE-4, evaluó la presencia/ausencia de APs, siendo la referencia para determinar el rendimiento del cuestionario PURE-4.
ResultadosSe incluyeron 268 pacientes (115 [42,9%] mujeres; edad media, 47,1±12,6 años). Se diagnosticó de APs a 34 pacientes (12,7%) en una media (DE) de 1,4±1,6 semanas. La puntuación PURE-4 media para los pacientes con psoriasis diagnosticados de APs fue de 2,3±1,1, y de 1,3±1,3 para los pacientes sin APs (p<0,001). El punto de corte óptimo con mejor rendimiento para detectar APs fue ≥2 respuestas positivas, con valor predictivo negativo del 95,1% (intervalo de confianza 95%: 90,3-97,6).
ConclusionesEl cuestionario PURE-4 demostró un buen rendimiento para el cribado de APs, con un punto de corte óptimo ≥2. Esta sencilla herramienta podría facilitar la derivación temprana de los pacientes al servicio de reumatología.
Psoriasis often precedes the onset of psoriatic arthritis (PsA), so dermatologists often face the challenge of early identifying signs of PsA in patients with psoriasis. Our aim was to validate the Spanish version of the PURE-4 questionnaire as a screening tool for PsA, evaluate its performance in terms of sensitivity, specificity, feasibility, reliability, and build validity.
MethodsThis was a cross-sectional, observational, multicenter trial of adult patients with psoriasis. Initially, patients were assessed by a dermatologist and completed 2 self-administered versions (in print and online) of the PURE-4 questionnaire. Afterwards, the rheumatologist, blinded to the PURE-4 results, assessed the presence/absence of PsA, being the reference to determine the performance of the PURE-4 questionnaire.
ResultsA total of 268 patients were included (115 [42.9%] women; mean age, 47.1±12.6). The prevalence of PsA according to rheumatologist diagnosis was 12.7% (34 patients). The mean PURE-4 score for patients with psoriasis diagnosed with PsA was 2.3±1.1, and 1.3±1.3 for patients without PsA (P<.001). The cutoff value ≥2 demonstrated the best performance for detecting PsA, with a negative predictive value of 95.1% (95% confidence interval, 90.3-97.6).
ConclusionsThe PURE-4 questionnaire demonstrated good performance in detecting PsA, with an optimal cutoff point ≥2. This simple tool could facilitate early referral of patients to the rheumatology unit.
La psoriasis es una enfermedad dermatológica inflamatoria e inmunomediada que afecta aproximadamente al 1-3% de los adultos en Europa occidental1. La psoriasis puede asociarse con varias comorbilidades, entre ellas la artritis psoriásica (APs)2. La prevalencia estimada de la APs oscila entre el 0,05 y el 0,25% en la población general y entre el 6 y el 41% en los pacientes con psoriasis3. Generalmente, la psoriasis aparece antes que las manifestaciones clínicas de la APs4,5, lo que explica por qué los dermatólogos suelen ser los primeros especialistas que se enfrentan al reto de identificar a aquellos pacientes con riesgo de desarrollar APs.
Se estima una prevalencia de APs no diagnosticada entre los pacientes con psoriasis del 15-40%4,6,7. El diagnóstico es complejo y suele confirmarse tras varios años, evidenciando lagunas en la detección e intervención, cuando se sabe que el tratamiento precoz mejora los resultados clínicos y en salud8. Por ello, la identificación de APs entre los pacientes con psoriasis es crucial, ya que facilitaría la derivación rápida al reumatólogo tras la aparición de los primeros síntomas. Se ha recomendado al dermatólogo el seguimiento estrecho de signos de APs en pacientes con psoriasis al menos una vez al año e idealmente cada 6 meses, realizando una exploración física completa para comprobar si hay inflamación periférica y dactilitis, entesitis y dolor axial inflamatorio9.
Con el objetivo de facilitar la detección temprana de APs en las consultas de dermatología, se desarrolló y validó en una población francesa con psoriasis una herramienta sencilla, el cuestionario Psoriatic arthritis UnclutteRed screening Evaluation (PURE-4)10. El PURE-4 tiene como puntos fuertes su viabilidad en la práctica clínica, una buena capacidad de discriminación y valores de sensibilidad y especificidad elevados (85,7% y 83,6%, respectivamente)10. El cuestionario se ha adaptado culturalmente al español siguiendo la metodología estándar11, y los expertos recomiendan su uso debido al reducido número de ítems9. El objetivo de este estudio es validar la versión española del PURE-4 en términos de sensibilidad, especificidad, factibilidad, fiabilidad y validez de constructo. Además, se evaluó su versión electrónica con asistente virtual (chatbot).
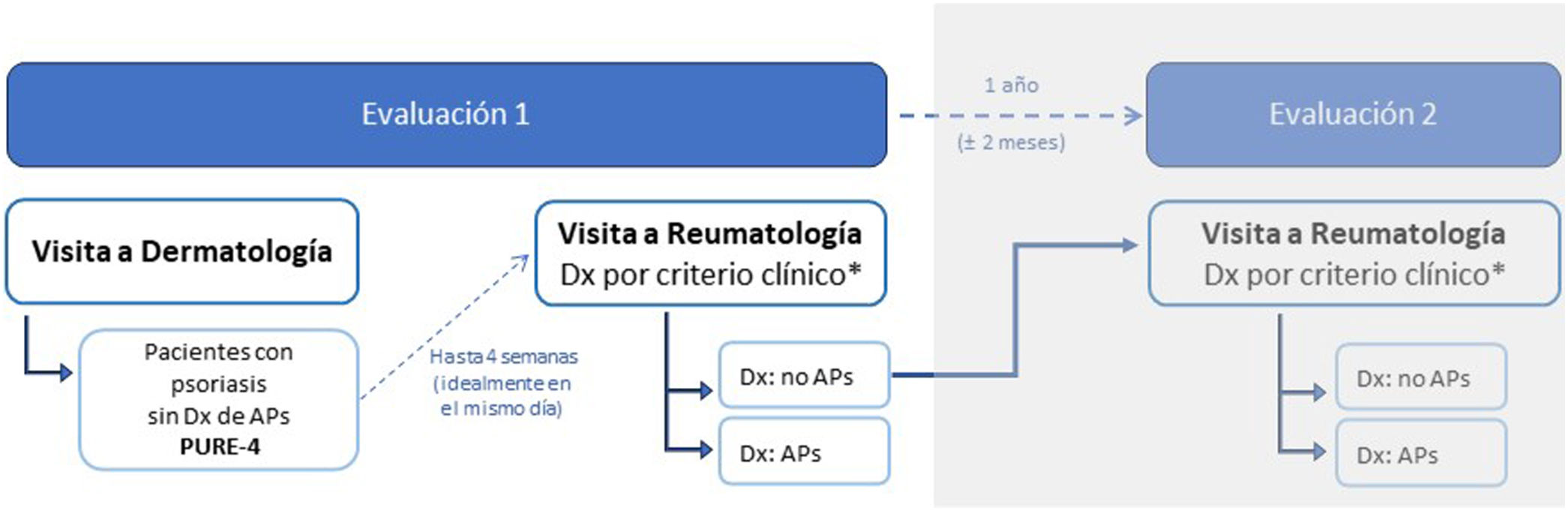
MétodosDiseño del estudio y participantesEstudio observacional y multicéntrico realizado en 19 hospitales de España, con dos evaluaciones transversales. La primera evaluación incluyó a pacientes con psoriasis, sin diagnóstico de APs, y fue realizada por dermatólogos y reumatólogos durante las visitas rutinarias. La segunda evaluación incluyó a pacientes sin diagnóstico de APs (en la evaluación 1) y fue realizada por los mismos reumatólogos un año después (±2 meses) para determinar la presencia de APs (fig. 1). Los resultados de la evaluación 2 no se incluyen en este artículo.
Entre el 15 de noviembre y el 30 de diciembre de 2020, se reclutaron pacientes adultos con psoriasis sin diagnóstico previo de APs que podían responder al cuestionario PURE-4 en papel y en formato electrónico. Teniendo en cuenta que la probabilidad de encontrar APs en pacientes con psoriasis moderada-grave aumenta, y para garantizar una prevalencia de APs del 15%, al menos el 60% de los pacientes incluidos debían tener psoriasis moderada-grave (Índice de Área y Gravedad de la Psoriasis [PASI] ≥7)12,13. Todos los participantes firmaron el consentimiento informado antes del reclutamiento. El estudio fue aprobado por el Comité Ético del Hospital de Bellvitge (referencia PR384/20 [CSI 20/89]) y se llevó a cabo siguiendo los principios descritos en la Declaración de Helsinki.
ProcedimientosLa primera visita al dermatólogo fue seguida de una visita independiente al reumatólogo (idealmente, el mismo día, o máximo en las 4 semanas siguientes a la visita del dermatólogo). En el momento de la inclusión, se registraron los datos demográficos y clínicos (apartado «Métodos suplementarios», en el material adicional) y los pacientes cumplimentaron la versión en papel del PURE-4. Antes de finalizar la visita, el dermatólogo proporcionó al paciente la versión electrónica del PURE-4 y recogió las opiniones y preferencias del paciente respecto a las versiones en papel y electrónica del cuestionario. Posteriormente, el reumatólogo, ciego a los resultados del PURE-4, evaluó la presencia/ausencia de APs basándose en la historia clínica y exploración del paciente. Cuando fueron necesarias pruebas complementarias para el diagnóstico de la APs según la práctica clínica, se permitieron 2 meses adicionales para confirmarlo.
Cuestionario PURE-4El cuestionario PURE-4 se compone de 4 preguntas con respuesta afirmativa o negativa sobre los signos de dactilitis, dolor inflamatorio en el talón, dolor bilateral en los glúteos y dolor articular periférico con inflamación antes de los 50 años (figura S1 del material adicional). Cada respuesta positiva suma 1 punto, siendo la puntuación máxima la suma de las respuestas «Sí» (de 0 a 4 puntos)10. También se evaluó una versión electrónica del cuestionario PURE-4 en español, apoyada por un chatbot o asistente virtual, con información e imágenes del significado de los ítems.
Medidas del estudioSe examinó el rendimiento del cuestionario español PURE-4 en papel, tomando como referencia el diagnóstico clínico confirmado por el reumatólogo. Se compararon las percepciones de los pacientes (sencillo, rápido, cómodo y útil) de las versiones en papel y electrónica, con una escala visual analógica de 0 a 10, y las preferencias de los pacientes entre ambas versiones.
Análisis de los datosLos datos se presentan como media±desviación estándar (o mediana y rango intercuartílico) para las variables cuantitativas y como frecuencias y porcentajes para las variables categóricas. Las comparaciones entre los participantes con y sin APs se realizaron mediante la prueba t de Student, la prueba exacta de Fisher y la prueba de Mantel-Haenszel, según procediera. Se utilizó la curva receiver operating characteristic (ROC) y el área bajo la curva (AUC) para evaluar el rendimiento del PURE-4 para detectar la APs, y se analizaron la validez, la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y el índice de Youden, para encontrar la puntuación de corte óptima para la clasificación de los pacientes. Las pruebas de validación adicionales se describen en los «Métodos suplementarios» del material adicional. Mediante el coeficiente de correlación intraclase (CCI) se evaluó la coherencia interna entre las versiones en papel y electrónica del cuestionario. Los análisis estadísticos se realizaron con el programa informático SAS versión 7.15.
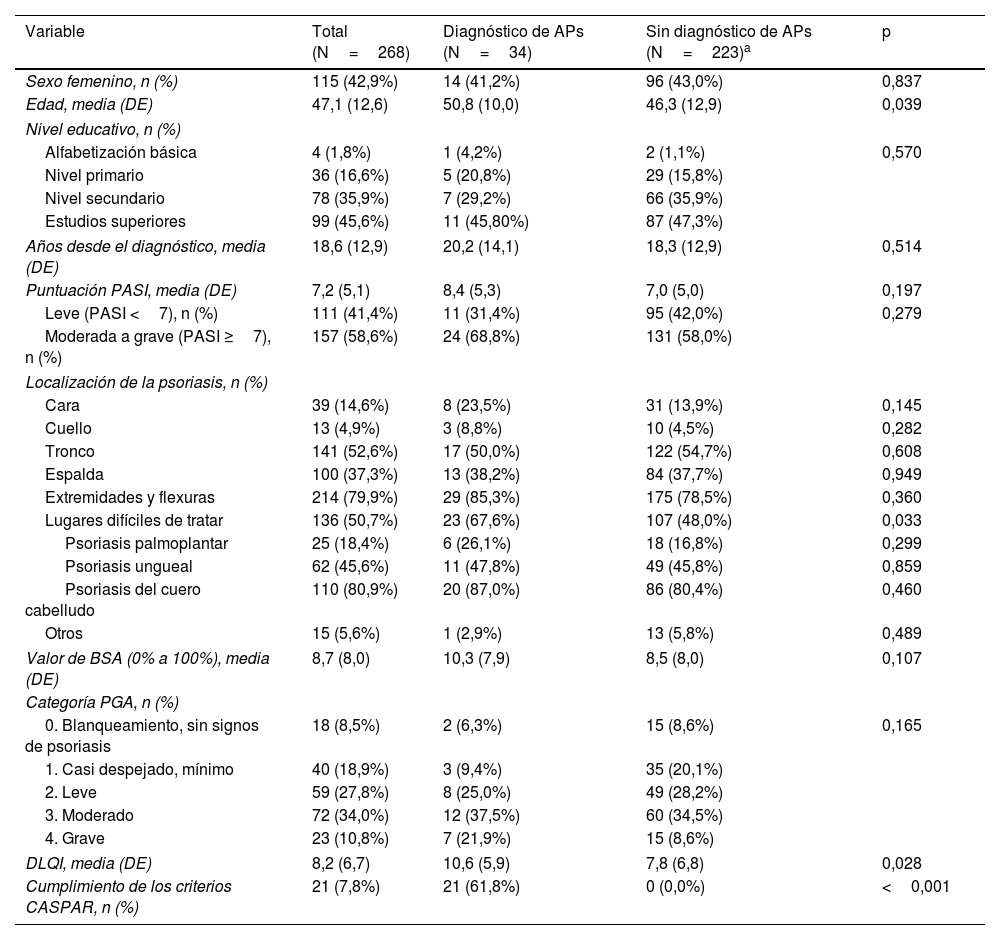
ResultadosParticipantes del estudio y evaluaciones clínicasSe reclutaron 283 pacientes con psoriasis; se excluyeron 3 porque presentaban APs u otra afección reumatológica y 12 porque no acudieron a la consulta de reumatología. El análisis final incluyó a 268 pacientes (115 [42,9%] mujeres; edad media, 47,1±12,6). La tabla 1 muestra los datos demográficos y clínicos de los pacientes con y sin APs. La puntuación PASI media fue de 7,2±5,1. Un total de 238 (88,8%) pacientes recibían tratamiento activo para la psoriasis. El tiempo medio entre la consulta dermatológica y la reumatológica fue de 1,4±1,6 semanas. En la evaluación 1, la prevalencia de APs basada en el diagnóstico del reumatólogo fue del 12,7% (n=34); no fue posible confirmar ni descartar el diagnóstico de APs en 11 pacientes, incluso una vez obtenidos los resultados de las pruebas complementarias dentro de este periodo. En general, las localizaciones de psoriasis más frecuentes fueron las extremidades y zonas de flexión (APs 85,3% vs. no APs 78,5%; p=0,360), tronco (APs 50,0% vs. no APs 54,7%; p=0,608) y localizaciones difíciles de tratar (APs 67,6% vs. no APs 48,0%; p=0,033). La información sobre signos inflamatorios, hallazgos de imagen y pruebas complementarias se muestra en la tabla S1 del material adicional.
Características demográficas y clínicas de todos los pacientes con psoriasis y de aquellos con y sin APs
| Variable | Total (N=268) | Diagnóstico de APs (N=34) | Sin diagnóstico de APs (N=223)a | p |
|---|---|---|---|---|
| Sexo femenino, n (%) | 115 (42,9%) | 14 (41,2%) | 96 (43,0%) | 0,837 |
| Edad, media (DE) | 47,1 (12,6) | 50,8 (10,0) | 46,3 (12,9) | 0,039 |
| Nivel educativo, n (%) | ||||
| Alfabetización básica | 4 (1,8%) | 1 (4,2%) | 2 (1,1%) | 0,570 |
| Nivel primario | 36 (16,6%) | 5 (20,8%) | 29 (15,8%) | |
| Nivel secundario | 78 (35,9%) | 7 (29,2%) | 66 (35,9%) | |
| Estudios superiores | 99 (45,6%) | 11 (45,80%) | 87 (47,3%) | |
| Años desde el diagnóstico, media (DE) | 18,6 (12,9) | 20,2 (14,1) | 18,3 (12,9) | 0,514 |
| Puntuación PASI, media (DE) | 7,2 (5,1) | 8,4 (5,3) | 7,0 (5,0) | 0,197 |
| Leve (PASI <7), n (%) | 111 (41,4%) | 11 (31,4%) | 95 (42,0%) | 0,279 |
| Moderada a grave (PASI ≥7), n (%) | 157 (58,6%) | 24 (68,8%) | 131 (58,0%) | |
| Localización de la psoriasis, n (%) | ||||
| Cara | 39 (14,6%) | 8 (23,5%) | 31 (13,9%) | 0,145 |
| Cuello | 13 (4,9%) | 3 (8,8%) | 10 (4,5%) | 0,282 |
| Tronco | 141 (52,6%) | 17 (50,0%) | 122 (54,7%) | 0,608 |
| Espalda | 100 (37,3%) | 13 (38,2%) | 84 (37,7%) | 0,949 |
| Extremidades y flexuras | 214 (79,9%) | 29 (85,3%) | 175 (78,5%) | 0,360 |
| Lugares difíciles de tratar | 136 (50,7%) | 23 (67,6%) | 107 (48,0%) | 0,033 |
| Psoriasis palmoplantar | 25 (18,4%) | 6 (26,1%) | 18 (16,8%) | 0,299 |
| Psoriasis ungueal | 62 (45,6%) | 11 (47,8%) | 49 (45,8%) | 0,859 |
| Psoriasis del cuero cabelludo | 110 (80,9%) | 20 (87,0%) | 86 (80,4%) | 0,460 |
| Otros | 15 (5,6%) | 1 (2,9%) | 13 (5,8%) | 0,489 |
| Valor de BSA (0% a 100%), media (DE) | 8,7 (8,0) | 10,3 (7,9) | 8,5 (8,0) | 0,107 |
| Categoría PGA, n (%) | ||||
| 0. Blanqueamiento, sin signos de psoriasis | 18 (8,5%) | 2 (6,3%) | 15 (8,6%) | 0,165 |
| 1. Casi despejado, mínimo | 40 (18,9%) | 3 (9,4%) | 35 (20,1%) | |
| 2. Leve | 59 (27,8%) | 8 (25,0%) | 49 (28,2%) | |
| 3. Moderado | 72 (34,0%) | 12 (37,5%) | 60 (34,5%) | |
| 4. Grave | 23 (10,8%) | 7 (21,9%) | 15 (8,6%) | |
| DLQI, media (DE) | 8,2 (6,7) | 10,6 (5,9) | 7,8 (6,8) | 0,028 |
| Cumplimiento de los criterios CASPAR, n (%) | 21 (7,8%) | 21 (61,8%) | 0 (0,0%) | <0,001 |
APs: artritis psoriásica; BSA (Body surface area): superficie corporal; CASPAR: criterios de clasificación de la artritis psoriásica; DE: desviación estándar; DLQI: índice de calidad de vida dermatológica; PASI: índice de área y gravedad de la psoriasis; PGA (Physician's Global Assessment): evaluación global del médico.
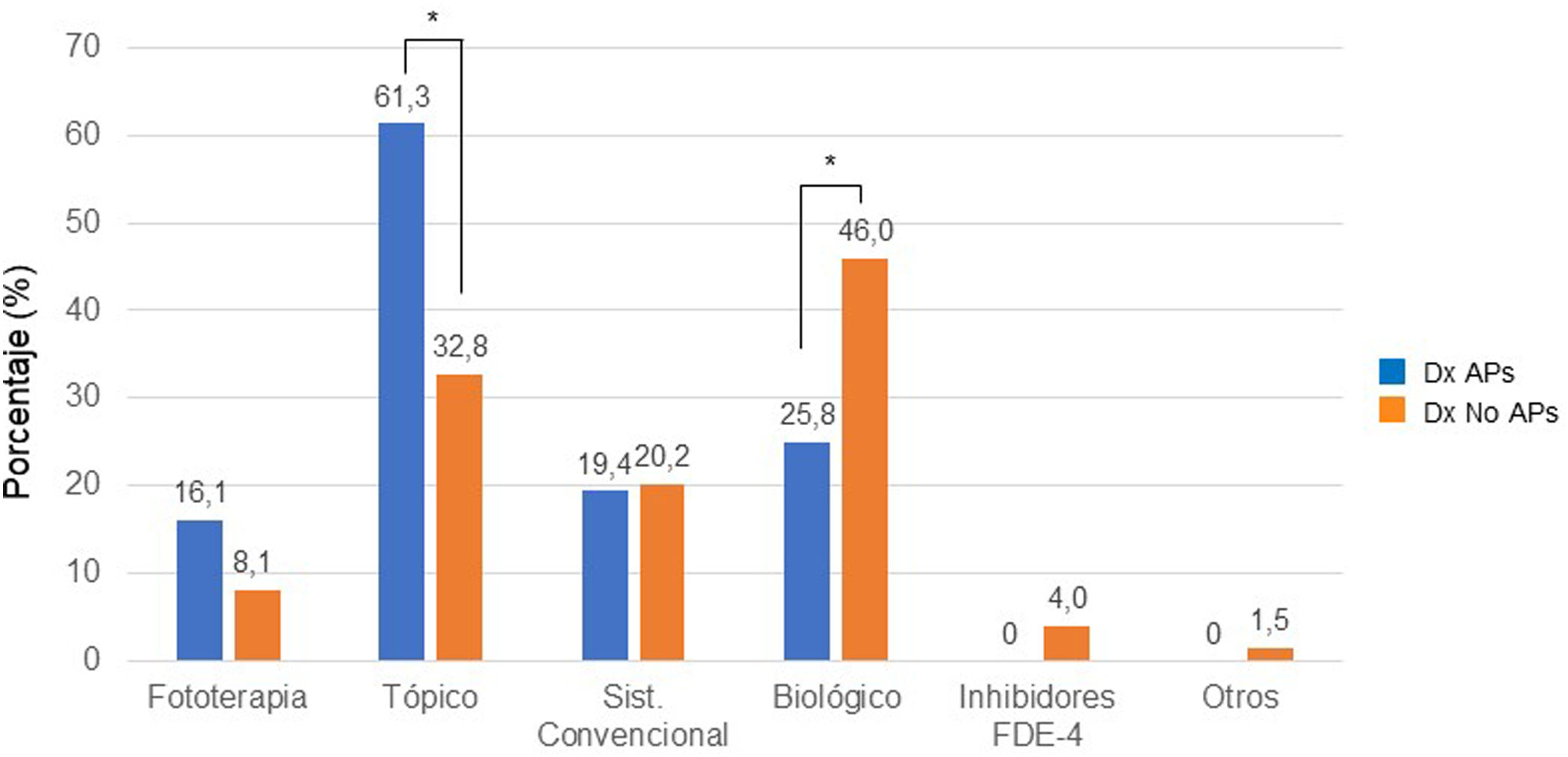
La figura 2 ilustra la distribución del tratamiento actual de la psoriasis entre los pacientes con y sin APs. Recibían tratamiento biológico el 25,8% de los pacientes con APs vs. el 46,0% de los pacientes sin APs (p=0,035), mientras que los tratamientos tópicos eran utilizados por el 61,3% vs. 32,8%, respectivamente (p=0,002).
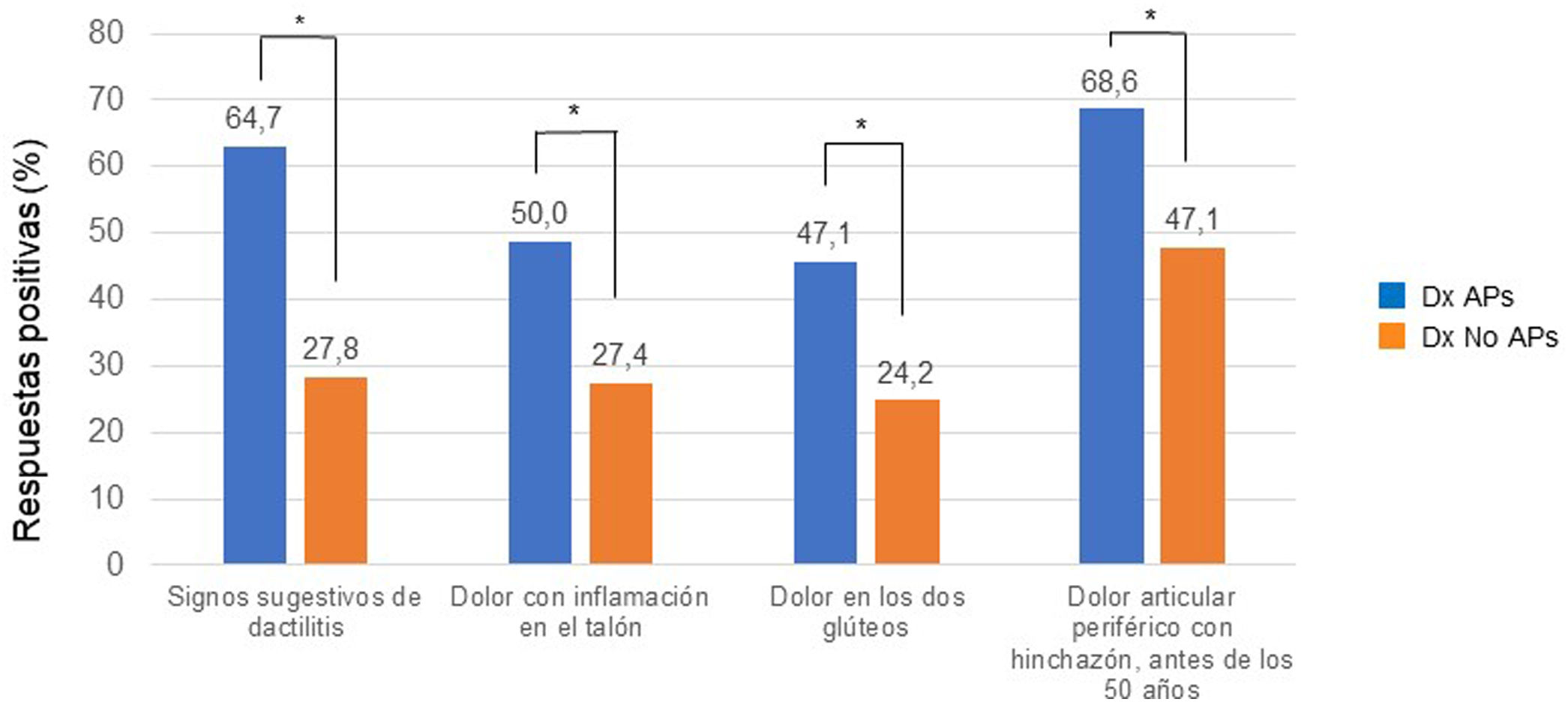
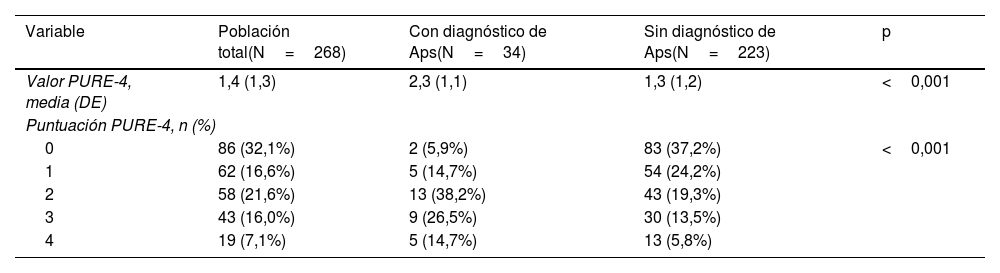
Respuestas al cuestionario y resultados del cribadoTodos los pacientes cumplimentaron el cuestionario PURE-4 en papel. En la tabla 2 se muestra la puntuación media del PURE-4 entre los pacientes con APs de 2,3±1,1, y de 1,3±1,3 entre los pacientes sin diagnóstico de APs (p<0,001). El dolor articular periférico con inflamación antes de los 50 años fue el ítem más frecuentemente respondido afirmativamente por 137 (51,1%) pacientes (fig. 3).
Resultados del PURE-4 en la Evaluación 1
| Variable | Población total(N=268) | Con diagnóstico de Aps(N=34) | Sin diagnóstico de Aps(N=223) | p |
|---|---|---|---|---|
| Valor PURE-4, media (DE) | 1,4 (1,3) | 2,3 (1,1) | 1,3 (1,2) | <0,001 |
| Puntuación PURE-4, n (%) | ||||
| 0 | 86 (32,1%) | 2 (5,9%) | 83 (37,2%) | <0,001 |
| 1 | 62 (16,6%) | 5 (14,7%) | 54 (24,2%) | |
| 2 | 58 (21,6%) | 13 (38,2%) | 43 (19,3%) | |
| 3 | 43 (16,0%) | 9 (26,5%) | 30 (13,5%) | |
| 4 | 19 (7,1%) | 5 (14,7%) | 13 (5,8%) | |
APs: artritis psoriásica; DE: desviación estándar; PURE-4: Psoriatic arthritis UnclutteRed screening Evaluation.
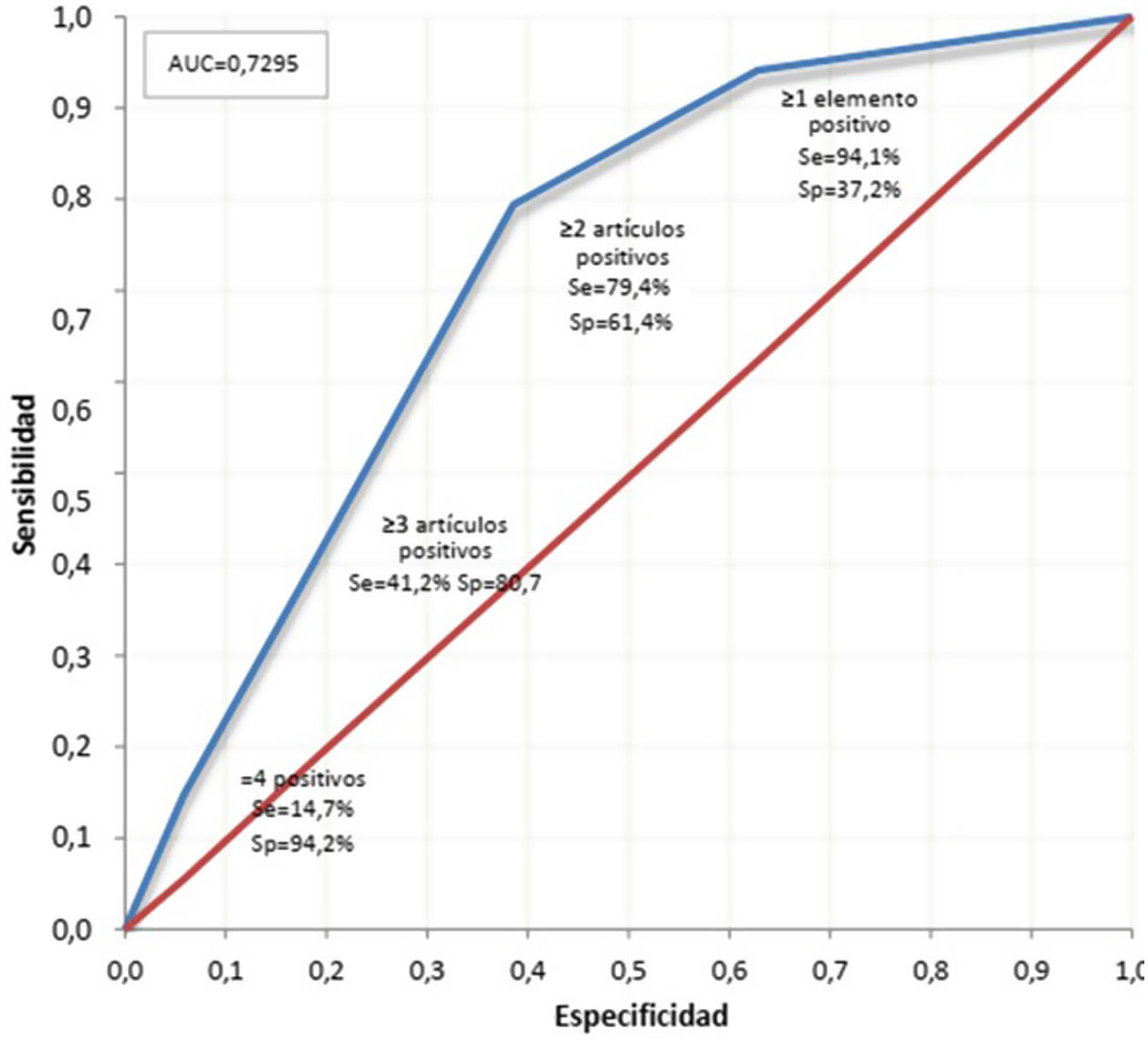
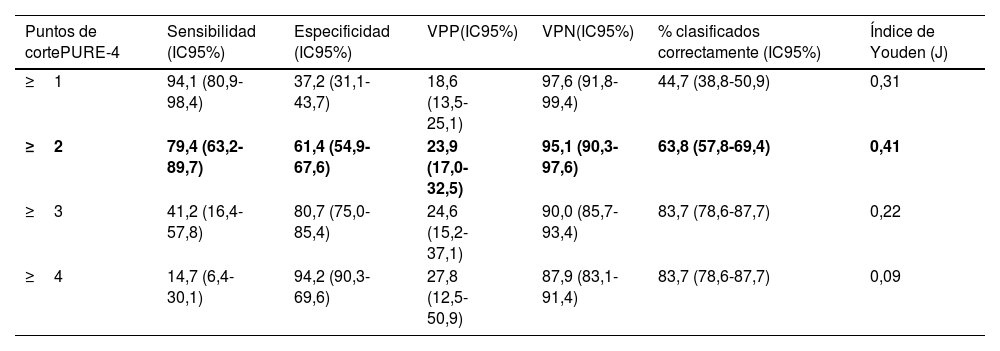
Utilizando el índice de Youden, el punto de corte óptimo fue ≥2, con el mayor porcentaje de pacientes correctamente clasificados, mostrando una sensibilidad del 79,4% (intervalo de confianza del 95% [IC95%]: 63,2-89,7) y una especificidad del 61,4% (IC95%: 54,9-67,6%) para detectar la APs (tabla 3). El 63,8% de los pacientes fueron clasificados igual por el cuestionario PURE-4 y el reumatólogo, con un valor predictivo negativo del 95,1%. La curva ROC mostró una AUC de 0,729 (IC95%: 0,649-0,809) (fig. 4), lo que indica un buen rendimiento del PURE-4. La distribución de los pacientes según los resultados del PURE-4 se muestra en la figura S2 del material adicional.
Sensibilidad y especificidad del cuestionario PURE-4 con las diferentes puntuaciones de corte
| Puntos de cortePURE-4 | Sensibilidad (IC95%) | Especificidad (IC95%) | VPP(IC95%) | VPN(IC95%) | % clasificados correctamente (IC95%) | Índice de Youden (J) |
|---|---|---|---|---|---|---|
| ≥1 | 94,1 (80,9-98,4) | 37,2 (31,1-43,7) | 18,6 (13,5-25,1) | 97,6 (91,8-99,4) | 44,7 (38,8-50,9) | 0,31 |
| ≥2 | 79,4 (63,2-89,7) | 61,4 (54,9-67,6) | 23,9 (17,0-32,5) | 95,1 (90,3-97,6) | 63,8 (57,8-69,4) | 0,41 |
| ≥3 | 41,2 (16,4-57,8) | 80,7 (75,0-85,4) | 24,6 (15,2-37,1) | 90,0 (85,7-93,4) | 83,7 (78,6-87,7) | 0,22 |
| ≥4 | 14,7 (6,4-30,1) | 94,2 (90,3-69,6) | 27,8 (12,5-50,9) | 87,9 (83,1-91,4) | 83,7 (78,6-87,7) | 0,09 |
IC: intervalo de confianza; PURE-4: Psoriatic arthritis UnclutteRed screening Evaluation; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
La consistencia interna del cuestionario PURE-4 obtuvo un valor α de Cronbach de 0,610, indicativo de buena consistencia. El material adicional (tabla S2 del material adicional) describe la relación entre la puntuación de PURE-4 y las variables clínicas evaluadas por los reumatólogos (dactilitis, entesitis, dolor lumbar inflamatorio y dolor articular periférico), siendo todas ellas estadísticamente significativas (p<0,05). La puntuación media de PURE-4 (2,19±1,29) fue significativamente mayor en los pacientes que cumplían los criterios CASPAR que en los que no los cumplían (1,29±1,26; p=0,002). El porcentaje de concordancia entre ambos criterios diagnósticos (PURE-4 y CASPAR) fue del 61,4%.
Versiones en papel y electrónica del cuestionario PURE-4Para la comparación de ambas versiones del cuestionario se incluyó a los 280 pacientes de los que se disponía la información. El 98,9% (n=277) completaron las dos versiones del cuestionario, y sólo 16 (5,8%) pacientes necesitaron ayuda del asistente virtual. Las respuestas en ambas versiones del cuestionario PURE-4 presentaron una buena correlación (CCI=0,965) y ambas se consideraron herramientas sencillas, rápidas, cómodas y útiles, aunque el cuestionario en papel recibió una valoración ligeramente superior (material adicional, tabla S3). Más pacientes prefirieron la versión en papel (39,0%) que la versión electrónica (27,6%); un tercio valoró ambas opciones por igual (33,5%).
DiscusiónEste estudio estuvo motivado por la necesidad de abordar el reto que supone el reconocimiento temprano de la APs por parte de los dermatólogos que atienden a pacientes con psoriasis. Según los resultados, el rendimiento del cuestionario PURE-4 fue ligeramente mejor que el publicado para otras herramientas de cribado de APs, como la Psoriatic Arthritis Screening Evaluation (PASE), la Psoriasis Epidemiology Screening Tool (PEST), el Toronto Psoriatic Arthritis Screen (ToPAS) o el cuestionario CONTEST14,15, aunque la precisión diagnóstica muestra gran heterogeneidad según la herramienta de cribado16.
El análisis de la curva ROC mostró buenos valores de predicción negativa para la detección de la APs, lo que indica que el cuestionario PURE-4 es adecuado para su uso como herramienta de cribado inicial, aunque con cierta probabilidad de resultados falsos positivos. Por lo tanto, los pacientes con un resultado superior a la puntuación de corte (>2) deben someterse a un examen reumatológico formal para verificar el diagnóstico de APs, lo que está en consonancia con la naturaleza de una prueba de cribado. Los beneficios del cuestionario PURE-4 son varios: es un método de cribado rápido y útil en consultas sobrecargadas; agiliza la derivación a reumatología y la eventual confirmación de la APs9; y aumenta la posibilidad de que los pacientes reciban el tratamiento adecuado para reducir el deterioro de su calidad de vida17.
En nuestra cohorte, la prevalencia de APs fue del 12,7%, similar a la del estudio de validación realizado por Audureau et al.10, aunque ellos utilizaron los criterios CASPAR como referencia. Aunque la gravedad y la duración de la psoriasis parecen elevar el riesgo de desarrollar APs18,19, en nuestro estudio la gravedad de la psoriasis fue similar entre los que tenían o no APs, excepto en las zonas difíciles de tratar, que eran más frecuentes en aquellos con APs. Además, la calidad de vida, evaluada mediante el Dermatology Life Quality Index, estaba más afectada en pacientes con APs. Datos recientes indican que la terapia biológica también podría influir en la incidencia de APs, disminuyendo o retrasando el riesgo de afectación articular20–22. Nuestros resultados mostraron que los pacientes que recibían terapia biológica tenían una menor frecuencia de APs. En cualquier caso, sería conveniente buscar activamente manifestaciones de APs al menos una vez al año e idealmente cada 6 meses9, independientemente del tratamiento que reciba el paciente o de la gravedad de la psoriasis.
Las herramientas digitales pueden fomentar el autocuidado de los pacientes y facilitar una comunicación más eficaz entre pacientes y médicos, lo que mejoraría el manejo clínico a largo plazo23. En este contexto, el uso de las nuevas tecnologías representa un valioso facilitador para la implantación del cribado digital de la APs24, permitiendo un seguimiento más activo de los pacientes con psoriasis. La versión electrónica del cuestionario PURE-4 demostró una alta correlación (CCI=0,963) con el cuestionario convencional. Esta herramienta podría facilitar la detección (a distancia) de síntomas articulares, de forma sencilla y rápida. Puesto que un tratamiento oportuno puede reducir los síntomas cutáneos, el dolor y la inflamación subclínica25,26, un método de detección preciso tiene el potencial de cambiar el curso clínico de la APs. Una intervención más temprana puede prevenir la progresión de la artritis, reducir los brotes y, por tanto, mejorar el control de la enfermedad y la calidad de vida27.
Las limitaciones de este estudio son las siguientes: aunque las dos modalidades de la versión española el cuestionario PURE-4 podrían utilizarse para facilitar la detección de la APs, los resultados son aplicables al contexto español y pueden no ser generalizables a otros países. Además, para minimizar el sesgo de selección, todos los participantes cumplimentaron el cuestionario PURE-4 independientemente de la presencia o ausencia de signos de APs, aunque sin diagnóstico clínico confirmado. Si bien pudiera percibirse como una limitación del flujo de pacientes atendidos en consultas de dermatología, el presente estudio fue diseñado para la validación del PURE-4 para la temprana detección de APs tras su adaptación lingüística11. Por ello se estableció que al menos el 60%12 de la muestra tuviera psoriasis moderada-grave, definida por un PASI≥713, ya que la psoriasis moderada-grave presenta mayor riesgo de aparición de APs5. Por otro lado, el 43% de los pacientes recibían terapia biológica, lo que probablemente haya disminuido la probabilidad de incidencia relacionada con la APs20–22,28. Otra limitación, que sólo afecta a la comparación entre las versiones en papel y electrónica del PURE-4, es el hecho de que los pacientes completaran ambas versiones en la misma visita y orden, lo que pudo producir un sesgo de recuerdo en las respuestas del cuestionario electrónico. Sin embargo, esto no influye en el objetivo principal del estudio, ya que la versión en papel se administró siempre en primer lugar, careciendo del efecto de aprendizaje.
En conclusión, la versión española del cuestionario PURE-4 ha sido validada con métodos rigurosos en términos de sensibilidad, especificidad, viabilidad y validez de constructo para el cribado de la APs. El punto de corte óptimo fue ≥2, con una consistencia interna aceptable. Tanto su versión en papel como electrónica fueron muy bien valoradas por los pacientes, con proporciones similares de pacientes que preferían la versión en papel, la electrónica o ambas. Así pues, este cuestionario podría guiar la derivación temprana a reumatología reduciendo el retraso en el diagnóstico y el tratamiento de la APs. Esta herramienta debería considerarse como un complemento para el dermatólogo a la hora de explorar en profundidad los signos y síntomas de la APs en el paciente con psoriasis.
FinanciaciónEste estudio ha sido financiado por Novartis Farmacéutica S.A., España, siguiendo las buenas prácticas de publicación (GPP-2022).
Conflicto de interesesIsabel Belinchón Romero ha recibido honorarios como consultora y/o ponente y ha participado en ensayos clínicos esponsorizados por las siguientes compañías farmacéuticas en cuyo arsenal terapéutico hay fármacos usados para tratar la psoriasis: Janssen Pharmaceuticals Inc, Almirall SA, Lilly, AbbVie, Novartis, Celgene, Biogen, Amgen, Leo-Pharma, Pfizer-Wyeth, BMS, UCB, y MSD.
Ana López-Ferrer ha recibido honorarios por su participación como miembro de comités científicos, consultora y/o ponente y ha recibido becas por investigación o participación en ensayos clínicos de las siguientes compañías farmacéuticas (pero no en relación con este manuscrito): AbbVie, Almirall, Amgen, Janssen, LEO Pharma, MSD, Eli Lilly, Novartis y UCB Pharma.
Marta Ferran i Farrés ha recibido honorarios como consultora y/o ponente y ha participado en ensayos clínicos esponsorizados por las siguientes compañías farmacéuticas: Janssen Pharmaceuticals Inc, Eli Lilly, Novartis, Pfizer-Wyeth, MSD, AbbVie, Celgene, y Almirall SA.
Raquel Rivera Díaz ha recibido honorarios como consultora y/o ponente y ha participado en ensayos clínicos esponsorizados por las siguientes compañías farmacéuticas: AbbVie, Almirall SA, Celgene, GSK, Janssen Pharmaceuticals Inc, Eli Lilly, Leo-Pharma, MSD, Novartis, Pfizer-Wyeth, y UCB.
David Vidal Sarro ha recibido honorarios como consultor y/o ponente y ha participado en ensayos clínicos esponsorizados por las siguientes compañías farmacéuticas: AbbVie, Celgene, Eli Lilly, Janssen Pharmaceuticals Inc, Novartis, Gebro Pharma, Leo-Pharma, y UCB.
Lourdes Rodríguez Fernández-Freire ha recibido honorarios como consultora y/o de las siguientes compañías farmacéuticas: AbbVie, Janssen Pharmaceuticals Inc, MSD, Pfizer-Wyeth, Novartis, Celgene, Almirall SA, Eli Lilly, y Leo-Pharma.
Pablo de la Cueva Dobao ha recibido honorarios como consultor y/o ponente y ha participado en ensayos clínicos esponsorizados por las siguientes compañías farmacéuticas: AbbVie, Almirall SA, Astellas Pharma, Biogen Inc., Boehringer Ingelheim, Celgene, Janssen Pharmaceuticals Inc, LEO Pharma, Eli Lilly, MSD, Novartis, Pfizer y UCB.
Jorge Santos Juanes ha recibido honorarios como consultor y/o ponente de las siguientes compañías farmacéuticas: Novartis, Eli Lilly, Janssen Pharmaceuticals Inc, AbbVie, Amgen, y Sanofi.
Vicenç Rocamora Duran ha recibido honorarios como consultor y/o ponente de las siguientes compañías farmacéuticas: Janssen Pharmaceuticals Inc, Eli Lilly, AbbVie, Almirall, Amgen, and Novartis.
Víctor Martín Vázquez y Lara Gómez Labradror son empleados de Novartis en España.
Ruben Queiro ha recibido honorarios como consultor, ponente y coordinador de proyectos de las siguientes compañías farmacéuticas: Abbvie, Lilly, UCB, Janssen, Pfizer, Amgen, Novartis, y ha recibido becas de Janssen, Novartis y Abbvie.
Los autores desean agradecer a Anabel Herrero, PhD, en nombre de Springer Healthcare, el apoyo editorial y la ayuda en la redacción del manuscrito.