Debido a la eclosión en el último quinquenio de nuevas alternativas terapéuticas para la dermatitis atópica (DA), nos planteamos estudiar la supervivencia actual de la ciclosporina (CsA) en esta patología. La CsA, como paso necesario solicitado por el Sistema Nacional de Salud de España para la autorización de otros tratamientos sistémicos, podría presentar una supervivencia menor que en otras enfermedades.
Material y métodoEstudio multicéntrico, observacional, de cohortes prospectivo para el que se recogieron pacientes incluidos en el Registro Español de Dermatitis Atópica (BIOBADATOP). Como cohorte de comparación se emplearon los datos del Registro Español de tratamientos sistémicos en Psoriasis (BIOBADADERM).
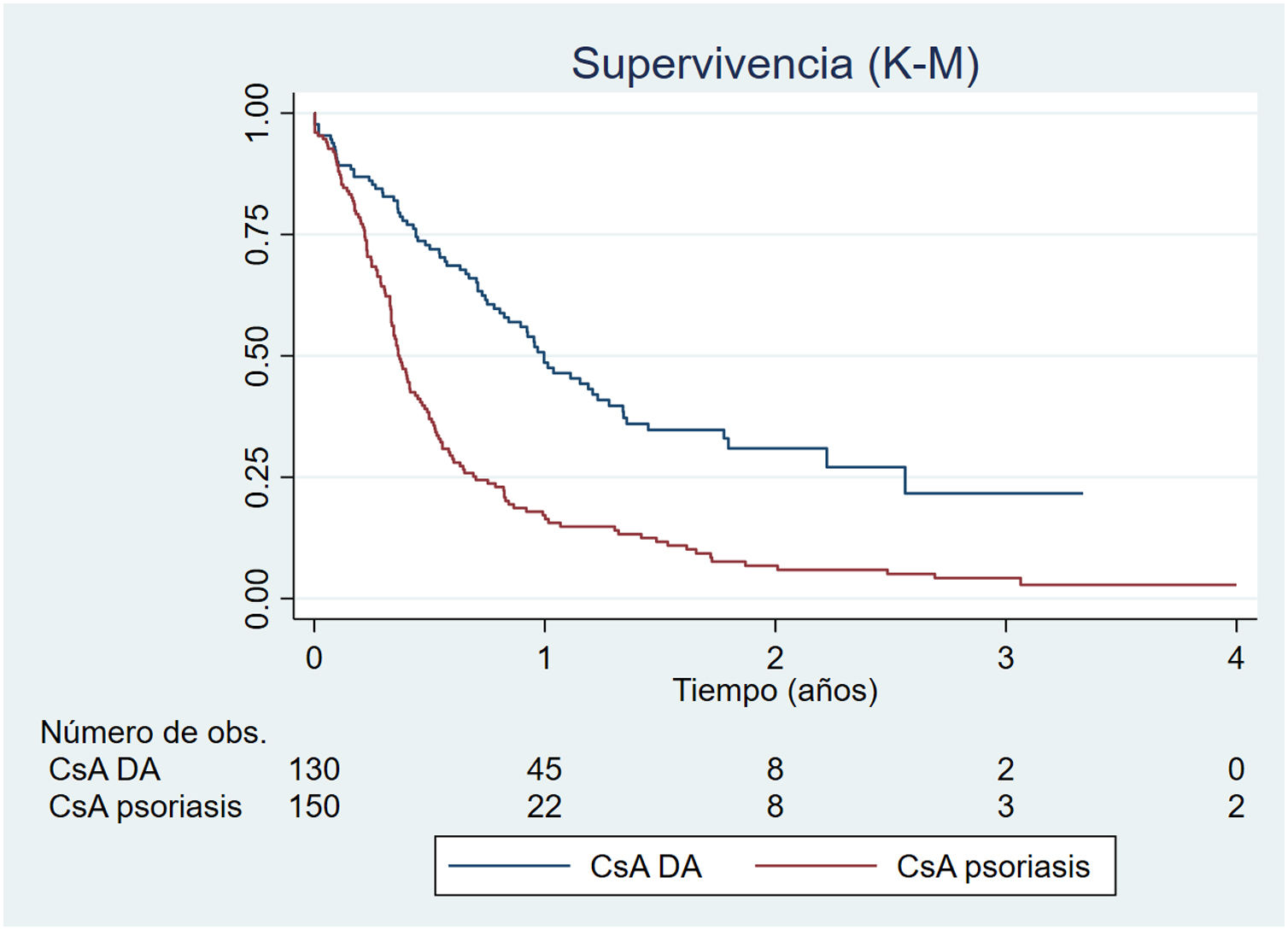
ResultadosSe incluyeron 130 pacientes diagnosticados de DA que habían recibido CsA (mediana de supervivencia de CsA: 1 año). En el grupo comparador se incluyeron 150 pacientes psoriásicos que habían recibido CsA (mediana de supervivencia: 0,37 años). Observamos una mayor supervivencia de la CsA en los pacientes con DA en comparación con los pacientes psoriásicos (p<0,001).
ConclusiónLa supervivencia de la CsA en BIOBADATOP es similar a la descrita en otras series de pacientes con DA, y superior a la observada en los pacientes con psoriasis en el registro BIOBADADERM.
The past 5 years have seen a proliferation of new treatments for atopic dermatitis (AD). We analyzed recent drug survival data for cyclosporine in this setting. Because the Spanish National Healthcare system requires patients with AD to be treated with cyclosporine before they can be prescribed other systemic treatments, drug survival for cyclosporine may be shorter than in other diseases.
Material and methodMulticenter, observational, prospective cohort study using data from the Spanish Atopic Dermatitis Registry (BIOBADATOP). Data from the Spanish Registry of Systemic Treatments in Psoriasis (BIOBADADERM) were used to create a comparison cohort.
ResultsWe analyzed data for 130 patients with AD treated with cyclosporine (median drug survival, 1 year). Median cyclosporine survival in the psoriasis comparison group (150 patients) was 0.37 years. Drug survival was significantly longer in AD than in psoriasis (P<.001).
ConclusionDrug survival of cyclosporine in the BIOBADATOP registry is similar to that described in other series of patients with AD and longer than that observed in the BIOBADADERM psoriasis registry.
La dermatitis atópica (DA) es una enfermedad crónica inmunomediada que se estima que afecta al 20% de la población infantil y al 8% de los adultos1. Las formas moderadas y graves de la enfermedad pueden impactar negativamente en la calidad de vida de los pacientes y su entorno2. Entre los factores que repercuten negativamente en la calidad de vida destacan el picor, la alteración del sueño y las modificaciones en las conductas de interacción social, lo que condiciona que estos pacientes tengan un mayor riesgo de comorbilidad psiquiátrica; en concreto, la prevalencia de ansiedad, depresión e ideación suicida están aumentadas2,3. Además, resulta importante la carga económica que supone esta enfermedad para los pacientes y sus familiares4.
El manejo de la DA moderada y grave es complejo y continúa suponiendo un reto para los clínicos. Debido a la eclosión en el último quinquenio de alternativas terapéuticas nuevas para la DA, tanto fármacos biológicos (dupilumab y tralokinumab) como inhibidores de la janus kinasa (upadacitinib, baricitinib y abrocitinib), nos planteamos estudiar la supervivencia actual de la ciclosporina (CsA) en esta patología. En concreto planteamos que, el hecho de que el tratamiento con la CsA sea un paso necesario solicitado por el Sistema Nacional de Salud de España para la autorización de otros tratamientos sistémicos en DA5 podría estar condicionando una supervivencia menor que en otras enfermedades.
El objetivo de este estudio es describir la supervivencia de la CsA en la DA con la hipótesis de que la CsA, cuya prescripción resulta obligatoria por criterios de reembolso de forma previa a los tratamientos innovadores, se pudiera administrar de forma transitoria, condicionando una baja supervivencia.
MétodoEstudio multicéntrico, observacional, de cohortes prospectivo para el que se recogieron pacientes incluidos en el Registro Español de Dermatitis Atópica (BIOBADATOP) que hubiesen iniciado tratamiento con CsA, desde marzo de 2020 (fecha de inicio del registro) hasta enero de 20236.
El objetivo del estudio fue conocer el tiempo de supervivencia de la CsA en la DA moderada-grave. Se definió como tiempo de supervivencia aquel que transcurrió entre el inicio del fármaco hasta su suspensión por cualquier motivo. Se recogieron variables demográficas, variables asociadas a la patología y variables asociadas al fármaco y al motivo de su suspensión.
Como cohorte de comparación se emplearon los datos del Registro Español de tratamientos sistémicos en Psoriasis (BIOBADADERM)7. El motivo que nos llevó a utilizar el registro BIOBADADERM como comparador fue que la CsA también está indicada para el tratamiento de la psoriasis, y en dicha patología no es necesario pautarla como paso previo a los tratamientos biológicos, por lo que la supervivencia no debería verse influida por este factor.
Se realizó un análisis estadístico obteniendo la mediana de supervivencia, así como el percentil 25 y 75 de supervivencia. Asimismo, se mostró la supervivencia de ambos fármacos utilizando curvas de Kaplan-Meier. Para el análisis comparativo de supervivencia de los fármacos se utilizó el test log-rank.
El análisis estadístico fue realizado utilizando el programa Stata 17 (StataCorp. 2021). Se definió como diferencia estadísticamente significativa un valor de p<0,05.
Ambos estudios han sido aprobados por un comité de ética (BIOBADATOP: CEIC Aragon N.o 22/2018, BIOBADADERM: CEIC Hospital Universitario Doce de Octubre N° 216/07) y todos los pacientes han dado su consentimiento para participar.
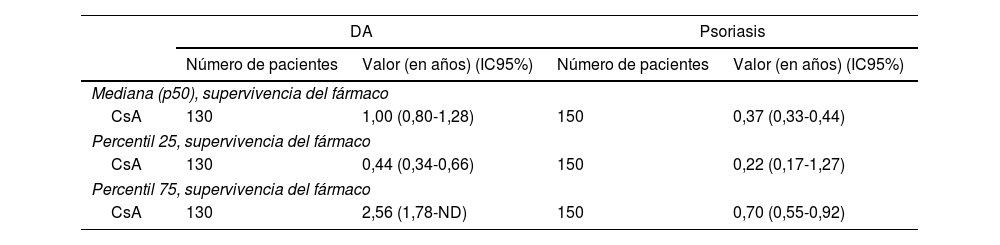
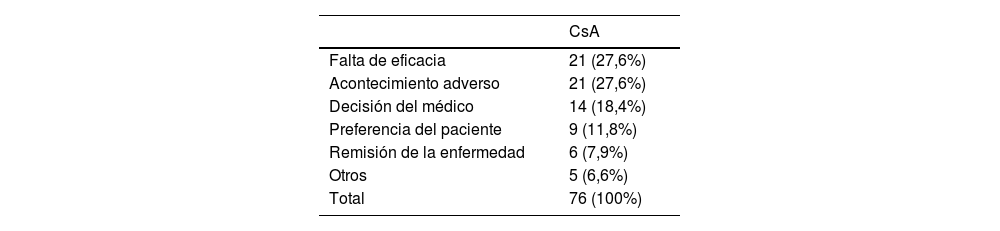
ResultadosSe incluyeron 130 pacientes diagnosticados de DA que habían recibido CsA (50% hombres, edad media 29,3 años). El EASI (Eczema Area and Severity Index) basal de los pacientes que iniciaron tratamiento con CsA fue de 19,9 y la duración media de la enfermedad al inicio del tratamiento, de 17,9 años. El 63,8% de los pacientes tratados con CsA habían recibido tratamiento previo con algún fármaco sistémico (tabla 1). La mediana de supervivencia de este fármaco en DA fue de 1 año (IC95%: 0,80-1,28) (tabla 2). Los motivos más frecuentes para la suspensión de la CsA fueron por igual la falta de eficacia del fármaco (27,6%) y la presencia de acontecimientos adversos (27,6%) (tabla 3).
Características basales de los pacientes diagnosticados de DA y psoriasis que recibieron tratamiento con la CsA
| DATratados con CsA,N (%) | PsoriasisTratados con CsA,N (%) | |
|---|---|---|
| Número de pacientes | 130 (100) | 150 (100) |
| Hombre | 65 (50) | 81 (54) |
| Tratamiento sistémico previo | 83 (63,8) | 63 (42,0) |
| Tratamiento con CsA previo | 31 (23,8) | 16 (10,7) |
| Tratamiento con MTX previo | 15 (11,5) | 42 (28,0) |
| Alguna comorbilidad | 41 (31,5) | 37 (24,7) |
| Edad al inicio del tratamiento en años, media (DE) | 29,3 (13,4) | 38,3 (14,0) |
| Duración enfermedad inicio tratamiento en años, media (DE) | 17,9 (11,9) | 10,9 (10,5) |
| EASI Puntuación total (0-72), media (DE) | 19,9 (11,0) | NA |
| PASI Puntuación total (0-72), media (DE) | NA | 12,5 (7,4) |
CsA: ciclosporina; DA: dermatitis atópica; DE: desviación estándar; MTX: metotrexato; NA: no aplica.
Supervivencia de CsA en DA y psoriasis
| DA | Psoriasis | |||
|---|---|---|---|---|
| Número de pacientes | Valor (en años) (IC95%) | Número de pacientes | Valor (en años) (IC95%) | |
| Mediana (p50), supervivencia del fármaco | ||||
| CsA | 130 | 1,00 (0,80-1,28) | 150 | 0,37 (0,33-0,44) |
| Percentil 25, supervivencia del fármaco | ||||
| CsA | 130 | 0,44 (0,34-0,66) | 150 | 0,22 (0,17-1,27) |
| Percentil 75, supervivencia del fármaco | ||||
| CsA | 130 | 2,56 (1,78-ND) | 150 | 0,70 (0,55-0,92) |
CsA: ciclosporina; DA: dermatitis atópica; ND: datos no disponibles, por no haberse alcanzado seguimiento suficiente.
En el grupo de pacientes con psoriasis, que utilizamos como comparador, se incluyeron 150 tratados con CsA (54% varones, edad media 38,3 años). El PASI (Psoriasis Area and Severity Index) basal fue de 12,5 y la duración media de la enfermedad al inicio del tratamiento, de 10,9 años (tabla 1). La mediana de supervivencia de la CsA en este grupo fue de 0,37 años (4 meses) (IC95%: 0,33-0,44) (tabla 2).
En la gráfica de Kaplan-Meier mostrada en la figura 1 puede observarse la supervivencia de la CsA en la DA y en la psoriasis, siendo significativamente mayor la supervivencia de la CsA en el grupo de la DA que en el de la psoriasis (log-rank test, p<0,001).
DiscusiónLa DA es una de las enfermedades que ha experimentado un mayor auge en el desarrollo de alternativas terapéuticas en los últimos años, lo que ha implicado un cambio en el paradigma de tratamiento. Actualmente el Sistema Nacional de Salud de España ha establecido como criterios de financiación de las terapias sistémicas avanzadas un nivel de gravedad medido por la escala EASI igual o mayor de 21 y el uso previo de CsA, salvo contraindicación5. Estas condiciones de acceso podrían estar influyendo en la prescripción, y por tanto la CsA tener una supervivencia menor que en otras enfermedades. Partiendo de esta hipótesis, hemos estudiado la supervivencia de la CsA en el registro español de tratamientos sistémicos en DA de la Academia Española de Dermatología y Venereología (AEDV) y lo hemos comparado con el de psoriasis8. En contra de la hipótesis, hemos descrito una supervivencia mayor de la CsA en el grupo de la DA.
Los estudios de supervivencia son un reflejo del manejo terapéutico en la práctica clínica real de patologías en los que se valoran criterios de efectividad, seguridad y preferencias del médico, más allá de las condiciones ideales de los ensayos clínicos9. En los últimos años, se han publicado varios estudios en los cuales se analiza la supervivencia de fármacos sistémicos clásicos y biológicos en la DA1,10–17.
Los datos de supervivencia de la CsA que encontramos al año de tratamiento son ligeramente superiores a los descritos en la literatura; así, van der Schaft et al. reportan una supervivencia de CsA al año del 34% (48,6% en nuestro trabajo), y Law Ping Man et al. reportan una mediana de supervivencia de CsA de 8 meses (1 año en nuestro trabajo)10,17. En una serie retrospectiva italiana donde se recogen 95 pacientes con DA en tratamiento con CsA, solo el 21,02% de los pacientes continuaban con este fármaco en la semana 7211.
Recientemente se ha comparado la supervivencia de CsA con dupilumab, reportando una mayor supervivencia de este último1,11,13,14,16. La órgano-toxicidad, las interacciones farmacológicas y la necesidad de monitorización, así como la existencia en la actualidad de otras alternativas con mejores expectativas en eficacia y seguridad, son factores que limitan de manera importante la supervivencia de los inmunosupresores clásicos frente a los fármacos biológicos11,12,14,16,18.
Para interpretar los resultados de supervivencia de fármacos es importante tener en cuenta las causas de suspensión. Para la CsA en DA la presencia de efectos adversos supone entre el 20% y el 50% de las suspensiones13,15–17, datos similares a los obtenidos en nuestro trabajo, donde reportamos un 27,6% de suspensiones por efectos adversos.
Comparación de la supervivencia de la ciclosporina en dermatitis atópica y psoriasisEn cuanto a la comparación entre las dos enfermedades, consideramos de interés resaltar que la CsA tuvo una mayor supervivencia en la DA que en la psoriasis, encontrándose más del doble de pacientes con este fármaco tras un año de tratamiento en el grupo de pacientes con DA (48,6%) frente al de psoriasis (17,2%). Varios factores pueden contribuir a este hecho, el principal es el menor número de alternativas terapéuticas aprobadas en DA. Así, desde 2017 y hasta 2021, el dupilumab, la CsA y los corticoides eran los únicos tratamientos sistémicos aprobados por la Agencia Europea del Medicamento para la DA grave. Además, cabe señalar que los pacientes con DA que presentan un EASI menor de 21 incluidos en el registro BIOBADATOP no pueden disponer en el momento actual de alternativas terapéuticas financiadas, como fármacos biológicos o inhibidores de JAK, conllevando una prolongación en el tiempo de tratamiento con CsA5,19. Otro factor que puede contribuir a estos hallazgos es la forma de prescripción diferente de la CsA en ambas patologías.
Limitaciones y ventajasComo limitaciones de nuestro trabajo cabe indicar el pequeño tamaño muestral y las posibles diferencias en las características de los pacientes con DA y psoriasis. Otras limitaciones importantes e inevitables son las propias del empleo de la supervivencia de fármacos como mediciones indirectas de efectividad, seguridad o ambos, que son influidas por múltiples factores externos, como la disponibilidad de otros fármacos o el periodo interdosis20. No obstante, destacamos el valor de este estudio prospectivo a partir de datos procedentes de numerosos centros, siendo la mayor parte de los análisis de supervivencia publicados hasta la fecha trabajos retrospectivos. Además, este trabajo refleja el manejo de la CsA en la DA en la práctica clínica real, en un momento donde el tratamiento de esta patología se encuentra en un punto de inflexión.
ConclusiónEn conclusión, observamos una mediana de supervivencia de la CsA en la DA de 1 año, siendo esta mayor que en los pacientes psoriásicos. El hecho de que el Sistema Nacional de Salud de España requiera experiencia previa de uso de la CsA en pacientes con DA moderada-grave para acceder a las terapias innovadoras, no parece condicionar una menor supervivencia. Las condiciones de acceso a la terapia sistémica avanzada podrían cambiar en un futuro, modificando previsiblemente la supervivencia de la CsA en la DA.
FinanciaciónEl proyecto BIOBADATOP es promovido por la Fundación Piel Sana de la AEDV, que recibe apoyo económico de empresas farmacéuticas (Sanofi, Abbvie, Pfizer y Leo-Pharma). Las compañías farmacéuticas colaboradoras no se involucraron de ninguna manera en lo siguiente: el diseño y ejecución del estudio; la recopilación, gestión, análisis e interpretación de datos; la preparación, revisión y aprobación del manuscrito; la decisión de enviar el manuscrito para su publicación.
Conflicto de interesesC. Couselo-Rodríguez ha participado como subinvestigadora o ponente en proyectos patrocinados por: Abbvie, Sanofi, Leo-Pharma, Lilly, UCB, Novartis, Pierre Fabre y Janssen. A. Batalla ha realizado actividades de formación y asistencia a cursos y congreso patrocinados por Abbvie, Celgene, Faes pharma, Isdin, Janssen, Leo-Pharma, Lethipharma, Lilly, Mylan, Novartis, Pierre Fabre y Sanofi. Subinvestigadora de ensayos clínicos promovidos por Abbvie, Celgene, Leo-Pharma, Lilly, Novartis, Pfizer y Sanofi. Actividades de consultoría de Abbvie y Sanofi. J.M. Carrascosa ha participado como investigador principal/subinvestigador y/o recibido honorarios como ponente y/o miembro de comité de expertos o steering comitee para Abbvie, Novartis, Janssen, Lilly, Sandoz, Amgen, Almirall, BMS, Boehringer Ingelheim, Biogen, UCB. P. Chicharro ha participado en consultorías, coloquios y ensayos clínicos organizados por las siguientes compañías: Janssen Pharmaceuticals, Almirall, Sanofi Genzyme, Lilly, Abbvie, Novartis, Leo-Pharma y Pfizer-Wyeth. A. González Quesada ha participado como consultora, como ponente y ha participado en ensayos clínicos de Abbvie, Pfizer, Novartis, Sanofi, Boehringer, Bristol-Meyer, Leo-Pharma, Janssen. P. de la Cueva ha participado como asesor y/o investigador y/o ponente con los siguientes laboratorios farmacéuticos: Abbvie, Almirall, BMS, Boehringer, Celgene, Janssen, Leo-Pharma, Lilly, MSD, Novartis, Novo Nordisk, Pfizer, Roche, Sanofi y UCB. A.M. Giménez-Arnau ha participado como Medical Advisor para Uriach Pharma / Neucor, Genentech, Novartis, FAES, GSK, Sanofi-Regeneron, Amgen, Thermo Fisher Scientific, Almirall, Celldex, Leo-Pharma. Ha participado como investigadora en proyectos patrocinados por Uriach Pharma, Novartis, Instituto Carlos III-FEDER, y ha realizado actividades de formación patrocinadas por Uriach Pharma, Novartis, Genentech, Menarini, Leopharma, GSK, MSD, Almirall, Sanofi y Avene. Y. Gilaberte ha participado como asesora de Isdin, Roche Posay, Galderma; ha realizado conferencias para Almirall, Sanofi, Avene, Rilastil, Lilly, Uriage, Novartis, Cantabria Labs; y ha participado en proyectos de investigación de Almirall, Sanofi, Pfizer, Abbvie y Leo-Pharma. M. Rodríguez-Serna ha participado como ponente y consultora para Novartis, Sanofi, Abbvie, Pfizer, Lilly y Leo-Pharma; ha sido investigadora principal en ensayos clínicos de Novartis, Abbvie y Leo-Pharma. T. Montero-Vilchez ha participado como consultora, en coloquios y en ensayos clínicos de Abbvie, Almirall, Incyte, Leo-Pharma, Lilly, Novartis, Sanofi, Pfizer-Wyeth y UCB Pharma y del Instituto de Salud Carlos III. M. Elosua-González ha sido investigadora y/o ponente para Abbvie, Lilly, Galderma, Leo-Pharma, Pfizer, UCB Pharma y Sanofi Genzyme. J.F. Silvestre-Salvador no tiene conflictos de interés que declarar con respecto a este artículo. M. Munera-Campos ha recibido honorarios por asesoría científica, presentaciones u otras actividades relacionadas de Abbvie, Leo-Pharma, Janssen, Sanofi y Galderma, y ha participado como investigadora principal y subinvestigadora en ensayos clínicos: Lilly, Leo-Pharma, Novartis, Janssen, Sanofi, Pfizer, Abbvie, Almirall, UCB y Galderma. J. Sánchez-Pérez no tiene conflictos de interés que declarar con respecto a este artículo. G. Carretero no tiene conflictos de interés que declarar con respecto a este artículo. C. Mauleón-Fernández ha participado en ensayos clínicos de dermatitis atópica patrocinados por Sanofi y Leo-Pharma. L Curto-Barredo ha recibido honorarios como ponente y asesora de Novartis, Sanofi, Abbvie, Lilly, Leo-Pharma y Menarini. A. Ballano-Ruiz no tiene conflictos de interés que declarar con respecto a este artículo. R. Botella-Estrada ha participado como consultor, conferenciante o investigador de ensayos clínicos patrocinados por Pfizer, Abbvie, Almirall, Novartis, Janssen, Leo-Pharma, Lilly, Celgene, Roche y SunPharma. S. Arias-Santiago no tiene conflictos de interés que declarar con respecto a este artículo. F.J. Navarro-Triviño no tiene conflictos de interés que declarar con respecto a este artículo. G. Roustán-Gullón ha recibido honorarios por asesoría y cursos de Sanofi, Abbvie, Lilly, Pfizer y Leo-Pharma. I. Betlloch no tiene conflictos de interés que declarar con respecto a este artículo. E. del Alcázar ha participado como ponente y/o investigadora de ensayos clínicos patrocinados por Amgen, Almirall, Janssen, Lilly, Leo-Pharma, Novartis, UCB y Abbvie. M.T. Abalde-Pintos no tiene conflictos de interés que declarar. I. García-Doval ha recibido ayudas para desplazamiento y formación en congresos científicos patrocinados por Abbvie, MSD, Pfizer y Sanofi. M.Á. Descalzo no tiene conflictos de interés que declarar. Á. Flórez ha realizado ensayos clínicos y ha actuado como conferenciante y consultora para Abbvie, Almirall, Amgen, Janssen, Leo-Pharma, Lilly, Novartis, Pfizer, Sanofi, y UCB Pharma.
A todos los investigadores de BIOBADATOP y BIOBADADERM, por realizar un esfuerzo adicional en la práctica clínica con la recogida de datos, así como a los pacientes y/o representantes legales por acceder a su inclusión en el registro correspondiente.