El metaanálisis (MA) permite evaluar la eficacia clínica de un tratamiento al agregar los resultados de varios ensayos clínicos (RCT) preservando la aleatorización; los efectos agregados (con sus intervalos de confianza) pueden representarse mediante un diagrama de «bosque». Para comparar la eficacia de diversas opciones terapéuticas se pueden utilizar comparaciones directas o indirectas. Estas últimas incluyen comparaciones indirectas de tratamientos ancladas a placebo, MA en red (NMA) (que a su vez pueden ser frecuentistas o bayesianos, dependiendo del marco estadístico y la definición de probabilidad elegida), comparaciones indirectas de tratamientos ajustadas según covariables, y comparaciones indirectas con datos individuales. Los NMA bayesianos permiten establecer un orden de eficacia basado en probabilidades o intervalos de credibilidad, que pueden describirse con el área bajo la curva de probabilidad de rango acumulativa (SUCRA), y la superioridad estadística se demuestra mediante comparaciones a pares, que generalmente se presentan en forma de tablas de liga. La presente revisión, orientada a un lector clínico, describe estos aspectos metodológicos con detalle empleando como ejemplo las recientes publicaciones de NMA que permiten establecer la eficacia relativa de los tratamientos biológicos de la psoriasis moderada a grave. Sobre la base de distintos NMA, los cuatro tratamientos más eficaces tanto a corto (10-16 semanas de tratamiento) como a largo plazo (aproximadamente un año) son risankizumab (número uno de orden en todos los estudios que lo incluyen), seguido de brodalumab, guselkumab e ixekizumab, aunque las diferencias entre ellos no siempre resultan significativas.
Meta-analysis offers a way to assess the clinical efficacy of a treatment by combining the results of randomized clinical trials while maintaining randomization; the combined effects, with their confidence intervals, can be represented with a forest plot. The efficacy of several different treatment options can be assessed with either direct or indirect comparisons. Indirect comparisons may be placebo-anchored as well as network meta-analyses (NMA) that use either a frequentist or Bayesian approach, depending on the statistical framework and the definition of probability selected. Indirect comparisons may also adjust for covariates or utilize individual participant data. Bayesian NMA are able to establish a rank order of efficacy based on probabilities or credibility intervals, which can be described by the surface under the cumulative ranking curve(SUCRA). Statistical superiority is demonstrated by pairwise comparisons, which are generally presented in league tables. This review provides clinical practitioners with detailed descriptions of these methods, drawing on examples from recently published NMA that rank the relative efficacy of biologic treatments for moderate to severe psoriasis. According to NMA findings, the four most effective treatments in both the short term (10-16 weeks) and the long term (approximately one year) are, in rank order, risankizumab (first in all studies that include it), brodalumab, guselkumab, and ixekizumab. However, the between-treatment differences are not always significant.
Con la introducción de los agentes biológicos hace más de 15 años se han producido enormes avances terapéuticos en el manejo de la psoriasis. Adalimumab y ustekinumab fueron los primeros biológicos administrados por vía subcutánea con un umbral satisfactorio de eficacia (tasa de respuesta PASI 75 diferencial con respecto a placebo, respectivamente) superior al 50% (número de pacientes a tratar [NNT] < 2)1. Aunque uno de los ensayos clínicos aleatorizados (RCT) de adalimumab incluía un brazo de tratamiento activo con metotrexato (posteriormente se publicó un estudio comparativo de infliximab con metotrexato), el primer RCT competitivo entre dos agentes biológicos (ustekinumab frente a etanercept) fue publicado en 20102.
En 2015 se introdujo en el mercado secukinumab, el primer representante disponible de una nueva familia de anticuerpos dirigidos contra la interleucina 17 (IL-17A). La característica fundamental de los anti-IL-17A es la rapidez de inicio de su acción terapéutica, y el haber elevado la respuesta PASI 90 a estándar de eficacia terapéutica, con tasas de respuesta diferencial frente a placebo iguales o superiores al 70%3. Estos biológicos han incluido en su desarrollo clínico RCT con etanercept, adalimumab y ustekinumab, además de placebo, y recientemente se ha incluido guselkumab como comparador activo en un par de RCT.
Guselkumab, aprobado por la European Medicines Agency (EMA) a finales de 2017, es el primer representante de una clase de agentes biológicos que bloquea específicamente la subunidad p19 de la IL-23, y que actualmente incluye también a tildrakizumab y risankizumab. Los correspondientes estudios comparativos también han incluido etanercept, adalimumab, ustekinumab y secukinumab, dependiendo en gran medida de cuál fuera el competidor más relevante cuando se diseñaron los correspondientes RCT.
Comparaciones de eficacia y seguridadEl dermatólogo se encuentra ante una elección difícil, con múltiples opciones, y los RCT pivotales que llevaron al registro de cada fármaco no permiten evaluar su eficacia (o seguridad) relativa, comparándola frente a otras opciones terapéuticas. Otros factores pueden influir en mayor o menor medida (dependiendo de cada fármaco) en el resultado, como pueden ser el fallo terapéutico previo a uno o más biológicos, el peso o las comorbilidades, con especial referencia a la artritis psoriásica. Por otra parte, ni las poblaciones ni la situación basal (con aclarado terapéutico y valores de PASI superiores a 12) de los RCT representan adecuadamente la realidad clínica. En cualquier caso, se hace necesario poder comparar los datos de eficacia de diferentes fármacos, puesto que el análisis de coste-efectividad teniendo en cuenta el coste de adquisición en cada momento es un componente esencial de cualquier algoritmo terapéutico.
En primer lugar debe efectuarse una revisión sistemática, cuya metodología está bien establecida4, para identificar todos los RCT publicados sobre la patología a estudiar (en nuestro caso la psoriasis en placas). Cuando existen varios RCT de un mismo fármaco deben combinarse estadísticamente los resultados empleando métodos que conserven la aleatorización de cada RCT, y a tal efecto se ha desarrollado la metodología del metaanálisis (MA). Los MA permiten mejorar la precisión de los resultados, pero pueden inducir a error si no se tienen en cuenta las diferencias de diseño entre los estudios y los sesgos de publicación.
En el caso de la psoriasis, la metodología de los estudios y los criterios de selección en general son muy uniformes, lo que representa una ventaja, aunque siempre debe evaluarse la posible heterogeneidad de los estudios. En muchos casos los datos/resultados de interés son dicotómicos (por ejemplo, respuesta PASI 90: sí/no); discutiremos esta situación en detalle, aunque existen métodos de MA que se aplican a datos/resultados continuos, ordinales o combinaciones de éstos. Finalmente, deben emplearse análisis de sensibilidad (cambiando las condiciones o los RCT a incluir) para confirmar la robustez de los resultados, de forma que puedan influir en la toma de decisiones terapéuticas o de reembolso.
El pairwise MA (MA por pares) permite agregar los datos de varios RCT de un fármaco A comparado con placebo (o con otro fármaco B); al combinar diferentes estudios puede detectarse una diferencia significativa que quizá no se detectaría en RCT individuales con potencia estadísticamente insuficiente.
En los MA se calcula para cada uno de los estudios un parámetro estadístico que represente el efecto de la intervención (tratamiento); para variables dicotómicas puede emplearse el cociente de probabilidades (OR), el cociente de riesgos (RR), o la diferencia de «riesgos» (probabilidades o porcentajes de respuesta) entre el fármaco y su comparador (generalmente placebo). Por ejemplo, si un fármaco permite obtener una respuesta PASI 90 en 633 de 1.000 pacientes (63,3%), comparada con 25 sobre 950 (2,6%) para placebo, la OR es (633 × 925)/(25 × 367) = 63,8; el RR es (633 × 950)/25 × 1.000) = 36,1; la diferencia de riesgos o tasa diferencial de respuesta (63,3-2,6) = 60,7%, o 0,67, y hay que tratar a tres pacientes para conseguir una respuesta PASI 90 en dos (NNT = 1/0,67 = 1,5). OR y RR son medidas relativas, mientras que la diferencia de «riesgos»/probabilidades de respuesta o el NNT son medidas absolutas; en general las medidas relativas son más consistentes entre estudios y no tienen límites numéricos (una probabilidad no puede ser negativa). En general, el clínico tiende a sobreestimar el efecto de un tratamiento cuando se mide en OR; aunque para acontecimientos infrecuentes (con una probabilidad aproximadamente < 20%) las diferencias entre OR y RR son pequeñas. No es éste el caso de la respuesta al tratamiento en los RCT de psoriasis.
Existen dos modelos estadísticos fundamentales en los MA, dependiendo de si se considera que cada RCT estima un efecto del fármaco cuyo valor es inmutable, o bien que los efectos de cada RCT siguen una distribución aleatoria5:
- •
El modelo de efectos fijos asume que no existe variación en el efecto relativo del tratamiento entre los diferentes RCT, y que las diferencias observadas se deben solo al azar; en este caso se pretende calcular el «verdadero» efecto del tratamiento; por lo general se emplea el método estadístico de Mantel-Haenszel, en especial para tamaños de estudio pequeños, pero también pueden emplearse el método del inverso de la varianza y el método de Peto, más potente y menos sesgado cuando hay estudios sin eventos (por ejemplo, de mortalidad), el efecto de la intervención es pequeño (probabilidad < 1%) y el tamaño de los brazos de tratamiento es similar.
- •
En el modelo de efectos aleatorios se asume que el efecto del tratamiento es variable entre RCT (el resultado de cada RCT sería una muestra de una distribución normal), y el efecto agrupado sería la media de una distribución normal cuya desviación estándar reflejaría la heterogeneidad. En este caso (modelo de efectos aleatorios) se emplea por lo general el método de DerSimonian-Laird.
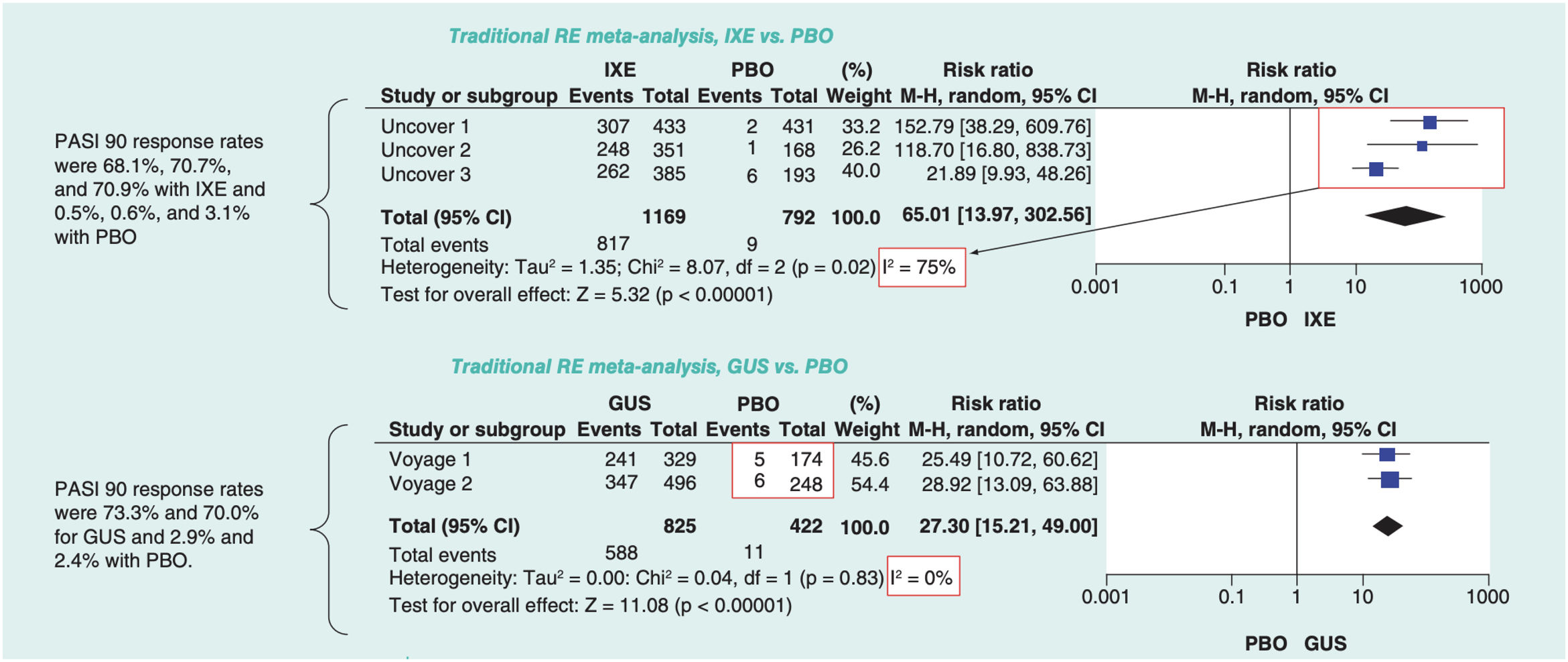
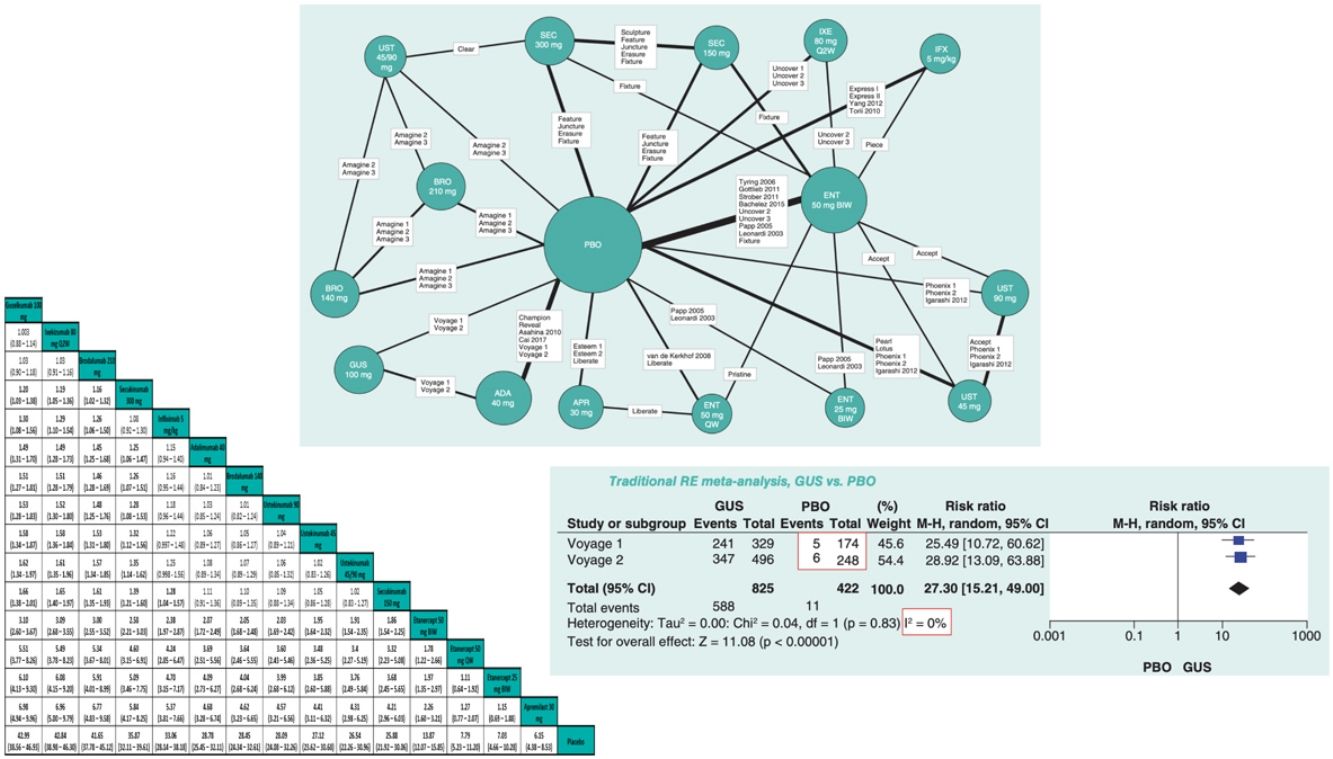
La medida del efecto para cualquiera de estos métodos puede ser OR, RR o diferencias de riesgo, excepto cuando se emplea el método de Peto, que solo permite combinar OR. El efecto de cada RCT se representa en un diagrama de efectos o «bosque» (forest plot) mediante bloques con líneas horizontales que delimitan el intervalo de confianza (IC), generalmente con un nivel del 95%. El tamaño del bloque a menudo representa el peso asignado a cada estudio en el MA. Una forma frecuente de ponderar los RCT es según el inverso de la varianza, o cuadrado del error estándar: los estudios grandes tienen más peso porque su error estándar es menor. El «efecto sumario», o promedio ponderado de los efectos de cada intervención se representa mediante un diamante (con altura proporcional al número de sujetos incluidos en los RCT) (fig. 1)6.
Ejemplo de dos diagramas de bosque correspondientes a dos MA por pares con modelo de efectos aleatorios; los efectos (RR de respuesta PASI 90) se han estimado mediante el método de Mantel-Haenszel (M-H) y se han calculado diversas medidas de la heterogeneidad.
Modificada de Cameron C., et al.6.
Existen diferentes medidas de la heterogeneidad (debida a diferencias de características en las poblaciones de cada estudio [diversidad clínica], diseño de los estudios, medida de las variables de interés y sesgo [diversidad metodológica]) entre los diferentes RCT incluidos en un MA; por ejemplo, la prueba Q de Cochran (χ2) con su correspondiente P, o I2 con su correspondiente IC, que se emplea en las revisiones Cochrane. I2 se calcula a partir de la Q de Cochran como 100% × (Q – grados de libertad)/Q, y describe el porcentaje de la variabilidad en las estimaciones del efecto debida a la heterogeneidad más que al error de muestreo aleatorizado. Los valores negativos se consideran como 0% e indican que no se observa heterogeneidad; valores por debajo de 25% indican que la heterogeneidad de los RCT es baja; por encima de 50% indican una alta heterogeneidad. Otra medida de heterogeneidad que se emplea para MA con modelo de efectos aleatorios es τ2.
La heterogeneidad entre los diferentes RCT puede deberse a interacciones del tratamiento con diversas covariables (valores basales de peso, edad, comorbilidades, efecto placebo, etc.) que determinan sesgos (bias)7. Las covariables pueden ser interdependientes; por ejemplo, se ha visto que el peso puede modificar la respuesta no solo del tratamiento, sino también del placebo8. Existen medidas estadísticas de la magnitud del sesgo y modelos de metarregresión que tienen en cuenta estas interacciones, siendo en general preferible en este caso utilizar comparaciones indirectas con datos individuales (véase más abajo).
El MA por pares produce una estimación agrupada del efecto de un tratamiento comparado con placebo, y el IC 95% indica que el valor «real» o «promedio» del efecto se encuentra dentro del intervalo con un 95% de probabilidad, pero no permite establecer una comparación rigurosa del efecto relativo de dos tratamientos, en especial cuando se solapan los IC9.
La eficacia relativa de diversos tratamientos o intervenciones terapéuticas puede evaluarse mediante RCT clínicos comparativos de asignación aleatoria (comparaciones directas), MA de múltiples RCT (comparaciones indirectas) y datos de registro de pacientes.
Los RCT comparativos «frente a frente» (head to head, o H2H) implican asignación aleatoria y evaluación a doble ciego de la eficacia, pero pese a que los criterios de inclusión son idénticos y los brazos de tratamiento generalmente están equilibrados, pueden incluir factores de sesgo. Por ejemplo, incluso asumiendo que no se hayan producido cambios relevantes en la potencia de la molécula con el transcurso del tiempo, el no incluir un brazo placebo puede elevar la respuesta terapéutica con respecto a los RCT pivotales, como se observa en algunos RCT de equivalencia10. La elección del momento (endpoint) en que se determina el resultado principal del RCT (outcome) tiende a favorecer el objetivo del promotor11,12. Cuando existen diferencias entre la respuesta cutánea y la respuesta articular entre dos fármacos, la elección de una medida compuesta de resultado (composite outcome measure) también puede favorecer a uno de los fármacos13.
Incluso cuando se dispone de RCT H2H, tanto los clínicos como las agencias evaluadoras están dando cada vez mayor importancia a los diversos métodos de comparación indirecta entre tratamientos, en especial cuando existen múltiples opciones. La combinación de comparaciones directas e indirectas permite una estimación más refinada del valor relativo de cada fármaco, siempre y cuando se cumplan determinadas condiciones que discutiremos más adelante14.
Los diferentes métodos disponibles para efectuar comparaciones indirectas de tratamientos incluyen15:Comparaciones indirectas de tratamientos (ITC) ajustadas o «ancladas», comparando datos agregados de los RCT de un fármaco A con datos agregados de los correspondientes brazos placebo o de otro fármaco B que se ha comparado con placebo.MA en red (NMA), comparando los datos agregados de diversos fármacos con placebo (y entre sí cuando existen RCT H2H), ajustando o no las características basales de los RCT y en particular las diversas respuestas placebo.Comparaciones indirectas con datos individuales de un tratamiento ajustados a las características agregadas de otros (matching-adjusted indirect comparisons, o MAIC), ponderando los datos de pacientes individuales de manera que se equiparen a los de los RCT para los que solo se dispone de datos agregados16-19. Existen otros métodos de comparación indirecta con datos de pacientes individuales, y se han publicado recomendaciones con vistas a su empleo con fines de autorización y reembolso20.Comparaciones indirectas con datos individuales para cada brazo de tratamiento (individual patient-level data, o IPD).
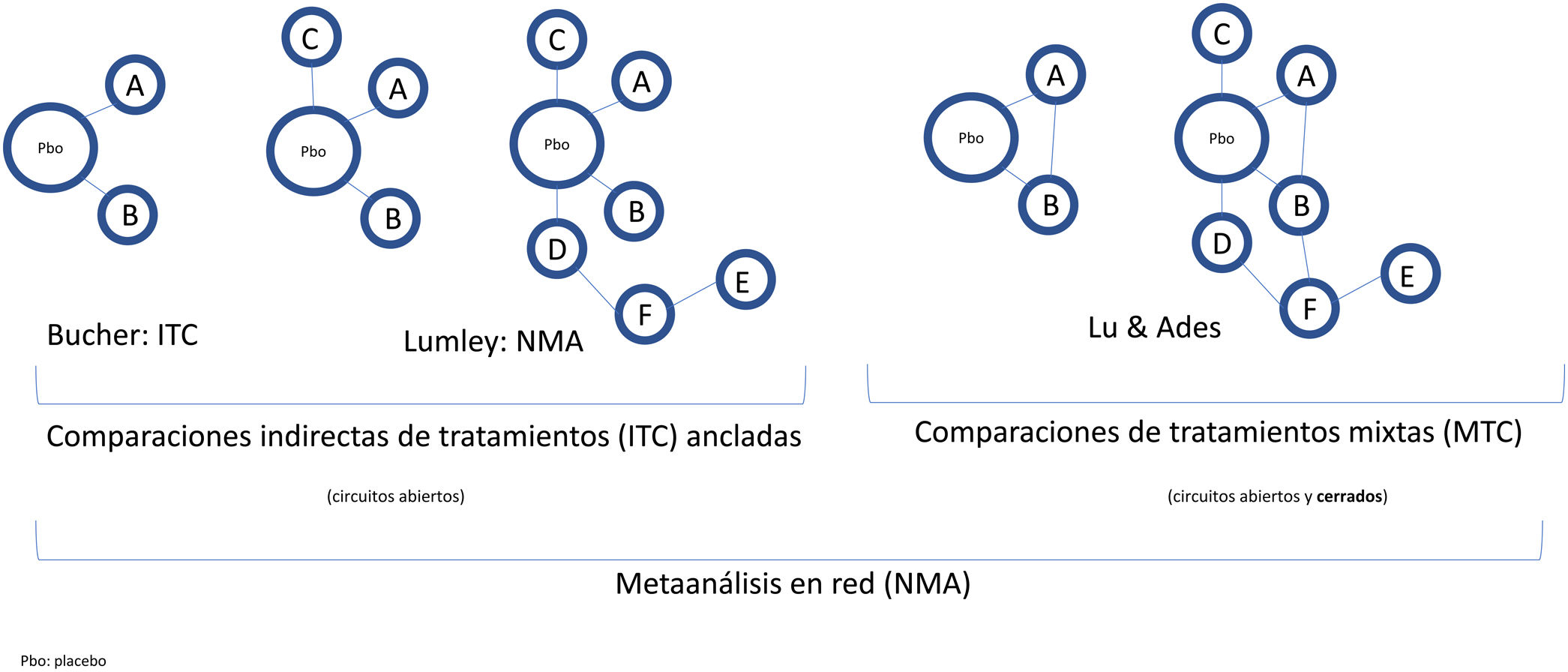
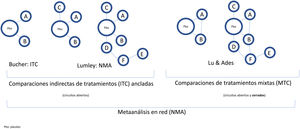
Conceptos básicos y metodología de las comparaciones indirectas de tratamientos (o intervenciones)La aleatorización en los RCT clínicos permite separar el efecto del fármaco de otros factores, y equipara el riesgo basal de los brazos de tratamiento, incluso en RCT efectuados en diferentes períodos. Para mantener el efecto de la aleatorización en las comparaciones múltiples, Bucher et al.21 introdujo el método ITC, empleando los OR como medida del efecto, aunque solo resulta aplicable a comparaciones indirectas de tratamientos que se hayan comparado con otro comparador común15. Posteriormente, Lumley et al.22 desarrolló una técnica (NMA) para comparar dos tratamientos a través de más de un comparador común, incluyendo una medida de la posible inconsistencia o discrepancia en los resultados, que ha sido objeto de desarrollo ulterior23,24. Finalmente, Lu y Ades25 incorporaron las comparaciones directas (RCT H2H) en un método más sofisticado denominado «comparaciones de tratamientos mixtos» (MTC), que permite ordenar los diferentes tratamientos con base en la probabilidad de que sean mejores o peores.
Las comparaciones indirectas de tratamientos requieren que los RCT clínicos de los tratamientos a comparar estén conectados entre sí formando una red, ya sea de forma abierta o formando circuitos cerrados, si se incluyen RCT H2H (evidencia directa, además de la indirecta) (fig. 2). Cuando se dispone de RCT H2H para algunos tratamientos, o incluso de RCT con múltiples brazos de tratamiento además de placebo, se emplean los NMA para obtener estimaciones del efecto relativo de diferentes tratamientos con mayor precisión que la de los MA apareados y ordenarlos de manera coherente, teniendo en cuenta las posibles inconsistencias entre los resultados de las comparaciones directas e indirectas.
Clasificación y nomenclatura de las comparaciones indirectas de intervenciones (tratamientos) y sus diagramas. En sentido amplio, todas las comparaciones indirectas son NMA, por contraposición a los MA tradicionales, que no comparan simultáneamente varios tratamientos, sino que agrupan diversos RCT comparando dos intervenciones, por ejemplo, un tratamiento frente a placebo. Bucher21 introdujo la ITC para comparar indirectamente dos tratamientos que se han comparado directamente con placebo en diversos RCT. Lumley22 introdujo la técnica del NMA en sentido estricto para comparar dos tratamientos a través de más de un comparador común. Lu y Ades25 introdujeron el método de las MTC, que incluyen tanto comparaciones indirectas como comparaciones directas mediante RCT H2H (circuitos cerrados) y permiten establecer un probable rango de eficacia de los diferentes tratamientos.
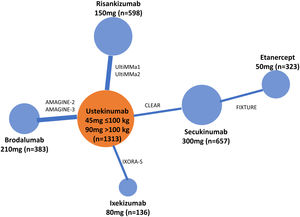
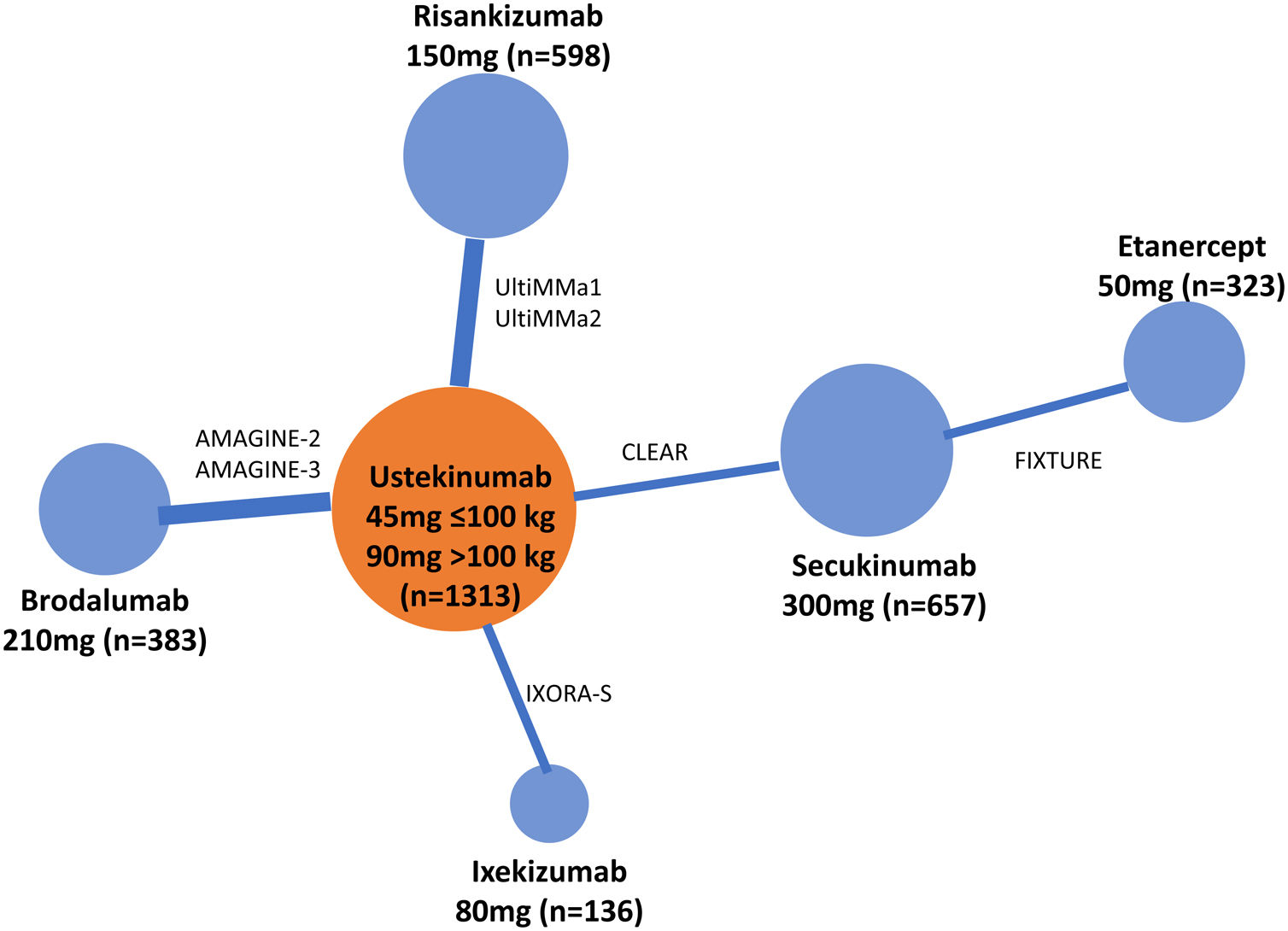
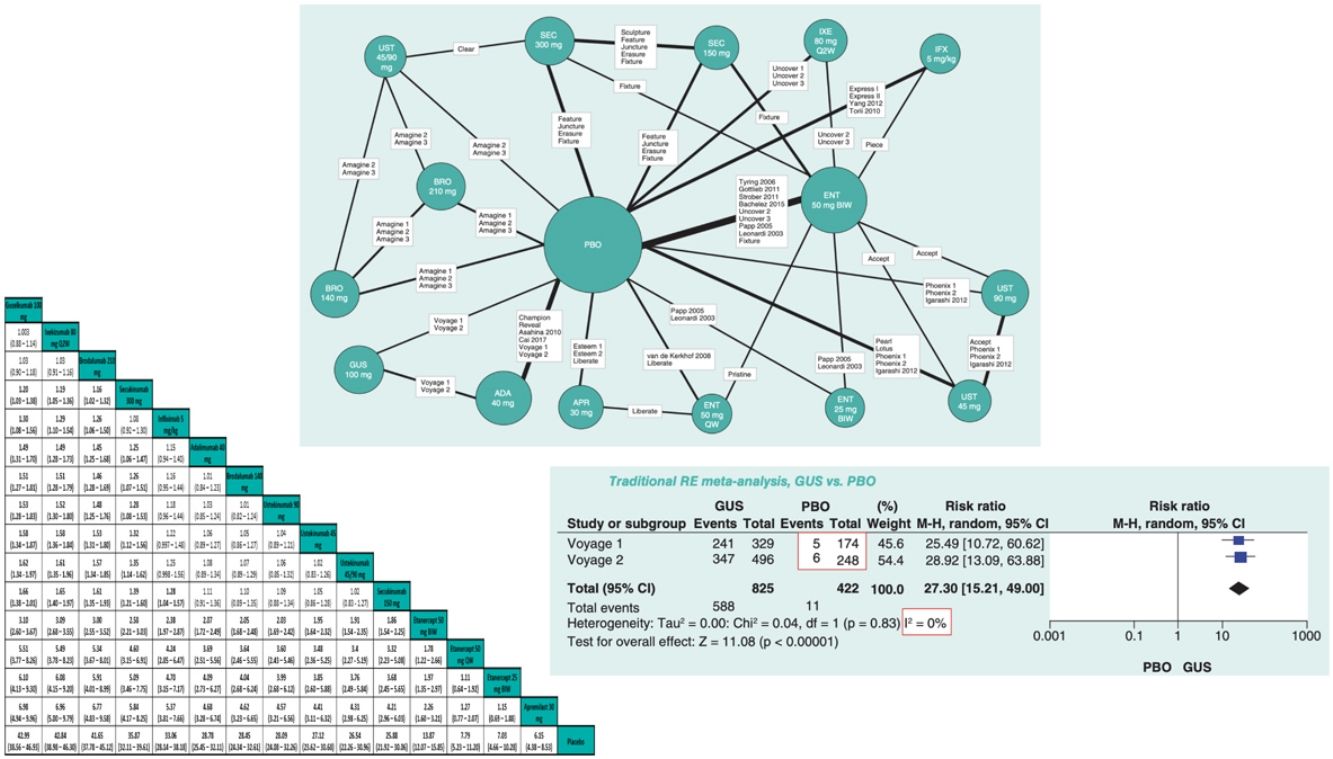
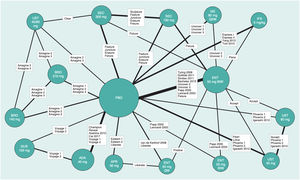
Existen diversas directrices para la publicación de RCT, MA y NMA; PRISMA es la más relevante para estos últimos26. En los NMA es esencial proporcionar información sobre la estructura de la red, para lo que se dispone de programas específicos que producen diagramas en los que el tamaño de los círculos es proporcional al número de pacientes aleatorizados en cada tratamiento (o placebo) y la anchura de las líneas es proporcional al número de estudios incluido en cada comparación (fig. 3)27.
Ejemplo de diagrama de la red en un NMA sobre resultados PASI 90 a 12 o 16 semanas de tratamientos biológicos de la psoriasis27. El tamaño de los nodos representa el tamaño muestral de las intervenciones y las anchuras de las líneas el número de estudios incluidos.
ADA: adalimumab; APR: apremilast; BIW: dos veces por semana, BRO: brodalumab; ENT: etanercept; GUS: guselkumab; IFX: infliximab; IXE: ixekizumab; PBO: placebo; QW: una vez por semana; Q2W: cada dos semanas; SEC: secukinumab; UST: ustekinumab.
Modificada de Cameron C., et al.6.
Los NMA pueden efectuarse en un marco frecuentista o bayesiano28.
En el primer caso, el resultado del NMA es una estimación puntal de la eficacia relativa de cada tratamiento frente a los demás, con un IC 95%: si se repitieran los NMA el valor «real» del efecto estaría comprendido en el IC el 95% de las ocasiones, lo que no quiere decir que la probabilidad de que el valor «real» se encuentre comprendido en el IC sea del 95%.
El marco bayesiano implica una distribución posterior de probabilidades basada en los resultados del NMA, que permite ordenar los diferentes tratamientos según su eficacia relativa29, facilitando las decisiones farmacoeconómicas. Cuando se evalúan los efectos de los tratamientos generalmente se asume que la probabilidad a priori es no informativa, aunque pueden incorporarse datos de NMA previos30. Los NMA bayesianos requieren cálculos intensivos mediante paquetes estadísticos que incluyen simulaciones Monte Carlo con cadenas de Markov (MCMC). Cuando existe heterogeneidad significativa entre los RCT incluidos en el NMA es recomendable emplear ajustes por el riesgo basal (por ejemplo, el efecto placebo) que tiene en cuenta múltiples covariables, observadas o no, y se asocia con un ajuste óptimo del modelo6. Los equivalentes de los IC para los efectos relativos de los diferentes tratamientos comparados por pares en las «tablas de liga» se denominan «intervalos de credibilidad» (ICr) en el marco bayesiano.
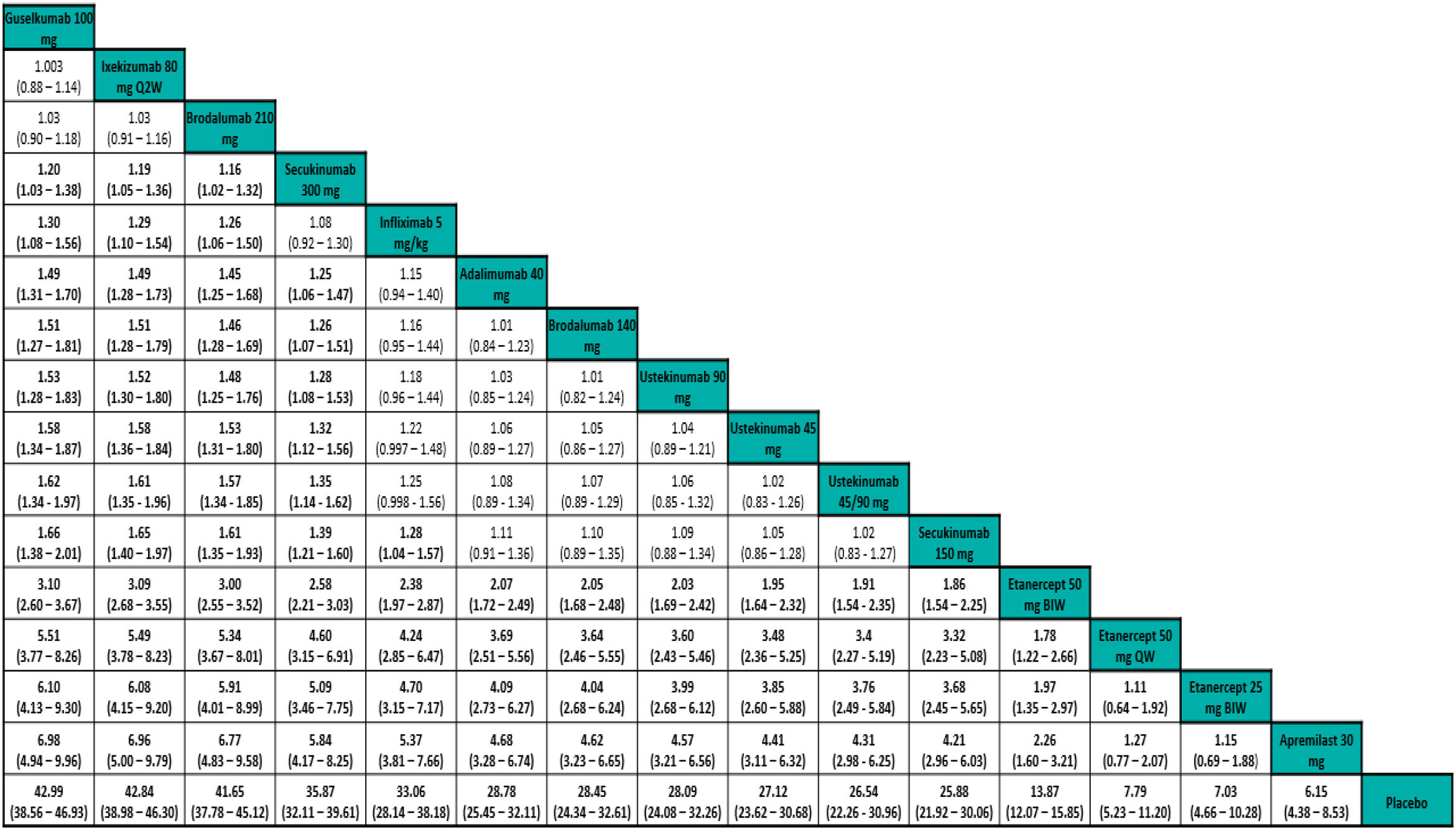
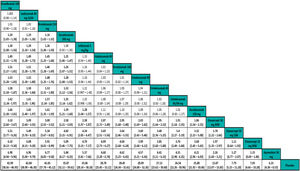
Los resultados de los NMA permiten comparar el efecto (eficacia, por ejemplo) relativo de cada tratamiento frente a otro. Los resultados generalmente se presentan en forma de «tablas de liga»31 (fig. 4).
Ejemplo de tabla de liga de un NMA frecuentista de efectos aleatorios con resultados del RR de respuesta PASI 90 ajustado al riesgo basal. Los tratamientos se ordenan de izquierda a derecha por orden de SUCRA decreciente. El estimador del efecto (eficacia) es el RR del tratamiento definido por la columna con respecto al definido por la línea; si el IC 95% no incluye uno, RR > 1 favorece al tratamiento definido por la columna, RR < 1 favorece al tratamiento definido por la línea.
Tomado de Cameron, et al.6.
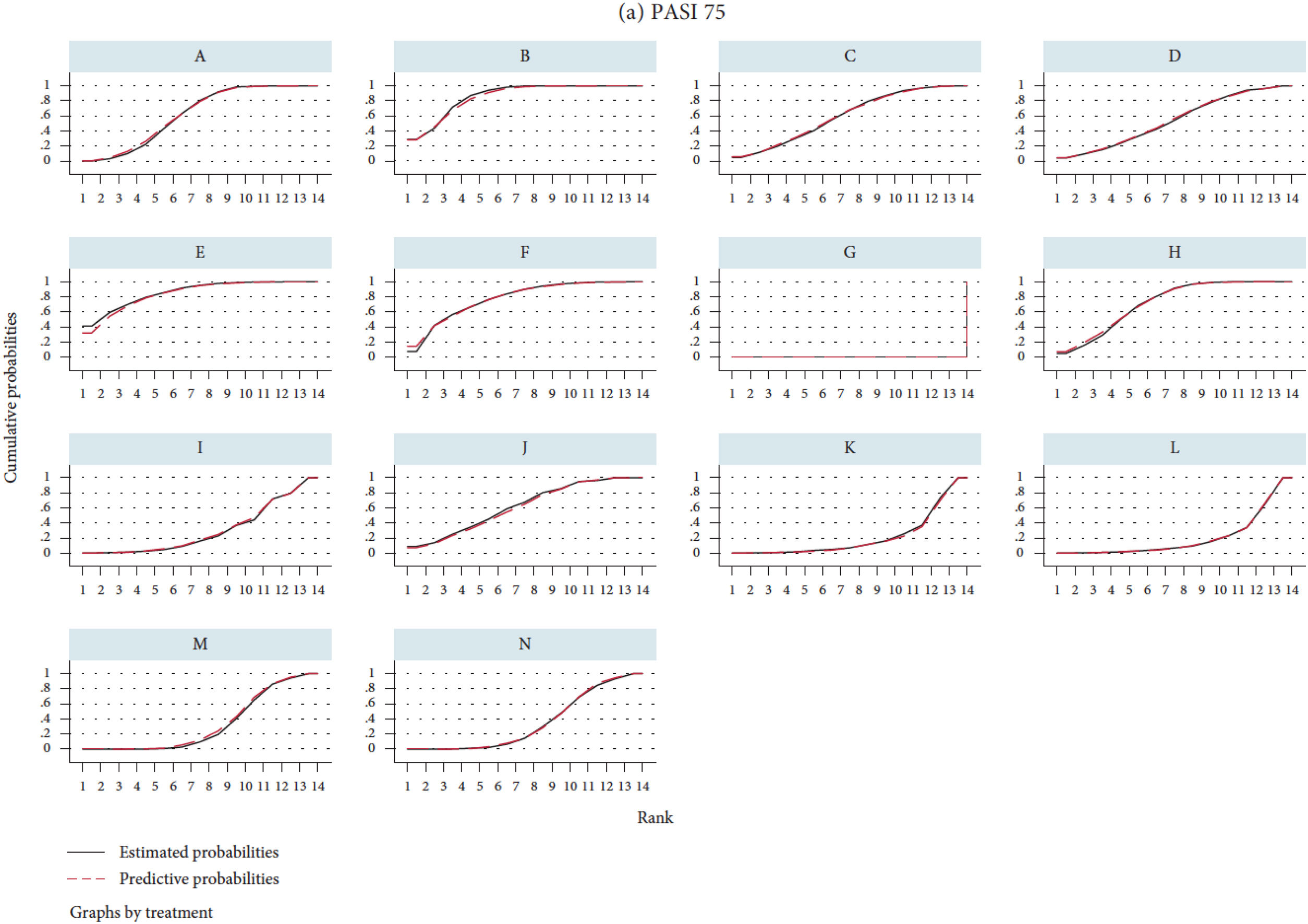
El ordenamiento (ranking) de los diferentes tratamientos se basa en el cálculo de las áreas bajo la curva de probabilidad de rango acumulativa, o surface under the cumulative ranking curve (SUCRA) (fig. 5)27, que se expresa en forma de porcentaje y puede interpretarse como la probabilidad de que todos los demás tratamientos sean inferiores32. También pueden representarse los números de orden estimados para cada fármaco en el NMA con su correspondiente ICr 95% en los denominados «rankogramas». Aunque la SUCRA se desarrolló en el marco bayesiano, algunos programas permiten calcular SUCRA en NMA frecuentistas; recientemente se ha propuesto un índice (P-score)33 que permite establecer un ordenamiento similar en el marco frecuentista.
Ilustración de los valores de SUCRA27. El rankograma (no representado) daría la probabilidad de rango, o sea de que cada tratamiento fuera el mejor, el segundo, el tercero, etc., siguiendo una distribución normal o de otro tipo. SUCRA es el área bajo la curva de probabilidad de rango acumulativa. En el eje horizontal se representa el posible rango de cada tratamiento (desde ser el mejor [1] hasta ser el peor [14 en este caso] de izquierda a derecha). En el eje vertical, la probabilidad acumulada de que cada tratamiento sea la mejor opción, la primera o segunda opción, una de las tres mejores opciones, etc. Si un tratamiento tiene el 100% de probabilidades de ser el mejor el primer valor de la «y» sería 1 (100%) y la curva seguiría horizontal (SUCRA del 100%); un tratamiento (por ejemplo, placebo) que tuviera el 100% de probabilidades de ser el peor tendría una curva representada por una línea horizontal hasta la última posición, donde subiría a 1 (SUCRA 0%). Los valores intermedios de SUCRA pueden considerarse como el porcentaje del área bajo la curva con respecto al rectángulo que representa el 100%, y permiten ordenar a los diferentes tratamientos. Otra manera de interpretar la SUCRA de un determinado tratamiento sería como la probabilidad (en porcentaje) de que los demás tratamientos sean peores.
A: brodalumab 140 mg; B, brodalumab 210 mg; C, guselkumab 100 mg; D, guselkumab 50 mg; E, ixekizumab 80 mg Q2W; F, ixekizumab 80 mg Q4W; G, placebo; H, risankizumab 150 mg; I, secukinumab 150 mg; J, secukinumab 300 mg; K, tildrakizumab 100 mg; L, tildrakizumab 200 mg; M, ustekinumab 45 mg; y N, ustekinumab 90 mg.
Tanto los ITC como los NMA emplean datos agregados, tal como se proporcionan en las publicaciones de forma sistematizada, siguiendo las directrices CONSORT y SPIRIT26. Cuando se dispone de los datos individuales de cada paciente para uno de los tratamientos y el placebo en varios RCT puede efectuarse una comparación indirecta con otros tratamientos tipo MAIC, y cuando se dispone de datos individuales para varios brazos de tratamiento puede efectuarse una comparación IPD.
Ejemplos recientes de comparaciones indirectas de tratamientos en psoriasisMetaanálisis en red (NMA)
En la mayoría de NMA de psoriasis se evalúan datos de respuesta al final del periodo comparado con placebo de los diversos RCT.
En un NMA frecuentista detallado con 14 tratamientos y dosis, incluyendo placebo, aunque solo tenía en cuenta 28 estudios27, los SUCRA y rangos medios correspondientes a la respuesta PASI 100 de los tratamientos a dosis aprobadas fueron: brodalumab 210 mg 85,0%, 2,9; ixekizumab 80 mg Q2W 83,3%, 3,2; risankizumab 150 mg 71,3%, 4,7; guselkumab 100 mg 61,4%, 6; secukinumab 300 mg 62,4%, 5,9; ustekinumab 90 mg 34,5%, 9,5; ustekinumab 45 mg 33,1%, 9,7; tildrakizumab 100 mg 21,9%, 11,2.
Una revisión sistemática y NMA bayesiano incluyó los últimos biológicos aprobados por la EMA para el tratamiento de la psoriasis y se centró en las respuestas PASI 50, PASI 75, PASI 90 y PASI 100 a 10-16 semanas34. El análisis incluyó exclusivamente RCT con las dosis autorizadas por la EMA y la U.S. Food and Drug Administration (FDA). El ajuste por respuesta placebo (determinante de heterogeneidad en los RCT) en el NMA mejoró la bondad de ajuste del modelo. La publicación incluyó resultados de respuesta diferencial y RR frente a placebo, RR frente a los seis fármacos aprobados más recientemente y NNT. Los NNT para PASI 100 fueron inferiores a tres en cuatro de los tratamientos comparados: ixekizumab (2,49; ICr 95% 1,66-4,43), risankizumab (2,55; ICr 95% 1,69-4,62), brodalumab (2,60; ICr 95% 1,17-4,72) y guselkumab (2,90; ICr 95% 1,83-5,52). Como referencia, el NNT PASI 100 calculado para adalimumab y ustekinumab fue aproximadamente 6.
La revisión más reciente del grupo Cochrane35, con un MA clásico y un NMA de marco frecuentista, incluyó 113 referencias correspondientes a 19 tratamientos diferentes de la psoriasis en placas moderada-grave, incluyendo moléculas pequeñas, con independencia de que la dosis utilizada en el estudio fuera la autorizada finalmente por la EMA. Se evaluaron como resultados principales el porcentaje de respuesta PASI 90 (no PASI 100) y el porcentaje de pacientes con acontecimientos adversos serios (SAE) al final de la fase de inducción (8-24 semanas). El método de NMA empleado fue la regresión multivariable, empleando el software Stata.
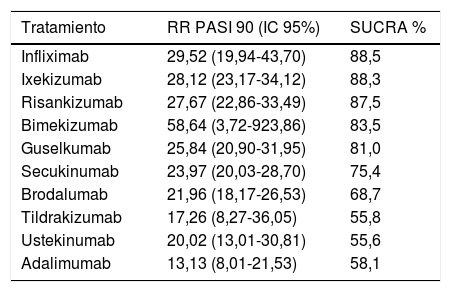
La ordenación (ranking) según SUCRA obtenida en este NMA no bayesiano se detalla en la tabla 1. Los autores de este NMA combinaron los resultados de eficacia (RR de conseguir respuesta PASI 90 frente a placebo) y aceptabilidad (valores inversos del RR de SAE frente a placebo) en una gráfica bidimensional, a semejanza de la utilizada previamente por los mismos36 y otros37 autores, que sitúa a risankizumab y bimekizumab (con un solo RCT) en el ángulo superior derecho, donde se ubicarían indicando los tratamientos «óptimos». Este NMA incluye seis análisis de sensibilidad seleccionando los estudios incluidos con base en parámetros adicionales como el número de participantes, el riesgo de sesgo, la dosis utilizada o el tiempo de valoración de la respuesta en la inducción.
Ordenación por RR (IC 95%) frente a placebo de respuesta PASI 90 y SUCRA, con base en el NMA frecuentista de efectos aleatorios de Sbidian E., et al.35
| Tratamiento | RR PASI 90 (IC 95%) | SUCRA % |
|---|---|---|
| Infliximab | 29,52 (19,94-43,70) | 88,5 |
| Ixekizumab | 28,12 (23,17-34,12) | 88,3 |
| Risankizumab | 27,67 (22,86-33,49) | 87,5 |
| Bimekizumab | 58,64 (3,72-923,86) | 83,5 |
| Guselkumab | 25,84 (20,90-31,95) | 81,0 |
| Secukinumab | 23,97 (20,03-28,70) | 75,4 |
| Brodalumab | 21,96 (18,17-26,53) | 68,7 |
| Tildrakizumab | 17,26 (8,27-36,05) | 55,8 |
| Ustekinumab | 20,02 (13,01-30,81) | 55,6 |
| Adalimumab | 13,13 (8,01-21,53) | 58,1 |
Un NMA bayesiano sustenta la actualización rápida 2020 de las directrices de la British Association of Dermatology para el tratamiento de la psoriasis con agentes biológicos38. Todos los datos empleados en este NMA corresponden a los publicados en los RCT a los 3-4 meses de tratamiento; se evaluó el porcentaje de respuesta con aclaramiento completo o casi completo, al cambio en Dermatology Life Quality Index (DLQI) y la retirada del tratamiento debido a acontecimientos adversos, y se efectuó un análisis de sensibilidad con las dosis autorizadas por la EMA. Por lo que respecta al aclaramiento completo o casi completo, a las dosis aprobadas, los fármacos disponibles se ordenan de la siguiente manera según el SUCRA y el rango (número de orden) promedio: risankizumab (89,9%; 2,2); ixekizumab (87,8%; 2,5); guselkumab (80,2%; 3,4); brodalumab (74,4%; 4,1); infliximab (73,5%; 4,2); secukinumab (68,8%; 4,7); adalimumab (41,1%; 8,1); ustekinumab (40,0%; 8,2); tildrakizumab (37,4%; 8,5); certolizumab pegol 200 mg (30,6%; 9,3); metotrexato (14,1%; 11,3); etanercept (12,3%; 11,5) y placebo (0%; 13).
Existen menos publicaciones con resultados de NMA a largo plazo (alrededor de un año)Un NMA frecuentista de la eficacia de diversos tratamientos a 52 semanas publicado en 201939 incluía resultados de RR, OR relativo y SUCRA (el primero en el rango de eficacia global resultaba brodalumab, con 97%, seguido de ixekizumab con 83%); sin embargo, este NMA no recogía ensayos clínicos de risankizumab ni guselkumab.
Una publicación reciente40 actualiza este estudio con un NMA bayesiano, recogiendo datos de eficacia (PASI 75, PASI 90 y PASI 100) hasta la semana 48-52 procedentes de 28 RCT, de los que en nueve se disponía de comparaciones H2H hasta el final de la fase de mantenimiento (análisis primario); los otros RCT se incluyeron en otro análisis asumiendo que las respuestas frente a placebo al final de la inducción (comparación con placebo a doble ciego) se mantuvieran durante el mantenimiento (análisis secundario).
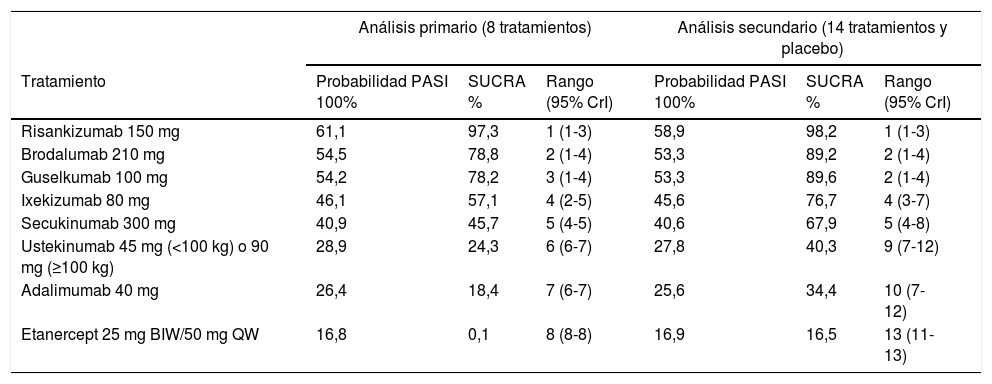
El análisis primario mostró que risankizumab es significativamente superior a los demás tratamientos (excepto brodalumab y guselkumab) en todos los niveles de respuesta PASI; que brodalumab y guselkumab son superiores a los demás excepto ixekizumab; y que ixekizumab y secukinumab son superiores a ustekinumab y adalimumab, siendo etanercept el tratamiento menos eficaz. Los NNT estimados para PASI 100, con ustekinumab como referente, fueron 4 para risankizumab, 5 para brodalumab y guselkumab, 7 para ixekizumab y 9 para secukinumab. Las probabilidades de respuesta PASI 100, SUCRA y medianas de rango con ICr 95% se detallan en la tabla 2. El análisis secundario, incluyendo 14 tratamientos y placebo, dio resultados concordantes con los del análisis primario (tabla 2).
Resultados (para respuesta PASI 100) de un NMA frecuentista con datos de eficacia hasta la semana 48-5240. El análisis primario incluye RCT H2H hasta el final de la fase de mantenimiento; el análisis secundario asume que las respuestas al final de la fase comparada con placebo persisten hasta el final del mantenimiento. Ordenación por estimación de probabilidad de respuesta PASI 100 frente a placebo, SUCRA y rango (95% CrI). En la figura 6 de la correspondiente publicación (que no reproducimos aquí) se incluye un rankograma del análisis secundario, con el rango (o número de orden) en el eje de abscisas y la SUCRA en el eje de ordenadas40
| Análisis primario (8 tratamientos) | Análisis secundario (14 tratamientos y placebo) | |||||
|---|---|---|---|---|---|---|
| Tratamiento | Probabilidad PASI 100% | SUCRA % | Rango (95% CrI) | Probabilidad PASI 100% | SUCRA % | Rango (95% CrI) |
| Risankizumab 150 mg | 61,1 | 97,3 | 1 (1-3) | 58,9 | 98,2 | 1 (1-3) |
| Brodalumab 210 mg | 54,5 | 78,8 | 2 (1-4) | 53,3 | 89,2 | 2 (1-4) |
| Guselkumab 100 mg | 54,2 | 78,2 | 3 (1-4) | 53,3 | 89,6 | 2 (1-4) |
| Ixekizumab 80 mg | 46,1 | 57,1 | 4 (2-5) | 45,6 | 76,7 | 4 (3-7) |
| Secukinumab 300 mg | 40,9 | 45,7 | 5 (4-5) | 40,6 | 67,9 | 5 (4-8) |
| Ustekinumab 45 mg (<100 kg) o 90 mg (≥100 kg) | 28,9 | 24,3 | 6 (6-7) | 27,8 | 40,3 | 9 (7-12) |
| Adalimumab 40 mg | 26,4 | 18,4 | 7 (6-7) | 25,6 | 34,4 | 10 (7-12) |
| Etanercept 25 mg BIW/50 mg QW | 16,8 | 0,1 | 8 (8-8) | 16,9 | 16,5 | 13 (11-13) |
BIW: dos veces por semana; QW: semanales.
Una publicación reciente incluye todos los agentes biológicos actualmente aprobados en nuestro medio, tanto a corto plazo (10-16 semanas) como al final de la fase de mantenimiento de los RCT (44-60 semanas)41. En primer lugar se efectuó una revisión sistemática de la literatura siguiendo la directriz PRISMA42, que incluyó RCT de fase 2, 3 o 4 en pacientes adultos con psoriasis moderada a grave, con tratamientos y posologías aprobados por la EMA.
Para comparar las respuestas a 10-16 semanas se efectuó un NMA de efectos aleatorios bayesiano ordinal; teniendo en cuenta la heterogeneidad de los RCT se ajustó la respuesta a placebo6. Como medida del efecto del tratamiento se estimaron las tasas de respuesta empleando la mediana «posterior» (en el sentido bayesiano) y los correspondientes ICr 95%, así como el NNT. También se efectuaron comparaciones por pares de los diferentes tratamientos con risankizumab, ixekizumab, brodalumab y guselkumab. Se describió con detalle el software estadístico empleado (R y WinBUGS, con probabilidades a priori no informativas) y se efectuaron análisis de sensibilidad excluyendo RCT específicos de país, incluyendo solamente RCT de fase tres, o incluyendo tratamientos convencionales adicionales.
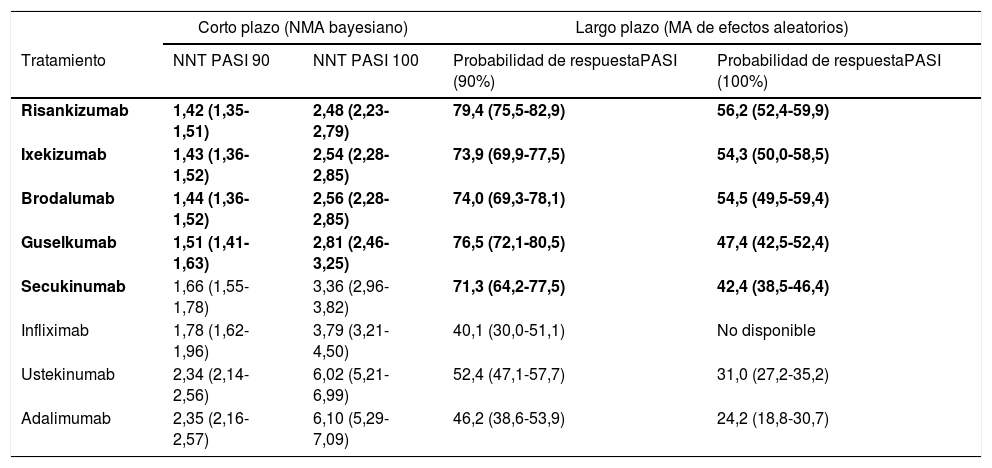
A corto plazo, risankizumab, ixekizumab, brodalumab y guselkumab tuvieron tasas de respuesta significativamente superiores a los demás tratamientos, incluyendo infliximab y secukinumab en el caso de los tres primeros, sin que se observaran diferencias significativas entre los cuatro. Las correspondientes medianas posteriores de las tasas de respuesta en los cuatro tratamientos fueron superiores a 85% para PASI 75, 66% para PASI 90 y 35% para PASI 100. Los correspondientes NNT, con sus ICr 95%, se recogen en la tabla 3. Los resultados de los análisis de sensibilidad concordaron con los del caso base.
Número de pacientes a tratar (NNT) para conseguir respuesta PASI 90 o PASI 100 (IC 95%) a corto plazo (10-16 semanas), y probabilidad de respuesta PASI 90 o PASI 100 (IC 95%) a largo plazo (44-60 semanas) estimada en el MA tradicional de efectos aleatorios para los mejores tratamientos biológicos41
| Corto plazo (NMA bayesiano) | Largo plazo (MA de efectos aleatorios) | |||
|---|---|---|---|---|
| Tratamiento | NNT PASI 90 | NNT PASI 100 | Probabilidad de respuestaPASI (90%) | Probabilidad de respuestaPASI (100%) |
| Risankizumab | 1,42 (1,35-1,51) | 2,48 (2,23-2,79) | 79,4 (75,5-82,9) | 56,2 (52,4-59,9) |
| Ixekizumab | 1,43 (1,36-1,52) | 2,54 (2,28-2,85) | 73,9 (69,9-77,5) | 54,3 (50,0-58,5) |
| Brodalumab | 1,44 (1,36-1,52) | 2,56 (2,28-2,85) | 74,0 (69,3-78,1) | 54,5 (49,5-59,4) |
| Guselkumab | 1,51 (1,41-1,63) | 2,81 (2,46-3,25) | 76,5 (72,1-80,5) | 47,4 (42,5-52,4) |
| Secukinumab | 1,66 (1,55-1,78) | 3,36 (2,96-3,82) | 71,3 (64,2-77,5) | 42,4 (38,5-46,4) |
| Infliximab | 1,78 (1,62-1,96) | 3,79 (3,21-4,50) | 40,1 (30,0-51,1) | No disponible |
| Ustekinumab | 2,34 (2,14-2,56) | 6,02 (5,21-6,99) | 52,4 (47,1-57,7) | 31,0 (27,2-35,2) |
| Adalimumab | 2,35 (2,16-2,57) | 6,10 (5,29-7,09) | 46,2 (38,6-53,9) | 24,2 (18,8-30,7) |
Los cuatro tratamientos significativamente superiores según el NMA bayesiano y los cinco según el MA de efectos aleatorios (comparaciones a pares de OR) se destacan en sombreado; se incluyen datos correspondientes a otros tratamientos con fines de comparación.
El análisis de la eficacia a largo plazo se ve dificultado por el cruce de brazos, la realeatorización y la selección de pacientes respondedores, lo que obligó a excluir numerosos RCT. Solo se incluyeron 22 RCT y se efectuó un MA tradicional de efectos aleatorios para estimar las tasas de respuesta PASI 75, PASI 90 y PASI 100, efectuando comparaciones por pares con risankizumab, ixekizumab, brodalumab y guselkumab y calculando los respectivos OR con IC 95%. Se efectuaron análisis de sensibilidad excluyendo RCT específicos de país, incluyendo solo RCT de fase 3, o solo RCT con análisis de imputación de no respuesta (NRI).
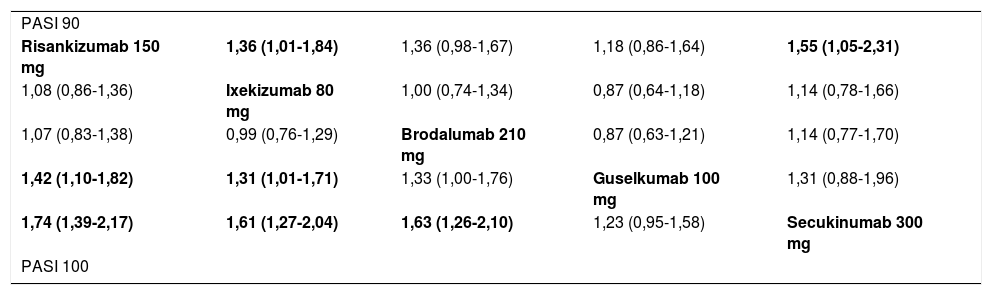
Las tasas de respuesta PASI 90 y PASI 100 a 44-60 semanas estimadas en el MA de efectos aleatorios se detallan en la tabla 3. En la tabla 4 se recogen las comparaciones a pares (OR) entre los cinco tratamientos con respuestas superiores a largo plazo (datos procedentes de la Figure 2 del Suplemento en la publicación original)41.
Tabla de liga que resume los resultados de las comparaciones indirectas (ITC) a pares de los diferentes tratamientos en el MA de efectos aleatorios de los resultados a largo plazo (44-60 semanas)41
| PASI 90 | ||||
| Risankizumab 150 mg | 1,36 (1,01-1,84) | 1,36 (0,98-1,67) | 1,18 (0,86-1,64) | 1,55 (1,05-2,31) |
| 1,08 (0,86-1,36) | Ixekizumab 80 mg | 1,00 (0,74-1,34) | 0,87 (0,64-1,18) | 1,14 (0,78-1,66) |
| 1,07 (0,83-1,38) | 0,99 (0,76-1,29) | Brodalumab 210 mg | 0,87 (0,63-1,21) | 1,14 (0,77-1,70) |
| 1,42 (1,10-1,82) | 1,31 (1,01-1,71) | 1,33 (1,00-1,76) | Guselkumab 100 mg | 1,31 (0,88-1,96) |
| 1,74 (1,39-2,17) | 1,61 (1,27-2,04) | 1,63 (1,26-2,10) | 1,23 (0,95-1,58) | Secukinumab 300 mg |
| PASI 100 | ||||
Los datos se dan como OR estimado (IC 95%).
En el triángulo inferior (PASI 100), el estimador del efecto (eficacia) es el OR estimado del tratamiento definido por la columna con respecto al definido por la línea; si el IC 95% no incluye el valor de 1, OR > 1 favorece al tratamiento definido por la columna, OR < 1 favorece al tratamiento definido por la línea.
En el triángulo superior (PASI 90) el estimador es el OR estimado para el tratamiento definido por la línea con respecto al tratamiento definido por la columna. Si el IC 95% no incluye el valor de 1, OR > 1 favorece al tratamiento definido por la línea, OR < 1 favorece al tratamiento definido por la columna. Se resaltan en sombreado las comparaciones significativas.
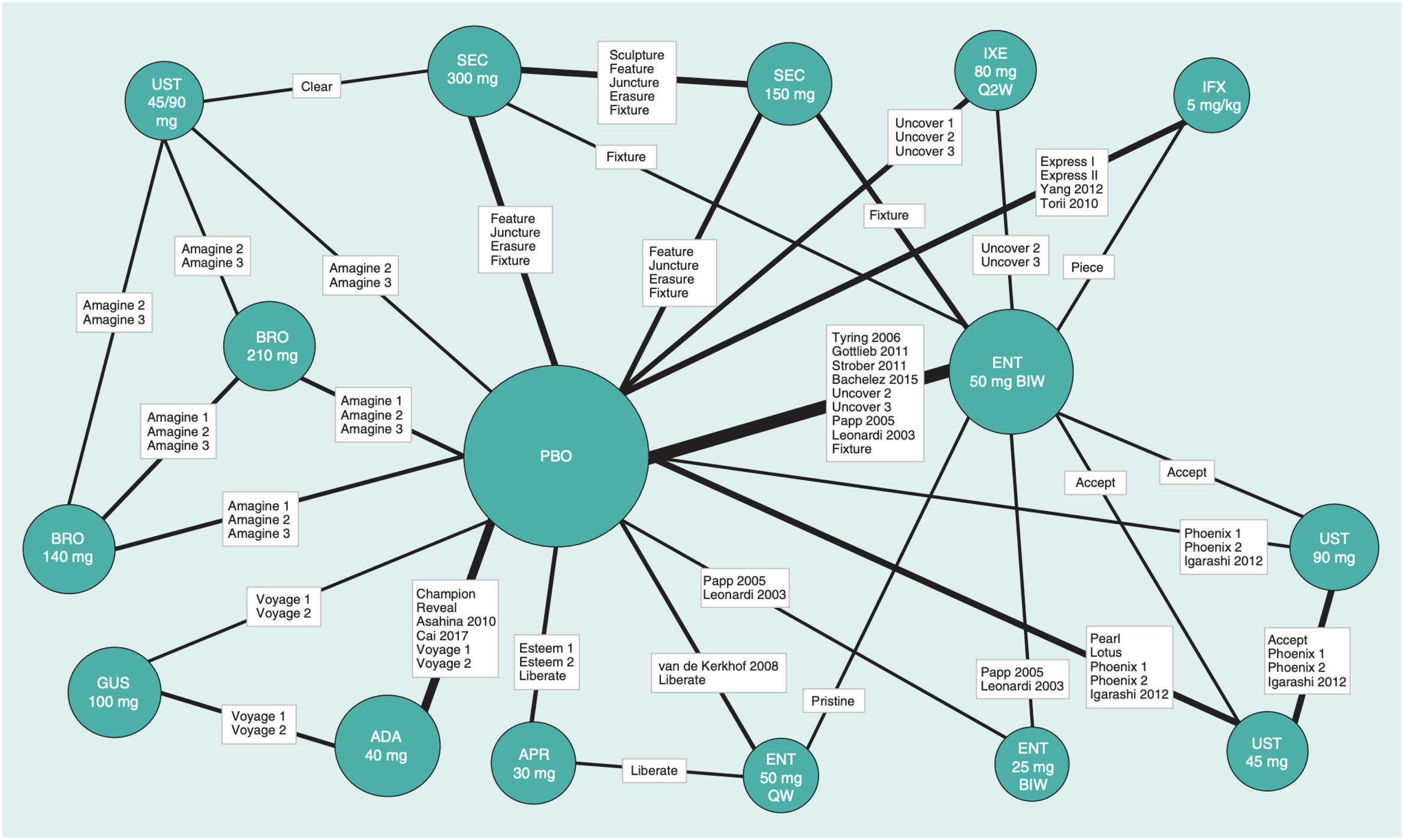
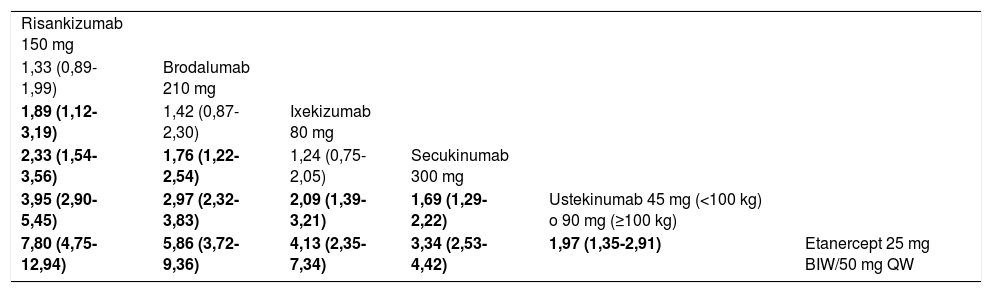
Con el fin de evaluar si el método del MA43 podía afectar a los resultados, se efectuó asimismo un NMA bayesiano de efectos fijos, incluyendo los RCT que mantenían la aleatorización hasta la semana 52 (siete RCT correspondiendo a seis tratamientos). El correspondiente diagrama de red obtenido a partir de los datos de la publicación original se ilustra en la figura 6. La tabla de liga de comparaciones a pares (OR) de este NMA se detalla en la tabla 5.
Diagrama de la red en el NMA bayesiano de efectos fijos efectuado con los RCT en los que se mantuvo la aleatorización hasta la semana 52.
Tomado de Armstrong A.W., et al.41.
Tabla de liga que resume los OR (ICr 95%) resultantes de las comparaciones por pares de tratamientos en el NMA bayesiano de efectos fijos de las respuestas PASI 90 a 52 semanas41
| Risankizumab 150 mg | |||||
| 1,33 (0,89-1,99) | Brodalumab 210 mg | ||||
| 1,89 (1,12-3,19) | 1,42 (0,87-2,30) | Ixekizumab 80 mg | |||
| 2,33 (1,54-3,56) | 1,76 (1,22-2,54) | 1,24 (0,75-2,05) | Secukinumab 300 mg | ||
| 3,95 (2,90-5,45) | 2,97 (2,32-3,83) | 2,09 (1,39-3,21) | 1,69 (1,29-2,22) | Ustekinumab 45 mg (<100 kg) o 90 mg (≥100 kg) | |
| 7,80 (4,75-12,94) | 5,86 (3,72-9,36) | 4,13 (2,35-7,34) | 3,34 (2,53-4,42) | 1,97 (1,35-2,91) | Etanercept 25 mg BIW/50 mg QW |
ICr 95%: intervalo de credibilidad 95%. Los datos se dan como OR estimado (ICr 95%). El estimador del efecto (eficacia) es el OR estimado del tratamiento definido por la columna con respecto al definido por la línea; si el ICr 95% no incluye 1, OR > 1 favorece al tratamiento definido por la columna, OR < 1 favorece al tratamiento definido por la línea. Se resaltan en sombreado las comparaciones significativas. BIW: dos veces por semana; QW: semanales.
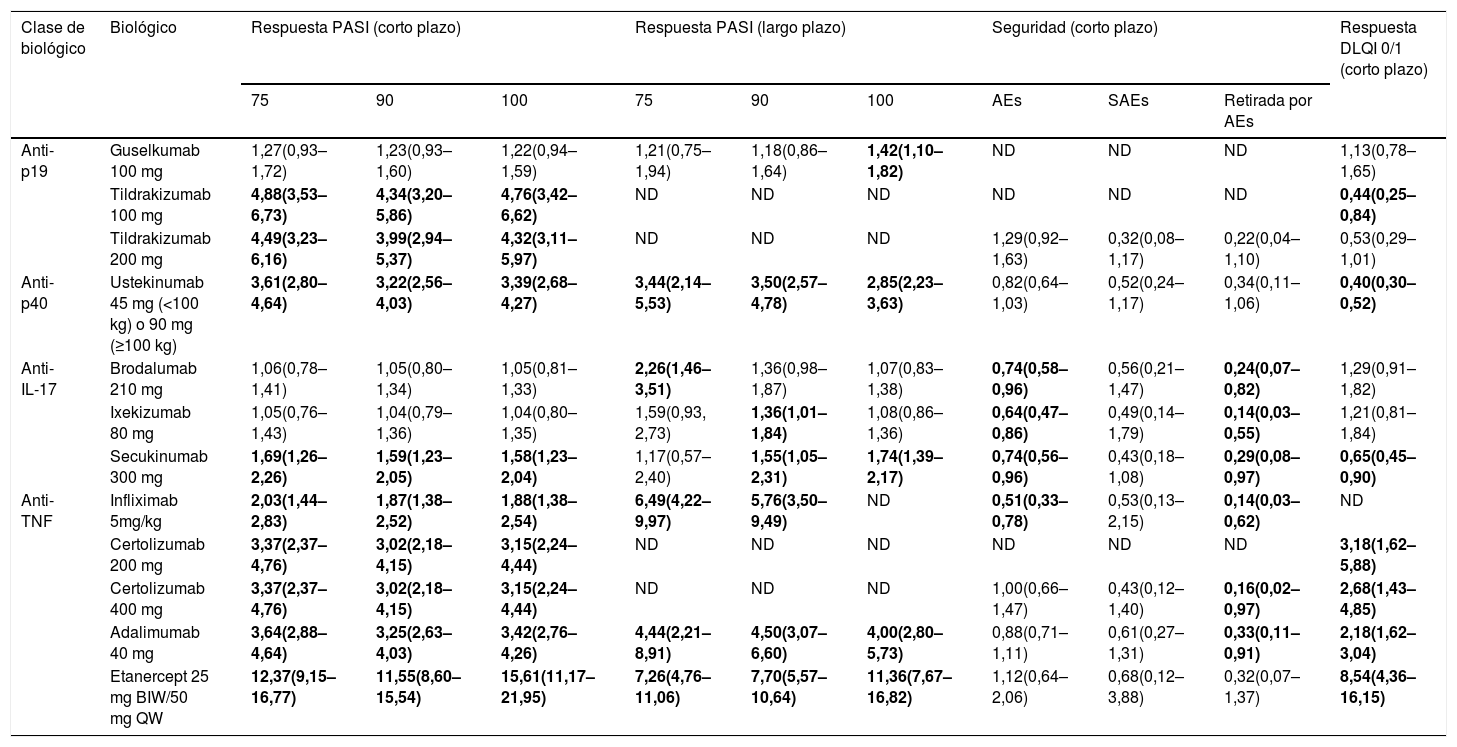
Los resultados de este NMA41 se pueden complementar con los correspondientes a seguridad (SAE y retiradas de los RCT debidas a SAE) y a impacto sobre la calidad de vida (porcentaje de respuesta DLQI 0/1) al final del período de inducción o evaluación de la respuesta principal en los RCT (semanas 12-16), que han sido presentados en forma de póster en el World Congress of Dermatology de Milán en 2019 (Shear et al. Póster 6285) y en el 28th Congress of the European Academy of Dermatology and Venereology de Madrid en 2019 (Warren RB, et al. Póster 1716). Los resultados de estas comparaciones por pares de risankizumab frente a los otros fármacos se detallan en la tabla 6.
Tabla resumen de las comparaciones indirectas de risankizumab 150 mg con otros fármacos biológicos para el tratamiento de la psoriasis en placas moderada a grave efectuadas en el NMA de Armstrong et al.41 y pósters basados en el mismo
| Clase de biológico | Biológico | Respuesta PASI (corto plazo) | Respuesta PASI (largo plazo) | Seguridad (corto plazo) | Respuesta DLQI 0/1 (corto plazo) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 75 | 90 | 100 | 75 | 90 | 100 | AEs | SAEs | Retirada por AEs | |||
| Anti-p19 | Guselkumab 100 mg | 1,27(0,93–1,72) | 1,23(0,93–1,60) | 1,22(0,94–1,59) | 1,21(0,75–1,94) | 1,18(0,86–1,64) | 1,42(1,10–1,82) | ND | ND | ND | 1,13(0,78–1,65) |
| Tildrakizumab 100 mg | 4,88(3,53–6,73) | 4,34(3,20–5,86) | 4,76(3,42–6,62) | ND | ND | ND | ND | ND | ND | 0,44(0,25–0,84) | |
| Tildrakizumab 200 mg | 4,49(3,23–6,16) | 3,99(2,94–5,37) | 4,32(3,11–5,97) | ND | ND | ND | 1,29(0,92–1,63) | 0,32(0,08–1,17) | 0,22(0,04–1,10) | 0,53(0,29–1,01) | |
| Anti-p40 | Ustekinumab 45 mg (<100 kg) o 90 mg (≥100 kg) | 3,61(2,80–4,64) | 3,22(2,56–4,03) | 3,39(2,68–4,27) | 3,44(2,14–5,53) | 3,50(2,57–4,78) | 2,85(2,23–3,63) | 0,82(0,64–1,03) | 0,52(0,24–1,17) | 0,34(0,11–1,06) | 0,40(0,30–0,52) |
| Anti-IL-17 | Brodalumab 210 mg | 1,06(0,78–1,41) | 1,05(0,80–1,34) | 1,05(0,81–1,33) | 2,26(1,46–3,51) | 1,36(0,98–1,87) | 1,07(0,83–1,38) | 0,74(0,58–0,96) | 0,56(0,21–1,47) | 0,24(0,07–0,82) | 1,29(0,91–1,82) |
| Ixekizumab 80 mg | 1,05(0,76–1,43) | 1,04(0,79–1,36) | 1,04(0,80–1,35) | 1,59(0,93, 2,73) | 1,36(1,01–1,84) | 1,08(0,86–1,36) | 0,64(0,47–0,86) | 0,49(0,14–1,79) | 0,14(0,03–0,55) | 1,21(0,81–1,84) | |
| Secukinumab 300 mg | 1,69(1,26–2,26) | 1,59(1,23–2,05) | 1,58(1,23–2,04) | 1,17(0,57–2,40) | 1,55(1,05–2,31) | 1,74(1,39–2,17) | 0,74(0,56–0,96) | 0,43(0,18–1,08) | 0,29(0,08–0,97) | 0,65(0,45–0,90) | |
| Anti-TNF | Infliximab 5mg/kg | 2,03(1,44–2,83) | 1,87(1,38–2,52) | 1,88(1,38–2,54) | 6,49(4,22–9,97) | 5,76(3,50–9,49) | ND | 0,51(0,33–0,78) | 0,53(0,13–2,15) | 0,14(0,03–0,62) | ND |
| Certolizumab 200 mg | 3,37(2,37–4,76) | 3,02(2,18–4,15) | 3,15(2,24–4,44) | ND | ND | ND | ND | ND | ND | 3,18(1,62–5,88) | |
| Certolizumab 400 mg | 3,37(2,37–4,76) | 3,02(2,18–4,15) | 3,15(2,24–4,44) | ND | ND | ND | 1,00(0,66–1,47) | 0,43(0,12–1,40) | 0,16(0,02–0,97) | 2,68(1,43–4,85) | |
| Adalimumab 40 mg | 3,64(2,88–4,64) | 3,25(2,63–4,03) | 3,42(2,76–4,26) | 4,44(2,21–8,91) | 4,50(3,07–6,60) | 4,00(2,80–5,73) | 0,88(0,71–1,11) | 0,61(0,27–1,31) | 0,33(0,11–0,91) | 2,18(1,62–3,04) | |
| Etanercept 25 mg BIW/50 mg QW | 12,37(9,15–16,77) | 11,55(8,60–15,54) | 15,61(11,17–21,95) | 7,26(4,76–11,06) | 7,70(5,57–10,64) | 11,36(7,67–16,82) | 1,12(0,64–2,06) | 0,68(0,12–3,88) | 0,32(0,07–1,37) | 8,54(4,36–16,15) | |
Los datos son OR estimados (IC 95%); para PASI 75, PASI 90 y PASI 100 procedentes de la eFigure 1 y eFigure 2 del supplementary online content41; para datos de seguridad procedentes de la Figura 2 del póster 6285 presentado en el World Congress of Dermatology, Milán 2019 (Shear NH, et al. Comparison of safety outcomes for treatments of moderate to severe plaque psoriasis through a network meta-analysis); para porcentajes de respuesta DLQI 0/1 procedentes de la Tabla 1 del póster 1716 presentado en el 28th Congress of the European Academy of Dermatology andVenereology de Madrid en 2019 (Warren RB, et al. Comparison of dermatology quality of life index for novel treatments of moderate-to-severe plaque psoriasis: a network meta-analysis). En negrita y sombreado resultados significativos (p < 0,05) basados en IC 95%.
AE: acontecimientos adversos; SAE: acontecimientos adversos serios; ND: datos no disponibles.
Cuando existe un desequilibrio entre los modificadores conocidos (covariables) del efecto del tratamiento y se dispone de datos individuales de pacientes, las MAIC pueden ser preferibles a las ITC y los NMA, reduciendo el sesgo. Un MAIC reciente que sirve como ejemplo de estudio compara la eficacia de ixekizumab y secukinumab44 empleando datos individuales de pacientes tratados con ixekizumab en RCT que lo comparaban con placebo, etanercept o ustekinumab, ajustándolos (eliminado casos o ponderando su representación en el brazo de tratamiento) para determinadas covariables tales como el peso basal, la duración de la psoriasis o el tratamiento sistémico previo. A continuación, se efectuó una ITC anclada por el método de Bucher empleando las medidas de efecto (diferencias de riesgo y OR) resultantes del ajuste de los datos individuales de ixekizumab a los datos agregados de los RCT de secukinumab para cada una de las comparaciones (placebo, etanercept y ustekinumab). Se efectuaron una serie de MAIC e ITC para cada comparación; como para cada comparación indirecta de ixekizumab frente a secukinumab obtuvieron dos resultados (a saber, a través de etanercept y a través de ustekinumab) los autores efectuaron un MA de los mismos con modelo de efectos fijos44.
Comparaciones indirectas con datos de pacientes individuales (IPD)En otra publicación se ha efectuado una comparación indirecta de guselkumab con ustekinumab empleando IPD de diferentes RCT del mismo promotor y ajustando las diferencias en las covariables mediante un modelo de regresión multivariable45. Esta publicación también ilustra las potenciales limitaciones de la inclusión de RCT con brazos en los que existe una pérdida parcial del «ciego» o un enriquecimiento de un brazo determinado con base en la respuesta previa al switch, pero los análisis de sensibilidad refuerzan los resultados obtenidos.
ConclusiónEl empleo de MA tradicionales y NMA (frecuentistas o bayesianos) incorpora la información de los RCT y permite establecer comparaciones indirectas y mixtas de la eficacia de los diferentes tratamientos, ordenándolos por rango. A la hora de interpretar y comparar los resultados de los diferentes MA y NMA es importante tener en cuenta la metodología empleada y el diseño de los estudios incluidos en la comparación. Con todas las limitaciones inherentes a la extrapolación de los RCT a la práctica clínica real, estos resultados son útiles para los clínicos y las agencias reguladoras o financiadoras, como ilustra el ejemplo de la psoriasis moderada a grave. Sobre la base de distintos NMA, los cuatro tratamientos más eficaces (respuesta PASI 90 y PASI 100) tanto a corto (10-16 semanas de tratamiento) como a largo plazo (aproximadamente un año) son risankizumab, brodalumab, ixekizumab y guselkumab, por este orden aproximado, aunque las diferencias entre ellos no siempre resultan significativas.
Conflicto de interesesEl Dr. L. Puig ha percibido honorarios como consultor y/o ponente de Abbvie®, Almirall®, Amgen®, Baxalta®, Biogen®, Boehringer Ingelheim®, Celgene®, Fresenius-Kabi®, Gebro®, Janssen®, JS BIOCAD®, Leo-Pharma®, Lilly®, Merck-Serono®, MSD®, Mylan®, Novartis®, Pfizer®, Regeneron®, Roche®, Sandoz®, Samsung-Bioepis®, Sanofi®, UCB®. Asimismo, ha participado en ensayos clínicos patrocinados por: Abbvie®, Almirall®, Amgen®, Boehringer Ingelheim®, Celgene®, Janssen®, Leo-Pharma®, Lilly®, Novartis®, Pfizer®, Regeneron®, Roche®, Sanofi®, y UCB®.


![Ilustración de los valores de SUCRA27. El rankograma (no representado) daría la probabilidad de rango, o sea de que cada tratamiento fuera el mejor, el segundo, el tercero, etc., siguiendo una distribución normal o de otro tipo. SUCRA es el área bajo la curva de probabilidad de rango acumulativa. En el eje horizontal se representa el posible rango de cada tratamiento (desde ser el mejor [1] hasta ser el peor [14 en este caso] de izquierda a derecha). En el eje vertical, la probabilidad acumulada de que cada tratamiento sea la mejor opción, la primera o segunda opción, una de las tres mejores opciones, etc. Si un tratamiento tiene el 100% de probabilidades de ser el mejor el primer valor de la «y» sería 1 (100%) y la curva seguiría horizontal (SUCRA del 100%); un tratamiento (por ejemplo, placebo) que tuviera el 100% de probabilidades de ser el peor tendría una curva representada por una línea horizontal hasta la última posición, donde subiría a 1 (SUCRA 0%). Los valores intermedios de SUCRA pueden considerarse como el porcentaje del área bajo la curva con respecto al rectángulo que representa el 100%, y permiten ordenar a los diferentes tratamientos. Otra manera de interpretar la SUCRA de un determinado tratamiento sería como la probabilidad (en porcentaje) de que los demás tratamientos sean peores. A: brodalumab 140 mg; B, brodalumab 210 mg; C, guselkumab 100 mg; D, guselkumab 50 mg; E, ixekizumab 80 mg Q2W; F, ixekizumab 80 mg Q4W; G, placebo; H, risankizumab 150 mg; I, secukinumab 150 mg; J, secukinumab 300 mg; K, tildrakizumab 100 mg; L, tildrakizumab 200 mg; M, ustekinumab 45 mg; y N, ustekinumab 90 mg. Ilustración de los valores de SUCRA27. El rankograma (no representado) daría la probabilidad de rango, o sea de que cada tratamiento fuera el mejor, el segundo, el tercero, etc., siguiendo una distribución normal o de otro tipo. SUCRA es el área bajo la curva de probabilidad de rango acumulativa. En el eje horizontal se representa el posible rango de cada tratamiento (desde ser el mejor [1] hasta ser el peor [14 en este caso] de izquierda a derecha). En el eje vertical, la probabilidad acumulada de que cada tratamiento sea la mejor opción, la primera o segunda opción, una de las tres mejores opciones, etc. Si un tratamiento tiene el 100% de probabilidades de ser el mejor el primer valor de la «y» sería 1 (100%) y la curva seguiría horizontal (SUCRA del 100%); un tratamiento (por ejemplo, placebo) que tuviera el 100% de probabilidades de ser el peor tendría una curva representada por una línea horizontal hasta la última posición, donde subiría a 1 (SUCRA 0%). Los valores intermedios de SUCRA pueden considerarse como el porcentaje del área bajo la curva con respecto al rectángulo que representa el 100%, y permiten ordenar a los diferentes tratamientos. Otra manera de interpretar la SUCRA de un determinado tratamiento sería como la probabilidad (en porcentaje) de que los demás tratamientos sean peores. A: brodalumab 140 mg; B, brodalumab 210 mg; C, guselkumab 100 mg; D, guselkumab 50 mg; E, ixekizumab 80 mg Q2W; F, ixekizumab 80 mg Q4W; G, placebo; H, risankizumab 150 mg; I, secukinumab 150 mg; J, secukinumab 300 mg; K, tildrakizumab 100 mg; L, tildrakizumab 200 mg; M, ustekinumab 45 mg; y N, ustekinumab 90 mg.](https://static.elsevier.es/multimedia/00017310/0000011200000003/v1_202103020647/S0001731020304099/v1_202103020647/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w9/t1/zx4Q/XH5Tma1a/6fSs=)