La dermatitis atópica (DA) es una enfermedad cutánea inflamatoria crónica con síntomas tales como el prurito, que pueden causar una carga significativa en la vida del paciente. Los resultados percibidos por los pacientes (PRO) complementan a los resultados clínicos evaluados en la DA por los médicos. Esta revisión sistemática tiene como objetivo identificar y describir las medidas de los resultados percibidos por los pacientes (PROM) utilizadas en estudios observacionales de DA durante la última década en España. Se identificaron 18 PROM para medir 13 PRO diferentes que evalúan múltiples aspectos de la enfermedad, incluyendo los síntomas y la gravedad de la enfermedad, la interferencia con las actividades diarias, el impacto psicosocial y laboral, el empoderamiento del paciente y la calidad de vida relacionada con la salud (CVRS). La CVRS, los síntomas (principalmente el prurito) y la ansiedad/depresión fueron los PRO más evaluados, siendo el Dermatology Life Quality Index, la Escala Visual Analógica del prurito y la Hospital Anxiety and Depression Scale, las PROM más frecuentemente empleadas, respectivamente. El número creciente de estudios observacionales sobre DA que incluyen PROM en España sugiere un aumento de la importancia de los PRO en el manejo de la DA.
Atopic dermatitis (AD) is a chronic inflammatory skin disease with symptoms such as pruritus that can be a major burden for patients. Patient-reported outcomes (PRO) complement clinician-reported outcomes in AD. This systematic review aims to identify and describe patient-reported outcome measures (PROM) used in observational studies of AD over the last decade in Spain. Eighteen PROM were identified to measure 13 different PRO that assess multiple aspects of the disease, including symptoms and disease severity, impact on daily activities and on work productivity/functioning, psychosocial impact, patient empowerment, and health-related quality of life (HRQoL). HRQoL, symptoms (particularly pruritus), and anxiety/depression were the most frequently assessed PRO, and the Dermatology Quality of Life Index, the Visual Analogue Pruritus Scale, and the Hospital Anxiety and Depression Scale were the most frequently used PROM, respectively. The growing number of observational studies on AD including PROM in Spain suggests that PRO are becoming increasingly important in the management of AD.
La dermatitis atópica (DA) es una enfermedad inflamatoria crónica cutánea frecuente, que afecta al 15,5% de los niños1 y al 7,2% de los adultos en España2. Se caracteriza por prurito intenso y lesiones eccematosas recurrentes3. La DA presenta síntomas que pueden interferir en las actividades de la vida diaria, y provocar alteraciones del sueño, dolor cutáneo, deterioro del desempeño psicosocial y laboral, y repercutir en la calidad de vida relacionada con la salud (CVRS)4,5, originando una carga significativa en la vida del paciente6.
A diferencia de otros trastornos, para la mayoría de enfermedades dermatológicas no se dispone de marcadores objetivos de la progresión de la enfermedad7. Por tanto, se han desarrollado diferentes medidas de resultados percibidos por los médicos (ClinRO) para evaluar los signos clínicos, así como su gravedad y extensión en la DA, como por ejemplo EASI (Eczema Area and Severity Index), IGA (Investigator Global Assessment), IGA validado para DA (vIGA-AD™), o SCORAD (SCORing Atopic Dermatitis). Este último incluye también la perspectiva del paciente, evaluando los principales síntomas de la DA (prurito y alteraciones del sueño). Evaluar los síntomas y su impacto en las actividades diarias, la productividad/desempeño laboral y CVRS desde la perspectiva del paciente es esencial para obtener una visión holística del impacto de la enfermedad y determinar su carga real5,7. Por tanto, los resultados percibidos por el paciente (PRO) complementan la ClinRO en la DA5. Por este motivo, se han desarrollado diversas medidas de resultados percibidos por el paciente (PROM) durante las últimas décadas, habiéndose integrado muchas de ellas en el desarrollo y evaluación de los nuevos tratamientos para la DA5.
Las PROM son también una parte integral de los programas de ensayo clínico sobre DA. En los últimos años ha surgido una nueva iniciativa para armonizar las medidas del resultado para el eccema (Harmonize Outcome Measures for Eczema - HOME)8 en los ensayos clínicos. Dicha iniciativa ha definido un conjunto principal de resultados e instrumentos que incluyen, entre otros: EASI, para medir los signos de la enfermedad; POEM (Patient-Oriented Eczema Measure), para recopilar los síntomas reportados por el paciente; NRS (Numerical Rating Scale), para medir el prurito máximo durante las últimas 24 horas; y DLQI (Dermatology Life Quality Index), para evaluar la CVRS8. HOME define actualmente un listado de instrumentos idóneos para medir dominios de salud en la práctica clínica, habiéndose acordado cinco dominios principales: PRO, control de la enfermedad/brote, evaluación global del paciente, signos reportados por el médico, y CV (calidad de vida) específica del eccema. POEM, el índice SCORAD orientado al paciente (PO-SCORAD), o ambos, han sido seleccionados hasta el momento para medir los síntomas de la DA en la práctica clínica. Además, la NRS del prurito ha sido provisionalmente recomendada como instrumento de medición de la intensidad del prurito6.
Existen muchas PROM diferentes para medir los PRO de la DA en la práctica clínica, muchas de los cuales se centran en los síntomas y el deterioro de la CVRS, pero ninguna evalúa ampliamente todos los aspectos de la enfermedad. Debido a esta variedad de instrumentos, existen algunas revisiones internacionales de PROM para DA en la literatura9–11, pero hasta la fecha ninguna ha revisado los instrumentos utilizados en España para la DA. Se ha realizado una revisión sistemática para identificar y describir las PROM específicas utilizadas en los estudios sobre DA en vida real durante la última década en España.
MétodosSe realizó una revisión sistemática de la literatura para identificar los estudios que validaran y/o utilizaran PROM para DA en el contexto de la práctica clínica en España. Se llevaron a cabo búsquedas en bases de datos españolas (MEDES, IBECS) e internacionales (PubMed/MEDLINE). Dicha revisión fue realizada siguiendo las recomendaciones PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses)12, así como las recomendaciones establecidas en el Manual Cochrane para revisiones sistemáticas de intervenciones13. Además, se realizó una búsqueda amplia en la literatura gris, incluyendo bases de datos específicas de herramientas de investigación de PRO (BiblioPRO, PROQOLID), las páginas web de los congresos de dermatología españoles (AEDV) y europeos (EADV), así como Google/Google Scholar. Por último, se revisaron los listados de referencias de los artículos recuperados para complementar la búsqueda sistemática.
La estrategia de búsqueda se centró en los términos relacionados con la enfermedad, PRO y PROM, y país de interés (Tabla S 1). La búsqueda se limitó a los artículos originales y comunicaciones a congresos publicados en inglés o español entre el 1 de abril de 2010 y el 1 de abril de 2020. Se seleccionaron las publicaciones que reportaron estudios observacionales y/o epidemiológicos que incluían pacientes españoles con DA, describían la validación de las PROM o el uso de herramientas para medir los PRO en DA. Se excluyeron de la revisión los artículos de revisión y opinión, las cartas al director, y los ensayos clínicos.
Tras eliminar los duplicados, dos investigadores independientes seleccionaron las publicaciones elegibles, aplicando los criterios de inclusión y exclusión predefinidos. En primer lugar, los investigadores realizaron un cribado por título y resumen, descartando las publicaciones fuera del ámbito de la revisión. Seguidamente se revisaron las publicaciones de texto completo. Las discrepancias que surgieron durante el proceso de selección o evaluación se resolvieron por consenso, implicando a un tercer investigador. Dos revisores independientes extrajeron los datos de las publicaciones seleccionadas.
Se categorizaron las publicaciones seleccionadas conforme a los objetivos del estudio en: “uso de PROM”, “uso y validación de PROM” y “validación de PROM”.
Se extrajeron los datos de cada estudio, incluyendo año de publicación, diseño del estudio, ámbito (nacional o multinacional), tipo de población (adultos y/o niños) y tamaño, patología evaluada (DA o patologías dermatológicas incluyendo DA), PRO evaluados, y PROM utilizadas.
Para cada PROM, los datos extraídos incluyeron: medida del resultado, tipo (genérico/específico), población diana, dominios y/o aspectos evaluados, número de ítems, periodo evaluado, rango de puntuación, y referencia de la validación de la PROM o adaptación transcultural. Cuando la información no estaba disponible en las publicaciones recuperadas, se revisó otra literatura disponible y las webs oficiales de los desarrolladores de las PROM.
Los datos se resumieron descriptivamente con frecuencias y porcentajes.
Para evaluar la calidad de los estudios observacionales incluidos se utilizó la declaración STROBE (Strengthening the Reporting of Observational Studies in Epidemiology)14, cuyos resultados se calcularon como el número de los 22 ítems adecuadamente reportados dividido por el número de ítems, expresado como porcentaje.
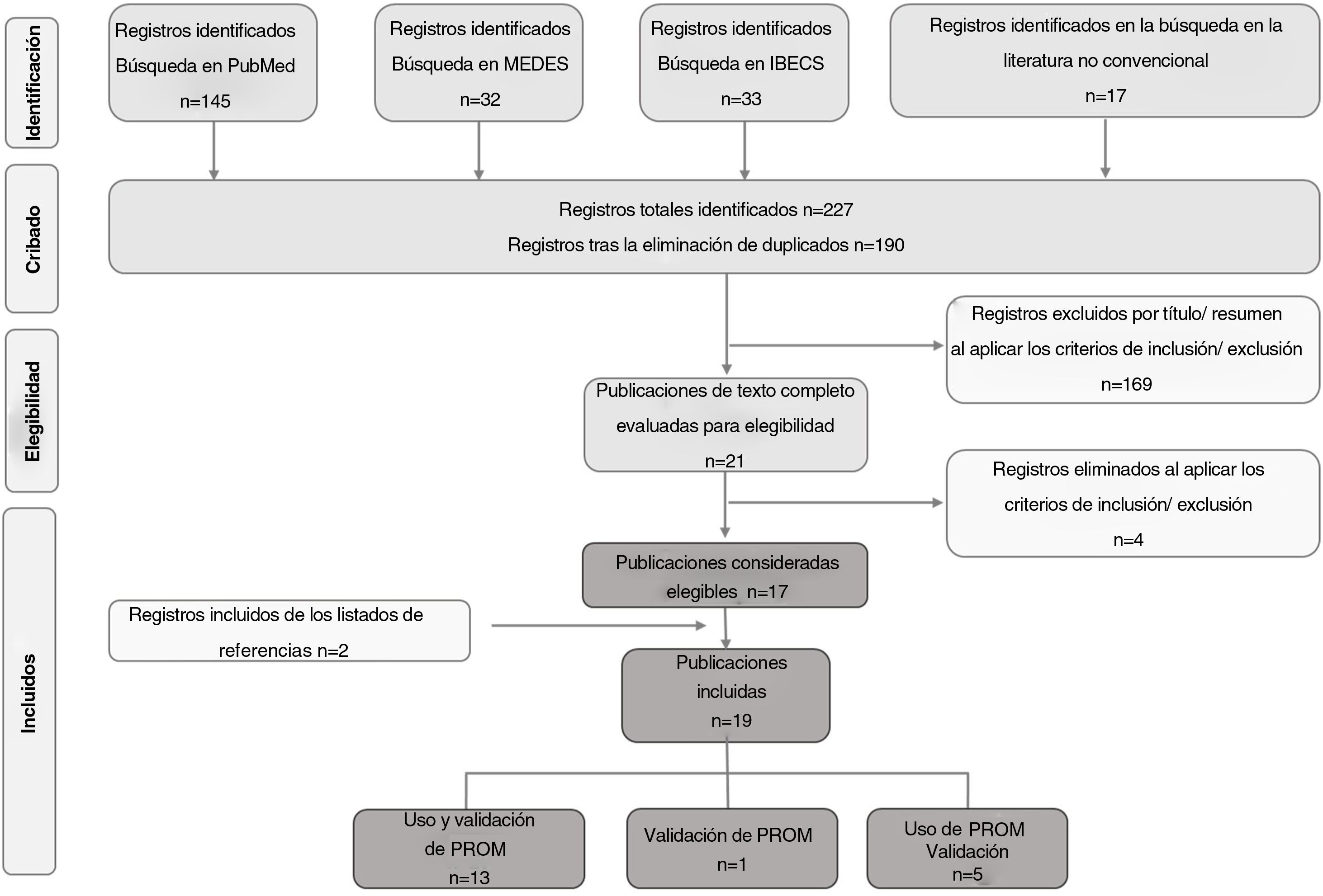
ResultadosSe recuperó inicialmente un total de 227 títulos potencialmente relevantes, 17 de los cuales se consideraron elegibles para su inclusión en la revisión. Se identificaron dos publicaciones adicionales durante la búsqueda en las listas de referencias clave; por tanto, se incluyeron finalmente 19 publicaciones en la revisión. De ellas, 13 reportaron el uso de PROM2,15–26, cinco reportaron el uso de PROM y validación de al menos una PROM en población española27–31, y una reportó exclusivamente la validación de una PROM32 (fig. 1).
Diagrama de flujo de la selección de publicaciones conforme a PRISMA
MEDES: MEDicina en ESpañol; IBECS: Índice Bibliográfico Español en Ciencias de la Salud; AEDV: Academia Española de Dermatología y Venereología; EADV: European Academy of Dermatology and Venereology; PROM: Patient-Reported Outcomes Measure.
Las 19 publicaciones incluidas en la revisión describían 17 estudios observacionales diferentes (tabla 1) realizados en los últimos diez años. La mayoría de estos estudios (n=11) fueron publicados durante el periodo 2018-2020. El 65% (n=11) de los estudios tenía un diseño transversal2,17,19–21,24,25,28–31, el 24% (n=4) eran estudios retrospectivos15,16,18,22,23,26,27, y el 12% (n=2) prospectivos15,22,27. En cuanto al ámbito geográfico, el 65% (n=11) se realizaron únicamente en España15,16,18,19,21–23,26–29,31. En relación con la población del estudio y la patología evaluada, el 71% (n=12) incluyó solo pacientes adultos2,16–18,20,2123,30,31, y el 82% (n=14) solo pacientes con DA2,15–19,22–29,31,32. Por último, en cuanto a la calidad de la información, los estudios transversales y prospectivos reflejaron un alto porcentaje de ítems STROBE adecuadamente reportados (77-100%), pero los estudios sobre series de casos reportaron porcentajes inferiores al 60%16,18,23. STROBE no fue evaluado en un estudio, en el que únicamente se disponía del resumen (tabla 1).
Características de los estudios observacionales incluidos en la revisión
| Autor (año) | Diseño del estudio | Localización | Tipo de población y tamaño (n) | Patología | PRO evaluadas | PROM utilizadas | STROBE |
|---|---|---|---|---|---|---|---|
| Daudén et al. (2011)27, Sanchez Perez at al. (2013)15 | Prospectivo | España | Adultos (172) y niños (151) | DA | Prurito | ISS | 19/2286% de los ítems bien reportados |
| CVRS | DLQI, cDLQI | ||||||
| Torrelo et al. (2012)28 | Transversal | España | Adultos (159) y niños (163) | DA | CVRS | ADIS | 21/2295% de los ítems bien reportados |
| Torrelo et al. (2013)29 | Transversal | España | Adultos (141) y niños (141) | DA | CVRS | DLQI, cDLQI, iDLQI | 22/22100% de los ítems bien reportados |
| ADIS | |||||||
| Adherencia | Escala Morisky de adherencia a la medicación | ||||||
| Satisfacción | EVA | ||||||
| Ortiz de Frutos et al. (2014)19 | Transversal | España | Adultos (125) y niños (116) | DA | CVRS | ADIS | 21/2295% de los ítems bien reportados |
| Control de la enfermedad | Escala Likert | ||||||
| Adherencia | Escala Likert | ||||||
| Dalgard et al. (2015)20 | Transversal | Multinacional(BE, DK, FR, AL, HU, IT, NL, NO, PL, RU, ES, TR, GB) | Adultos (2) | Diversas patologías dermatológicas incluyendo DA | Ansiedad/depresión | HADS | 22/22100% de los ítems bien reportados |
| Marron et al. (2016)21 | Transversal | España | Adultos (11) | Diversas patologías dermatológicas incluyendo DA | Prurito | ISS | 17/2277% de los ítems bien reportados |
| CVRS | DLQI | ||||||
| Ansiedad/depresión | HADS | ||||||
| Función familiar | APGAR familiar | ||||||
| Barbarot et al. (2018)2 | Transversal | Multinacional(FR, AL, IT, ES, GB, EEUU, CA, JP) | Adultos (9924) | DA | Gravedad de la enfermedad desde la perspectiva del paciente | PO-SCORAD | 22/22100% de los ítems bien reportados |
| POEM | |||||||
| Evaluación global del paciente | |||||||
| Ibáñez et al., (2018)22 | Prospectivo | España | Niños (275) | DA | Prurito | EVA PO-SCORAD | 22/22100% de los ítems bien reportados |
| Alteraciones del sueño | EVA PO-SCORAD | ||||||
| Benavente Villegas et al. (2018)23 | Serie de casos retrospectivos | España | Adultos (5) | DA | CVRS | DLQI | 7/ 2232% de los ítems bien reportados |
| Zeidler at al. (2018)30 | Transversal | Multinacional(FR, AL, IT, PL, RU, ES, CH, TR) | Adultos (27) | Diversas patologías dermatológicas incluyendo DA | CVRS | ItchyQoL | 20/2291% de los ítems bien reportados |
| Eckert et al. (2019)24 | Transversal | Multinacional(FR, AL, IT, ES, GB) | Adultos (*) | DA | CVRS | SF-36 (PCS and MCS) | 21/2295% de los ítems bien reportados |
| DLQI | |||||||
| Deterioro de la productividad y actividad laboral | WPAI | ||||||
| Ring et al. (2019)25, Arents et al. (2019)32 | Transversal | Multinacional(FR, ES, IT, RU, AL, NL, DK, SW, RCh) | Adultos (180) | DA | Gravedad de la enfermedad | POEM | 19/2286% de los ítems bien reportados |
| Autoevaluación de la gravedad | |||||||
| CVRS | DLQI | ||||||
| Ansiedad/depresión | HADS | ||||||
| Consecuencias emocionales | AESEC | ||||||
| Hernandez-Fernandez et al. (2019)26 | Serie de casos retrospectivos | España | Adultos (17) | DA | Prurito | EVA | No calculado (solo se disponía del resumen) |
| Ruiz-Villaverde et al. (2019)16 | Serie de casos retrospectivos | España | Adultos (30) | DA | Prurito | EVA | 13/2259% de los ítems bien reportados |
| CVRS | DLQI | ||||||
| Pereyra-Rodriguez et al. (2019)31 | Transversal | España | Adultos (17) | DA | Empoderamiento del paciente | DATEMP | 18/2282% de los ítems bien reportados |
| CVRS | DLQI | ||||||
| de Bruin-Weller et al. (2020)17 | Transversal | Multinacional(FR, AL, ES, IT, GB, CA) | Adultos (290) | DA | Prurito | NRS | 19/2286% de los ítems bien reportados |
| EVA PO-SCORAD | |||||||
| Dolor | NRS | ||||||
| Alteraciones del sueño | EVA PO-SCORAD | ||||||
| Pregunta 2 de POEM | |||||||
| Pregunta 4 de PSQI | |||||||
| Ansiedad/depresión | HADS | ||||||
| CVRS | DLQI | ||||||
| Briceño Casado et al. (2020)18 | Serie de casos retrospectivos | España | Adultos (6) | DA | CVRS | DLQI | 13/2259% de los ítems bien reportados |
3720 pacientes internacionales (1.860 con DA, 1.860 sin DA), el 37% de la muestra eran pacientes españoles. BE: Bélgica; CA: Canadá; CH: Suiza; RCh: República Checa; AL: Alemania; DK: Dinamarca; FR: Francia; HU: Hungría; IT: Italia; JP: Japón; NL: Holanda; NO: Noruega; PL: Polonia; RU: Rusia; SW: Suecia; ES: España; TR: Turquía; GB: Gran Bretaña; EEUU: Estados Unidos; DA: Dermatitis atópica; ADIS: Atopic Dermatitis Impact Scale; AESEC: Atopic Eczema Score of Emotional Consequences; cDLQI: children Dermatology Life Quality Index; DATEMP: Dermatitis ATópica EMPoderamiento; DLQI: Dermatology Quality of Life Index; HADS: Hospital Anxiety and Depression Scale; CVRS: Calidad de vida relacionada con la salud; iDLQI: Infant Dermatology Life Quality Index; ISS: Itchy Severity Scale; MCS: Mental Component Scale; NRS: Numerical rating Scale; PCS: Physical Component Scale; PO-SCORAD: Patient Oriented Scoring Atopic Dermatitis; POEM: Patient-Oriented Eczema Measure; PSQI: Pittsburgh Sleep Quality IndexSF-36: Short Form-36; EVA: Escala visual analógica; STROBE: Strengthening the reporting of observational studies in epidemiology; WPAI: Work Productivity and Activity Impairment.
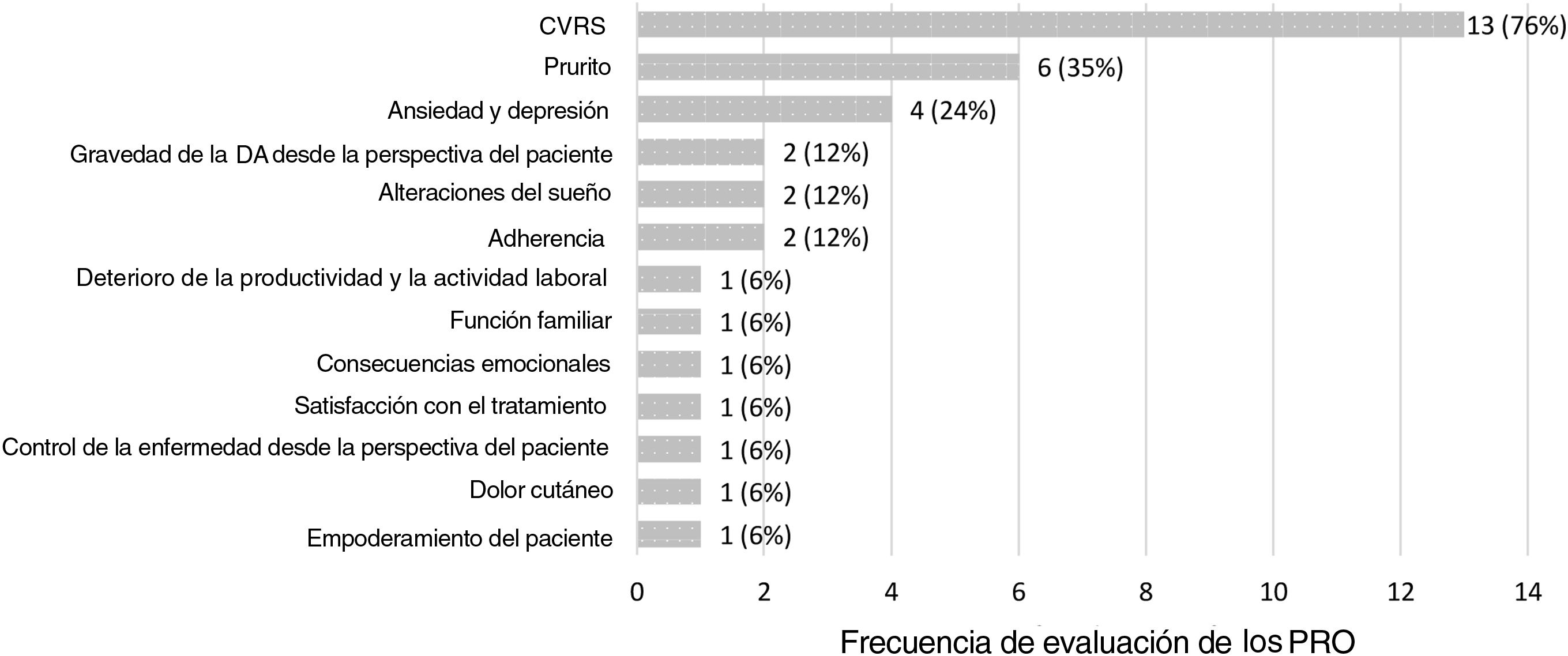
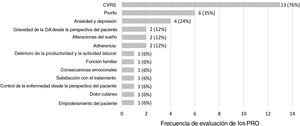
Los 17 estudios observacionales identificados evaluaron 13 PRO diferentes. Los PRO más frecuentemente evaluados fueron CVRS, prurito como principal síntoma de DA, así como ansiedad y depresión. La figura 2 representa la frecuencia de evaluación de los PRO en los estudios incluidos en la revisión.
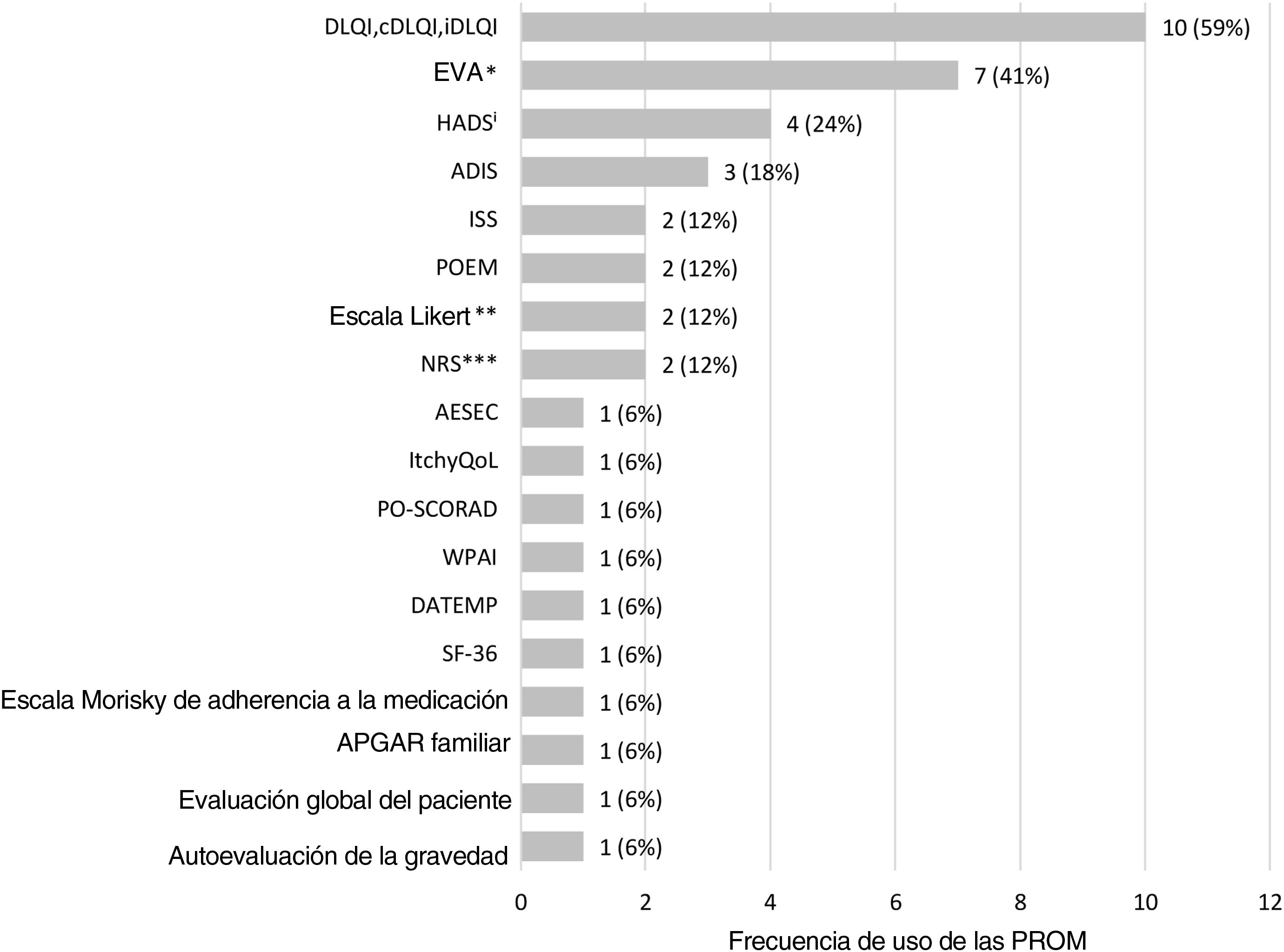
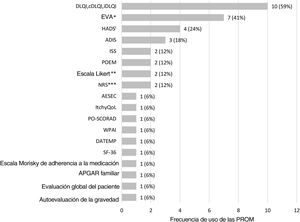
Se utilizaron un total de 18 PROM diferentes, siendo DLQI y las Escalas Visuales Analógicas (EVA; tres EVA y una EVA PO-SCORAD para prurito, una EVA y una EVA PO-SCORAD para alteraciones del sueño) las más frecuentemente aplicadas para evaluar la CVRS y los síntomas de la enfermedad, respectivamente (fig. 3, tabla 2).
Frecuencia de las PROM utilizadas en los 17 estudios observacionales.
ADIS: Atopic Dermatitis Impact Scale; AESEC: Atopic Eczema Score of Emotional Consequences; cDLQI: children Dermatology Life Quality Index; DATEMP: Dermatitis ATópica EMPoderamiento; DLQI: Dermatology Quality of Life Index; HADS: Hospital Anxiety and Depression Scale; iDLQI: infant Dermatology Life Quality Index; ISS: Itchy Severity Scale; MCS: Mental Component Scale; NRS: Numerical rating Scale; PCS: Physical Component Scale; PO-SCORAD: Patient Oriented Scoring Atopic Dermatitis; POEM: Patient-Oriented Eczema Measure; SF-36: Short Form-36; EVA: Escala visual analógica; WPAI: Work Productivity and Activity Impairment; *incluye EVA para satisfacción del tratamiento (1),EVA para prurito (3), EVA para alteraciones del sueño (1); EVA PO-SCORAD para prurito (1) y EVA PO-SCORAD para alteraciones del sueño (1); **incluye una escala Likert para el control de la enfermedad y una escala Likert para adherencia al tratamiento;***incluye NRS para prurito (1) y NRS para dolor cutáneo (1); Uno de los estudios evaluó solamente el componente de depresión del cuestionario (HADS-D).
Características de las PROM identificadas en los estudios observacionales que implican a pacientes de DA en España
| Categoría de PRO | PROM | Tipo | Población diana | Dominios y/o aspectos evaluados | Ítems | Periodo evaluado (si está disponible) / rango de puntuación | Validación de PROM o adaptación transcultural |
|---|---|---|---|---|---|---|---|
| CVRS | DLQI, cDLQI, iDLQI | Específico para patologías dermatológicas | Adultos (DLQI), niños (cDLQI) y bebés (iDLQI) | Síntomas, funciones y emociones | 10 | Rango de puntuación: 0-30 (0-1, sin efecto en la vida del paciente; 2-5, poco efecto; 6-10, efecto moderado; 11- 20, efecto muy grande; y 21-30, efecto extremadamente grande) | DLQI: Desarrollado en 1994 por Finlay et al.33. Adaptación transcultural al español realizada en 1998 por De Tiedra et al.51.cDLQI: desarrollado y validado en 1995 por Lewis-Jones et al.34.iDLQI: desarrollado y validado en 2001 por Lewis-Jones et al.35. cDLQI y iDLQI tienen una traducción al español disponible en http://www.cardiff.ac.uk/. |
| ADIS | Específico para DA | Adultos y niños | Sensaciones del paciente e impacto de la DA en las actividades sociales, el ocio y las relaciones del paciente28 | Versión adultos: 9Versión niños: 8 | Rango de puntuación: 0 (impacto mínimo sobre CVRS) – 10 (impacto máximo sobre CVRS) | Desarrollado y validado en España en 2012 y 2013, respectivamente por Torrelo et al.28,29. | |
| ItchyQoL | Específico para prurito | Adultos | Síntomas, funciones y emociones | 22 | Rango de puntuación: 0-110 (0–30, poco deterioro de la CVRS; 31–50, leve; 51–80, moderado; y 81–110, grave) | Desarrollado y validado en 2008 por Desai et al36. Validado en España por Zeidler et al. en 201930. | |
| SF-36 | Genérico | Adultos | Funciones físicas; Rol físico; Dolor corporal; Salud general; Vitalidad; Funciones sociales; Rol emocional; Salud mental y 2 componentes resumen (Físico y Mental) | 36 | Periodo evaluado: cuatro semanas previasRango de puntuación: Escala 0-100, en la que las puntuaciones más altas son indicativas de mejor estado de salud | Desarrollado en 1992 por Ware et al.38. Validado y traducido al español en 1995 por Alonso et al.37. | |
| Prurito | ISS | Específico para prurito | Adultos y niños | Frecuencia, intensidad y extensión del prurito. Efecto del prurito en el ánimo, la vida sexual (adultos) y el sueño del paciente39 | Versión adultos:7Versión niños: 6 | Rango de puntuación: 0-21 (0=sin presencia de prurito - 21=prurito muy grave) | Originariamente desarrollado y validado en 2007 por Majeski et al.39. Validado en España en 2011 por Daudén et al.27. |
| EVA | Genérico | Adultos | Intensidad del prurito | 1 | Periodo evaluado: no especificadoRango de puntuación: 0-10 (0=no prurito – 10=prurito insoportable) | Información de la validación no disponible | |
| NRS | Genérico | Adultos | Intensidad del prurito | 1 | Periodo evaluado: últimas 24hRango de puntuación: 0-10 (0=sin prurito – 10=peor prurito imaginable) | Información de la validación no disponible | |
| EVA PO-SCORAD | Específico para DA | Adultos y niños | Intensidad del prurito | 1 | Periodo evaluado: últimos tres díasRango de puntuación: 0-10 (0=sin prurito – 10=prurito insoportable) | Validado en Europa en 2011 por Stalder et al.40.Versión en español disponible en https://www.poscorad.com/#/ | |
| Alteraciones del sueño | EVA | Genérico | Adultos | Presencia de alteraciones del sueño | 1 | Rango de puntuación: 0-10 (0=sin problemas de sueño - 10=incapacidad de dormir) | Información de la validación no disponible |
| EVA PO-SCORAD | Específico para DA | Adultos y niños | Presencia de alteraciones del sueño | 1 | Periodo evaluado: últimos tres díasRango de puntuación: 0-10 (0=sin problemas de sueño - 10=incapacidad de dormir) | Validado en Europa en 2011 por Stalder et al.40.Versión en español disponible en https://www.poscorad.com/#/ | |
| Pregunta 4 - PSQI modificada* | Genérico | Adultos | PSQI incluye indicadores (10 ítems) para: calidad subjetiva del sueño; latencia del sueño; duración del sueño; eficiencia habitual del sueño; alteraciones del sueño; uso de medicación para el sueño; disfunción durante el día52De Bruin Weller et al.18 utilizaron solo una modificación de la pregunta 4 del cuestionario PSQI (duración del sueño): “durante la semana pasada, ¿cuántas horas de sueño real durmió por la noche?” | 1 | Periodo evaluado: última semanaMedia de horas de sueño durante la última semana18 | Originalmente desarrollado y validado en 1989 por Buysse et al.52. Validado en España en 1997 por Royuela-Rico et al.53. | |
| Dolor cutáneo | NRS | Genérico | Adultos | Nivel de dolor de la piel | 1 | Periodo evaluado: últimas 24hRango de puntuación: 0-10 (0=sin dolor - 10=peor dolor imaginable) | Información de la validación no disponible |
| Control de la enfermedad desde la perspectiva del paciente | Cuestionario basado en la escala Likert | Genérico19 | Adultos y niños | Grado de control de la enfermedad | 1 | Rango de puntuación: 1-6 (1=control de la enfermedad excelente – 6=control de la enfermedad muy malo) | Desarrollado en 2014 por Ortiz de Frutos et al.19. Información de la validación no disponible |
| Gravedad de la DA desde la perspectiva del paciente | PO-SCORAD | Específico para DA | Adultos y niños | Superficie afectada, gravedad e intensidad de los síntomas de la DA | 9 | Periodo evaluado: últimos 3 días40Rango de puntuación: 0-103: Superficie afectada y gravedad de los signos (7 ítems) rango 0–83; intensidad los síntomas (2 ítems) rango 0–20(0-24, DA leve; 25-49, DA moderada; ≥50, DA grave) | Validado en Europa en 2011 por Stalder et al.40.Versión en español disponible en https://www.poscorad.com/#/ |
| POEM | Específico para DA | Adultos | Frecuencia de los síntomas41 | 7 | Periodo evaluado: últimos 7 díasRango de puntuación: 0-28 (≤7, leve; 8-16, moderada;>16, grave) | Desarrollado y validado en 2004 por Charman et al.41.Versión en español disponible (certificado de la validación lingüística disponible en www.nottingham.ac.uk) | |
| Evaluación global del paciente | Genérico | Adultos | Gravedad de la enfermedad | 1 | Rango de puntuación: leve, moderada o grave | Información de la validación no disponible | |
| Autoevaluación de la gravedad | Genérico | Adultos | Gravedad de la enfermedad | 1 | Rango de puntuación: ausencia, cuasi ausencia, leve, moderada o grave | Información de la validación no disponible | |
| Satisfacción con el tratamiento | EVA | Genérico | Adultos | Satisfacción general. Grado de satisfacción con la prevención de brotes, alargamiento de los intervalos libres de brotes, frecuencia de aplicación del tratamiento, información recibida acerca de la terapia de mantenimiento, e información recibida acerca de los brotes durante la terapia de mantenimiento | 1 | Rango de puntuación: 0-10 (0=satisfacción mínima - 10=satisfacción máxima) | Información de la validación no disponible |
| Adherencia | Escala Morisky de adherencia a la medicación | Genérico | Adultos | Adherencia al tratamiento | 4 | Rango de puntuación: Se consideró que los pacientes se habían adherido al tratamiento si respondían “no” a las preguntas 1, 3, y 4 y “sí” a la pregunta 2. | Desarrollado y validado en 1986 por Morisky et al.43. Validado en España en 1992 por Val Jiménez et al.44. |
| Cuestionario basado en una escala Likert19 | Genérico19 | Adultos y niños | Adherencia del paciente a las recomendaciones relacionadas con el tratamiento, hidratación de la piel, uso de jabón especial, evitación de altas temperaturas, y recomendaciones alimentarias | 5 | Rango de puntuación: 1-6 (1=siempre utiliza o cumple la indicación - 6=raramente o nunca la utiliza) | Desarrollado en 2014 por Ortiz de Frutos et al.19. Información de la validación no disponible | |
| Ansiedad y depresión | HADS | Genérico | Adultos | Ansiedad y depresión | 7 para ansiedad+7 para depresión | Periodo evaluado: últimos 7 díasRango de puntuación: 0-21 (0–7, normal; 8–10, presencia de síntomas de ansiedad o depresión; y 11–21, ansiedad o depresión clínicas). | Desarrollado en 1983 por Zigmond et al.46. Validación en español realizada en 2003 por Herrero et al.45 |
| Consecuencias emocionales | AESEC | Específico para DA | Adultos | Efecto de la DA en el estado emocional del paciente | 28 | Periodo evaluado: no específico del tiempoRango de puntuación: 0-84 (0–27,’sin/pequeño efecto’; 28–40,’efecto moderado’; 40–52,’gran efecto’; y 53–84,’efecto muy grande’) | AESEC fue desarrollado y validado en dos estudios de múltiples países incluidos en la revisión25,32. |
| Función familiar | APGAR familiar | Genérico | Adultos | Adaptación, asociación, crecimiento, afecto y resolución | 5 | Rango de puntuación: los pacientes tienen tres opciones de respuesta: “Casi siempre”, “A veces”, o “Casi nunca”. El paciente elige una de las tres opciones, que se puntúan del siguiente modo: ‘Casi siempre’ (2 puntos), ‘A veces’ (1 punto), o ‘Casi nunca’ (0 puntos). Seguidamente se totalizan las puntuaciones para cada una de las preguntas. Una puntuación de 7-10 es indicativa de familia altamente funcional; 4-6 es indicativa de familiar moderadamente disfuncional; 0-3 sugiere una familia gravemente disfuncional | Desarrollado en 1978 por G Smilkstein48. Validado en España en 1996 por Bellon-Saameño et al.47. |
| Deterioro de la productividad y actividad laboral | WPAI | Genérico | Adultos | Absentismo, presentismo, deterioro laboral general, y deterioro de la actividad | 6 | Periodo evaluado: los últimos 7 díasRango de puntuación: los resultados de WPAI se expresan como porcentajes de limitación, donde las cifras más altas indican mayor limitación y menor productividad, es decir, peores resultados. | Desarrollado y validado en 1993 por Reilly et al.50 La validación lingüística al español fue realizada en 2006 por Gawlicki et al.49. |
| Empoderamiento del paciente | DATEMP | Específico para DA | Adultos | 4 dimensiones: autocuidados activos (técnicas), conocimiento básico acerca de la enfermedad (conocimiento), preocupaciones personales y sociales (técnicas de afrontamiento), e intención de cambio (cambio). | 17 | Periodo evaluado: el cuestionario evalúa el empoderamiento del paciente en el momento actual.Rango de puntuación: 17-85 (17, bajo nivel de empoderamiento; 85, alto nivel de empoderamiento) | Pereyra-Rodriguez et al. desarrollaron y validaron este cuestionario en la población española31. |
ADIS: Atopic Dermatitis Impact Scale; AESEC: Atopic Eczema Score of Emotional Consequences; cDLQI: children Dermatology Life Quality Index; DATEMP: Dermatitis ATópica EMPoderamiento; DLQI: Dermatology Quality of Life Index; HADS: Hospital Anxiety and Depression Scale; iDLQI: infant Dermatology Life Quality Index; ISS: Itchy Severity Scale; MCS: Mental Component Scale; NRS: Numerical rating Scale; PCS: Physical Component Scale; PO-SCORAD: Patient Oriented Scoring Atopic Dermatitis; POEM: Patient-Oriented Eczema Measure; PSQI: Pittsburgh Sleep Quality IndexSF-36: Short Form-36; EVA: Escala visual analógica; WPAI: Work Productivity and Activity Impairment; * Solo se utilizó una modificación de la pregunta 4 del cuestionario PSQI en la publicación de De Bruin Weller et al.18 y, por tanto, no se ha tenido en cuenta PSQI entre las PROM identificadas. Los detalles sobre los dominios y/o aspectos evaluados, ítems, periodo evaluado, rango de puntuación y validación o adaptación transcultural de PROM han sido obtenidos de la literatura.
Para evaluar la CVRS se utilizaron cuatro PROM diferentes en trece estudios observacionales, algunos de ellos administrados simultáneamente en el mismo estudio (n=2). Tres PROM fueron cuestionarios específicos de la CVRS: DLQI15–18,21,23,25,27,31 (o sus versiones para niños (cDLQI) y bebés (iDLQI)), ADIS (Atopic Dermatitis Impact Scale)19,28,29 y el cuestionario ItchyQoL30. La otra PROM identificada fue un cuestionario genérico sobre CVRS: Short Form-36 (SF-36)24. DLQI, cDLQI y iDLQI son cuestionarios específicos para patologías dermatológicas que se componen de 10 ítems, que evalúan síntomas, sensaciones y problemas relacionados con las actividades diarias, el ocio, el trabajo y la escuela, las relaciones personales y el tratamiento33–35. ADIS es un cuestionario específico para DA que puede administrarse a adultos y niños, compuesto de 9 y 8 ítems respectivamente, evalúa las sensaciones del paciente y el impacto de la DA en las actividades sociales, el ocio, y las relaciones del paciente28,29. ItchyQoL es un cuestionario específico para el prurito utilizado en adultos, que se compone de 22 ítems que evalúan los síntomas, las funciones y las emociones30,36. Por último, SF-36 es un cuestionario genérico para adultos, que se compone de 36 ítems que evalúan las funciones físicas, el rol físico, el dolor corporal, la salud general, la vitalidad, las funciones sociales, el rol emocional y la salud mental. Todas estas PROM miden el impacto de la enfermedad en la CVRS de los pacientes37,38.
Síntomas y control de la enfermedadSe evaluaron tres síntomas en los estudios identificados, siendo el prurito el más frecuentemente evaluado (seis estudios), seguido de las alteraciones del sueño (dos estudios) y el dolor cutáneo (un estudio).
El prurito se evaluó en los estudios utilizando una única PROM (n=5) o dos PROM (n=1). Se utilizaron cuatro PROM diferentes: ISS (Itchy Severity Scale)15,21,27, una EVA16,22,26, una NRS (Numerical Rating Scale)17 y EVA PO-SCORAD17. ISS es una herramienta específica para el prurito en enfermedades cutáneas que cuantifica la frecuencia, intensidad y extensión del prurito, así como su efecto en el ánimo, la vida sexual y el sueño del paciente en adultos y niños a través de un cuestionario de 7 y 6 ítems, respectivamente27,39. NRS y EVA son escalas unidimensionales genéricas que se administran a adultos para evaluar la intensidad del prurito, mientras que EVA PO-SCORAD se ha desarrollado y validado también para su uso en niños34. Para evaluar la presencia de alteraciones del sueño, un estudio utilizó una EVA22 genérica, mientras que otro estudio utilizó tres medidas diferentes17: EVA PO-SCORAD, la pregunta 2 de POEM (“A lo largo de la última semana, ¿cuántas noches se ha visto alterado su sueño a causa de su eccema?”), y una modificación de la pregunta 4 de PSQI (Pittsburgh Sleep Quality Index) (“Durante la semana pasada, ¿cuántas horas de sueño real durmió por la noche?”). Por último, el nivel de dolor cutáneo se evaluó en adultos utilizando una NRS17.
El grado de control de la enfermedad desde la perspectiva del paciente fue evaluado en un estudio utilizando un cuestionario basado en una escala Likert de 6 puntos19.
Gravedad de la DA desde la perspectiva del pacienteLa gravedad de la DA desde la perspectiva del paciente fue evaluada en los estudios con una única PROM (n=1) o tres PROM (n=1). Las cuatro PROM identificadas fueron: PO-SCORAD2, POEM2, Evaluación Global del Paciente (donde el paciente evaluó la enfermedad como leve, moderada o grave)2, y una autoevaluación de la gravedad (nula, casi nula, leve, moderada o grave)25. PO-SCORAD es una herramienta específica de la enfermedad que puede utilizarse en adultos y niños, e incluye 7 ítems que miden la gravedad de los signos de la DA (superficie afectada por el eccema en los últimos 3 días, sequedad de la piel sin eccema, evaluación de la gravedad del eccema en los últimos 3 días), y dos Escalas Visuales Analógicas (EVA PO-SCORAD) para evaluar la intensidad de los síntomas (prurito y alteraciones del sueño)40. POEM es un cuestionario específico diseñado para su uso en pacientes adultos con DA compuesto de 7 ítems, que evalúan la gravedad de la DA, valorando la frecuencia de los síntomas (sequedad, prurito, descamación, agrietamiento, pérdida de sueño, sangrado, exudación) por semana41. Aunque no está identificada en nuestra revisión, existe también una versión para niños42.
Satisfacción con el tratamientoLa satisfacción del paciente con el tratamiento de mantenimiento para la DA fue determinada en un estudio utilizando múltiples EVA29. Se valuaron aspectos diferentes de la satisfacción incluyendo satisfacción general, satisfacción con la prevención de brotes, satisfacción con la prolongación de los intervalos sin brotes, satisfacción con la frecuencia de aplicación del tratamiento, satisfacción con la información recibida acerca del tratamiento de mantenimiento, y satisfacción con la información recibida acerca del tratamiento de los brotes durante el tratamiento de mantenimiento.
AdherenciaSe utilizaron dos PROM para evaluar la adherencia en dos estudios: para medir la adherencia al tratamiento se utilizó la escala Morisky de adherencia a la medicación29, un cuestionario genérico validado43,44. Sin embargo, para evaluar la adherencia a las recomendaciones médicas se utilizó una escala Likert de 6 puntos19.
Impacto psicosocialEl impacto psicosocial de la DA fue evaluado en cuatro estudios utilizando una única PROM (n=2) o dos PROM (n=2). La presencia de ansiedad y depresión asociadas a DA fue evaluada a través de HADS (Hospital Anxiety and Depression Scale)17,20,21,25, que es un cuestionario genérico para adultos compuesto de dos subescalas: una de ellas mide la presencia de ansiedad (7 ítems) y la otra la depresión (7 ítems)45,46. Se utilizó AESEC (Atopic Eczema Score of Emotional Consequences), un cuestionario específico para adultos con DA que se compone de 28 ítems, el cual determina el efecto de la DA en el estatus emocional del paciente25. Arents et al.32 reportaron con detalle las propiedades psicométricas de AESEC. APGAR familiar, un cuestionario genérico para adultos compuesto de 5 ítems47,48, permitió evaluar el modo en que la función familiar (adaptación, asociación, crecimiento, afecto y resolución) se vio afectada por la DA21.
Deterioro de la productividad y la actividad laboralLa productividad laboral (incluyendo absentismo, presentismo, deterioro laboral general, y deterioro de la actividad) fue evaluada en un estudio utilizando WPAI (Work Productivity and Activity Impairment)24, un cuestionario genérico para adultos compuesto de 6 ítems49,50.
Empoderamiento del pacienteEl nivel de empoderamiento del paciente se evaluó en un estudio utilizando DATEMP (Dermatitis ATópica EMPoderamiento), un cuestionario específico para adultos con DA, desarrollado y validado originariamente en español, y compuesto de 17 ítems, que evalúa aspectos como el autocuidado activo, los conocimientos básicos sobre la enfermedad, las preocupaciones personales y sociales, y la intención de cambio31.
DiscusiónEsta revisión identificó y describió las PROM utilizadas en estudios observacionales sobre DA en España durante los últimos 10 años, para evaluar los aspectos clave de la enfermedad desde la perspectiva de los pacientes. Las PROM identificadas evaluaron la aparición de síntomas (ej.: prurito) y la gravedad de la enfermedad, la interferencia con las actividades diarias, el impacto en la función psicosocial y laboral, el empoderamiento del paciente y la CVRS. Esta revisión proporciona a los dermatólogos una visión general sobre las herramientas disponibles para medir los PRO en estudios observacionales, con aplicabilidad en la práctica clínica en España. El creciente interés por medir los resultados de PRO para obtener la perspectiva del paciente se refleja en los resultados de la revisión, dado que más de la mitad de los estudios observacionales publicados identificados, pertenecen a los últimos tres años.
En total se identificaron dieciocho PROM diferentes: el 55% eran genéricas (aplicables a un amplio rango de enfermedades), el 6% eran específicas de patologías dermatológicas (aplicables a diferentes trastornos cutáneos), el 11% eran específicas para prurito (uno de los principales síntomas de la DA), y un tercio eran específicas de la DA. Tanto las medidas específicas para patologías dermatológicas, como para la DA aportan una visión complementaria de las áreas/dominios afectados que no se evalúan con los instrumentos genéricos.
Las PROM identificadas evaluaron trece resultados del paciente distintos, en los que la CVRS, los síntomas (principalmente prurito) y la ansiedad/depresión fueron los más frecuentemente evaluados. Estos hallazgos están en línea con una revisión sistemática previa que identificó las PROM utilizadas en ensayos clínicos para evaluar nuevos tratamientos para la DA, en los que las herramientas para evaluar la CVRS y el prurito, fueron las más comúnmente empleadas5.
Nuestra revisión muestra que el DLQI y sus versiones para niños y bebés son las herramientas más utilizadas en los estudios observacionales en España. A pesar de no ser una herramienta específica para DA, DLQI ha sido ampliamente utilizado como medida de la CVRS en los ensayos clínicos dermatológicos, validado en los pacientes con DA, e incluido en las recomendaciones HOME desde 20179. Aun cuando estudios previos han reflejado una correlación significativa entre las medidas de CVRS (tales como DLQI) y la gravedad de la DA, existe poca información acerca del uso rutinario de estas medidas en el manejo de los pacientes con DA54. Esta revisión destaca el uso generalizado del DLQI en los estudios observacionales sobre dermatología en España. Además, su inclusión como resultado sugiere que es posible integrar información acerca del impacto de la enfermedad y sus síntomas en la CVRS en la práctica clínica. Herramientas de medida tales como el DLQI pueden ayudar a evaluar mejor el manejo/control de la enfermedad, así como la efectividad de los tratamientos, más allá de la evaluación clínica objetiva. Sin embargo, las subescalas de DLQI han reflejado previamente un efecto suelo considerable (que dificulta la detección del empeoramiento de la CVRS percibida)55, y la última revisión sistemática de HOME de las medidas de la CVRS indicaron una validez estructural insuficiente para recomendar el uso de DLQI11. Algunos autores recomiendan añadir una herramienta genérica a una PROM específica para dermatología, para medir el estado de salud de los pacientes en términos genéricos, y en situaciones en las que la enfermedad cutánea tiene un impacto sustancial en la CVRS, más allá del impacto específico de la enfermedad57,58. Nuestra revisión identificó el SF-36 como posible herramienta genérica disponible sobre CVRS para la población española.
De acuerdo con el último consenso HOME6, los síntomas reportados por el paciente son el dominio más prioritario para medir en la práctica clínica en pacientes con eccema atópico. En nuestra revisión, los síntomas se midieron como resultado independiente (utilizando una EVA o NRS) o junto con otros aspectos de la enfermedad, como parte de una PROM amplia, como PO-SCORAD, POEM o los cuestionarios de CVRS. Los síntomas, como resultado independiente, fueron evaluados en un tercio de los estudios revisados15–17,21,22,26,27. El prurito fue evaluado en todos ellos, siendo la EVA del prurito la PROM más utilizada (67%), a diferencia de las recomendaciones de HOME, que recomiendan provisionalmente NRS como herramienta de preferencia para medir la intensidad del prurito. Las alteraciones del sueño fueron evaluadas en un tercio de los estudios que evalúan los síntomas reportados por el paciente como resultado independiente17,22, y el dolor cutáneo en el 17%17. Aunque constituyen síntomas principales de la DA y un dominio relevante para los ensayos clínicos, todavía no son contemplados como medida estándar en la práctica clínica. En una revisión sistemática previa que evaluaba los síntomas reportados en ensayos clínicos sobre DA, se observó que el 78% de ellos utilizaba PROM para evaluarlos, de los cuales el 37% midió los síntomas como resultados independientes. Entre ellos el prurito fue el síntoma más evaluado (98%), siendo la EVA la PROM más utilizada (76%)56, seguida de la alteración del sueño (61%), que es considerada en gran medida un indicador de prurito.
Dado que en los pacientes con DA moderada y grave la sintomatología puede repercutir en las actividades diarias del paciente y el bienestar emocional15, la medida de los síntomas, especialmente el prurito, se convierte en un punto clave de la evaluación de la enfermedad. Nuestra revisión ha identificado herramientas tanto unidimensionales (EVA o NRS) como multidimensionales (PO-SCORAD o POEM) para evaluar el prurito. Aunque las escalas unidimensionales y PO-SCORAD evalúan la intensidad del prurito, y POEM recoge su frecuencia, las herramientas multidimensionales aportan una visión más holística de la enfermedad, y han sido previamente correlacionadas con la gravedad de la DA y las diferentes dimensiones de la CVRS57. Sin embargo, el uso de estos instrumentos en la práctica clínica es escaso y está limitado a la investigación clínica y, en virtud de la iniciativa HOME, se prefieren las escalas unidimensionales como método simple y rápido para evaluar la intensidad del prurito en la práctica clínica59–62.
Nuestros resultados reflejan que el impacto psicosocial de la DA, incluyendo la ansiedad y la depresión, las consecuencias emocionales y la función familiar constituyen PRO evaluados en los estudios observacionales recientes identificados. Entre ellos, la ansiedad y la depresión han sido los PRO más evaluados, y el cuestionario HADS la PROM más utilizada. Esto está en línea con la alta carga de trastornos de tipo psiquiátrico reportados en la literatura entre los pacientes con DA en España. Por ejemplo, De Bruin-Weller et al. informan de la presencia de comorbilidades emocionales o mentales en el 17-31% de los pacientes con DA de leve a grave, respectivamente, que se incrementa con la gravedad de la enfermedad17. Se ha reportado una mayor prevalencia de ansiedad y depresión en pacientes con DA, en comparación con los pacientes sin DA, asociándose peores puntuaciones HADS con una mayor gravedad de la enfermedad63. Además, los pacientes españoles que padecen prurito crónico presentan diferencias estadísticamente significativas en la subescala de ansiedad de HADS, en comparación con aquellos que no padecen prurito crónico21. Debido a la asociación entre DA y trastornos psiquiátricos, HADS podría ser una herramienta de utilidad en la práctica clínica para evaluar la salud mental de estos pacientes.
Recientemente, un estudio internacional en pacientes adultos con DA evidenció el alto impacto en la productividad y actividad del paciente, con un mayor impacto negativo en los pacientes con enfermedad moderada y grave64. Es probable que la disminución de la gravedad de la DA reduzca la carga para el paciente y, por tanto, el impacto sobre la productividad y actividad, lo cual podría ser un aspecto a tener en cuenta en la práctica clínica. Sin embargo, nuestra revisión ha identificado solo un estudio que evalúe el impacto de DA en la productividad laboral a través del cuestionario WPAI.
Por último, en nuestra revisión la escala Morisky de adherencia a la medicación fue la PROM elegida para evaluar la adherencia del paciente al tratamiento29, mientras que una escala Likert se utilizó para medir la adherencia a las recomendaciones médicas19. Para evaluar la satisfacción del paciente se utilizó una escala EVA29. Estos resultados subrayan la posible infravaloración del impacto de la adherencia y de la satisfacción del paciente con el tratamiento en los pacientes de DA, ya que solo dos publicaciones las evalúa, siendo relevantes para valorar la efectividad del tratamiento prescrito.
A pesar del creciente número de estudios que evalúan las PROM en nuestra revisión, el uso sistemático de herramientas para captar la percepción del paciente para un manejo integral de la DA en España es aún escaso. El uso limitado de PROM en la práctica podría deberse al tiempo reducido de las consultas, la falta de colaboración o la incapacidad de los pacientes para completar las PROM, la falta de hábito de incorporar al paciente en la toma de decisiones, y el modelo sanitario actual en el que el empoderamiento del paciente es bajo. No obstante, nuestros resultados muestran que el uso de PROM en la práctica clínica podría ir en aumento, dado que la perspectiva del paciente se está haciendo más relevante para el médico en el manejo de la enfermedad. Sin embargo, sigue habiendo margen para incrementar la medida de los síntomas reportados por el paciente, y sus consecuencias en los distintos aspectos de la vida del paciente.
La principal fortaleza de esta revisión es el enfoque sistemático utilizado y el foco sobre los PRO evaluados en los estudios observacionales, que han permitido aportar una visión general sobre las PROM identificadas, que puede ser aplicable al uso en la práctica clínica real. Esta revisión no está exenta de limitaciones. Aunque se utilizó STROBE para determinar la calidad de los estudios observacionales incluidos, la revisión no analizó los posibles sesgos de dichos estudios. Además, la revisión incluyó estudios internacionales que incluían a pacientes españoles con DA, independientemente del tamaño de su muestra. Por tanto, sus resultados pueden no constituir una representación precisa de nuestro entorno. Sin embargo, el objetivo de la revisión no fue analizar los resultados obtenidos en dichos estudios, sino identificar las posibles PROM utilizadas en los estudios en vida real que pudieran tener aplicabilidad en la práctica clínica habitual en España. Por último, nuestra revisión no fue diseñada para ser una revisión exhaustiva de todas las PROM disponibles, sino para identificar las PROM utilizadas en los estudios de vida real, ya que estos pueden reflejar mejor la práctica clínica rutinaria en España. Por ello se excluyeron las PROM utilizadas en los ensayos clínicos, y aquellas no reportadas en los estudios observacionales que incluían pacientes españoles a lo largo de la última década.
ConclusionesEl número de estudios observacionales que incluyen PROM llevados a cabo con pacientes españoles ha aumentado con el tiempo, lo que sugiere una creciente importancia de los PRO en la evaluación y manejo de la DA desde un punto de vista centrado en el paciente. Existen diversas PROM validadas disponibles para su uso en España, que cubren los principales aspectos de la enfermedad, incluyendo los síntomas (ej.: prurito) y la gravedad de la enfermedad, la interferencia con las actividades diarias, el impacto en el funcionamiento psicosocial y laboral, el empoderamiento del paciente y la CVRS. Sin embargo, sigue existiendo margen para incrementar la medida de los síntomas reportados por el paciente, de cara a comprender sus consecuencias y el impacto en la vida del paciente en términos de progresión de la enfermedad y efectividad del tratamiento.
Conflicto de interesesLilly Spain ha financiado la publicación de este artículo.