La alopecia areata (AA) es una enfermedad autoinmune frecuente, que puede afectar significativamente la calidad de vida y ocasionar altas tasas de depresión y ansiedad. El abordaje terapéutico estándar incluye glucocorticoides por diversas vías de administración, inmunosupresores e inmunoterapia de contacto, con respuestas muy variables. En su fisiopatología están implicados los linfocitos T CD8+, el interferón gamma, la interleucina 15 y la vía de señalización de Janus quinasa (JAK), una familia de proteínas tirosina quinasa que median la transmisión de señales y modulan la expresión génica a través de su ligando intracelular, STAT1.
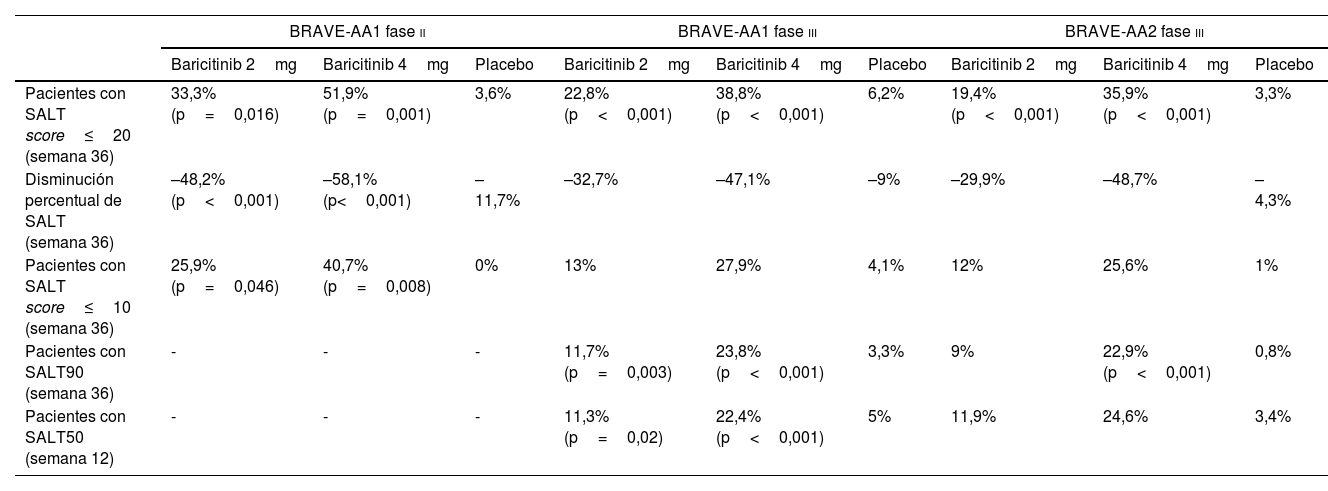
La Food and Drug Administration y el Comité de medicamentos de uso humano europeo han aprobado recientemente un nuevo fármaco de administración oral para la AA grave: baricitinib, inhibidor reversible de JAK1 y JAK2. Dichas decisiones están apoyadas por los resultados de 2 ensayos clínicos aleatorizados (ECA) fase iii: BRAVE-AA1 y BRAVE-AA2, que reclutaron 1.200 pacientes con AA grave, definida como una puntuación en la escala Severity of Alopecia Tool (SALT)≥50. Se evaluó el porcentaje de individuos que alcanzaron un SALT≤20 a las 36 semanas. Se alcanzó esa puntuación en el 38,8% y 35,9% con baricitinib 4mg, 22,8% y 19,4% con baricitinib 2mg y 6,2% y 3,3% con placebo (BRAVE-AA1 y BRAVE-AA2, respectivamente). Con baricitinib 4mg un 22,9-23,8% de los pacientes logró una respuesta completa o casi completa (SALT90). Los eventos adversos únicamente requirieron la suspensión de baricitinib 2mg en 3 y 4 pacientes, y de baricitinib 4mg en 5 y 6 pacientes (BRAVE-AA1 y BRAVE-AA2, respectivamente). Dichos eventos incluyeron, según dosis y series, acné (4,7-5,8%), aumento sérico de creatina quinasa (1,6-5,7%) y de lipoproteína de baja densidad (20,5-30,3%), infecciones urinarias (1,1-7,7%) o citopenias2. Los resultados de seguridad y eficacia son similares a los del ECA fase ii BRAVE-AA1 (tabla 1). No se dispone de datos de seguridad a largo plazo en AA, pero en artritis reumatoide un estudio con una mediana de seguimiento de 4,6 años observó riesgos relativos para infección grave y herpes zoster de 2,6 y 3,0, respectivamente, sin mayor incidencia de neoplasias o eventos cardiovasculares graves4.
Comparación de los resultados de eficacia de los ensayos clínicos aleatorizados de baricitinib en alopecia areata2,3
| BRAVE-AA1 fase ii | BRAVE-AA1 fase iii | BRAVE-AA2 fase iii | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Baricitinib 2mg | Baricitinib 4mg | Placebo | Baricitinib 2mg | Baricitinib 4mg | Placebo | Baricitinib 2mg | Baricitinib 4mg | Placebo | |
| Pacientes con SALT score≤20 (semana 36) | 33,3%(p=0,016) | 51,9%(p=0,001) | 3,6% | 22,8%(p<0,001) | 38,8%(p<0,001) | 6,2% | 19,4%(p<0,001) | 35,9% (p<0,001) | 3,3% |
| Disminución percentual de SALT (semana 36) | –48,2% (p<0,001) | –58,1% (p<0,001) | –11,7% | –32,7% | –47,1% | –9% | –29,9% | –48,7% | –4,3% |
| Pacientes con SALT score≤10 (semana 36) | 25,9% (p=0,046) | 40,7% (p=0,008) | 0% | 13% | 27,9% | 4,1% | 12% | 25,6% | 1% |
| Pacientes con SALT90 (semana 36) | - | - | - | 11,7% (p=0,003) | 23,8% (p<0,001) | 3,3% | 9% | 22,9% (p<0,001) | 0,8% |
| Pacientes con SALT50 (semana 12) | - | - | - | 11,3% (p=0,02) | 22,4% (p<0,001) | 5% | 11,9% | 24,6% | 3,4% |
Severity of Alopecia Tool (SALT) score: medida de alopecia en cuero cabelludo basada en el porcentaje de pérdida capilar valorado en diferentes áreas por separado. Para su cálculo el porcentaje de pérdida capilar en regiones interparietales se multiplica por 0,4, el de la región occipital por 0,24 y en cada hemilado de las regiones parietales por 0,18. El SALT score se obtiene de la suma de las 4 cifras resultantes.
Se encuentran en estudio otros inhibidores de JAK (JAKi) como tofacitinib y ruxolitinib. Aunque no se dispone de comparaciones frente a frente entre los diferentes JAKi orales, un metaanálisis no muestra diferencias significativas en la respuesta al tratamiento, con similar porcentaje de respuesta clínica con tofacitinib (77,3%, 34/44) y ruxolitinib (82,3%, 14/17)5. La administración tópica es una alternativa con un mejor perfil de seguridad, pero menos eficaz (77,8% de respuestas bajo tratamiento oral vs. 46,4% bajo tratamiento tópico). En todos los JAKi estudiados en AA se observa una importante pérdida de eficacia a las pocas semanas o meses tras su interrupción5.
La aprobación de baricitinib añade una opción terapéutica efectiva y bien tolerada para los pacientes con AA grave. Sin embargo, quedan interrogantes como los efectos a largo plazo (infecciones, neoplasias y trombosis, eventos observados con otros JAKi bajo otras indicaciones), la dosis de mantenimiento mínima eficaz y su impacto en la calidad de vida, en el absentismo escolar y laboral. Es necesaria la elaboración de un algoritmo terapéutico para AA que integre baricitinib, y el desarrollo de estudios de coste-eficacia, dado su elevado precio.