El linfogranuloma venéreo (LGV) es una enfermedad emergente en hombres que tienen sexo con hombres (HsH), con una incidencia en España de 1,15 casos por 100.000 habitantes en el año 2017. Suele cursar como una proctitis severa que puede ocasionar abscesos, fístulas y estenosis anal. Raramente se manifiesta con úlceras genitales o adenopatías inflamatorias inguinales. El objetivo de este trabajo fue describir una serie de pacientes con LGV de un hospital público de Andalucía.
Material y métodosEstudio observacional descriptivo de una cohorte retrospectiva de casos diagnosticados de LGV. Se recogieron variables epidemiológicas, clínicas, microbiológicas, de tratamiento, así como los hábitos sexuales de los pacientes.
ResultadosSe seleccionaron los 17 casos diagnosticados entre octubre de 2016 y mayo de 2019 en HsH, 12 de ellos positivos para el VIH. Trece pacientes tuvieron una proctitis muy sintomática con ulceraciones en el canal anal y el recto. En 4 pacientes el LGV se manifestó en la forma genital o inguinal. Se identificaron prácticas sexuales de alto riesgo: un número elevado de parejas y sexo anal receptivo anónimo sin protección, búsqueda de sexo por Internet y sexo en grupo o fuera de nuestra comunidad. La Chlamydia trachomatis L2 se identificó en todos los casos, con una buena respuesta a la doxiciclina oral. Dos pacientes con la forma clásica necesitaron ciclos más prolongados de tratamiento y en 3 de ellos fue necesario tratamiento quirúrgico.
ConclusionesAnte una proctitis sintomática en HsH con prácticas sexuales de alto riesgo debemos tomar muestras de exudado para identificar los serovares de LGV. Las úlceras genitales y los bubones inguinales son también muy sugerentes de la infección. La sospecha de LGV y el tratamiento precoz son fundamentales para prevenir las complicaciones y la transmisión de la enfermedad.
Lymphogranuloma venereum (LGV) is an emerging disease in men who have sex with men (MSM): the incidence was 1.15 cases per 100,000 population in Spain in 2017. Patients with LGV characteristically have severe proctitis that can cause abscesses, fistulas, and anal stenosis. Genital ulcers and inflammatory inguinal adenopathy may occasionally be present. The aim of this study was to describe a series of patients with LGV treated in a public health service hospital in Andalusia, Spain.
Material and methodsRetrospective, observational description of a series of patients diagnosed with LGV. We gathered epidemiologic, clinical, microbiologic, and treatment data. Patients’ sexual behaviors were also noted.
ResultsWe found 17 cases of LGV diagnosed in MSM between October 2016 and May 2019. Twelve of the patients were also infected with the human immunodeficiency virus, and 13 had severe proctitis with ulcers in the anal canal and rectum. Four patients had genital or inguinal manifestations. The following high-risk sexual behaviors were on record: a high number of sexual partners, receptive anal sex with strangers and without a condom, seeking sexual partners online, participation in group sex, and sex with partners from outside Andalusia. Chlamydia trachomatis serovar L2 was identified in all cases, and the infection responded well to oral doxycycline. Two patients with the most characteristic form of LGV required longer treatment cycles. Three required surgery.
ConclusionsWhen symptomatic proctitis is found in MSM who engage in high-risk sex, the LGV exudate should be sampled and the C trachomatis serovar identified. Genital ulcers or inguinal buboes are also highly suggestive of LGV. Clinical suspicion and early treatment are the keys to preventing complications and disease transmission.
Chlamydia trachomatis es una bacteria intracelular implicada con frecuencia en infecciones exudativas de la mucosa de la uretra y del cérvix en todo el mundo. Es la principal responsable en Occidente de la enfermedad pélvica inflamatoria en la mujer1. Esta bacteria se aísla habitualmente en el canal anal en hombres y mujeres con sexo anal receptivo, aunque en la mayoría de los casos la infección pasa inadvertida2. Existen serovares de la bacteria con especial apetencia por los ganglios linfáticos y responsables del linfogranuloma venéreo (LGV), infección de transmisión sexual (ITS) relegada a países de África, Asia y Sudamérica y hasta hace pocos años excepcional en nuestro medio3. Coincidiendo con la epidemia del VIH a finales de los 90 aparecieron nuevos casos de LGV a nivel anorrectal en comunidades de hombres que tienen sexo con hombres (HsH) de Europa4 y de Estados Unidos5. Clínicamente cursaban como proctitis muy sintomáticas con sangrado y tenesmo rectal, sin apreciarse adenopatías inguinales como en la forma clásica. En el momento actual el LGV es una de las principales causas de proctitis severa en pacientes VIH en nuestro medio y se ha relacionado con prácticas sexuales de alto riesgo. La forma clásica de LGV se inicia como una pápula indolora que rápidamente se ulcera, seguida en unas semanas por una linfadenitis genital y adenopatías supurativas inguinales. En un tercer estadio la obstrucción linfática puede producir elefantiasis, fistulización de las adenopatías y fibrosis y ulceración crónica secundaria3. Esta forma de LGV genital se diagnostica raramente en Europa, pero es también casi exclusiva de HsH.
En este estudio describimos los casos de LGV diagnosticados en una consulta monográfica de Infecciones de Trasmisión Sexual, recogiendo los factores de riesgo asociados, las características clínicas y epidemiológicas, la respuesta al tratamiento, así como las complicaciones derivadas de la infección.
Material y métodoSe realizó un estudio observacional de una cohorte retrospectiva que incluyó a los pacientes sintomáticos con un diagnóstico de LGV en la consulta monográfica de Enfermedades de Transmisión Sexual del Área de Dermatología del hospital público Costa del Sol en Marbella (Málaga) desde el primer caso en octubre de 2016 hasta el último caso en mayo de 2019. Se recogieron los datos de filiación y epidemiológicos, así como información clínica, de tratamiento y aspectos microbiológicos. Se realizó un cribado completo de ITS, de acuerdo con las prácticas de riesgo y se actualizaron los test serológicos. Se encuestó de forma anónima a los pacientes sobre aspectos específicos de sus hábitos sexuales.
Los test específicos para Chlamydia fueron realizados en los pacientes con una sintomatología compatible y sospecha de LGV. Para el estudio microbiológico se utilizó una prueba de amplificación de ácidos nucleicos para C. trachomatis (BD MAX CT/GC/TV) con muestras de exudado y/o de tejido, que muestra una sensibilidad del 95,7% y una especificidad del 99,2%. La confirmación posterior en un laboratorio de referencia se llevó a cabo mediante una PCR a tiempo real específica para linfogranuloma. Para ello, las muestras fueron extraídas usando un procedimiento automatizado (Viral total nucleic acid purification kit, Maxwell, Promega), seguido de una PCR doble para la diana codificante del gen ompA. Se realizó estudio genómico con secuenciación de la región amplificada de 996 pb (ompA) mediante el método BigDye Terminador v3.1 (Life Technologies) con secuenciador ABI Prism 310 (Applied Biosystems). Esta técnica tiene una sensibilidad del 90% y una especificidad del 100%, con un límite de detección de 200 copias/ml.
En aquellos casos en los que se tomaron imágenes clínicas, estas fueron precedidas por la cumplimentación del consentimiento informado específico.
Se realizó un análisis descriptivo utilizando medidas de posición (mediana y rango intercuartílico [RIQ]) para las variables cuantitativas y distribución de frecuencias para las cualitativas. Estableciendo como variable de segmentación el tipo de linfogranuloma se utilizó el test exacto de Fisher para valorar las diferencias en distribución respecto a las variables cualitativas, y el test U de Mann-Whitney para las cuantitativas. Se estableció el nivel de significación estadística en p<0,05.
ResultadosDiecisiete hombres, todos HsH, con una mediana de edad de 38 años (RIQ: 16) fueron diagnosticados de LGV en el periodo que duró el estudio. Trece de ellos tuvieron afectación anorrectal y 4 la forma clásica genital o inguinal de la enfermedad. El 76,5% eran de origen español y el 70,6% habían completado estudios universitarios. El 88,2% de los pacientes tenían antecedentes de otras ITS, siendo 12 de ellos pacientes infectados por el VIH. No se identificó ninguna otra ITS asociada en el momento del diagnóstico. Tres pacientes con LGV anorrectales tenían neoplasias intraepiteliales anales en relación con un virus del papiloma humano de alto riesgo y 4 tenían antecedentes de verrugas anogenitales. Ocho pacientes tenían una historia previa de sífilis. Todos los sujetos infectados por el VIH se encontraban en estadio A y con tratamiento antirretroviral, con una mediana de CD4 de 1.014/mm3 (RIQ: 450,3), 10 de estos con carga viral indetectable en el momento del diagnóstico (tabla 1).
Datos de filiación de los pacientes con linfogranuloma venéreo. Características clínicas, aspectos de diagnóstico y de tratamiento
| Frecuencia | Porcentaje | |
|---|---|---|
| Edad | ||
| Mediana: 38,0; RIQ: 16 | ||
| Origen | ||
| Español | 13 | 76,5 |
| Extranjero | 4 | 23,5 |
| Nivel de estudios | ||
| Primario | 2 | 11,8 |
| Secundario | 3 | 17,6 |
| Universitario | 12 | 70,6 |
| ITS previas | ||
| Sí | 15 | 88,2 |
| No | 2 | 11,8 |
| Sífilis previa | ||
| Sí | 8 | 47,1 |
| No | 9 | 52,9 |
| HPV previa | ||
| Sí | 7 | 41,2 |
| No | 10 | 58,8 |
| VIH | ||
| Sí | 12 | 70,6 |
| No | 5 | 29,4 |
| Antigüedad VIH (años) | ||
| Mediana: 10,0; RIQ: 5,5 | ||
| Estadio VIH | ||
| A1 | 5 | 41,7 |
| A2 | 6 | 50,0 |
| A3 | 1 | 8,3 |
| Carga viral (copias) | ||
| Indetectable | 10 | 83,4 |
| 28.000 | 1 | 8,3 |
| 10 millones | 1 | 8,3 |
| Nadir CD4 | ||
| Mediana: 318,5; RIQ: 107,5 | ||
| CD4 actual | ||
| Mediana: 1.014; RIQ: 450,3 | ||
| Tipo linfogranuloma | ||
| Anorrectal | 13 | 76,5 |
| Clásico | 4 | 23,5 |
| Demora diagnóstica | ||
| Mediana: 5,0; RIQ: 3,5 | ||
| Muestra | ||
| Exudado | 8 | 47,1 |
| Tejido | 6 | 35,3 |
| Ambas | 3 | 17,6 |
| Serovar | ||
| L2 | 16 | 94 |
| L2b | 1 | 6 |
| Serología | ||
| IgG | 13 | 76,5 |
| IgG/IgM | 1 | 5,9 |
| No realizado | 3 | 17,6 |
| Tratamiento | ||
| Doxiciclina 3 semanas | 15 | 88,2 |
| Doxiciclina más de 3 semanas | 2 | 11,8 |
Con respecto al estudio microbiológico, las muestras positivas para linfogranuloma en el periodo estudiado correspondieron al 43% (13/31) de todos los test positivos para C. trachomatis a nivel anal. La segunda causa más frecuente de proctitis fue la gonorrea (8 casos). De todas las infecciones por C. trachomatis en cualquier localización, las infecciones por el serovar de LGV correspondieron al 16% (17/106).
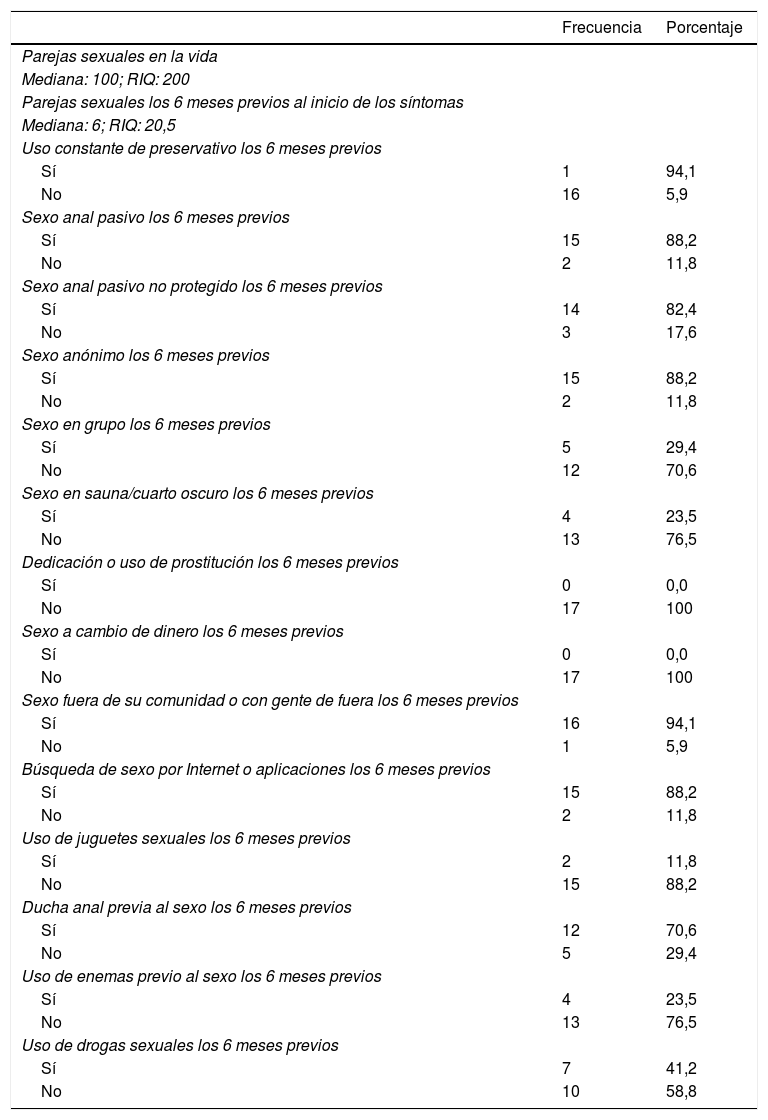
En cuanto a los hábitos sexuales, la mediana del recuento de parejas totales en la vida sexual de los pacientes fue de 100 (RIQ: 200), 6 parejas (RIQ: 20,5) en los 6 meses previos al inicio de los síntomas. Dieciséis pacientes (94,1%) habían hecho un uso inconstante del condón en ese periodo de tiempo y 14 (82,4%) habían tenido sexo anal receptivo sin uso de protección. Quince pacientes (88,2%) tuvieron sexo anónimo y dieciséis (94,1%) habían tenido sexo fuera de Andalucía o habían tenido sexo con varones procedentes del resto de España o del extranjero. Quince pacientes (88,2%) habían concertado citas a través de Internet o habían usado aplicaciones móviles para los encuentros sexuales. Doce pacientes (70,6%) habitualmente realizaban duchas anales previas a los encuentros sexuales y 9 (52,9%) habían tenido sexo en grupo, en saunas o en cuartos oscuros. El resto de los hábitos sexuales se muestran en la tabla 2.
Hábitos sexuales de los pacientes diagnosticados de linfogranuloma venéreo
| Frecuencia | Porcentaje | |
|---|---|---|
| Parejas sexuales en la vida | ||
| Mediana: 100; RIQ: 200 | ||
| Parejas sexuales los 6 meses previos al inicio de los síntomas | ||
| Mediana: 6; RIQ: 20,5 | ||
| Uso constante de preservativo los 6 meses previos | ||
| Sí | 1 | 94,1 |
| No | 16 | 5,9 |
| Sexo anal pasivo los 6 meses previos | ||
| Sí | 15 | 88,2 |
| No | 2 | 11,8 |
| Sexo anal pasivo no protegido los 6 meses previos | ||
| Sí | 14 | 82,4 |
| No | 3 | 17,6 |
| Sexo anónimo los 6 meses previos | ||
| Sí | 15 | 88,2 |
| No | 2 | 11,8 |
| Sexo en grupo los 6 meses previos | ||
| Sí | 5 | 29,4 |
| No | 12 | 70,6 |
| Sexo en sauna/cuarto oscuro los 6 meses previos | ||
| Sí | 4 | 23,5 |
| No | 13 | 76,5 |
| Dedicación o uso de prostitución los 6 meses previos | ||
| Sí | 0 | 0,0 |
| No | 17 | 100 |
| Sexo a cambio de dinero los 6 meses previos | ||
| Sí | 0 | 0,0 |
| No | 17 | 100 |
| Sexo fuera de su comunidad o con gente de fuera los 6 meses previos | ||
| Sí | 16 | 94,1 |
| No | 1 | 5,9 |
| Búsqueda de sexo por Internet o aplicaciones los 6 meses previos | ||
| Sí | 15 | 88,2 |
| No | 2 | 11,8 |
| Uso de juguetes sexuales los 6 meses previos | ||
| Sí | 2 | 11,8 |
| No | 15 | 88,2 |
| Ducha anal previa al sexo los 6 meses previos | ||
| Sí | 12 | 70,6 |
| No | 5 | 29,4 |
| Uso de enemas previo al sexo los 6 meses previos | ||
| Sí | 4 | 23,5 |
| No | 13 | 76,5 |
| Uso de drogas sexuales los 6 meses previos | ||
| Sí | 7 | 41,2 |
| No | 10 | 58,8 |
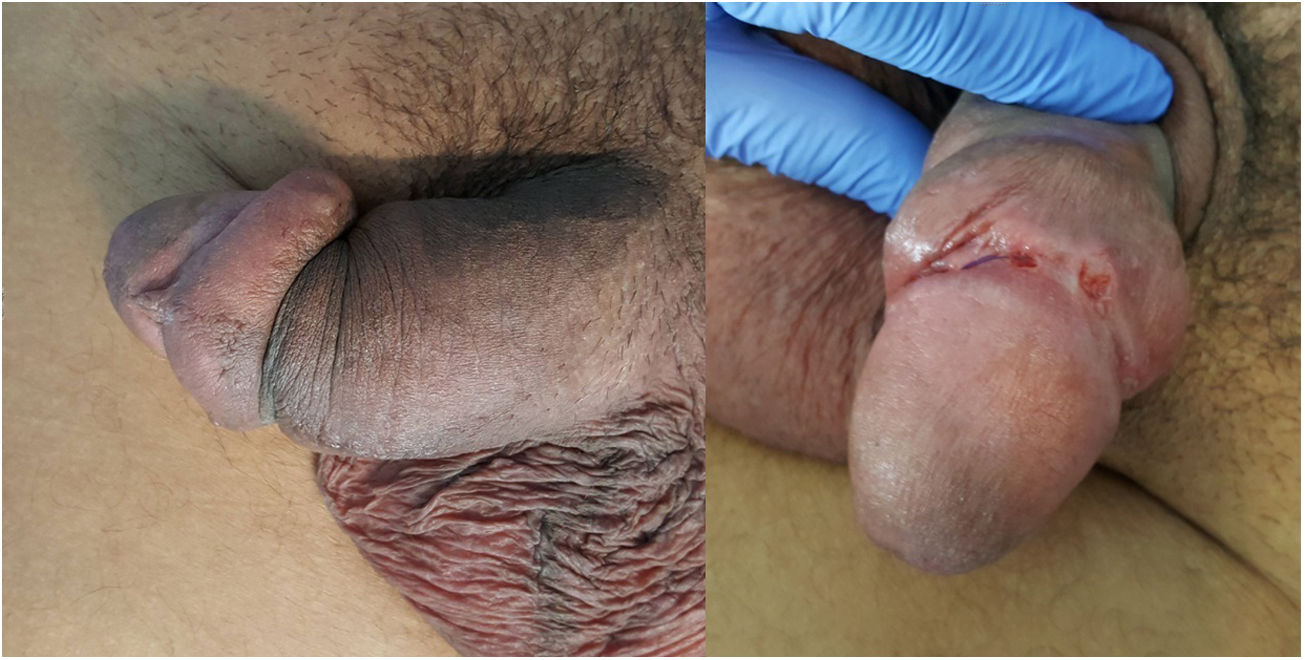
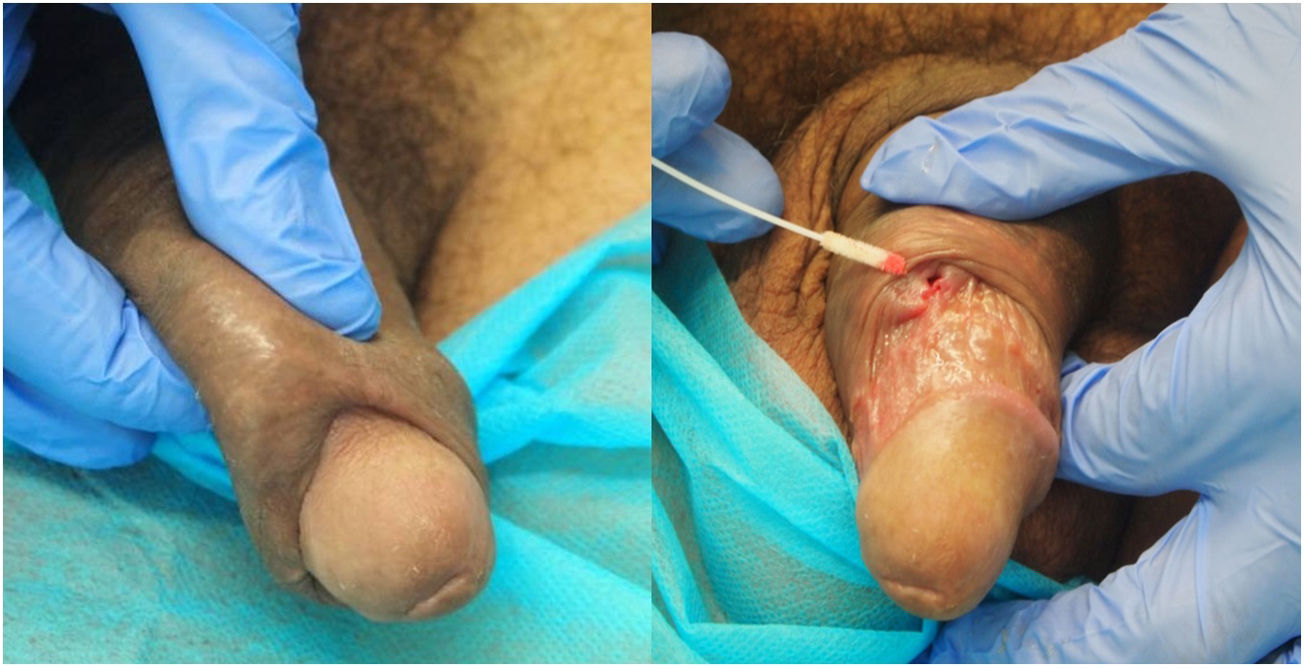
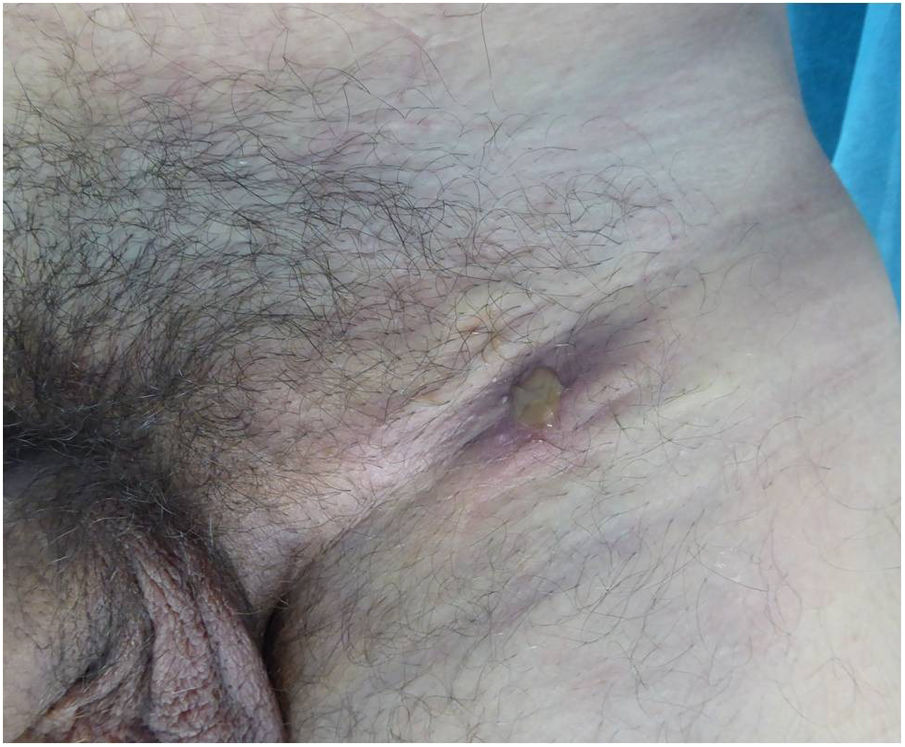
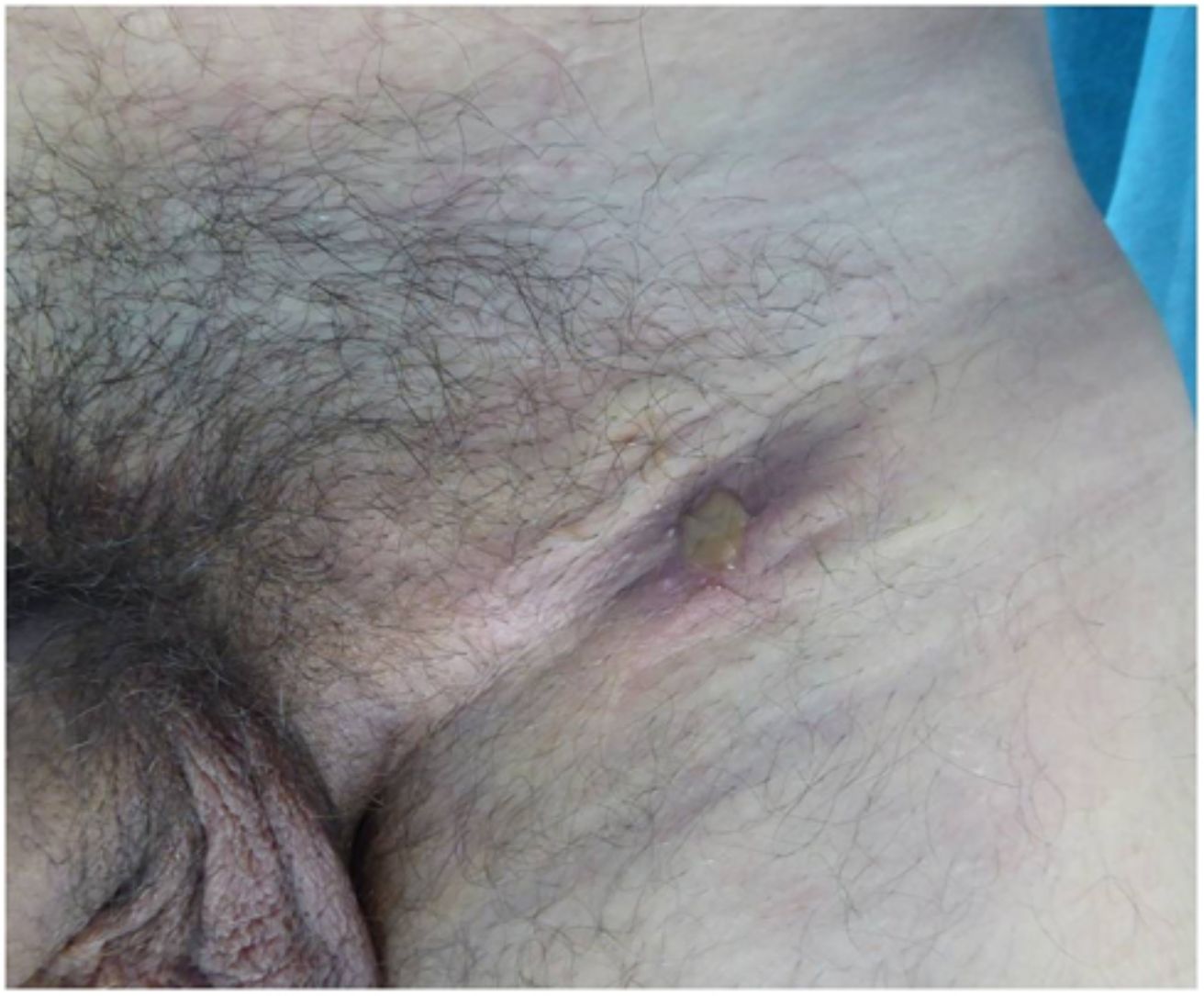
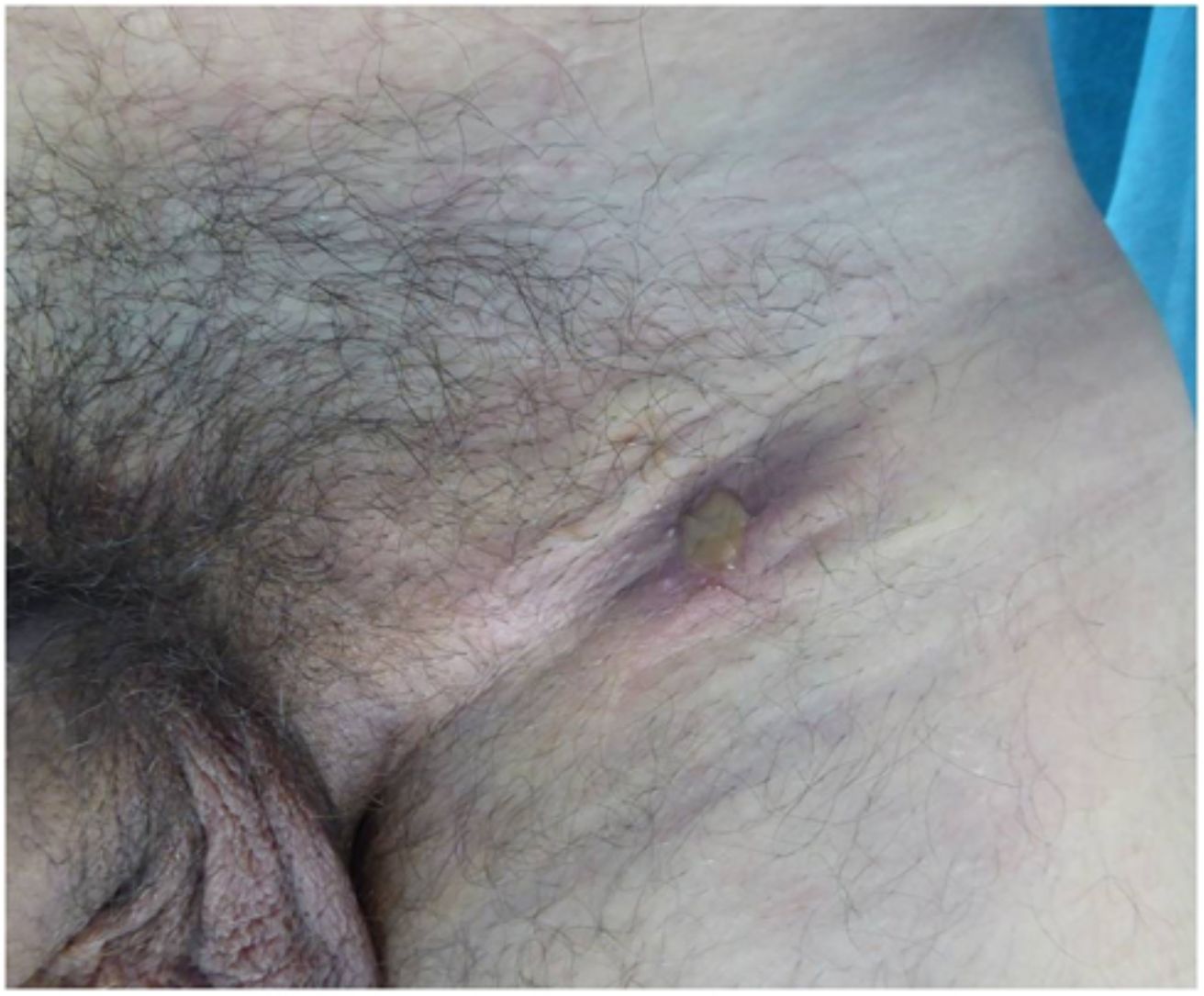
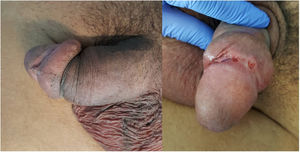
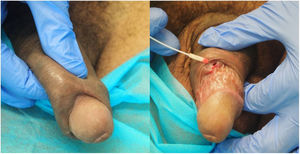
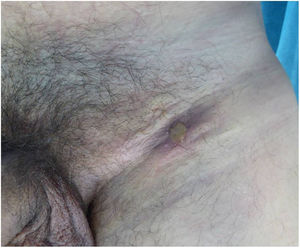
La forma de presentación en 13 casos fue una proctitis muy sintomática que motivó visitas a urgencias. Cuatro de los pacientes consultaron por lesiones genitales o masas inguinales. En uno de ellos la presentación clínica fue la aparición de 2 úlceras en el prepucio con linfedema doloroso asociado (fig. 1) y múltiples adenopatías en área del pubis. Otro paciente tuvo un absceso crónico en el pene con fistulización a la piel (fig. 2). En 2 pacientes el LGV se manifestó únicamente con bubones inguinales, en un caso con supuración secundaria a la piel y con un trayecto fistuloso hacia la zona escrotal (fig. 3). En las formas anorrectales los principales síntomas fueron el dolor espontáneo y el exudado purulento anal, aunque otros referían además tenesmo y sangrado. Los diagnósticos en las formas anorrectales de LGV fueron diversos: enfermedad inflamatoria intestinal en 4 pacientes, cáncer de ano en 2 pacientes y colitis infecciosa, fisuras, fístulas anales y hemorroides en el resto. En todos los casos se asociaba mal estado general y febrícula, y en 5 de ellos se comprobó pérdida de peso. No se encontró en ningún caso alteraciones en el hemograma ni en la bioquímica y en 14 pacientes en los que se realizó serología de C. trachomatis, esta fue positiva (IgG en todos los casos e IgM en uno de ellos).
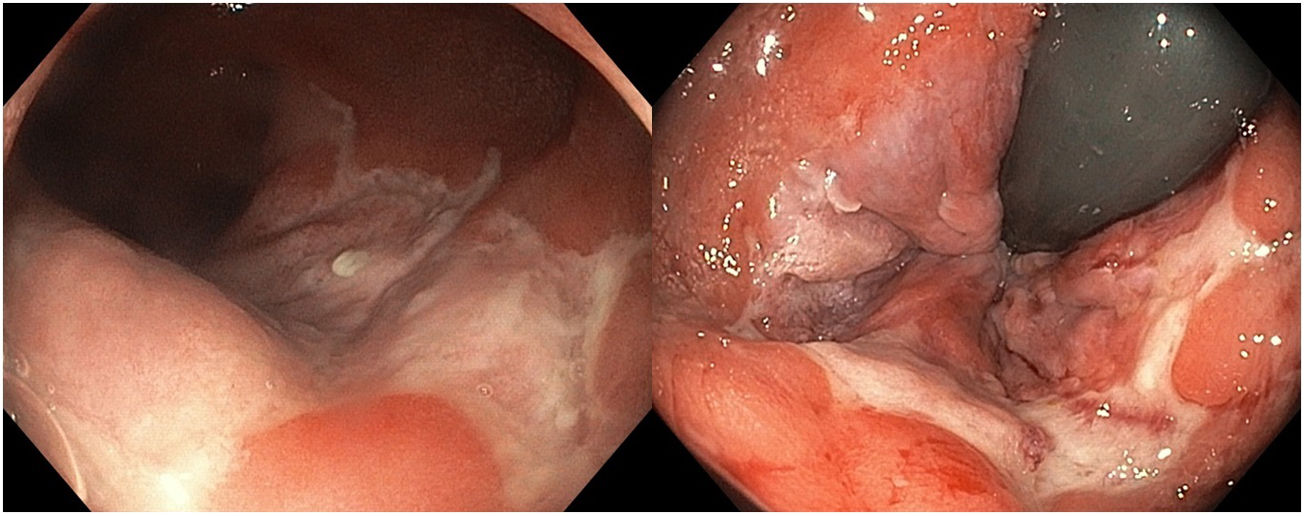
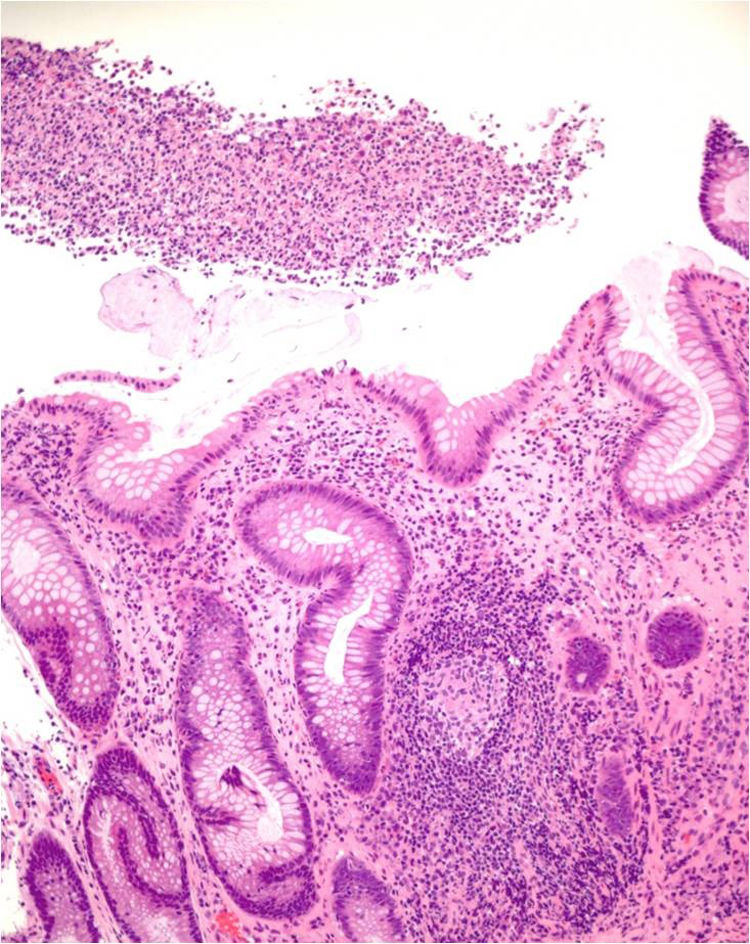
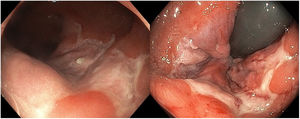
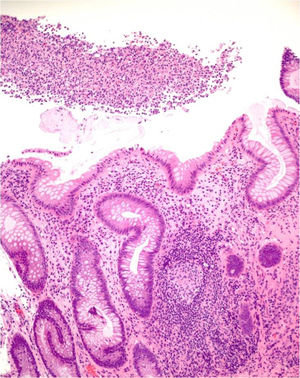
En 9 pacientes con afectación anorrectal se practicó una rectosigmoidoscopia, que demostró úlceras extensas superficiales de límites geográficos en el canal anal y en la ampolla rectal (fig. 4). En las histologías de estos pacientes predominaron los patrones granulomatosos con infiltrados crónicos inespecíficos, asociados a criptitis aguda en 3 de los casos (fig. 5). No se evidenciaron microorganismos en las biopsias y las inmunohistoquímicas para citomegalovirus y Treponema pallidum fueron negativas. En el caso 1 se realizó una resonancia nuclear magnética que demostró edema de la mucosa rectal con obliteración de la luz con extensión al mesorrecto, asociado a múltiples adenopatías en las cadenas pararrectales e hipogástricas. En los casos de LGV clásico la ecografía fue de utilidad para demostrar y hacer un seguimiento de las adenopatías inflamatorias inguinales, así como de los abscesos y de las fístulas. En todos los casos se identificó el serovar L2 de C. trachomatis (con referencia en genbank CP002682.1) como agente etiológico.
Todos los pacientes con formas anorrectales respondieron a un ciclo de doxiciclina 100mg 2 veces al día durante 21 días, con mejoría importante de la sintomatología tras la primera semana del tratamiento. Un paciente con un absceso en el pene y otro con adenopatías inguinales supurativas necesitaron cursos más prolongados de tratamiento, que se suspendieron cuando la clínica cedió y se pudo comprobar la curación mediante un nuevo estudio microbiológico. Los exudados anales en las formas anorrectales tomados a los 2 meses del diagnóstico fueron negativos en todos los casos. Dos pacientes con formas anorrectales tuvieron como secuelas estenosis del canal anal y cicatrización anómala con ulceración secundaria en la zona del recto adyacente a la línea pectínea. Tres de nuestros pacientes necesitaron cirugía para exéresis o drenaje de los bubones y de un absceso persistente en el pene. Las características clínicas de los pacientes se muestran en la tabla 2. Comparando los hábitos sexuales entre los pacientes con LGV anorrectal y clásico, el sexo anal receptivo (p=0,044) y el sexo anal receptivo no protegido (p=0,006) se recogieron con mayor frecuencia en las formas anorrectales. La ducha anal previa a los encuentros sexuales (p=0,053), el sexo fuera de nuestra comunidad o con foráneos (p=0,235) y el sexo en grupo (p=0,261) también fueron más frecuentemente recogidos en el grupo de LGV anorrectal (tabla 3).
Estudio comparativo de los hábitos sexuales de los pacientes con linfogranuloma venéreo anorrectal frente a la forma clásica
| Forma anorrectal | Forma clásica | p | |
|---|---|---|---|
| Sexo anal receptivo 6 meses previos | 13 (100%) | 2 (50%) | 0,044 |
| Sexo anal receptivo sin condón 6 meses previos | 13 (100%) | 1 (25%) | 0,006 |
| Ducha anal previa 6 meses previos | 11 (84,6%) | 1 (25%) | 0,053 |
| Sexo fuera de la comunidad o con foráneos 6 meses previos | 13 (100%) | 3 (75%) | 0,235 |
| Sexo en grupo 6 meses previos | 5 (38,5%) | 0 (0%) | 0,261 |
En nuestro estudio hemos presentado 17 pacientes HsH con LGV, la mayoría con afectación anorrectal, 2 con enfermedad exclusiva inguinal y otros 2 con lesiones en el pene, formas clásicas consideradas excepcionales en Europa, pero de más difícil manejo y con una mayor probabilidad de complicaciones. En nuestra serie 5 de los casos aparecieron en pacientes no infectados por el VIH con hábitos sexuales de alto riesgo tanto para el contagio del VIH como del linfogranuloma. Esta es la segunda serie publicada del sur de España, presentando los primeros casos con la forma clásica de la enfermedad.
Con la liberalización de las relaciones sexuales entre hombres y la aparición del VIH se empezaron a diagnosticar formas de LGV rectales responsables de epidemias en comunidades gays de Holanda4 y de San Francisco5. De los 1.693 casos declarados en la Europa Comunitaria entre el 2002 y el 2007, solo 4 procedieron de España6 con un aumento considerable en los años posteriores. En Barcelona se declararon 146 casos entre el 2007 y el 2011, y la mitad de ellos solo en el año 20117. En un centro de nuestra comunidad autónoma entre diciembre de 2013 y abril de 2015 se identificó el serovar de LGV en 13 muestras anales, 8 en pacientes con proctitis sintomáticas8. A nivel nacional en el 2017 se declararon 414 casos en 6 comunidades autónomas, con una incidencia de 1,15 casos por 100.000 habitantes9.
El LGV anorrectal afecta principalmente a HsH infectados por el VIH, con hábitos sexuales de alto riesgo10. En nuestra serie los pacientes reconocieron un elevado número de parejas, muchas de ellas anónimas, un uso inconstante de preservativo y contactos sexuales fuera de nuestra comunidad o con foráneos en los meses previos al diagnóstico, factores considerados de riesgo para el contagio y la propagación de la infección. La facilidad actual de los desplazamientos, así como los contactos mediante redes sociales de Internet y aplicaciones móviles han facilitado la propagación del LGV al poner en contacto a HsH de distintas localizaciones de España y de Europa. Los pacientes con LGV clásico practicaban con frecuencia sexo anal activo, lo que explicaría la puerta de entrada y la localización de la infección. La ducha anal referida por la mayoría de nuestros pacientes se ha considerado también un factor facilitador de la adquisición de la Chlamydia, al alterar la integridad de la mucosa anal11. En un estudio de casos y controles en HsH en 6 clínicas inglesas en el grupo de pacientes con LGV, datos como el sexo anónimo, un número elevado de parejas, sexo en cuartos oscuros o en grupo y la búsqueda de sexo por Internet fueron significativamente más frecuentes en los pacientes diagnosticados de LGV12. Otros factores de riesgo, como el sexo anal desprotegido con hombres seropositivos para el VIH, la ducha anal previa, sexo bajo la influencia de drogas e incluso juegos sexuales en los que se usaba la orina, fueron recogidos en el estudio.
El LGV anorrectal cursa habitualmente como una proctitis severa, en la que suele predominar el exudado anal, en ocasiones sanguinolento13. El tenesmo rectal es uno de los síntomas principales, y puede ir acompañado de malestar general y de febrícula con pérdida de peso si se mantiene en el tiempo3. La afectación de los ganglios pararrectales y la ausencia de afectación de los inguinales hace imposible demostrar la afectación linfática en la exploración clínica. La resonancia nuclear magnética puede demostrar la afectación de la pared rectal y de tejidos circundantes, así como la extensión a los ganglios linfáticos4. El desconocimiento del síndrome por parte del clínico puede llevar a confusión al radiólogo, que puede interpretar los hallazgos como de origen tumoral14, como ocurrió en nuestro primer caso. La magnitud de los síntomas obliga al especialista no familiarizado con el cuadro a la solicitud de endoscopias en las que las imágenes y las histologías se pueden asemejar a la enfermedad inflamatoria intestinal15. La toma de una muestra para el estudio microbiológico de los exudados o del tejido de la biopsia y la evaluación mediante técnicas de secuenciación de ácidos nucleicos permiten identificar los serovares linfáticos de C. trachomatis16, pero estas técnicas están disponibles solamente en laboratorios especializados. La toma del exudado es obligada en pacientes con proctitis sintomáticas y antecedentes de sexo anal receptivo no protegido, sobre todo si se trata de pacientes seropositivos para el VIH. La histología es indistinguible de la enfermedad inflamatoria intestinal15, pero permite realizar el diagnóstico diferencial con otras proctitis de origen infeccioso y con los carcinomas anorrectales. El papel del dermatólogo en el diagnóstico del LGV y la formación continuada que puede ofrecer a otros especialistas que tratan habitualmente a estos pacientes es fundamental para el correcto manejo de la infección y para evitar pruebas complementarias innecesarias.
La forma genital e inguinal de LGV venéreo en Europa es casi exclusiva de los HsH, pero es bastante más infrecuente que la forma anorrectal17, hecho que puede explicarse por la menor integridad del epitelio mucoso de la zona rectal. En Francia en un periodo de 6 años se confirmaron 50 casos de LGV clásico, 36 manifestados con adenopatías inguinales y 14 de ellos asociados a ulceración genital18. En nuestra serie 4 pacientes con sexo anal insertivo presentaron una forma clásica de linfogranuloma, 2 con lesiones ulceradas o abscesos genitales y los otros 2 con enfermedad inguinal. Uno de ellos se diagnosticó tras estudio del tejido de la exéresis de una adenopatía inflamatoria inguinal con una serología de C. trachomatis positiva, en ausencia de sintomatología genital y con muestras uretrales y anales negativas para la bacteria. Otro paciente con antecedentes de uretritis tras un contacto sexual de riesgo tuvo adenopatías fluctuantes inguinales bilaterales, con supuración a la piel. En ocasiones la puerta de entrada es uretral, cursando como una uretritis con escasa sintomatología y pasajera, asociada en ocasiones a la enfermedad inguinal18. En nuestra casuística, el LGV es causa excepcional de ulceración genital por ITS en contraposición con otras mucho más frecuentes. En el periodo de nuestro estudio hemos demostrado un solo caso, 83 úlceras genitales por virus del herpes y 70 por la bacteria responsable de la sífilis.
La infección, si se detecta a tiempo, responde de forma rápida al tratamiento con tetraciclinas19, que debe instaurarse de forma precoz y empírica ante la sospecha clínica, en espera de la confirmación definitiva con las técnicas de PCR a tiempo real y secuenciación20. Las demoras en el diagnóstico pueden dar lugar a secuelas del tipo fibrosis linfática y linfedema genital, fístulas crónicas y estenosis rectales13. En nuestra serie, la sospecha clínica y el diagnóstico microbiológico genérico de infección por C. trachomatis nos hizo iniciar tratamiento específico con doxiciclina en el régimen aconsejado, evitando las secuelas en la mayoría de los casos anorrectales. Hasta un 27% de las proctitis por Chlamydia asintomáticas están relacionadas con serovares linfáticos de la bacteria15, por lo que sería aconsejable la identificación del subtipo para adecuar la duración del tratamiento. En 2 de las formas clásicas de nuestra serie los ciclos de antibióticos tuvieron que prolongarse ante la persistencia de los síntomas y de la infección. En la serie francesa referida de LGV clásico el tratamiento antibiótico tuvo que ser prolongado más de 3 semanas en 8 de los pacientes, todos ellos con formas inguinales abscesificadas18. En nuestra serie en 3 de los casos fue necesario recurrir a la cirugía para tratar las complicaciones.
Nuestro estudio se ha centrado en las formas sintomáticas de LGV debido a que no enviamos de forma rutinaria para su serotipado aquellas detecciones asintomáticas de Chlamydia genéricas a nivel anal. Las guías europeas actuales aconsejan el serotipado de todas las muestras anales positivas para Chlamydia21, ya que se estima que hasta el 35% de las infecciones anorrectales de LGV son asintomáticas.
El LGV anorrectal debe sospecharse ante cualquier proctitis sintomática en hombres receptores anales, sobre todo en los pacientes que viven con el VIH. La adquisición de la infección está condicionada por prácticas sexuales de alto riesgo. Aunque la forma clásica de LGV es excepcional, debe sospecharse en los HsH con prácticas de riesgo que presenten cuadros de ulceración genital o adenopatías dolorosas inguinales con tendencia a la supuración. La sospecha y el conocimiento de las formas clínicas de LGV debe orientar a tomar la muestra para C. trachomatis, identificar el serovar e instaurar un tratamiento adecuado de forma precoz que evite las complicaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses en este trabajo de investigación ni en la redacción del manuscrito.