En España, aunque el Ministerio de Sanidad elabora el informe de posicionamiento terapéutico (IPT) y las condiciones de reembolso de los fármacos, las Comunidades Autónomas (CC. AA.) gestionan los servicios de salud y deciden sobre las condiciones de prescripción en su ámbito territorial. El objetivo del estudio EQUIDAD fue describir los condicionantes para la prescripción de los nuevos fármacos en Dermatología en las CC. AA. y sus posibles diferencias.
Material y métodosEstudio transversal realizado en abril-mayo del 2023. Dos dermatólogos con responsabilidades directivas de cada Comunidad Autónoma (C. A.) informaron sobre los condicionantes autonómicos y locales en la prescripción de los fármacos cuyo IPT para el tratamiento de enfermedades dermatológicas fue publicado en los años 2016-2022. Los datos fueron recogidos mediante un cuestionario online.
ResultadosUn total de 33 investigadores de 17 CC. AA. participaron en el estudio. Se observaron inequidades entre CC. AA. para el acceso a los nuevos fármacos. Existieron condicionantes autonómicos adicionales al IPT en psoriasis en el 64,7% de las CC. AA., siendo este porcentaje menor en dermatitis atópica (35,3%) o melanoma (11,8%). El más frecuente fue el requisito de un orden de prescripción previo para el uso del fármaco. En algunas CC. AA. se detectaron además variaciones y condicionantes locales (diferencias entre centros de una misma C. A.).
ConclusionesExiste una multiplicidad de criterios tanto a nivel autonómico como local que añade restricciones adicionales a las establecidas por los IPT y que plantean una situación de inequidad entre los pacientes y los profesionales de las diferentes CC. AA. en el acceso a los nuevos fármacos.
Although the Spanish Ministry of Health prepares national therapeutic positioning reports (TPRs) and drug reimbursement policies, each of the country's 17 autonomous communities (ACs) is responsible for health care services and prescription requirements in its territory. The aim of the EQUIDAD study was to describe and explore potential differences in prescription requirements for new dermatology drugs across the autonomous communities.
Material and methodsCross-sectional study conducted in April and May, 2023. Two dermatologists with management responsibilities from each autonomous community reported on territorial and more local prescription requirements for drugs covered by national TPRs issued between 2016 and 2022.
ResultsThirty-three researchers from 17 autonomous communities participated. The data submitted revealed between-community inequities in access to new drugs. Overall, 64.7% of the regions imposed additional prescription requirements to those mentioned in the TPRs for psoriasis. This percentage was lower for atopic dermatitis (35.3%) and melanoma (11.8%). The most common requirement for accessing a new drug was a previous prescription for another drug. Differences and additional requirements were also detected at
the local level (i.e., differences between hospitals within the same autonomous community).
ConclusionsSpain's autonomous communities have multiple regional and local prescription requirements that are not aligned with national TPR recommendations. These differences result in inequitable access to new drugs for both patients and practitioners across Spain.
La mejora en los conocimientos patogénicos de numerosas dermatosis ha condicionado el desarrollo, aprobación y comercialización de nuevos fármacos en Dermatología en los últimos años1,2, circunstancia que supone un importante avance para el manejo de los pacientes con enfermedades cutáneas. La introducción de nuevos medicamentos financiados tiene un impacto relevante en el gasto del Sistema Nacional de Salud3.
Con el objetivo de asegurar la seguridad, eficacia y sostenibilidad del uso de fármacos, el proceso de aprobación de nuevos fármacos sigue una serie de pasos bien estructurados en España4. Tras la aprobación del medicamento por parte de la Agencia Europea del Medicamento, se abre un proceso de decisión sobre su precio y financiación en el Sistema Nacional de Salud, y su eventual incorporación a la práctica asistencial5. En este proceso se elabora el Informe de Posicionamiento Terapéutico (IPT), el cual recoge los criterios de uso y seguimiento del fármaco6 y lo posiciona en relación con las alternativas terapéuticas disponibles basándose en criterios de eficiencia y seguridad, tras haber fijado la Comisión Interministerial de Precios de los Medicamentos el precio máximo de los medicamentos aprobados, el cual es financiado por los servicios de salud de las distintas Comunidades Autónomas (CC. AA.).
Existen estudios previos realizados en el marco de la sanidad española que ponen de manifiesto la existencia de diferencias en el acceso a fármacos entre las distintas CC. AA.7,8. Los motivos de estas diferencias pueden ser múltiples, entre otros: la existencia de criterios adicionales a los del IPT para la financiación del fármaco en algunas CC. AA., o directamente la no aprobación en la prescripción de algunos fármacos en áreas concretas del territorio nacional, aun cuando su uso haya sido aprobado por el IPT.
Finalmente, debe tenerse en cuenta que, a los condicionantes autonómicos para la prescripción de fármacos, pueden sumarse una serie de condicionantes locales. La gestión individualizada de cada unidad de farmacia hospitalaria permite el establecimiento de protocolos concretos a nivel local en algunas regiones, que podrían suponer mayores restricciones para el acceso a los nuevos fármacos en Dermatología en nuestro medio9,10.
El objetivo del estudio EQUIDAD fue describir los condicionantes a nivel de cada comunidad autónoma (C. A.) para la prescripción de los nuevos medicamentos cuyo IPT fue publicado por el Ministerio de Sanidad y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) entre los años 2016 y 2022 para indicaciones dermatológicas en España, y describir la existencia de posibles diferencias geográficas en el acceso a estos fármacos en el territorio español.
Material y métodosDiseño: se realizó un estudio transversal. Para ello, se creó y difundió un cuestionario online a través de la Academia Española de Dermatología y Venereología (AEDV) en marzo del 2023 en el cual se preguntó a los investigadores por los condicionantes de prescripción de los fármacos incluidos en el estudio. Los investigadores responsables de cada C. A. revisaron y rellenaron de forma independiente la información disponible de su C. A. de trabajo en los meses de abril y mayo del 2023. Las discrepancias surgidas dentro de cada C. A. se resolvieron mediante reevaluación conjunta del cuestionario con los investigadores responsables.
Fármacos incluidos en el estudio: se incluyeron en el estudio aquellos fármacos para los cuales se emitió resolución de financiación en IPT para el tratamiento de enfermedades dermatológicas entre los años 2016 y 2022. En este periodo se aprobaron fármacos para las siguientes enfermedades dermatológicas: dermatitis atópica, psoriasis, carcinoma basocelular, carcinoma de células de Merkel y melanoma.
Investigadores participantes: se incluyeron 2participantes por cada C. A. evaluada. Los investigadores participantes fueron seleccionados por los coordinadores del estudio con base en los siguientes criterios: a) ejercer como dermatólogos, preferiblemente jefes de Servicio o jefes de Sección, o en su defecto como facultativos especialistas de Área en sus respectivas CC. AA., y b) tener conocimiento sobre la financiación de los fármacos a nivel autonómico.
Variables de interés: para la realización del estudio se recogieron las siguientes variables sobre los condicionantes existentes para la prescripción farmacológica de los fármacos anteriormente mencionados:
Condicionantes específicos para la prescripción existentes en la C. A. para cada uno de los fármacos evaluados. Se consideraron las siguientes opciones: exigencia de la C. A. del cumplimiento estricto del IPT, existencia de restricciones adicionales al IPT, o ausencia de condicionantes para la prescripción del fármaco en el caso de que no existieran documentos oficiales específicos. En caso de existir restricciones adicionales a las impuestas por el IPT se interrogó sobre la naturaleza de estas (orden de prescripción, no disponibilidad del fármaco, prescripción limitada a especialistas no dermatólogos u otras).
Existencia de condicionantes específicos para la prescripción a nivel local en algunos hospitales de la C. A. Se consideraron las siguientes opciones: sí existen, no existen, o desconozco si existen.
Análisis estadístico: se emplearon estadísticos descriptivos para evaluar las características de los datos recogidos. Las variables cualitativas se expresaron como distribuciones de frecuencias relativas y absolutas. Todos los análisis se realizaron con STATA (Stata Corp. 2021. Stata Statistical Software: versión 17. College Station, TX, EE. UU.). Para la realización de los mapas se empleó ArcGIS (ESRI. 2020. Environmental Systems Research Institute: versión 10.8. Redlands, CA, EE. UU.).
ResultadosSe contactó con un total de 34 investigadores distribuidos en las 17 CC. AA. evaluadas, recibiendo 33 respuestas (97%). Una C. A. (Comunidad Foral de Navarra) fue evaluada únicamente por un investigador. El perfil profesional de los investigadores encuestados incluyó un 66,7% de jefes de Servicio, un 21,2% de jefes de Sección y un 12,1% de facultativos especialistas de Área. Los fármacos estudiados quedan recogidos en la tabla 1.
Resumen de principios activos aprobados por la AEMPS entre los años 2016-2022 con indicación de tratamiento para enfermedades dermatológicas y condicionantes autonómicos específicos detectados en el estudio
| Fármacos incluidos en el estudio y condicionantes autonómicos encontrados (n=17) | ||
|---|---|---|
| n | % | |
| Dermatitis atópica | ||
| Baricitinib | ||
| C. A. impone restricciones adicionales a las del IPT | 4 | 23,5 |
| C. A. exige cumplimiento estricto del IPT | 6 | 35,3 |
| No existen condicionantes específicos para este fármaco | 7 | 41,2 |
| Dupilumab | ||
| C. A. impone restricciones adicionales a las del IPT | 2 | 11,8 |
| C. A. exige cumplimiento estricto del IPT | 8 | 47,1 |
| No existen condicionantes específicos para este fármaco | 7 | 41,2 |
| Upadacitinib | ||
| C. A. impone restricciones adicionales a las del IPT | 3 | 17,6 |
| C. A. exige cumplimiento estricto del IPT | 7 | 41,2 |
| No existen condicionantes específicos para este fármaco | 7 | 41,2 |
| Tralokinumab | ||
| C. A. impone restricciones adicionales a las del IPT | 3 | 17,6 |
| C. A. exige cumplimiento estricto del IPT | 7 | 41,2 |
| No existen condicionantes específicos para este fármaco | 7 | 41,2 |
| Psoriasis | ||
| Ixekizumab | ||
| C. A. impone restricciones adicionales a las del IPT | 8 | 47,1 |
| C. A. exige cumplimiento estricto del IPT | 3 | 17,6 |
| No existen condicionantes específicos para este fármaco | 6 | 35,3 |
| Brodalumab | ||
| C. A. impone restricciones adicionales a las del IPT | 8 | 47,1 |
| C. A. exige cumplimiento estricto del IPT | 3 | 17,6 |
| No existen condicionantes específicos para este fármaco | 6 | 35,3 |
| Guselkumab | ||
| C. A. impone restricciones adicionales a las del IPT | 7 | 41,2 |
| C. A. exige cumplimiento estricto del IPT | 4 | 23,5 |
| No existen condicionantes específicos para este fármaco | 6 | 35,3 |
| Tildrakizumab | ||
| C. A. impone restricciones adicionales a las del IPT | 7 | 41,2 |
| C. A. exige cumplimiento estricto del IPT | 4 | 23,5 |
| No existen condicionantes específicos para este fármaco | 6 | 35,3 |
| Risankizumab | ||
| C. A. impone restricciones adicionales a las del IPT | 7 | 41,2 |
| C. A. exige cumplimiento estricto del IPT | 4 | 23,5 |
| No existen condicionantes específicos para este fármaco | 6 | 35,3 |
| Bimekizumab | ||
| C. A. impone restricciones adicionales a las del IPT | 8 | 47,1 |
| C. A. exige cumplimiento estricto del IPT | 3 | 17,6 |
| No existen condicionantes específicos para este fármaco | 6 | 35,3 |
| Enfermedades oncológicas | ||
| Carcinoma de células de Merkel | ||
| Avelumab | ||
| C. A. impone restricciones adicionales a las del IPT | 2 | 11,8 |
| C. A. exige cumplimiento estricto del IPT | 3 | 17,6 |
| Existen condicionantes, pero con menores restricciones que las del IPT | 1 | 5,9 |
| No existen condicionantes específicos para este fármaco | 11 | 64,7 |
| Carcinoma basocelular | ||
| Sonidegib | ||
| C. A. impone restricciones adicionales a las del IPT | 1 | 5,9 |
| C. A. exige cumplimiento estricto del IPT | 7 | 41,2 |
| No existen condicionantes específicos para este fármaco | 9 | 52,9 |
| Cemiplimab | ||
| C. A. impone restricciones adicionales a las del IPT | 6 | 35,3 |
| C. A. exige cumplimiento estricto del IPT | 5 | 29,4 |
| No existen condicionantes específicos para este fármaco | 6 | 35,3 |
| Melanoma | ||
| Encorafenib+bimetinib | ||
| C. A. impone restricciones adicionales a las del IPT | 1 | 5,9 |
| C. A. exige cumplimiento estricto del IPT | 6 | 35,3 |
| Existen condicionantes, pero con menores restricciones que las del IPT | 1 | 5,9 |
| No existen condicionantes específicos para este fármaco | 9 | 52,9 |
| Nivolumab+ipilimumab | ||
| C. A. impone restricciones adicionales a las del IPT | 1 | 5,9 |
| C. A. exige cumplimiento estricto del IPT | 7 | 41,2 |
| No existen condicionantes específicos para este fármaco | 9 | 52,9 |
| Pembrolizumab | ||
| C. A. exige cumplimiento estricto del IPT | 8 | 47,1 |
| No existen condicionantes específicos para este fármaco | 9 | 52,9 |
IPT: índice de posicionamiento terapéutico.
*Los condicionantes descritos se basan en la presencia de directrices autonómicas específicas, y no incluyen posibles restricciones locales a nivel de hospital.
En 15 de las 16 CC. AA. que contaron con 2investigadores se encontraron discrepancias entre los encuestados, que fueron resueltas según el protocolo del estudio. El motivo más frecuente de las discrepancias obtenidas fue la duda sobre el origen de las restricciones (autonómicas o locales), dado que en múltiples centros los condicionantes a nivel hospitalario diferían de las directrices autonómicas en caso de existir, o la presencia de directrices hospitalarias confundían sobre la existencia de normativa escrita autonómica, que daban lugar a diferencias en los protocolos de prescripción de los fármacos en los centros de la misma C. A.
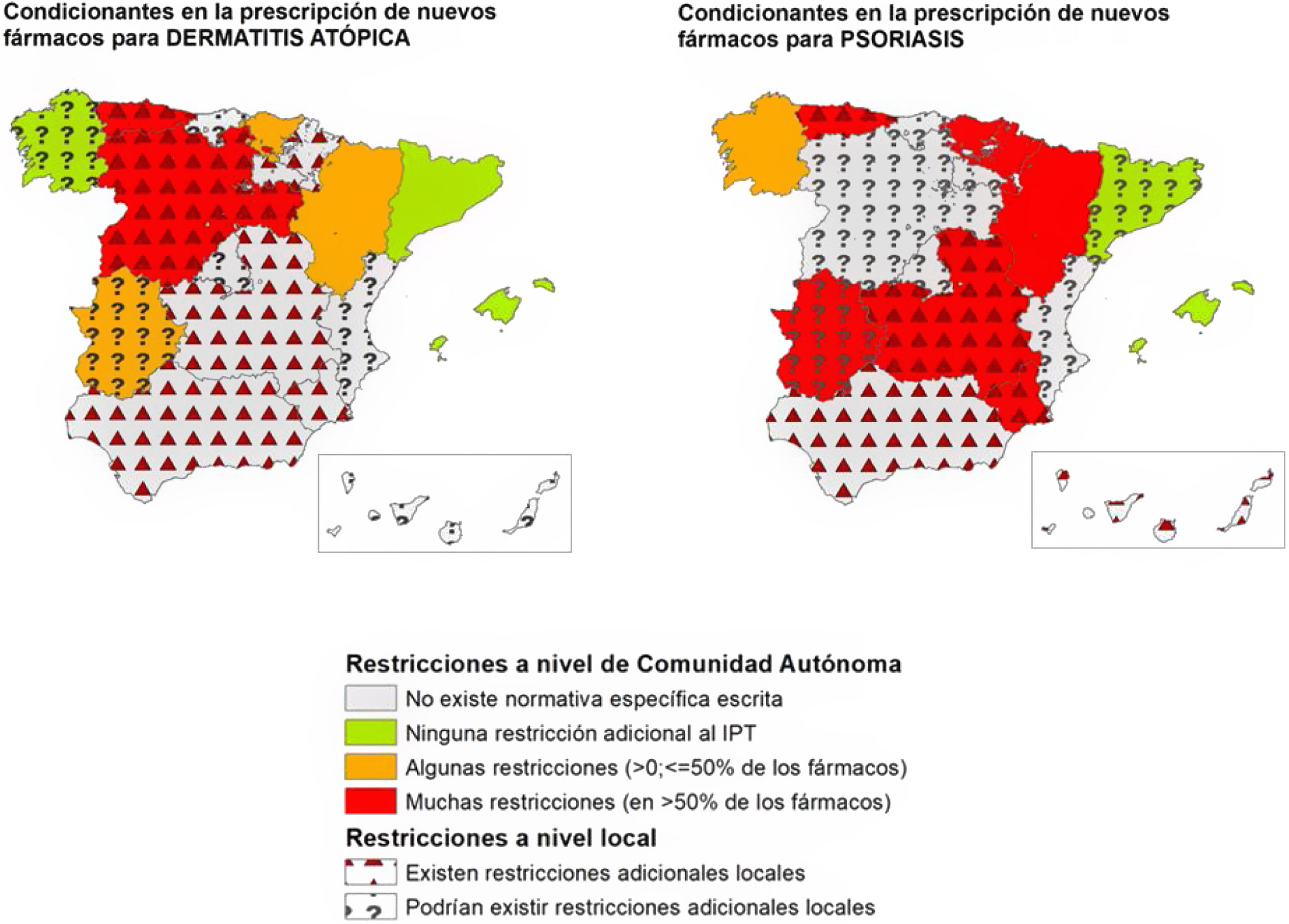
Tras la resolución de discrepancias, se observaron diferencias en los condicionantes de acceso a los nuevos fármacos en dermatología entre las diferentes CC. AA. El porcentaje de CC. AA. en el que se declaró la existencia de condicionantes autonómicos adicionales al IPT varió entre los fármacos, desde el 5,9% para las combinaciones de fármacos como nivolumab+ipilimumab o encorafenib+binimetinib; el 11,8% para dupilumab o el 17,6% para upadacitinib, y porcentajes más altos en fármacos para psoriasis como ixekizumab, brodalumab o bimekizumab (47,1%) (tabla 1).
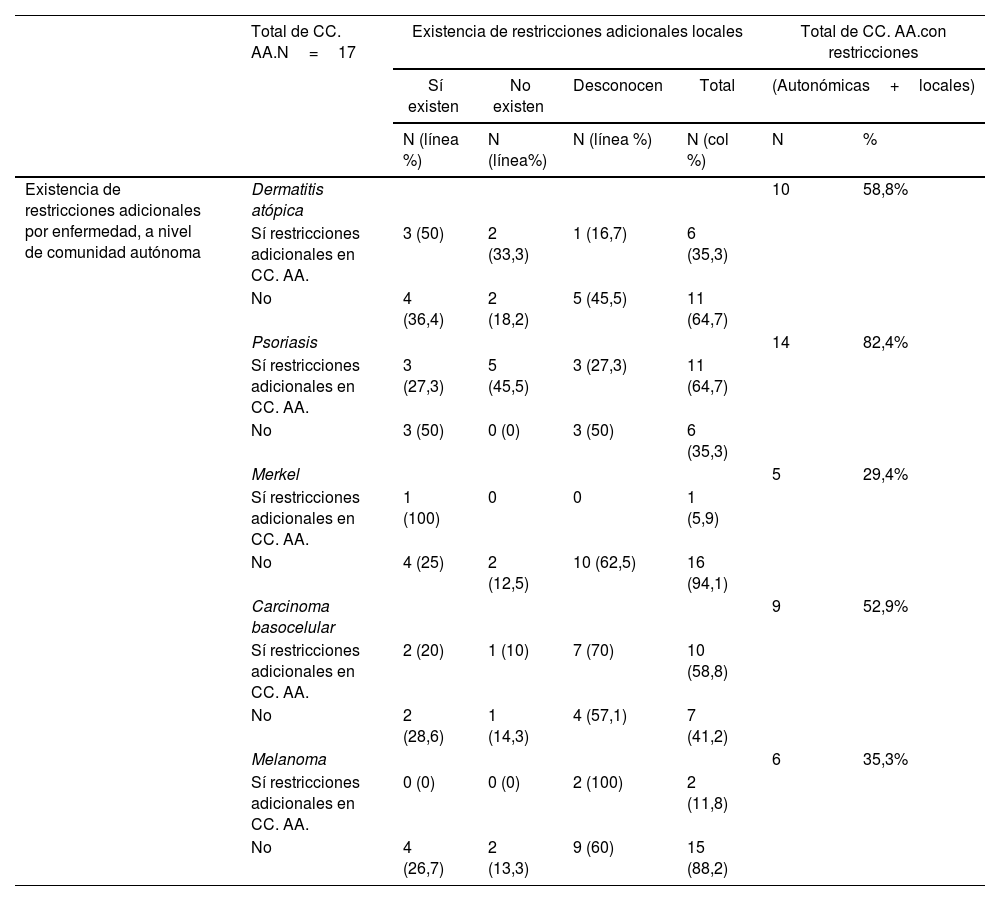
Estos datos fueron similares a los encontrados en la evaluación agrupada por enfermedades (tabla 2). Los fármacos para psoriasis fueron los más afectados por restricciones adicionales al IPT a nivel autonómico (64,7% de las CC. AA.), existiendo menos restricciones autonómicas para aquellos fármacos empleados en dermatitis atópica (35,3%), melanoma (11,8%) o carcinoma de células de Merkel (5,9%). Los datos detallados para cada C. A. y cada fármaco pueden observarse en el material suplementario (tablas S1, S2 y S3, anexo).
Resumen de restricciones adicionales al IPT existentes en España en la prescripción de nuevos fármacos (tanto a nivel de directrices autonómicas oficiales, como a nivel de restricciones locales a nivel de hospital)
| Total de CC. AA.N=17 | Existencia de restricciones adicionales locales | Total de CC. AA.con restricciones | |||||
|---|---|---|---|---|---|---|---|
| Sí existen | No existen | Desconocen | Total | (Autonómicas+locales) | |||
| N (línea %) | N (línea%) | N (línea %) | N (col %) | N | % | ||
| Existencia de restricciones adicionales por enfermedad, a nivel de comunidad autónoma | Dermatitis atópica | 10 | 58,8% | ||||
| Sí restricciones adicionales en CC. AA. | 3 (50) | 2 (33,3) | 1 (16,7) | 6 (35,3) | |||
| No | 4 (36,4) | 2 (18,2) | 5 (45,5) | 11 (64,7) | |||
| Psoriasis | 14 | 82,4% | |||||
| Sí restricciones adicionales en CC. AA. | 3 (27,3) | 5 (45,5) | 3 (27,3) | 11 (64,7) | |||
| No | 3 (50) | 0 (0) | 3 (50) | 6 (35,3) | |||
| Merkel | 5 | 29,4% | |||||
| Sí restricciones adicionales en CC. AA. | 1 (100) | 0 | 0 | 1 (5,9) | |||
| No | 4 (25) | 2 (12,5) | 10 (62,5) | 16 (94,1) | |||
| Carcinoma basocelular | 9 | 52,9% | |||||
| Sí restricciones adicionales en CC. AA. | 2 (20) | 1 (10) | 7 (70) | 10 (58,8) | |||
| No | 2 (28,6) | 1 (14,3) | 4 (57,1) | 7 (41,2) | |||
| Melanoma | 6 | 35,3% | |||||
| Sí restricciones adicionales en CC. AA. | 0 (0) | 0 (0) | 2 (100) | 2 (11,8) | |||
| No | 4 (26,7) | 2 (13,3) | 9 (60) | 15 (88,2) | |||
CC. AA: comunidades autónomas.
Las restricciones adicionales al IPT encontradas para nuevos fármacos en Dermatología a nivel autonómico fueron fundamentalmente de 2tipos. En primer lugar, el condicionante adicional más frecuentemente descrito por los investigadores fue el requisito de un orden de prescripción previo (tablas S1, S2, anexo), es decir, que los pacientes tuvieran que recibir determinados tratamientos antes de poder optar al fármaco, sin que esto estuviese reflejado en el IPT. Esto sucedió en un 47,1% de las CC. AA. para los fármacos de psoriasis, y en un 29,4% de las mismas para dermatitis atópica. En el caso de la dermatitis atópica, el orden de prescripción fue variable entre las diferentes CC. AA. (tabla S1, anexo). Para el caso de la psoriasis, la exigencia más común fue el uso de fármacos biosimilares, o bien anti-TNF en primer lugar (tabla S2, anexo). En segundo lugar, se refirieron los siguientes condicionantes: no poder prescribir el fármaco en ninguna circunstancia, lo cual sucedió hasta en un máximo de 3 CC. AA. para algunos fármacos de psoriasis como bimekizumab, de 2 CC. AA. para algunos fármacos de dermatitis atópica como tralokinumab (tabla S1, anexo), o que la prescripción estuviera limitada a una especialidad distinta como oncología médica para los fármacos oncológicos, lo cual se comunicó hasta en un 35,2% de las CC. AA. para cemiplimab.
En relación con el empleo de fármacos para procesos oncológicos cutáneos, si bien en la mayor parte de las CC. AA. no se expresaron condicionantes específicos escritos para la mayoría de los fármacos estudiados (tabla S3, anexo), se constató que la prescripción de dichos fármacos a nivel práctico recae en exclusiva en la especialidad de Oncología Médica en más de la mitad de las CC. AA., con la imposibilidad de ser prescritos por parte de dermatólogos, que son aquellos especialistas que atienden y tratan al paciente cuando el tumor está localizado exclusivamente a nivel cutáneo y que también intervienen en el seguimiento en todos los estadios. Desconocemos si esta imposibilidad de prescripción se sustenta en algún documento oficial autonómico o local.
Otro condicionante expresado a nivel autonómico encontrado en el estudio ha sido la necesidad de mantener un coste medio paciente-año dentro de unos límites concretos en algunas CC. AA. (tabla S2, anexo). En este sentido, la selección del fármaco quedaría a elección del facultativo, siempre que el cómputo global del precio de los fármacos se mantuviese dentro del rango exigido, el cual no fue accesible de forma pública en documentos oficiales.
Con respecto a los condicionantes locales dentro de una misma C. A. existentes en algunos hospitales, los investigadores reconocieron la existencia de los mismos en un 41,2% de las CC. AA. para dermatitis atópica, un 35,3% para psoriasis, un 29,4% para carcinoma de células de Merkel y un 23,5% para los fármacos de carcinoma basocelular y melanoma. La proporción de investigadores que desconocía si existían o no condicionantes locales adicionales fue mayor en las enfermedades oncológicas que en psoriasis y en dermatitis atópica (tabla 2).
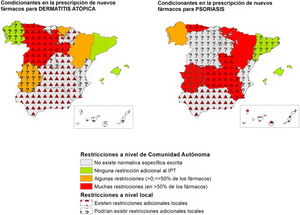
De manera general, considerando tanto los condicionantes autonómicos, como aquellos expresados por los investigadores como existentes a nivel local, se comunicó la existencia de restricciones adicionales a las proporcionadas por el IPT hasta en un 82,4% de las CC. AA. en fármacos para psoriasis (tabla 2) (fig. 1). Este porcentaje fue menor en el caso de los fármacos aprobados para dermatitis atópica (58,8%), carcinoma basocelular (52,9%), melanoma (35,3%) y carcinoma de células de Merkel (29,4%) (tabla 2).
Representación de la existencia de condicionantes de acceso a nuevos fármacos a nivel autonómico y local para dermatitis atópica y psoriasis en las distintas CC. AA., en abril-mayo del 2023. En los casos en los que los 2participantes no son conocedores de limitaciones locales, no se puede asegurar que no existan.
Si bien el IPT define las condiciones de uso y reembolso de los fármacos relacionados con la innovación en Dermatología, el presente estudio pone de manifiesto una gran heterogeneidad en su aplicación en las distintas CC. AA. De este modo, un porcentaje importante de CC. AA. cuenta con disposiciones específicas escritas adicionales al IPT o requisitos específicos para la utilización de estos fármacos (tabla 1) (fig. 1). A ello hay que añadir, en muchos casos, condicionantes locales introducidos por las gerencias de cada centro.
En aquellas CC. AA. en las que se han descrito condicionantes autonómicos específicos para la prescripción adicionales a los existentes en el IPT, el más frecuentemente observado ha sido el orden de prescripción, priorizándose el uso de fármacos biosimilares o con mayor tiempo de comercialización. Sin embargo, el orden de prescripción no fue el mismo en todas las CC. AA. Teniendo en cuenta que el objetivo del orden de prescripción probablemente sea la contención del gasto farmacéutico, parece aconsejable que estas medidas estén fundamentadas en estudios que evalúen la eficiencia y la seguridad de tal orden de prescripción, dado que en caso contrario las recomendaciones propuestas podrían eventualmente carecer de impacto farmacoeconómico o incluso llegar a empeorarlo. En ausencia de evidencia que apoye estas restricciones adicionales, podrían desarrollarse métodos alternativos del control de gasto farmacéutico que facilitasen una mayor libertad de prescripción basada en datos científicos sin perder de vista la eficiencia, como los requisitos de gasto medio por paciente-año, el pago por resultados, la potenciación de la optimización de dosis o un sistema de compra a nivel nacional.
Resulta llamativo cómo, de forma independiente a la existencia de condicionantes autonómicos, se ha constatado la frecuente presencia de condicionantes locales adicionales (de ámbito hospitalario) en varias CC. AA. (tabla S2, anexo). Estos datos van en consonancia con lo observado por Rodríguez-Lescure et al. para el acceso a fármacos oncológicos en España7 quienes mostraron que, en más de la mitad de los casos, las decisiones sobre el acceso a fármacos se tomaban a nivel local. Tampoco en este caso se ha logrado recoger soporte documental fundamentado en la evidencia que justifique estas decisiones. No logramos encontrar otros estudios en nuestro medio cercano acerca del objetivo de esta publicación.
La descripción geográfica del acceso a la innovación de prescripción hospitalaria en Dermatología muestra una gran heterogeneidad, no solo autonómica, sino a menudo también local. Las directrices y condicionantes, a menudo sin un soporte científico bien establecido, carecen además con frecuencia de la transparencia y accesibilidad que serían exigibles. En estas circunstancias, no es infrecuente que se recurra a soluciones individuales. En al menos 3CC. AA. se comunicó la existencia de algún caso en que, debido a las restricciones adicionales establecidas a nivel hospitalario, algún paciente cambiara de domicilio o solicitara ser derivado a otro hospital para poder optar a un fármaco al que no podía optar en otro centro de la misma ciudad, por estas restricciones. Varios investigadores también mostraron preocupación por el hecho de que, en la elaboración de estos protocolos en los que se establecen restricciones adicionales locales, en numerosos casos no se cuenta con la opinión de los dermatólogos, que son los especialistas que mejor conocen la enfermedad y los que tratan a los pacientes.
La principal limitación del presente estudio ha sido la imposibilidad para recoger los datos centro a centro, por lo que el estudio se ha centrado en la recogida de datos a nivel autonómico. Es probable, por lo tanto, que queden infrarrepresentadas la variabilidad y las inequidades existentes a nivel local, las cuales podrían ser aún mayores a las detectadas. Además, la dificultad para el acceso a los protocolos de algunas comunidades ha podido dar lugar a la aparición de sesgos. Finalmente, como las políticas sanitarias cambian con el tiempo, los datos recogidos representan únicamente el momento del periodo de recogida de datos. Independientemente de ello, sirven para cumplir el objetivo del estudio, que fue evaluar la existencia de inequidades en el acceso a los nuevos fármacos en Dermatología, y en caso de detectarlas, describirlas.
Como fortalezas del presente estudio deben resaltarse la participación de investigadores implicados en gestión en sus centros, de todas las CC. AA. del territorio nacional y la recogida de datos a través de 2fuentes distintas con una corrección posterior de las discrepancias. Como perspectiva futura, sería de interés para próximos estudios incluir datos sobre la equidad en el acceso, no solo a los fármacos novedosos, sino también a las propias consultas de Dermatología.
En conclusión, los datos presentados reflejan una situación de inequidad en los condicionantes de acceso a nuevos fármacos en Dermatología entre CC. AA., con multiplicidad de criterios tanto a nivel autonómico como local, siendo frecuente la existencia de restricciones adicionales a las establecidas por los IPT sin que se basen en métodos de decisión explícitos que demuestren integrar la evidencia científica. Esta situación puede condicionar diferencias en el acceso a la innovación en Dermatología y, por lo tanto, también en el pronóstico y en el impacto en la calidad de vida de los pacientes en función de su lugar de residencia.
Resulta prioritaria, en el ámbito de los nuevos fármacos de prescripción hospitalaria en dermatología, la coordinación de esfuerzos entre las distintas autoridades gestoras con el fin de desarrollar criterios de acceso coherentes con el IPT, fundamentados en estudios farmacoeconómicos metodológicamente adecuados, accesibles y que cuenten con el soporte y asesoramiento de los profesionales implicados en estas enfermedades. Entendemos que las restricciones podrían deberse a diferencias en financiación entre CC. AA., o a la distinta priorización del gasto, entre otros. En cualquier caso, la existencia de estos condicionantes genera desigualdades a título individual en el tratamiento de enfermedades prevalentes como la psoriasis o la dermatitis atópica y de enfermedades oncológicas dentro del territorio nacional y, por tanto, una falta de equidad que debe ser prioritario corregir. La coordinación interterritorial y una mayor transparencia son fundamentales para equiparar el acceso a nuevos fármacos entre las distintas zonas del país, lo cual debería plantearse como un objetivo prioritario en políticas de salud.
Conflicto de interesesManuel Sánchez Díaz ha recibido financiación para la asistencia a congresos de Sanofi, Lilly, Novartis y Almirall.
Ángeles Flórez ha recibido honorarios o soporte para actividades formativas o actuado como conferenciante o consultora o realizados ensayos clínicos o proyectos de investigación para Abbvie, ACELYRIN Inc, Alcedis GmbH, Almirall, Amgen, BMS, Celgene, Galderma, Incyte Corporation, Janssen-Cilag, Kyowa Kirin, Leo Pharma, Lilly, Novartis, Pfizer, Roche Farma, Sanofi-Aventis, Sun Pharma, Takeda y UCB Biosciences GmbH.
Mariano Ara-Martín: ponente y asesor para Abbvie, Novartis, Janssen, Lilly, Almirall, Leo Pharma, Amgen, UCB, Sanofi, Pfizer.
Pablo Coto-Segura: ha actuado como ponente, asesor, ayuda para congresos o recibido fondos para investigación por parte de Abbvie, Almirall, Amgen, Bristol Meier Squib, Leo Pharma, UCB pharma y Sanofi.
Ana Martín-Santiago ha sido asesora o ha recibido honorarios como ponente en eventos educativos de AbbVie, Amgen, Janssen, LEO Pharma, Leti, Lilly, Mylan, Novartis, Pierre-Fabre, Pfizer, Sanofi-Genzyme, UCB y Viatrix.
Pedro Mercader-García ha recibido financiación para la asistencia a congresos de Lilly y Sanofi y ha recibido dinero como ponente para Leo Pharma, Abbvie y Sanofi.
Jaime Notario ha recibido honorarios por participar en consultorías o como ponente o en ensayos clínicos patrocinados por AbbVie, Almirall, Amgen, Boehringer Ingelheim, Eli Lilly, Janssen, LEO Pharma, MSD, Novartis, Pfizer y UCB Pharma.
Lucía Palacio Aller ha recibido financiación para la asistencia a congresos de Lilly, Janssen, Sanofi.
Ignacio García-Doval ha recibido financiación para la asistencia a congresos de Abbvie, MSD, Pfizer y Sanofi.
Mercè Grau-Pérez ha recibido financiación para la asistencia a cursos o congresos de Abbvie, Almirall, Janssen, Sanofi, Lilly y Novartis.
José-Manuel Carrascosa ha recibido honorarios o soporte para actividades formativas o actuado como conferenciante o consultor, o realizado ensayos clínicos o proyectos de investigación para Abbvie, Almirall, Amgen, BMS, Celgene, Galderma, Janssen-Cilag, Leo Pharma, Lilly, Novartis, Pfizer, Sanofi-Aventis, UCB, Sandoz y Boehringer Ingelheim.
Este trabajo se ha realizado gracias a la Beca Juan de Azúa, concedida por la Fundación Piel Sana de la Academia Española de Dermatología y Venereología.