En los últimos años se ha producido una revolución en el conocimiento de la dermatitis atópica (DA) que ha revertido en un salto cualitativo en las expectativas terapéuticas. En este contexto, resulta fundamental disponer de datos de práctica clínica de calidad.
Material y métodoBIOBADATOP es el Registro Español de Dermatitis Atópica, un estudio observacional, prospectivo y multicéntrico, con una cohorte de pacientes de cualquier edad con DA que requieren el empleo de tratamiento sistémico (convencional o innovador). Se registraron los datos demográficos, de diagnóstico, los tratamientos y los acontecimientos adversos (AA).
ResultadosSe incluyeron 258 pacientes, con 347 tratamientos sistémicos iniciados para la DA. Se suspendieron el 29,4% de los tratamientos, principalmente por falta de eficacia (10,7%). Durante el período de seguimiento se registraron 132AA. Del total, el 65% (86) relacionaron con el tratamiento sistémico iniciado, siendo los más frecuentes dupilumab (39AA) y ciclosporina (38AA). Los AA más frecuentes fueron: conjuntivitis (11pacientes), cefalea (6), hipertricosis (5) y náuseas (4). Se registró un AA grave (mastoiditis aguda) relacionado con ciclosporina.
ConclusionesEn este primer informe, la descripción de AA está limitada por los cortos períodos de seguimiento, que no permiten el cálculo de tasas de incidencias crudas ni ajustadas y no se han realizado comparaciones. Hasta la fecha del análisis no se han registrado AA graves en relación a las nuevas terapias. BIOBADATOP permitirá generar conocimiento en términos de efectividad y seguridad de los tratamientos sistémicos clásicos y las nuevas terapias en DA.
In recent years, remarkable improvements in our understanding of atopic dermatitis (AD) have revolutionized treatment perspectives, but access to reliable data from clinical practice is essential.
Materials and methodThe Spanish Atopic Dermatitis Registry, BIOBADATOP, is a prospective, multicenter database that collects information on patients of all ages with AD requiring systemic therapy with conventional or novel drugs. We analyzed the registry to describe patient characteristics, diagnoses, treatments, and adverse events (AEs).
ResultsWe studied data entries for 258 patients who had received 347 systemic treatments for AD. Treatment was discontinued in 29.4% of cases, mostly due to a lack of effectiveness (in 10.7% of cases). A total of 132 AEs were described during follow-up. Eighty-six AEs (65%) were linked to a systemic treatment, most commonly dupilumab (39AEs) and cyclosporine (38AEs). The most common AEs were conjunctivitis (11patients), headache (6), hypertrichosis (5), and nausea (4). There was 1severe AE (acute mastoiditis) associated with cyclosporine.
ConclusionsInitial findings on AEs from the Spanish BIOBADATOP registry are limited by short follow-up times precluding comparisons or calculation of crude and adjusted incidence rates. At the time of our analysis, no severe AEs had been reported for novel systemic therapies. BIOBADATOP will help answer questions on the effectiveness and safety of conventional and novel systemic therapies in AD.
El avance en el conocimiento de la patogénesis de la dermatitis atópica (DA) ha permitido el desarrollo de nuevas estrategias terapéuticas desarrolladas, por primera vez en la historia de esta enfermedad, frente a elementos clave en el circuito patogénico. Disponemos en la actualidad de grupos terapéuticos de naturaleza y mecanismo de acción variados. Los datos de seguridad y de eficacia de las nuevas terapias provienen fundamentalmente de ensayos clínicos, que han permitido la autorización de fármacos como dupilumab, baricitinib, upadacitinib, tralokinumab y abrocitinib1.
Aunque los ensayos clínicos son necesarios, resultan insuficientes para conocer la efectividad y la seguridad de las nuevas terapias. Las razones son varias: suelen incluir a pacientes muy seleccionados, excluyendo a aquellos con determinadas comorbilidades y mayor riesgo de toxicidades2. Por otra parte, el tamaño muestral solo permite detectar aquellos acontecimientos adversos (AA) más frecuentes, mientras que los AA de frecuencia inferior al 1:1.000 son habitualmente detectados tras su uso en la práctica clínica.
Los registros son una fuente de conocimiento en farmacovigilancia y permiten generar datos en poblaciones no seleccionadas, a menudo con comorbilidades y tratamientos concomitantes, durante largos períodos de observación. La Fundación Piel Sana AEDV (FPSAEDV) cuenta con ejemplos previos como BIOBADADERM (Registro Español de tratamientos sistémicos en Psoriasis), iniciado en 2007 por el Grupo de Psoriasis de la AEDV3, un referente internacional en la experiencia en práctica clínica real en psoriasis4,5.
En 2020 se incluyó el primer paciente en el Registro Español de Dermatitis Atópica, BIOBADATOP, iniciativa promovida en colaboración con el Grupo Español de Investigación en Dermatitis de Contacto y Alergia Cutánea (GEIDAC) y el Grupo Español de Dermatología Pediátrica (GEDP), grupos de trabajo de la AEDV y también realizado en sintonía con The European TREatment of severe Atopic eczema Taskforce (TREAT Europe), una iniciativa internacional destinada a armonizar la recogida de datos observacionales en pacientes con DA en tratamiento sistémico6.
El objetivo de BIOBADATOP es describir la seguridad, la efectividad y el impacto en la calidad de vida en pacientes con DA que reciban tratamientos sistémicos en hospitales españoles con la estandarización y calidad suficientes para integrarse en registros internacionales.
Los objetivos principales son:
- 1.
Describir la seguridad a corto y a largo plazo de los tratamientos sistémicos para el eccema atópico, incluyendo fototerapia (farmacovigilancia).
- 2.
Describir la efectividad a corto y a largo plazo de los tratamientos sistémicos para el eccema atópico, incluyendo fototerapia, aportando datos para la toma de decisiones y la creación de guías.
Son objetivos secundarios:
- 1.
Describir la seguridad a corto y a largo plazo de los tratamientos tópicos para el eccema atópico.
- 2.
Describir la efectividad de diferentes formas de atención, incluyendo la educación del paciente.
- 3.
Describir las comorbilidades de la DA.
Presentamos la metodología del registro BIOBADATOP y los primeros resultados tras su puesta en marcha.
Material y métodosDiseñoBIOBADATOP es un estudio observacional, de cohortes, prospectivo y multicéntrico, que incluye pacientes de cualquier edad con DA que inicien tratamiento sistémico.
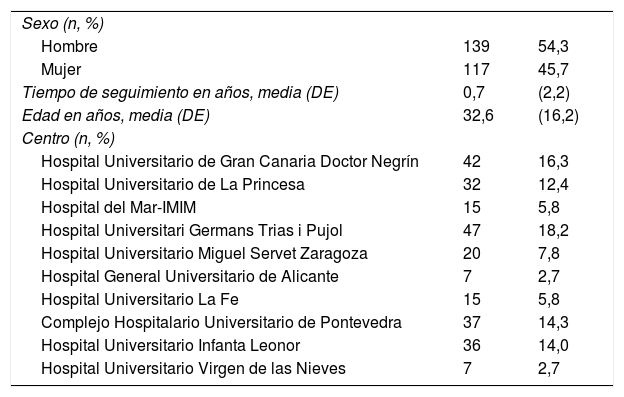
Centros participantesPara participar, los centros deben disponer de al menos un dermatólogo con interés y responsabilidad en el tratamiento de la DA moderada-grave. Los centros podrán ir sumándose al estudio, manteniéndose cierta representatividad geográfica en la distribución de centros. En el momento del presente trabajo participan en BIOBADATOP los hospitales reflejados en la tabla 1.
Descripción demográfica
| Sexo (n, %) | ||
| Hombre | 139 | 54,3 |
| Mujer | 117 | 45,7 |
| Tiempo de seguimiento en años, media (DE) | 0,7 | (2,2) |
| Edad en años, media (DE) | 32,6 | (16,2) |
| Centro (n, %) | ||
| Hospital Universitario de Gran Canaria Doctor Negrín | 42 | 16,3 |
| Hospital Universitario de La Princesa | 32 | 12,4 |
| Hospital del Mar-IMIM | 15 | 5,8 |
| Hospital Universitari Germans Trias i Pujol | 47 | 18,2 |
| Hospital Universitario Miguel Servet Zaragoza | 20 | 7,8 |
| Hospital General Universitario de Alicante | 7 | 2,7 |
| Hospital Universitario La Fe | 15 | 5,8 |
| Complejo Hospitalario Universitario de Pontevedra | 37 | 14,3 |
| Hospital Universitario Infanta Leonor | 36 | 14,0 |
| Hospital Universitario Virgen de las Nieves | 7 | 2,7 |
El registro incluye pacientes pediátricos y adultos con DA que comienzan un agente sistémico inmunomodulador en la práctica clínica habitual. Todos los pacientes deben cumplir los criterios diagnósticos de Reino Unido/Irlanda (The U.K. Working Party's Diagnostic Criteria for Atopic Dermatitis)7,8.
Exposición y seguimientoEn la visita de inclusión se recogen los datos demográficos y los relacionados con el diagnóstico, así como los datos de gravedad basales incluyendo el Eczema Area and Severity Index (EASI), el Dermatology Life Quality Index (DLQI) y el Patient Oriented Eczema Measure (POEM), información sobre pruebas diagnósticas, comorbilidades y tratamientos previos para su DA.
Las visitas de seguimiento se realizan de acuerdo a la práctica clínica y se registrarán aquellas más próximas a los 3 y 6meses desde el inicio de cada tratamiento sistémico, y posteriormente de forma anual. Se registrarán los cambios en la gravedad, el tratamiento sistémico principal y los tratamientos concomitantes.
En cada visita se registran los AA que hayan ocurrido desde la última consulta y se codifican de acuerdo a la terminología MedDRA (Medical Dictionary for Drug Regulatory Activities, disponible en: https://www.meddra.org).
Los pacientes incluidos seguirán en el registro durante un período de tiempo indefinido, habiéndose planificado una duración del estudio de 10 o más años.
Variables medidasCon el objetivo de describir la población incluida en el registro y evaluar aquellos factores que pueden tener efecto sobre la incidencia de AA, para cada uno de los pacientes se recogen los datos resumidos en la tabla 2.
Datos registrados de los pacientes: visita inicial y visitas de seguimiento
| Visita inicial |
| • Datos demográficos, incluyendo el grupo étnico |
| • Altura y peso |
| • Historia familiar y personal de comorbilidades atópicas |
| • Diagnóstico personal de la dermatitis atópica e historia terapéutica |
| • Registro de las comorbilidades que forman parte del índice de Charlson |
| • Formas de dermatitis atópica: eccema numular, eccema palmoplantar, prurigo nodular |
| • Descripción de áreas afectadas: cara y párpados, genitales, manos, eritrodermia |
| • Niveles de inmunoglobulina E total |
| • Gravedad al entrar en la cohorte: EASI, EVA prurito, DLQI, POEM |
| • Formación o programas educativos al paciente (escuelas de atopia) |
| • Pruebas de cribado previas (serologías VHB, VHC, VIH, VVZ) |
| • Tratamientos previos (incluyendo tópicos, sistémicos y fototerapia) |
| Visitas de seguimiento |
| • Cambios en el tipo, la localización y la gravedad de la dermatitis atópica |
| • Revisión del tratamiento sistémico principal y tratamientos concomitantes, fototerapia y tratamiento tópico |
| • Si el tratamiento principal cambia: razones del cambio y resultados en el paciente en el momento en que se inicia el nuevo tratamiento |
| • Motivos de interrupción del tratamiento si se produce |
| • Revisión de los acontecimientos adversos sufridos desde la última consulta |
| • Cualquier visita adicional en el hospital o centro de salud, relacionada con su dermatitis atópica o con el tratamiento |
| • Pérdida de productividad (días perdidos en actividades habituales debido a su dermatitis atópica) |
| • Gravedad en la visita: EASI, EVA prurito, DLQI, POEM |
Se realizó un análisis descriptivo de los pacientes incluidos desde el inicio (marzo de 2020) hasta el corte actual (noviembre de 2022). El análisis estadístico se realizó mediante el programa Stata (versión 17.0 Statacorp, Texas, EE.UU.). Los datos demográficos y clínicos se describieron mediante estadísticos convencionales (medias y desviaciones estándar, frecuencias absolutas y relativas).
Cálculo del tamaño muestralConsiderando la experiencia previa con el registro BIOBADADERM, se espera recoger datos de alrededor de 5.700 personas-año en cada una de las cohortes (unos 2.500 pacientes en 10años). Se estima que dicho tamaño muestral sería suficiente para poder detectar, con una potencia estadística del 80% y una significación del 0,05 bilateral, riesgos relativos de entre 1,5 y 2 para AA con incidencias de entre 4-10casos por cada 1.000 años-persona en el grupo de comparación. Para los AA raros y tardíos se establece una colaboración con otros miembros de TREAT.
Manejo de datos y control de calidadLos datos de los pacientes se recogen mediante la asignación de un código de identificación único y de forma protocolizada mediante un sistema online de captura de datos: Research Electronic Data Capture (REDCap)9, alojado en la FPSAEDV.
Aspectos éticosEl estudio ha sido aprobado por el Comité Ético de Investigación Clínica de Aragón (PA18/051), por la AEMPS y por parte de los centros participantes, cumpliendo con la declaración de Helsinki y la legislación vigente. Además, ha recibido el sello EnCePP (European Network of Centres for Pharmacoepidemiology and Pharmacovigilance), sello de calidad, independencia y transparencia de la red coordinada por la Agencia Europea del Medicamento (EMA).
ResultadosEn marzo de 2020 tuvo lugar la inclusión de los primeros pacientes. Se han incluido los datos registrados hasta noviembre de 2022. El registro cuenta en este momento con la participación de 13 hospitales.
Características basales principalesActualmente hay 258 pacientes registrados, de los cuales 139 (54,3%) son hombres. La edad media al inicio del reclutamiento es de 32,6años (desviación estándar [DE] ±16,2), y el seguimiento promedio es de 9meses en el momento actual.
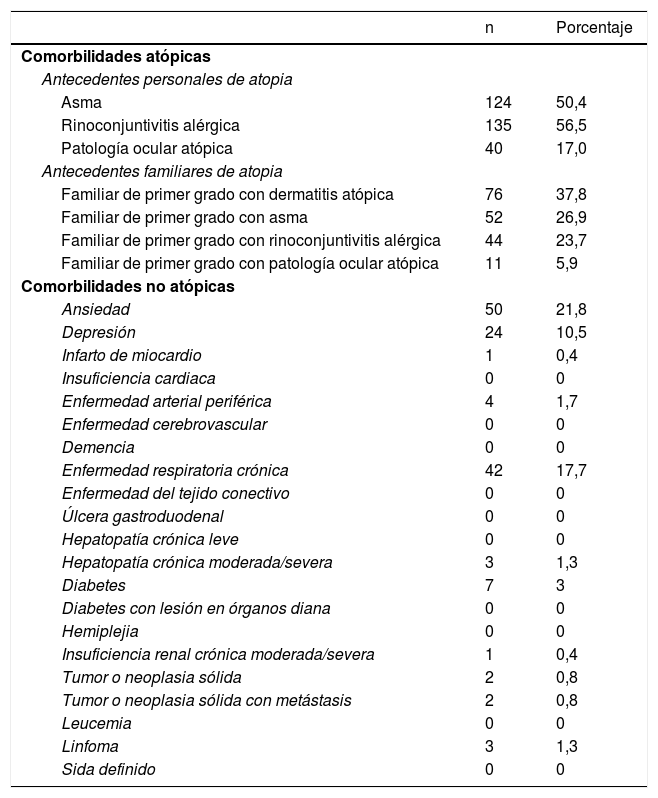
En la tabla 3 se recogen las comorbilidades registradas. El 50,4% presentaban asma y el 56,5%, rinoconjuntivitis alérgica. Tan solo el 17% tenían patología ocular atópica. En cuanto a otras comorbilidades, destaca la ansiedad (21,8%), seguida de la enfermedad respiratoria crónica (17,7%) y la depresión (10,5%).
Comorbilidades atópicas y no atópicas de los sujetos incluidos
| n | Porcentaje | |
|---|---|---|
| Comorbilidades atópicas | ||
| Antecedentes personales de atopia | ||
| Asma | 124 | 50,4 |
| Rinoconjuntivitis alérgica | 135 | 56,5 |
| Patología ocular atópica | 40 | 17,0 |
| Antecedentes familiares de atopia | ||
| Familiar de primer grado con dermatitis atópica | 76 | 37,8 |
| Familiar de primer grado con asma | 52 | 26,9 |
| Familiar de primer grado con rinoconjuntivitis alérgica | 44 | 23,7 |
| Familiar de primer grado con patología ocular atópica | 11 | 5,9 |
| Comorbilidades no atópicas | ||
| Ansiedad | 50 | 21,8 |
| Depresión | 24 | 10,5 |
| Infarto de miocardio | 1 | 0,4 |
| Insuficiencia cardiaca | 0 | 0 |
| Enfermedad arterial periférica | 4 | 1,7 |
| Enfermedad cerebrovascular | 0 | 0 |
| Demencia | 0 | 0 |
| Enfermedad respiratoria crónica | 42 | 17,7 |
| Enfermedad del tejido conectivo | 0 | 0 |
| Úlcera gastroduodenal | 0 | 0 |
| Hepatopatía crónica leve | 0 | 0 |
| Hepatopatía crónica moderada/severa | 3 | 1,3 |
| Diabetes | 7 | 3 |
| Diabetes con lesión en órganos diana | 0 | 0 |
| Hemiplejia | 0 | 0 |
| Insuficiencia renal crónica moderada/severa | 1 | 0,4 |
| Tumor o neoplasia sólida | 2 | 0,8 |
| Tumor o neoplasia sólida con metástasis | 2 | 0,8 |
| Leucemia | 0 | 0 |
| Linfoma | 3 | 1,3 |
| Sida definido | 0 | 0 |
Las formas clínicas de presentación de la DA más comunes son la dermatitis flexural (93,3%), la dermatitis en cara y párpados (84,6%) y la dermatitis de las manos (67,1%). El resto de manifestaciones incluyeron: afectación genital (31,6%), eritrodermia —afectación de más del 70% de la superficie corporal— (17,2%), eccema palmoplantar (12,1%), eccema numular (12,6%) y prurigo nodular —presencia de ≥5nódulos palpables— (11,6%).
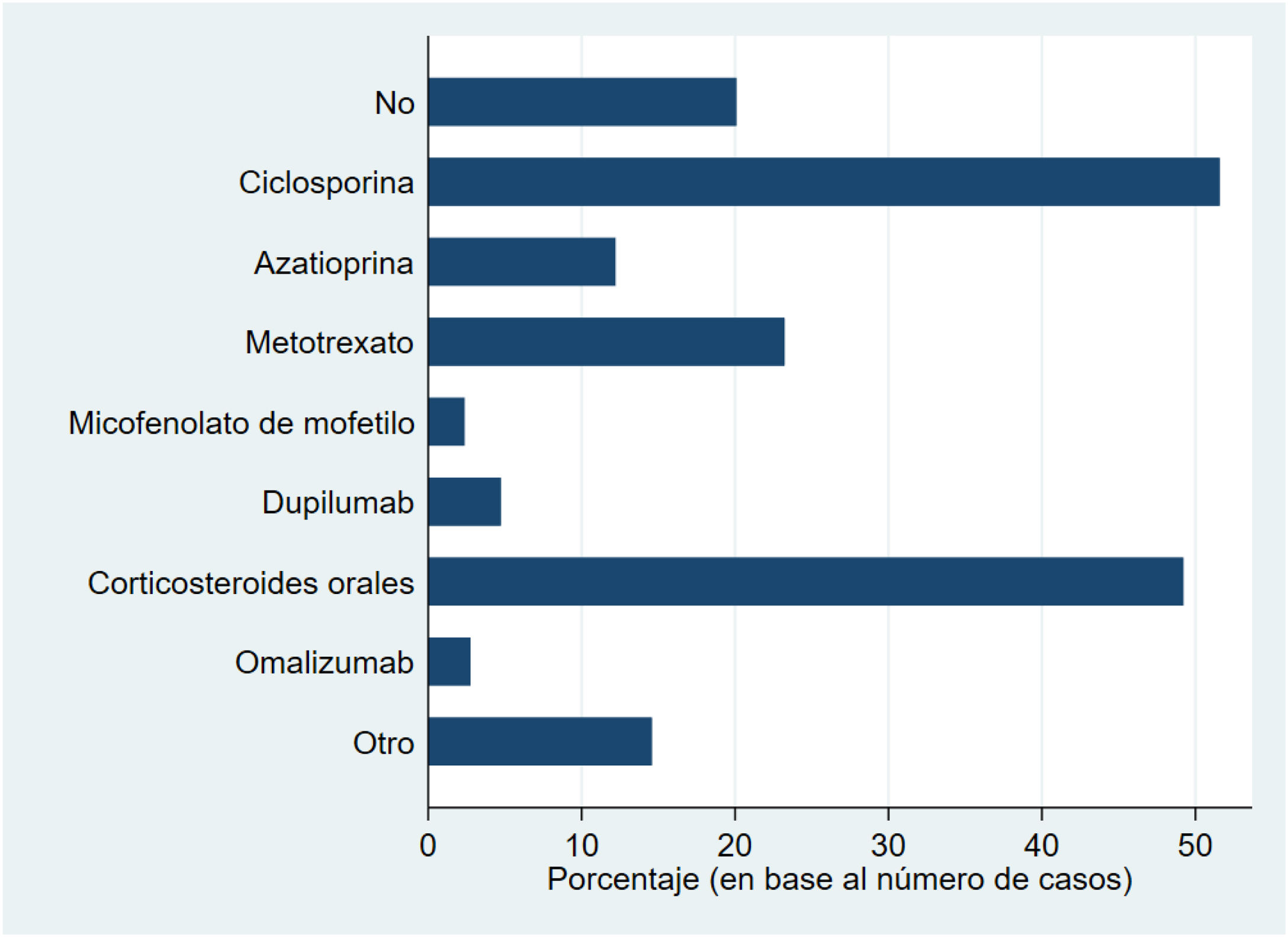
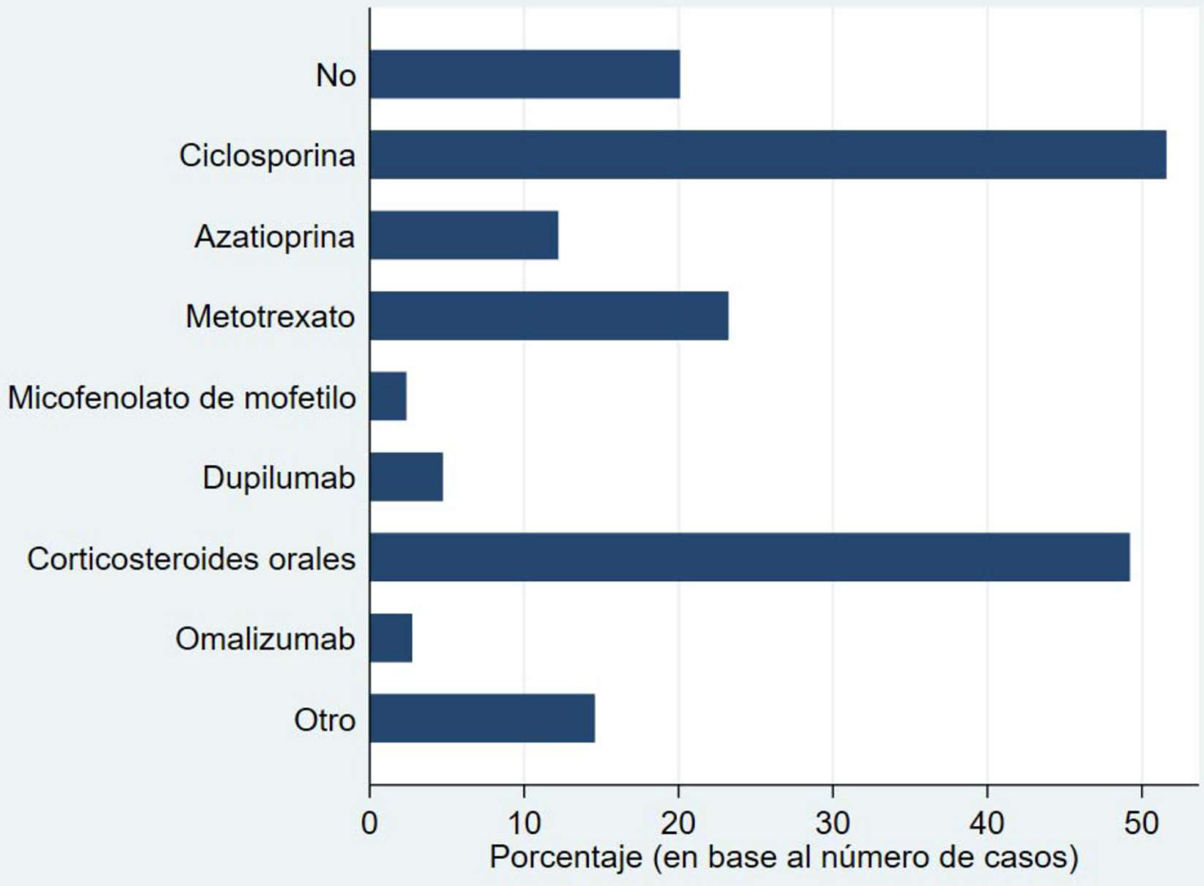
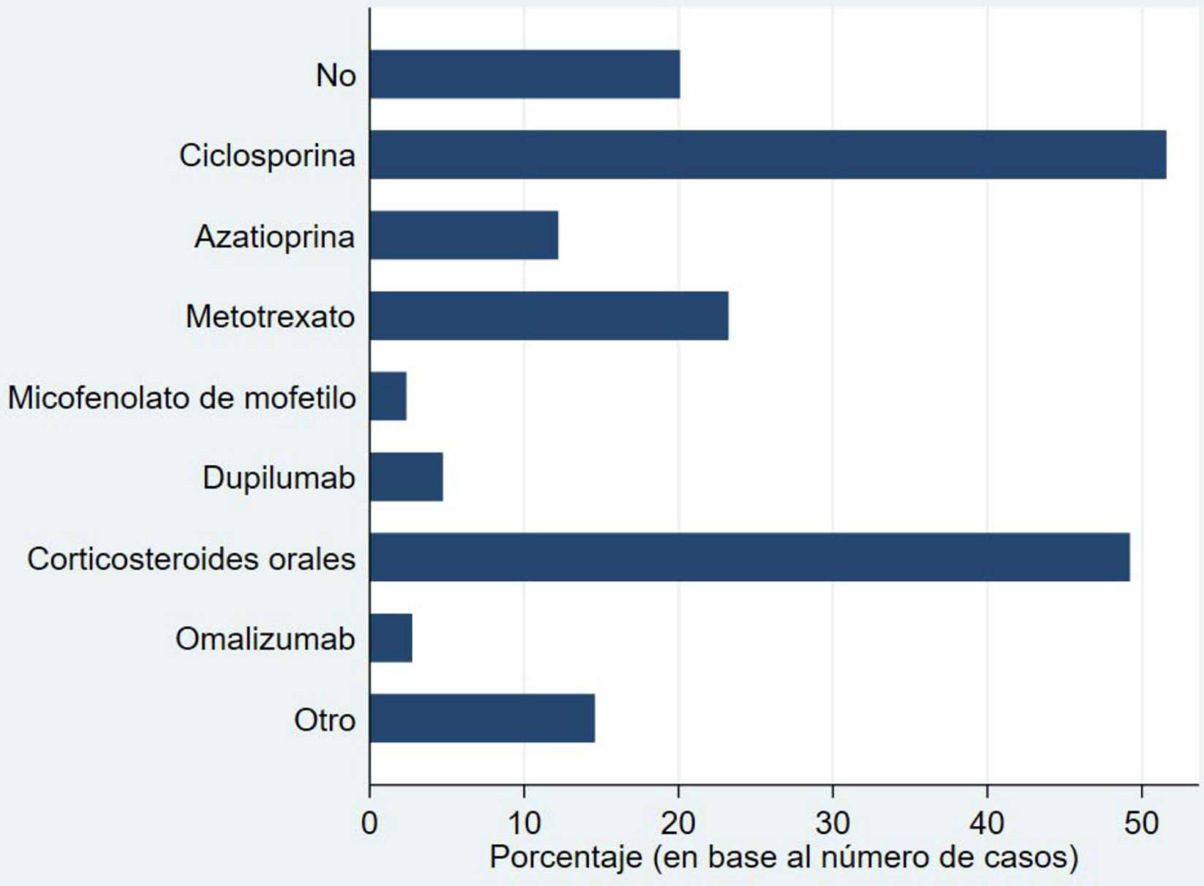
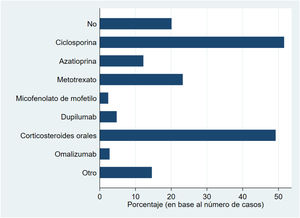
La figura 1 muestra los tratamientos sistémicos recibidos previamente a la inclusión en BIOBADATOP. El 20% no han recibido ningún sistémico previo. Respecto a los tratamientos previos más utilizados, se recoge el uso de ciclosporina en más del 50% y los corticosteroides orales en el 49%. Le sigue a distancia metotrexato, con algo más del 20% de uso previo.
El 44,3% habían sido tratados con fototerapia, siendo la ultravioletaB de banda estrecha (UVB-BE) la más común. La mayoría (97,4%) había recibido corticoides tópicos, y el 44,3%, inhibidores de la calcineurina tópicos.
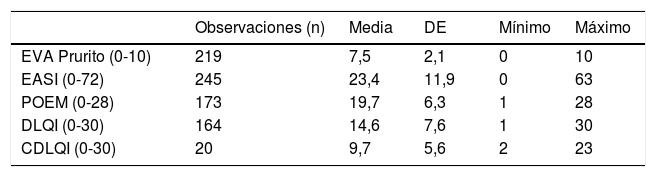
Datos de las visitas inicial y de seguimientoEn la visita inicial, la gravedad media de la DA medida por el EASI fue de 23,4 (DE=11,9, rango de 0 a 63). La calidad de vida se registró de acuerdo al POEM (media de 19,7, DE=6,3), al DLQI en mayores de 15años (media de 14,6, DE=7,6) y el Children's Dermatology Life Quality Index (CDLQI) en pacientes de 4-15años (media de 9,7; DE=5,6). La tabla 4 recoge las puntuaciones basales para los principales desenlaces de interés.
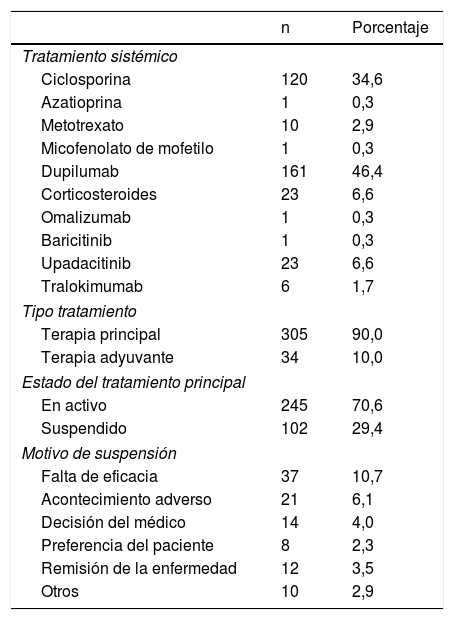
Respecto a los tratamientos iniciados, hasta la fecha se han registrado 347 tratamientos sistémicos, siendo su distribución la que aparece en la tabla 5. Prácticamente todos (90%) se han administrado como tratamiento principal. Se han suspendido el 29,4% de los tratamientos iniciados, principalmente por falta de eficacia (10,7%).
Tratamientos sistémicos iniciados (visita inicial o de inclusión en BIOBADATOP)
| n | Porcentaje | |
|---|---|---|
| Tratamiento sistémico | ||
| Ciclosporina | 120 | 34,6 |
| Azatioprina | 1 | 0,3 |
| Metotrexato | 10 | 2,9 |
| Micofenolato de mofetilo | 1 | 0,3 |
| Dupilumab | 161 | 46,4 |
| Corticosteroides | 23 | 6,6 |
| Omalizumab | 1 | 0,3 |
| Baricitinib | 1 | 0,3 |
| Upadacitinib | 23 | 6,6 |
| Tralokimumab | 6 | 1,7 |
| Tipo tratamiento | ||
| Terapia principal | 305 | 90,0 |
| Terapia adyuvante | 34 | 10,0 |
| Estado del tratamiento principal | ||
| En activo | 245 | 70,6 |
| Suspendido | 102 | 29,4 |
| Motivo de suspensión | ||
| Falta de eficacia | 37 | 10,7 |
| Acontecimiento adverso | 21 | 6,1 |
| Decisión del médico | 14 | 4,0 |
| Preferencia del paciente | 8 | 2,3 |
| Remisión de la enfermedad | 12 | 3,5 |
| Otros | 10 | 2,9 |
De los 258 pacientes incluidos, 232 (89,9%) están en seguimiento activo con fármaco sistémico, y 15 (5,8%) están en seguimiento sin fármaco sistémico activo por haberlo suspendido. En 11 (4,3%) se ha producido una pérdida de seguimiento.
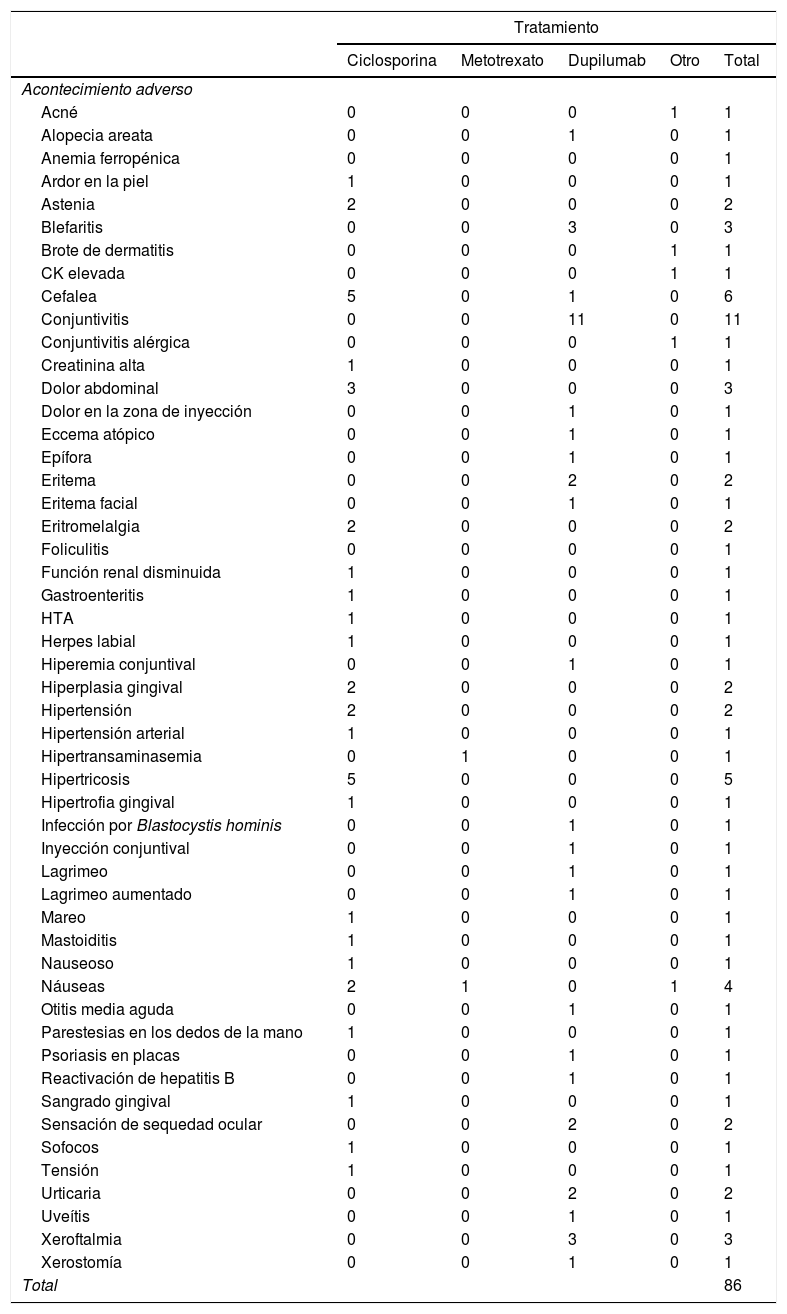
Descripción de acontecimientos adversosDurante el período de seguimiento se han registrado 132AA, siendo 7 de ellos (5,3%) considerados graves. Del total de 132AA, el 65% (86) se han relacionado con el agente iniciado, siendo los más frecuentes dupilumab (39AA) y ciclosporina (38AA). Los AA más frecuentes fueron: conjuntivitis (11casos), cefalea (6), hipertricosis (5) y náuseas (4). Debido al escaso número de AA registrados hasta el momento, no es posible realizar el cálculo de tasas de incidencias de acuerdo a la terminología MedDRA. En la tabla 6 se presenta la distribución de los AA relacionados por fármaco. Solo un caso ha sido grave y relacionado con ciclosporina: una mastoiditis aguda que motivó ingreso hospitalario, con resolución completa y retirada definitiva de ciclosporina.
Acontecimientos adversos completados relevantes (relacionados con un fármaco iniciado)
| Tratamiento | |||||
|---|---|---|---|---|---|
| Ciclosporina | Metotrexato | Dupilumab | Otro | Total | |
| Acontecimiento adverso | |||||
| Acné | 0 | 0 | 0 | 1 | 1 |
| Alopecia areata | 0 | 0 | 1 | 0 | 1 |
| Anemia ferropénica | 0 | 0 | 0 | 0 | 1 |
| Ardor en la piel | 1 | 0 | 0 | 0 | 1 |
| Astenia | 2 | 0 | 0 | 0 | 2 |
| Blefaritis | 0 | 0 | 3 | 0 | 3 |
| Brote de dermatitis | 0 | 0 | 0 | 1 | 1 |
| CK elevada | 0 | 0 | 0 | 1 | 1 |
| Cefalea | 5 | 0 | 1 | 0 | 6 |
| Conjuntivitis | 0 | 0 | 11 | 0 | 11 |
| Conjuntivitis alérgica | 0 | 0 | 0 | 1 | 1 |
| Creatinina alta | 1 | 0 | 0 | 0 | 1 |
| Dolor abdominal | 3 | 0 | 0 | 0 | 3 |
| Dolor en la zona de inyección | 0 | 0 | 1 | 0 | 1 |
| Eccema atópico | 0 | 0 | 1 | 0 | 1 |
| Epífora | 0 | 0 | 1 | 0 | 1 |
| Eritema | 0 | 0 | 2 | 0 | 2 |
| Eritema facial | 0 | 0 | 1 | 0 | 1 |
| Eritromelalgia | 2 | 0 | 0 | 0 | 2 |
| Foliculitis | 0 | 0 | 0 | 0 | 1 |
| Función renal disminuida | 1 | 0 | 0 | 0 | 1 |
| Gastroenteritis | 1 | 0 | 0 | 0 | 1 |
| HTA | 1 | 0 | 0 | 0 | 1 |
| Herpes labial | 1 | 0 | 0 | 0 | 1 |
| Hiperemia conjuntival | 0 | 0 | 1 | 0 | 1 |
| Hiperplasia gingival | 2 | 0 | 0 | 0 | 2 |
| Hipertensión | 2 | 0 | 0 | 0 | 2 |
| Hipertensión arterial | 1 | 0 | 0 | 0 | 1 |
| Hipertransaminasemia | 0 | 1 | 0 | 0 | 1 |
| Hipertricosis | 5 | 0 | 0 | 0 | 5 |
| Hipertrofia gingival | 1 | 0 | 0 | 0 | 1 |
| Infección por Blastocystis hominis | 0 | 0 | 1 | 0 | 1 |
| Inyección conjuntival | 0 | 0 | 1 | 0 | 1 |
| Lagrimeo | 0 | 0 | 1 | 0 | 1 |
| Lagrimeo aumentado | 0 | 0 | 1 | 0 | 1 |
| Mareo | 1 | 0 | 0 | 0 | 1 |
| Mastoiditis | 1 | 0 | 0 | 0 | 1 |
| Nauseoso | 1 | 0 | 0 | 0 | 1 |
| Náuseas | 2 | 1 | 0 | 1 | 4 |
| Otitis media aguda | 0 | 0 | 1 | 0 | 1 |
| Parestesias en los dedos de la mano | 1 | 0 | 0 | 0 | 1 |
| Psoriasis en placas | 0 | 0 | 1 | 0 | 1 |
| Reactivación de hepatitis B | 0 | 0 | 1 | 0 | 1 |
| Sangrado gingival | 1 | 0 | 0 | 0 | 1 |
| Sensación de sequedad ocular | 0 | 0 | 2 | 0 | 2 |
| Sofocos | 1 | 0 | 0 | 0 | 1 |
| Tensión | 1 | 0 | 0 | 0 | 1 |
| Urticaria | 0 | 0 | 2 | 0 | 2 |
| Uveítis | 0 | 0 | 1 | 0 | 1 |
| Xeroftalmia | 0 | 0 | 3 | 0 | 3 |
| Xerostomía | 0 | 0 | 1 | 0 | 1 |
| Total | 86 | ||||
BIOBADATOP representa una iniciativa emprendida por la AEDV con el fin de aportar información tanto clínico-epidemiológica, de farmacovigilancia y de efectividad en DA moderada-grave, tanto de los tratamientos sistémicos clásicos como de los de reciente introducción, en un momento clave en la historia de la enfermedad. En este primer informe describimos el estado actual y las características principales de la población incluida.
La mayoría de pacientes que inician un tratamiento sistémico en nuestro medio sufren DA grave, en términos de signos, pero también en gravedad del prurito e impacto en la calidad de vida, aspectos que, a pesar de reconocerse como fundamentales en la toma de decisiones para médicos y pacientes, no forman parte de los criterios de reembolso de los nuevos fármacos. A pesar de la heterogeneidad clínica de la DA, casi todos los pacientes incluidos presentan una dermatitis flexural, y es muy frecuente la afectación de áreas con mayor impacto y dificultad terapéutica, como es la afectación facial, palpebral, genital y el eccema de manos. Las comorbilidades atópicas, como el asma, están presentes en una gran proporción de pacientes. También lo están otras comorbilidades, especialmente las alteraciones del estado de ánimo.
Dupilumab fue aprobado por la Agencia Europea del Medicamento en septiembre de 2017. Posteriormente fue aprobado baricitinib, seguido de tralokinumab y upadacitinib. El agente moderno más empleado en el momento actual en los hospitales españoles que participan en el registro es dupilumab, algo que se explica, al menos en parte, por su aprobación más temprana respecto al resto. Esto tiene consecuencias en cuanto a la mayor familiaridad de uso del fármaco, con un mayor tiempo de prescripción y, por tanto, un mayor conocimiento de su comportamiento a largo plazo en la práctica clínica. Por otro lado, existen otros factores que podrán influir en la mayor o menor prescripción de determinados fármacos, como es el diferente acceso a su autorización o uso en primera línea según la normativa de cada comunidad autónoma.
Aunque el registro incluye pacientes pediátricos y adultos, la media de edad de los sujetos incluidos se sitúa en la tercera década de la vida. Esto está probablemente influido, de un lado, por el hecho de que muchos de los investigadores participantes son responsables de unidades de DA donde se atienden, sobre todo, casos moderados-graves del adulto, con menor representación de centros de referencia pediátricos. Por otro lado, la aprobación de las nuevas terapias ha sido posterior en niños y dispar entre los distintos fármacos.
En este primer informe del registro la descripción de AA es limitada, dado que los cortos periodos de seguimiento no permiten un cálculo preciso de tasas ni hacer comparaciones, describiéndose solo frecuencias que no tienen en cuenta el tiempo de exposición a cada fármaco. Así, se describe un mayor número de AA con dupilumab y con ciclosporina, los fármacos más usados. A pesar de dicha limitación, no se han registrado AA graves en relación con las nuevas terapias sistémicas hasta el momento del análisis. Se ha detectado, en cambio, un caso de infección grave (mastoiditis) en relación con ciclosporina, así como otros AA no graves, aunque relativamente frecuentes, incluyendo la cefalea, la hipertricosis y la hiperplasia y el sangrado gingival.
De la cohorte de nuevos tratamientos, disponemos de un mayor número de datos de dupilumab. Entre los AA más frecuentes destaca la aparición de conjuntivitis y otros AA de la superficie ocular, como blefaritis y xeroftalmia, y se ha registrado un único caso de eritema facial. Estos hallazgos son consistentes con los datos de seguridad del fármaco en vida real descritos recientemente y no se han detectado nuevas alertas de seguridad en nuestro registro10,11.
Algunos de los AA más importantes, como el riesgo de cáncer u otros potenciales AA graves, son demasiado infrecuentes como para poder describirlos adecuadamente en registros nacionales, lo que hace necesario combinar los datos de los registros de varios países. Este registro está directamente relacionado con TREAT Europe y utiliza un protocolo europeo estándar, similar al que siguen Reino Unido, Países Bajos, Alemania y otros países europeos, de modo que la colaboración permitirá aumentar la potencia estadística para los AA menos frecuentes. Alemania (TREATgermany)12 o Dinamarca (SCRATCH)13 han publicado datos de sus respectivos registros, y la TREAT Registry Taskforce también ha publicado el estado actual de los 8 registros que participan, incluido BIOBADATOP, con un total de 4.702 pacientes reclutados hasta mayo de 202214.
Nos encontramos ante un cambio importante en el tratamiento de la DA15. Hasta hace muy poco, el manejo de los pacientes refractarios a tratamiento tópico y/o fototerapia había dependido del uso de ciclosporina, así como del uso, fuera de indicación, de otros inmunosupresores, como metotrexato o azatioprina. Así lo refleja el antecedente previo de tratamiento con uno o varios inmunosupresores clásicos, y la elevada utilización de corticoides. Aunque los datos de los ensayos clínicos de las nuevas terapias sugieren un perfil de seguridad adecuado, será esencial conocer su comportamiento en pacientes no seleccionados.
Este registro permitirá generar conocimiento en términos de farmacovigilancia y efectividad de los tratamientos en nuestra práctica clínica, lo que nos ofrecerá una mejor comprensión de la DA moderada-grave y nos ayudará a mejorar el abordaje terapéutico de nuestros pacientes.
FinanciaciónEl proyecto BIOBADATOP se promueve por la Fundación Piel Sana de la Academia Española de Dermatología y Venereología, que recibe apoyo económico de empresas farmacéuticas (Sanofi, AbbVie, Pfizer y LEO Pharma). Las compañías farmacéuticas colaboradoras no se involucraron de ninguna manera en lo siguiente: el diseño y ejecución del estudio; la recopilación, gestión, análisis e interpretación de datos; la preparación, revisión y aprobación del manuscrito; la decisión de enviar el manuscrito para su publicación.
Conflicto de interesesM. Munera-Campos ha recibido honorarios por asesoría científica, presentaciones u otras actividades relacionadas de Abbvie, LEO Pharma, Janssen, Sanofi y Galderma, y ha participado como investigadora principal y subinvestigadora en ensayos clínicos: Lilly, LEO Pharma, Novartis, Janssen, Sanofi, Pfizer, AbbVie, Almirall, UCB y Galderma. P. Chicharro ha participado en consultorías, coloquios y ensayos clínicos organizados por las siguientes compañías: Janssen Pharmaceuticals, Almirall, Sanofi Genzyme, Lilly, AbbVie, Novartis, LEO Pharma y Pfizer-Wyeth. A. González Quesada ha participado como consultor, ponente y en ensayos clínicos de AbbVie, Pfizer, Novartis, Sanofi, Boeringher, Bristol-Meyer, Leo Pharma y Jansen. Á. Flórez Menéndez ha realizado ensayos clínicos y actuado como conferenciante y consultora para Abbvie, Almirall, Amgen, Janssen, LEO Pharma, Lilly, Novartis, Pfizer, Sanofi, y UCB Pharma. P. de la Cueva Dobao ha participado como asesor y/o investigador y/o ponente de: AbbVie, Almirall, BMS, Boehringer, Celgene, Janssen, LEO Pharma, Lilly, MSD, Novartis, Pfizer, Roche, Sanofi, UCB. A. M. Gimenez-Arnau ha participado como Medical Advisor para Uriach Pharma / Neucor, Genentech, Novartis, FAES, GSK, Sanofi-Regeneron, Amgen, Thermo Fisher Scientific, Almirall, Celldex y LEO Pharma. Y. Gilaberte-Calzada ha participado como asesora de Isdin y Roche Posay, Galderma, en conferencias para Almirall, Sanofi, Avene, Rilastil, Lylly, Uriage, Novartis, Cantabria Labs, y ha participado en proyectos de investigación de Almirall, Sanofi, Pfizer, AbbVie y LEO Pharma. M. Rodríguez Serna ha participado en asesorías para Sanofi, Pfizer, Leo, Novartis y Abbie. M. Elosua-González ha participado como investigadora y/o ponente para AbbVie, Lilly, Galderma, LEO Pharma, Pfizer, UCB Pharma y Sanofi Genzyme. E. del Alcázar ha participado como ponente y/o investigadora principal y/o subinvestigadora en ensayos clínicos para Amgen, Almirall, Janssen, Lilly, LEO Pharma, Novartis, UCB y AbbVie. A. Batalla ha participado en la realización de actividades de formación y asistencia a cursos y congresos para AbbVie, Celgene, Faes Farma, Isdin, Janssen, Leopharma, Lethipharma, Lilly, Mylan, Novartis, Pierre Fabre y Sanofi. Ha participado como subinvestigadora de ensayos clínicos promovidos por AbbVie, Celgene, LEO Pharma, Lilly, Novartis, Pfizer y Sanofi y en actividades de consultoría de Abbvie y Sanofi. H. Jin Suh Oh ha recibido financiación para actividades formativas y ha actuado como consultor y/o participado en ensayos clínicos para AbbVie, Celgene, Faes Farma. C. Mauleón Fernández ha participado en ensayos clínicos en dermatitis atópica para Leo Pharma y Sanofi. L. Curto Barredo ha recibido honorarios como ponente y asesora de Novartis, Sanofi, AbbVie, Lilly, Leo Pharma y Menarini, y ha participado como investigadora principal y/o subinvestigadora en proyectos de investigación/ensayos clínicos para Sanofi, Amgen, Almirall, Lilly, LEO Pharma, Novartis, AbbVie y Pfizer. G. Roustan Gullón ha recibido honorarios por asesoría y formaciones de Sanofi, AbbVie, Lilly, Pfizer y LEO Pharma. A. Rosell Díaz ha recibido honorarios como ponente para Sanofi y Leo Pharma, y ha participado como subinvestigador en estudios de Sanofi y Pfizer. I. García-Doval ha recibido soporte económico para congresos de AbbVie, MSD, Pfizer y Sanofi. J.M. Carrascosa ha participado como investigador principal/subinvestigador y/o recibido honorarios como ponente y/o miembro de comité de expertos o steering comitee para AbbVie, Novartis, Janssen, Lilly, Sandoz, Amgen, Almirall, BMS, Boehringer ingelheim, Biogen, UCB. El resto de los autores declara no tener ningún conflicto de intereses.
Queremos destacar y agradecer la dedicación de todos los investigadores en BIOBADATOP, y el esfuerzo que supone la recogida detallada de AA y otros datos relevantes en la práctica clínica, en ámbitos clínicos asistenciales en los que los recursos, tanto en tiempo como económicos, para esta actividad proceden casi siempre de los propios generados por los servicios de dermatología a partir de otras actividades.