La introducción de la inmunoterapia ha supuesto un gran avance en el manejo de los pacientes con carcinoma de células de Merkel (CCM) metastásico. Realizamos un estudio observacional retrospectivo de 14 casos de CCM metastásico tratados con avelumab. La tasa de respuesta fue de 57%, con una completa de 29% y otra parcial de 29%. El fármaco fue efectivo en 83% (5/6) de los sujetos que presentaron una única localización metastásica, pero la enfermedad progresó en 75% (3/4) de aquellos con metástasis óseas. No se detectaron efectos adversos graves en ninguno. No se relacionaron la expresión de PD1-L, la presencia de poliomavirus del CCM (MCPyV), ni la alteración del índice neutrófilo-linfocito (INL) con la respuesta al tratamiento. El avelumab es efectivo y seguro en el CCM en estadios avanzados, con una posible influencia del número y la localización de las metástasis en su efectividad.
The arrival of immunotherapy has revolutioned the management of patients with metastatic Merkel cell carcinoma (MCC). We conducted an observational, retrospective study of 14 cases treated with avelumab. The response rate was 57%: complete response was reached in 29% of patients, and partial responses in 29%. The drug proved effective in 83% (5/6) of the patients with a single metastatic site. However, the disease progressed in 75% (3/4) of the patients with bone metastases. PD1-L expression, MCC polyomavirus (MCPyV) positivity, and an impaired neutrophil-to-lypmhocyte ratio (NLR) could not be associated with responses to the therapy. Avelumab is an effective and safe drug for the management of advanced MCC, and its effectiveness appears to be impacted by the number and location of metastases.
El carcinoma de células de Merkel (CCM) es una neoplasia agresiva y poco frecuente que afecta principalmente a pacientes ancianos y/o inmunodeprimidos1. A pesar de representar menos de 1% de los tumores cutáneos malignos, el CCM constituye la tercera causa de muerte por cáncer de piel, por detrás del melanoma y del carcinoma epidermoide2,3. Los ensayos clínicos con los inhibidores del punto de control inmunitario (ICI) han mostrado actividad clínica y respuesta duraderas en sujetos con CCM avanzado4–6. El avelumab, un anticuerpo monoclonal humano anti PD-L1, es actualmente el único fármaco inmunoterápico aprobado por la agencia europea del medicamento (EMA) para el tratamiento del CCM metástasico4,6. A pesar de los buenos resultados de los ensayos, la experiencia en práctica clínica real es aún limitada, y muchos de los factores predictores de respuesta son todavía desconocidos7. El índice neutrófilo-linfocito (INL), cuyo valor predictivo es conocido en otros tumores, se ha identificado como un factor pronóstico independiente en el CCM8. Este se asoció a la respuesta a la inmunoterapia en el trabajo de Zaragoza et al., y parece que su modificación tras el inicio de esta sería también pronóstica en otros tumores8–10. Realizamos el presente estudio con el objetivo de describir la experiencia en vida real del uso de avelumab en el tratamiento del CCM metastásico en un centro monográfico oncológico.
MétodoSe realizó un estudio observacional y retrospectivo incluyendo a todos los pacientes con CCM metastásico tratados con avelumab en el Instituto Valenciano de Oncología (IVO), desde el 1 de enero de 2018 hasta el 15 de marzo de 2023, incluyéndose un total de 14. El avelumab se administró por vía intravenosa a la dosis de 10mg/kg cada dos semanas, manteniéndose hasta la progresión de la enfermedad o toxicidad inaceptable (efectos adversos graves y permanentes)4. Durante el tratamiento se llevó a cabo seguimiento clínico y de laboratorio incluyendo recuento y análisis bioquímico cada dos semanas, así como estudios radiológicos periódicos (tomografía axial computarizada [TAC] y/o tomografía por emisión de positrones [PET/TC]) cada tres a cinco meses. Se definió la respuesta según los criterios de evaluación del hallazgo en tumores sólidos RECIST versión 1.1 (Anexo 1)5. El resto de los parámetros evaluados incluyó la supervivencia global (SG), los efectos adversos y el análisis de biomarcadores (poliomavirus de células de Merkel [MCPyV], PD-L1, INL). Se calculó el INL previo al inicio de la inmunoterapia y seis semanas después, siguiendo el trabajo de Suh et al.10 y utilizando como referencia los valores de estudios previos (INL ≥ 4)8. Se realizó un análisis estadístico descriptivo de los datos con el programa IBM Statistical Package for the Social Sciences (SPSS) 25.0, así como un análisis inferencial univariado mediante la f de Fisher (fig. 1).
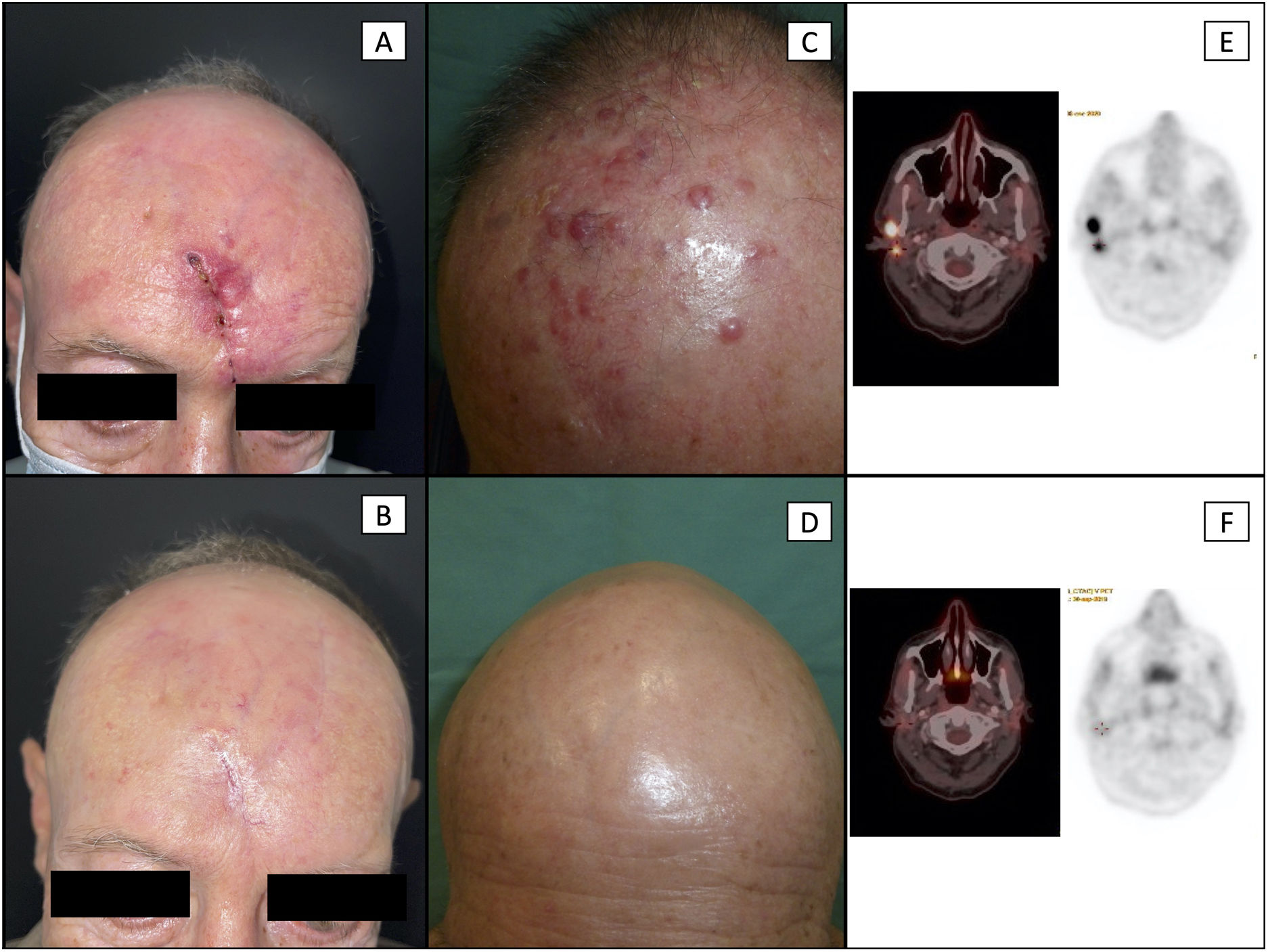
Paciente 6 (a-b): recidiva local en el área de la cicatriz de CCM intervenido quirúrgicamente previamente. En la imagen A se observa una piel de aspecto infiltrado, de color eritematoso en los alrededores de la cicatriz (el sujeto también presentó afectación ganglionar loco-regional). La recidiva fue confirmada histológicamente. En la imagen B se observa la desaparición total de las lesiones previas, con cierre completo de la cicatriz y ausencia de lesiones de CCM, tras el tratamiento de cinco ciclos de avelumab.
Paciente 2 (c-d): recidiva loco-regional en forma de satelitosis múltiples en paciente con antecedente de CCM primario localizado en el cuero cabelludo. En la imagen C se observan múltiples pápulas y nódulos eritematovioláceos correspondientes a metástasis cutáneas locorregionales (también presentó afectación ganglionar locorregional). En la imagen D se observa la desaparición total de todas las lesiones cutáneas, tras el tratamiento con siete ciclos de avelumab acompañado de radioterapia loco-regional adyuvante.
Paciente 2 (e-f): comparativas de cortes axiales de imágenes PET/TC a nivel cervical. En la imagen E se aprecian dos lesiones nodulares, hipermetabólicas en la imagen PET, correspondientes a adenopatías metastásicas. En la imagen F se observa la desaparición de dichas lesiones, tras el tratamiento con siete ciclos de avelumab.
CCM: carcinoma de células de Merkel; PET/TC: tomografía por emisión de positrones.
Se incluyó un total de 14 sujetos (13 varones y una mujer) con una mediana de edad de 70 años. Solo la paciente presentaba antecedentes de inmunosupresión (leucemia linfática crónica). Las principales características clínicas y los datos del tratamiento se encuentran reflejados en la tabla 1. La localización más frecuente del tumor primario fueron la cabeza (seis) y los miembros inferiores (seis), siendo la mediana de tamaño tumoral de 3,75cm. La mayoría debutaron con estadio IIIB (afectación ganglionar macroscópica; ocho) y todos desarrollaron metástasis en menos de dos años tras el diagnóstico. La localización más frecuente de las metástasis fue la ganglionar (13), seguida de la cutánea (cinco).
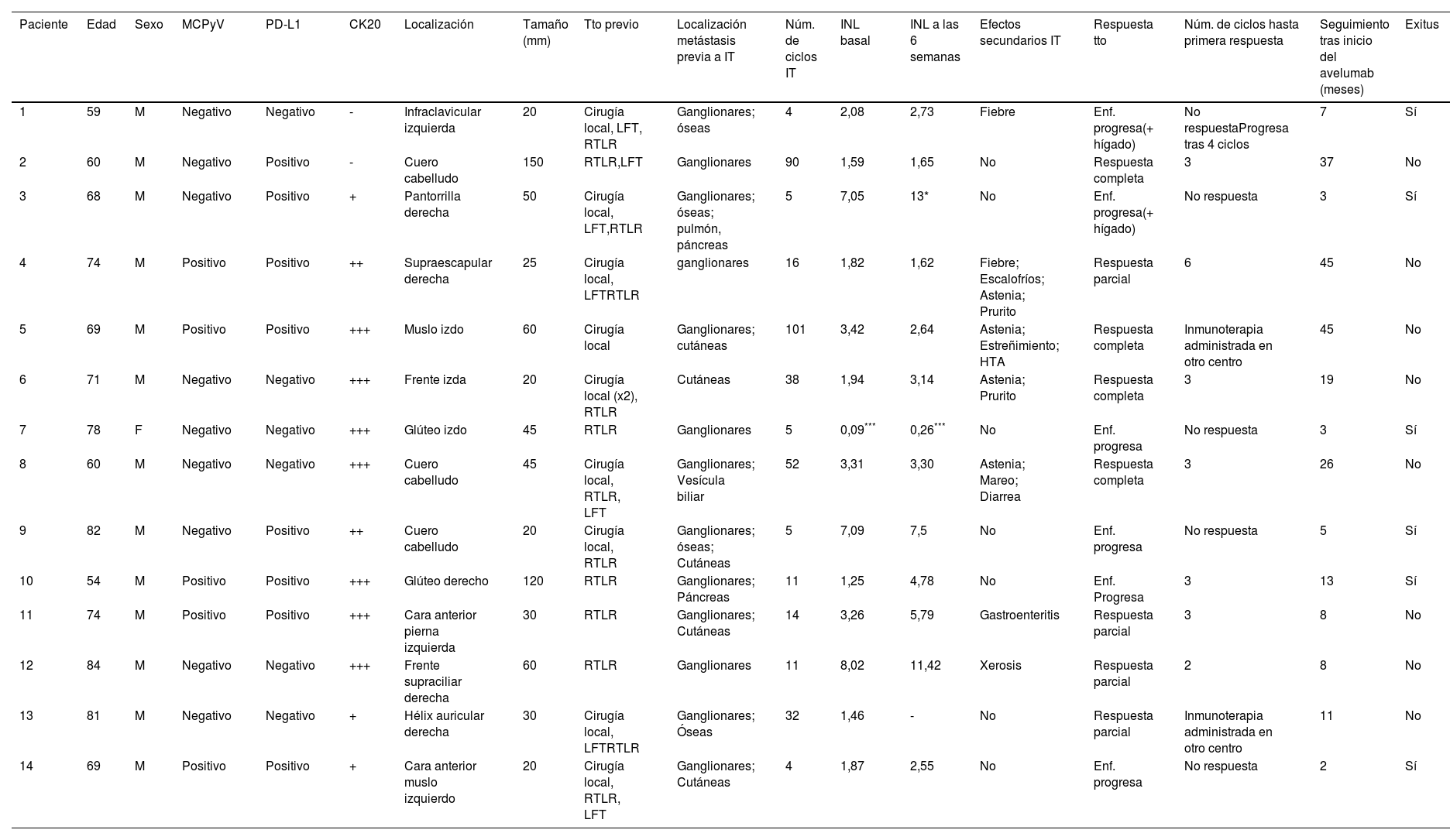
Principales características clínicas y del tratamiento
| Paciente | Edad | Sexo | MCPyV | PD-L1 | CK20 | Localización | Tamaño (mm) | Tto previo | Localización metástasis previa a IT | Núm. de ciclos IT | INL basal | INL a las 6 semanas | Efectos secundarios IT | Respuesta tto | Núm. de ciclos hasta primera respuesta | Seguimiento tras inicio del avelumab (meses) | Exitus |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 59 | M | Negativo | Negativo | - | Infraclavicular izquierda | 20 | Cirugía local, LFT, RTLR | Ganglionares; óseas | 4 | 2,08 | 2,73 | Fiebre | Enf. progresa(+ hígado) | No respuestaProgresa tras 4 ciclos | 7 | Sí |
| 2 | 60 | M | Negativo | Positivo | - | Cuero cabelludo | 150 | RTLR,LFT | Ganglionares | 90 | 1,59 | 1,65 | No | Respuesta completa | 3 | 37 | No |
| 3 | 68 | M | Negativo | Positivo | + | Pantorrilla derecha | 50 | Cirugía local, LFT,RTLR | Ganglionares; óseas; pulmón, páncreas | 5 | 7,05 | 13* | No | Enf. progresa(+ hígado) | No respuesta | 3 | Sí |
| 4 | 74 | M | Positivo | Positivo | ++ | Supraescapular derecha | 25 | Cirugía local, LFTRTLR | ganglionares | 16 | 1,82 | 1,62 | Fiebre; Escalofríos; Astenia; Prurito | Respuesta parcial | 6 | 45 | No |
| 5 | 69 | M | Positivo | Positivo | +++ | Muslo izdo | 60 | Cirugía local | Ganglionares; cutáneas | 101 | 3,42 | 2,64 | Astenia; Estreñimiento; HTA | Respuesta completa | Inmunoterapia administrada en otro centro | 45 | No |
| 6 | 71 | M | Negativo | Negativo | +++ | Frente izda | 20 | Cirugía local (x2), RTLR | Cutáneas | 38 | 1,94 | 3,14 | Astenia; Prurito | Respuesta completa | 3 | 19 | No |
| 7 | 78 | F | Negativo | Negativo | +++ | Glúteo izdo | 45 | RTLR | Ganglionares | 5 | 0,09*** | 0,26*** | No | Enf. progresa | No respuesta | 3 | Sí |
| 8 | 60 | M | Negativo | Negativo | +++ | Cuero cabelludo | 45 | Cirugía local, RTLR, LFT | Ganglionares; Vesícula biliar | 52 | 3,31 | 3,30 | Astenia; Mareo; Diarrea | Respuesta completa | 3 | 26 | No |
| 9 | 82 | M | Negativo | Positivo | ++ | Cuero cabelludo | 20 | Cirugía local, RTLR | Ganglionares; óseas; Cutáneas | 5 | 7,09 | 7,5 | No | Enf. progresa | No respuesta | 5 | Sí |
| 10 | 54 | M | Positivo | Positivo | +++ | Glúteo derecho | 120 | RTLR | Ganglionares; Páncreas | 11 | 1,25 | 4,78 | No | Enf. Progresa | 3 | 13 | Sí |
| 11 | 74 | M | Positivo | Positivo | +++ | Cara anterior pierna izquierda | 30 | RTLR | Ganglionares; Cutáneas | 14 | 3,26 | 5,79 | Gastroenteritis | Respuesta parcial | 3 | 8 | No |
| 12 | 84 | M | Negativo | Negativo | +++ | Frente supraciliar derecha | 60 | RTLR | Ganglionares | 11 | 8,02 | 11,42 | Xerosis | Respuesta parcial | 2 | 8 | No |
| 13 | 81 | M | Negativo | Negativo | + | Hélix auricular derecha | 30 | Cirugía local, LFTRTLR | Ganglionares; Óseas | 32 | 1,46 | - | No | Respuesta parcial | Inmunoterapia administrada en otro centro | 11 | No |
| 14 | 69 | M | Positivo | Positivo | + | Cara anterior muslo izquierdo | 20 | Cirugía local, RTLR, LFT | Ganglionares; Cutáneas | 4 | 1,87 | 2,55 | No | Enf. progresa | No respuesta | 2 | Sí |
CK20: citoqueratina 20; Enf.: enfermedad; F: femenino; IT: inmunoterapia; LFT: linfadenectomía; M: masculino; MCPyV: poliomavirus de células de Merkel; tto: tratamiento; RTL/RTLR: radioterapia local/locorregional; -: negativa; +: débil, ++: moderada; +++: intensa.
Todos los pacientes recibieron avelumab como tratamiento de primera línea. Se les administró una mediana de 12,5 ciclos (de cuatro a 101). Un total de ocho (57%) respondieron al avelumab, cuatro de ellos (29%) alcanzaron la respuesta completa de las lesiones, y en los otros cuatro (29%) esta fue parcial. Los sujetos respondedores recibieron una mediana de 33 ciclos. Actualmente, todos los respondedores continúan en tratamiento con avelumab, salvo el caso del cuarto, a quien se le retiró la medicación tras 16 ciclos por progresión de la enfermedad (el paciente ha recibido posteriormente seis periodos de quimioterapia con cisplatino-etopósido, con buena tolerancia y alcanzando una respuesta completa duradera con el esquema citotóxico, manteniéndose libre de enfermedad cuatro años y seis meses después del diagnóstico del tumor primario). El fármaco se suspendió ante la progresión tumoral durante el tratamiento en los otros seis sujetos: todos fallecieron a consecuencia de la enfermedad. La mediana de SG fue de 9,5 meses (rango 2-46), y en los respondedores esta fue de 19.
De los pacientes que recibieron avelumab, 50% no presentaron ninguna reacción adversa, y la mayoría de las que aparecieron fueron leves (G1) (tabla 1). Los efectos secundarios más comunes fueron la astenia, el prurito y la diarrea. Solo uno tuvo que suspender la terapia debido a una colitis inmunomediada tras 16 ciclos (G2), resuelta después de tratamiento con corticoides orales, con posterior reintroducción y tolerancia de este.
La expresión inmunohistoquímica del MCPyV fue positiva en cinco casos, y la de PD-L1 en ocho. Ninguno de los dos parámetros pareció guardar relación con la respuesta al tratamiento. Finalmente, tres pacientes tuvieron un INL elevado: dos de ellos mostraron enfermedad rápidamente progresiva, sin respuesta al avelumab. El tercero presentó, por ahora, una respuesta parcial al fármaco. Ninguno de los sujetos con respuesta completa tuvo un INL alterado. No se pudo relacionar de manera estadísticamente significativa la presencia de un INL alterado y la ausencia de respuesta al tratamiento. No se encontraron variaciones significativas entre el INL basal y a las seis semanas de inicio de la terapia (tabla 1).
DiscusiónEl CCM es uno de los tumores cutáneos más agresivos, con unas tasas de SG a los cinco años que oscilan entre 40 y 60% en los pacientes con afectación nodal, y entre 10 y 20% en aquellos con enfermedad metastásica visceral11,12. Antes del desarrollo de la inmunoterapia, el tratamiento de esta patología se fundamentaba en la quimioterapia basada en platinos6,7,13. A pesar de unas tasas de respuesta objetiva (ORR) a la quimioterapia como tratamiento de primera línea relativamente altas (entre 50-70%), estas eran de corta duración, siendo la mediana de duración de la respuesta de entre tres y ocho meses, sin demostrar beneficio en la SG5,11,13–15.
En los ensayos clínicos que condujeron a su aprobación, el avelumab demostró una ORR de 33% cuando se utilizó como tratamiento de segunda línea después de quimioterapia5,14, y de 39,7% cuando se empleó como primera línea15. Tras la aprobación del fármaco, se inició un programa de acceso ampliado en 38 países, que confirmó los datos de eficacia y seguridad del ensayo JAVELIN 200, con una ORR de 47%, sin nuevos eventos de seguridad detectables16. Además de los resultados de este programa ampliado, las publicaciones del uso de avelumab en práctica clínica real son aún escasas y consisten en cohortes de unas decenas de pacientes. Cowey et al.17 objetivaron una ORR de 64% como tratamiento de primera línea. Levy et al.18 encontraron una ORR de 57% en una cohorte de los Países Bajos, en la cual la mayoría recibieron avelumab como terapia de primera línea. Por último, Averbuch et al.19 obtuvieron una ORR de 59%, también en una mayoría de pacientes naive. Tanto en los estudios de vida real como en los clínicos, las respuestas se produjeron rápido, entre las siete y 10 semanas4,19. En nuestra serie, estas comenzaron a objetivarse entre los dos y seis primeros ciclos de tratamiento (es decir, cuatro y 12 semanas tras el inicio del tratamiento).
En nuestra serie, la ORR fue 57% similar a la del resto de cohortes de práctica clínica real, siendo en todos los casos superior a los resultados arrojados inicialmente por los estudios pivotales, habiéndose demostrado tanto en unos como en otros, tasas de respuesta a avelumab superiores cuando el fármaco es empleado en primera línea del escenario metastásico. Esto subraya la importancia de emplear la inmunoterapia como primera línea de tratamiento4,14,20. En los ensayos clínicos, la mediana de SG se situó entre 12 y 20 meses4,15, mientras que en las cohortes de práctica clínica real lo hizo entre 10 y 2517–19. En nuestra serie, la mediana de SG fue de 8,5 meses, destacando una de 22,5 en los pacientes respondedores. Estos datos son significativamente superiores a los de la quimioterapia convencional13,20.
Los efectos adversos más frecuentemente descritos en todas las publicaciones han sido grado 1-2, con una baja incidencia de efectos adversos graves (G3 y G4), que motivasen la suspensión del tratamiento4,14,15,17–21. En nuestra serie, el efecto adverso de mayor incidencia fue la astenia, que también está descrito como uno de los más frecuentes en la literatura7,21.
Hasta la fecha, los factores predictores de respuesta a la inmunoterapia con fármacos anti PD1/PD-L1 son mayoritariamente desconocidos22–24. Algunos estudios parecen indicar que la expresión de PD-L1 se asociaría a un mayor porcentaje de respuesta, pero esto no ha podido ser validado por otros trabajos1,4,6,15. Tanto los CCM MCPyV+como los MCPyV parecen responder de manera similar a estos fármacos1,6,19,24. Ninguno de estos dos factores se asoció a una mayor respuesta a avelumab en nuestra serie, encontrándose distribuidos de manera similar tanto en los pacientes respondedores como en los no respondedores. Por otro lado, el INL es un marcador interesante que, aunque se ha relacionado a un peor pronóstico en el CCM, no se lo ha hecho aún a su respuesta a la inmunoterapia24. No obstante, sí hay estudios que asocian este índice con la respuesta a la inmunoterapia en otros tumores sólidos8–10. En el presente trabajo no encontramos correspondencia entre la alteración de este índice y la respuesta a la inmunoterapia, aunque destaca que ninguno de los cuatro pacientes que mostraron una completa, y solo uno de los que la presentaron parcial, tuvieron un INL alterado (tabla 1). Probablemente, el pequeño tamaño muestral limite la posibilidad de encontrar una asociación estadística en esta serie. Tampoco hallamos variaciones significativas que pudieran relacionarse a la respuesta en el INL basal frente al calculado a las seis semanas.
Tres de los cuatro pacientes con metástasis óseas de nuestra serie no respondieron al fármaco, lo cual podría relacionar esta localización metastásica con una peor respuesta al tratamiento. Por otro lado, cinco de los seis con localización metastásica única respondieron al fármaco (todos salvo el caso del séptimo paciente, una mujer inmunodeprimida). En un estudio multicéntrico reciente, se identificaron la ausencia de inmunosupresión y la presencia de metástasis única como factores predictores de respuesta a avelumab, pero, hasta la fecha, ningún trabajo ha relacionado las metástasis óseas con una menor respuesta, a pesar de que estas sí se asocian a un peor pronóstico en otros tumores sólidos22. Por último, algunos estudios han relacionado la presencia de efectos adversos con una mayor probabilidad de respuesta, hecho que no hemos podido corroborar en nuestra serie6.
Las principales limitaciones de nuestra investigación, más allá de las inherentes a un estudio retrospectivo, son la falta de grupo control y el pequeño tamaño muestral.
ConclusiónEn el presente estudio observacional de vida real, el avelumab demostró ser efectivo y seguro para el tratamiento del CCM en la práctica clínica, y parece superar los datos de eficacia y seguridad presentados previamente en los ensayos clínicos. Aunque algunos trabajos sugieren la ausencia de inmunosupresión, la localización metastásica única, y la presencia de PDL-1 como factores predictores de respuesta a la inmunoterapia, ninguno de ellos se ha demostrado fehacientemente. En nuestra serie, la existencia de metástasis óseas, y de localización metastásica múltiple se asoció a una peor respuesta al tratamiento.
FinanciaciónNo se recibió ninguna fuente de financiación para realiza este trabajo.
Conflicto de interesesBLLC declara haber trabajado como consultor y haber recibido honorarios de Merck Amgen, Sanofi, Sunpharma y Roche.