En el campo de las anomalías vasculares, distinguir entre malformaciones vasculares y tumores vasculares se ha vuelto esencial para un enfoque terapéutico correcto. Sin embargo, el diagnóstico diferencial entre estos 2 grupos no está siempre correctamente explicado en los textos clásicos, principalmente porque a muchas malformaciones vasculares se las conoce todavía con nombres antiguos que sugieren tumores vasculares. Asimismo, el conocimiento genético y patogénico de estas entidades se ha incrementado notablemente en las décadas recientes, de tal manera que investigadores y clínicos tienen ahora una mejor comprensión de las malformaciones vasculares. En este artículo, presentamos las principales claves histopatológicas para reconocer las malformaciones vasculares e identificarlas como tal. También contextualizamos tal información en el conocimiento clínico y patogénico para mejor comprensión de estas entidades.
In the field of vascular anomalies, distinguishing between vascular malformations and tumors has become crucial for a correct therapeutic approach. However, the differential diagnosis between these two groups is not always well explained in classical texts, mainly because many vascular malformations are still known with old names that suggest a tumoral nature. Also, genetic and pathogenic knowledge of these entities has greatly increased in recent decades, so researchers and clinicians now have a better understanding of vascular malformations. In this paper, we present the main histopathological tips to recognize and identify a vascular malformation as such. We also contextualize such information in the clinical and pathogenic knowledge for a better understanding of these entities.
Durante mucho tiempo, las anomalías vasculares se han estudiado y descrito utilizando tanto nombres como conceptos acuñados en el siglo XIX, incluso muchos de ellos por el propio Virchow. Varios de esos nombres sugerían la presencia de tumores: hemangioma cavernoso, linfangioma, higroma quístico, linfangiomiomatosis y hemangioma cirsoide. A pesar de ser inadecuados, estos nombres se encuentran muchas veces en textos clásicos e incluso en la literatura reciente.
En la década de 1990, la clasificación de las anomalías vasculares propuesta por la Sociedad Internacional para el Estudio de las Anomalías Vasculares (ISSVA) realizó un aporte crucial: la división en 2 grandes grupos de anomalías vasculares, a saber, tumores y malformaciones vasculares (MV)1. Con el tiempo, las diferencias entre estos 2 grupos se demostraron sólidas y claras. Mientras que los tumores se consideraban crecimientos adquiridos proliferantes de vasos recién formados, las MV eran anomalías congénitas hechas de vasos dismórficos no proliferantes. De esta forma, esta nueva clasificación permitió el abordaje clínico y terapéutico de las anomalías vasculares. De hecho, los principios de la clasificación de la ISSVA han sido adoptados por la OMS en la clasificación de los tumores pediátricos publicada recientemente2.
Con el paso del tiempo, la comunidad internacional se dio cuenta de que ese enfoque dual no era tan apropiado como se esperaba. Por ejemplo, las MV de hecho proliferan3, aunque normalmente no tanto como los tumores vasculares. Entre las MV, las malformaciones linfáticas son las que presentan una mayor tasa de proliferación4, aunque, muy inferior a la observada en los tumores vasculares. Además, dado que la mayoría de las MV se deben a mutaciones somáticas poscigóticas, están formadas por células clonales5, lo que diluye la diferencia conceptual con los tumores.
No existe un marcador inmunohistoquímico universal que nos permita distinguir de forma fiable entre las MV y los tumores vasculares. Aunque se pensó que ciertos marcadores como el WT1 marcaban los tumores vasculares, más tarde se demostró que este marca áreas vasculares proliferativas «en general» y, por lo tanto, en ocasiones pueden expresarse en las MV6. El marcador GLUT-1 no se debe considerar como un marcador específico de tumores, ya que solo es expresado por las células endoteliales en el hemangioma infantil7, así como también en un subtipo de MV (la malformación venosa verrugosa)8.
A pesar de esto, muchos médicos, cirujanos e investigadores consideran que el enfoque dual sugerido por la ISSVA es útil y práctico, y es el que principalmente seguiremos en esta revisión. Nuestro objetivo es describir las principales características histopatológicas que pueden ayudar al dermatólogo y al patólogo general a identificar una MV como tal, así como a clasificarla en función del tipo de vasos identificados en ellas.
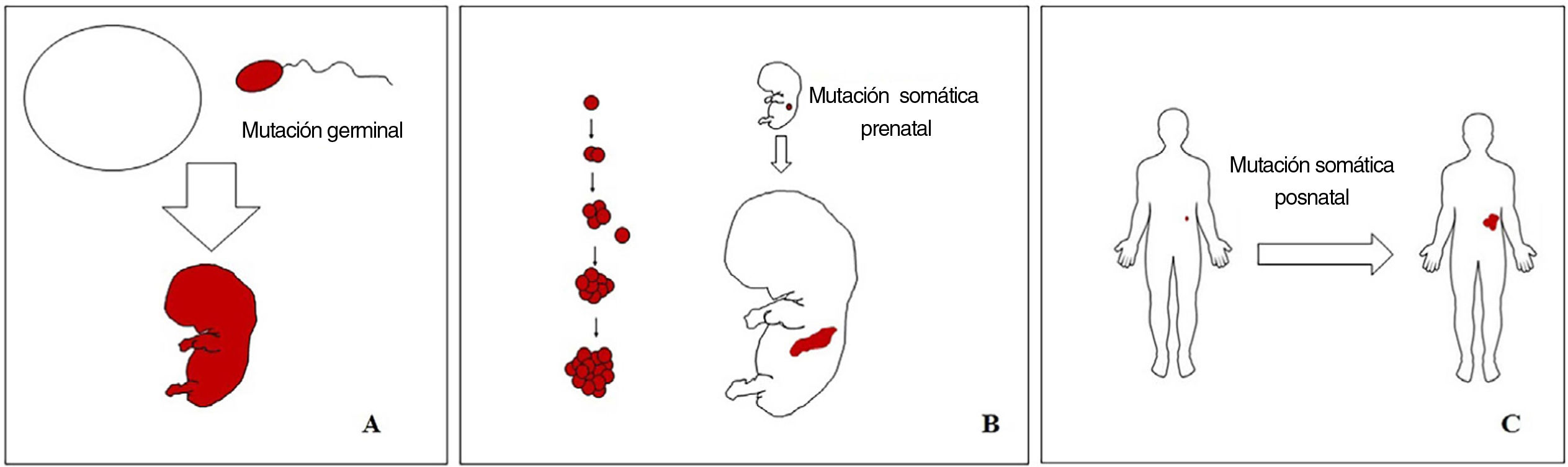
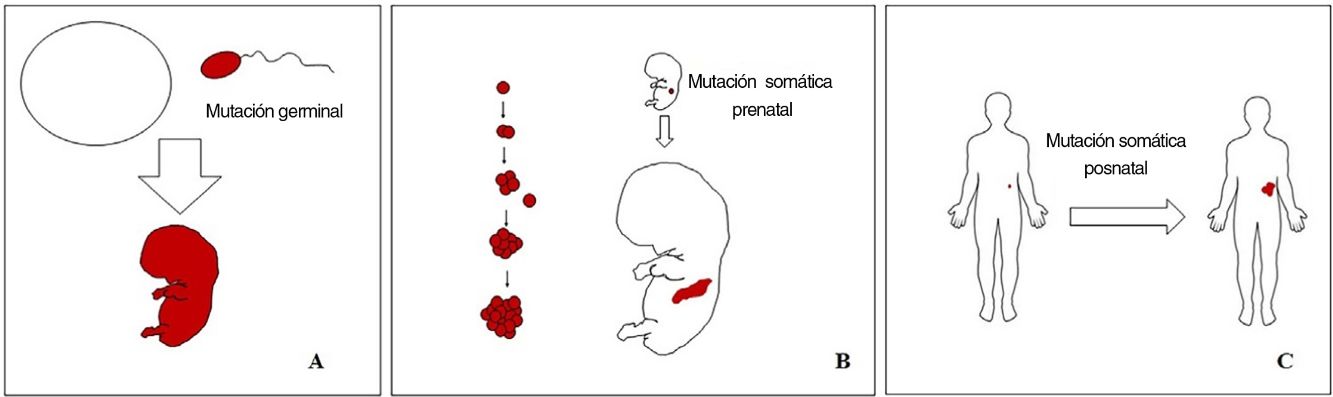
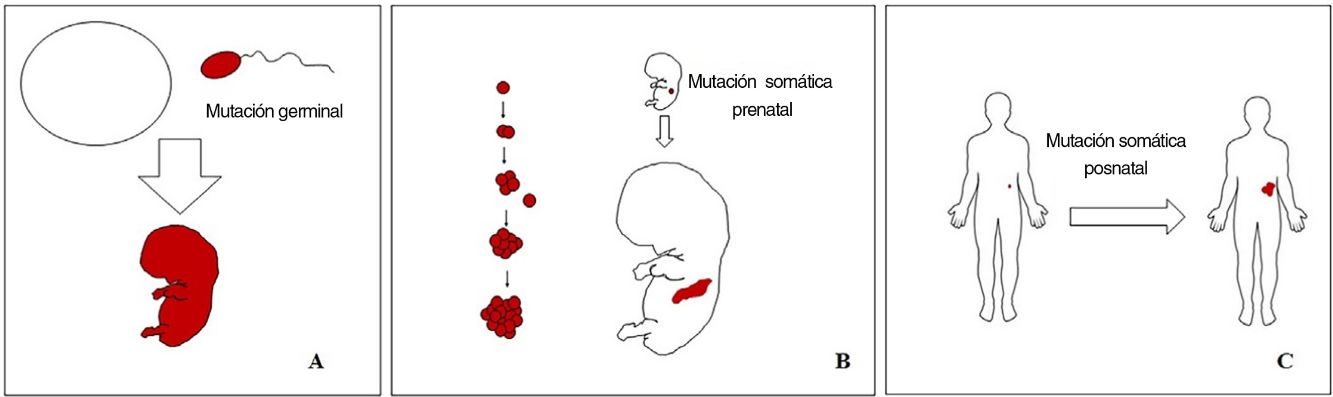
Conceptos básicos sobre las malformaciones vascularesLas malformaciones durante el desarrollo embriológico o fetal pueden ocurrir debido a mutaciones prenatales. Las mutaciones prenatales pueden ser germinales o somáticas (fig. 1). En una mutación germinal prenatal, la mutación ya está presente en la célula germinal (ya sea espermatozoide u óvulo). Por lo tanto, todas las células del individuo portarán la mutación (fig. 1A). En cambio, cuando ocurre una mutación somática prenatal, solo las células que se desarrollan a partir de la que ha sufrido la mutación portarán el defecto genético, desarrollando un mosaicismo. Dado que tales células mutadas siguen los patrones de crecimiento normales del desarrollo embriológico, la distribución de las células mutadas muchas veces adopta un patrón segmentario o lineal, siguiendo las líneas de Blaschko (fig. 1B). Por el contrario, en una mutación posnatal, las células que crecen a partir de las células mutadas se convierten en un tumor (fig. 1C).
Esquema de mutaciones prenatales y posnatales, y desarrollo de las malformaciones vasculares y los tumores. Las mutaciones prenatales pueden ser germinales (A) o somáticas (B). En el primer caso, todas las células del individuo portarán la mutación. En las mutaciones prenatales somáticas, por el contrario, solo las células desarrolladas después de la mutación portarán el defecto genético. Es por ello por lo que comúnmente se distribuyen de forma lineal o segmentaria, muchas veces siguiendo las líneas de Blaschko (B). Las mutaciones somáticas posnatales (C) producen principalmente tumores, que no suelen mostrar una distribución lineal.
Las MV son anomalías vasculares formadas por vasos dismórficos maduros. Estas características dismórficas son el resultado de mutaciones prenatales (principalmente somáticas, pero también, en ocasiones, de la línea germinal), por lo tanto, casi todas las MV son congénitas. Cuando las MV son causadas por mutaciones somáticas prenatales, deben considerarse un mosaicismo9 en el que todas las células de la MV portan la misma(s) mutación(es). Es bien sabido que algunas MV son el resultado de un «mecanismo de doble golpe» (del inglés double hit), en el que se produce una mutación posnatal somática en las células que ya portaban una mutación prenatal10,11. Los ejemplos más clásicos de malformaciones vasculares relacionadas con un «mecanismo de doble golpe» son las malformaciones glomulovenosas12 y las malformaciones arteriovenosas-capilares combinadas13. Por el contrario, los tumores vasculares son el resultado de mutaciones somáticas posnatales. Su morfología global es la de un tumor, sin una distribución lineal o segmentaria.
La mayoría de las MV son clínicamente evidentes en la infancia. Sin embargo, ese no es siempre el caso. A veces, una MV puede volverse clínicamente evidente solo cuando ocurren cambios secundarios (como trombosis o hemorragia)14.
Mientras que los tumores vasculares están formados por vasos proliferantes, las MV no proliferan o proliferan a un ritmo muy bajo. Esto no quiere decir que las MV no aumenten de tamaño con el paso del tiempo. Este aumento se debe a veces a la dilatación de los vasos malformados. Otras veces ocurren fenómenos trombóticos en los vasos de las MV15, acompañados o no de fenómenos hemorrágicos16. Por último, en algunos casos, las MV puede aumentar de tamaño debido a una tasa de proliferación lenta pero constante.
Uno de los conceptos más importantes en las MV es el del flujo sanguíneo17. Este se refiere a la velocidad del flujo sanguíneo a través de los vasos dismórficos de la MV y, por lo tanto, a la presión arterial en dichos vasos. Las MV de alto flujo serán las malformaciones y fístulas arteriovenosas. Además, aquellas MV combinadas que muestran un componente arteriovenoso suelen tener áreas de alto flujo. La distinción entre una MV de bajo flujo y una de alto flujo se puede realizar antes de la cirugía mediante ecografía o resonancia magnética dinámica18. El abordaje clínico y terapéutico de una MV dependerá en gran medida de la evidencia de áreas de alto flujo o no. Cuando en una malformación existe un alto riesgo de hemorragia, está indicada la terapia invasiva (endovascular, quirúrgica y/o radioterapia) versus el manejo médico solo. De lo contrario, el manejo médico puede ser una opción. Por otro lado, la escleroterapia o la cirugía es el tratamiento comúnmente indicado para las MV de bajo flujo, aunque algunas pueden controlarse con medicamentos19. En este sentido, la identificación de ciertas mutaciones en las MV es crucial para el éxito del tratamiento con terapia dirigida20,21.
Clasificación de las malformaciones vascularesSe ha intentado en varias ocasiones clasificar las anomalías vasculares. Una de las clasificaciones más completas es la de la ISSVA22. Dicha clasificación está disponible gratuitamente en la página web de la ISSVA (issva.org/classification).
Desde el punto de vista histopatológico, las malformaciones vasculares se clasifican según el tipo de vasos malformados. Por lo tanto, existen malformaciones capilares, linfáticas, venosas y arteriovenosas, pero también malformaciones combinadas. Además, el cuerpo glómico también puede tener malformaciones. Aunque morfológicamente distintas, estas malformaciones glomuvenosas se incluyen actualmente en el grupo de malformaciones venosas. Las malformaciones glomuvenosas no deben de ser confundidas con los tumores glómicos. Estos últimos son verdaderos tumores que aparecen en la vida adulta, y aunque también presentan estructuras venosas, estas últimas no están malformadas.
La clasificación actual de las malformaciones vasculares aceptada por el ISSVA se muestra en la tabla 1.
Tipos principales de malformaciones vasculares simples
| Capilares | Linfáticas | Venosas | Arteriovenosas |
|---|---|---|---|
| Nevus simple/mancha salmón, «beso del ángel», «picadura de cigüeña» | Quística:MacroquísticaMicroquísticaMixta | Común | Esporádica |
| Cutáneos y/o mucosos (también conocidos como mancha en «vino de Oporto»):No sindrómicoSíndrome de Sturge-WeberCon sobrecrecimiento óseo y/o de partes blandasPresentación difusa con sobrecrecimiento | Anomalía linfática generalizada que incluye la linfangiomiomatosis kaposiforme | Cutáneo-mucoso familiar | Telangiectasia hemorrágica hereditaria |
| Reticulados:Con microcefaliaCon megalencefalia | Enfermedad de Gorham-Stout | Síndrome del nevus azul en tetina de goma (Bean) | En malformación capilar |
| Cutis marmorata telangiectásica congénita | Tipo del canal | Malformación glomovenosaa | Fístula arteriovenosa congénita |
| Telangiectasia hemorrágica hereditaria | Progresivo «adquirido» (anteriormente conocida como linfangioma progresivo) | Cavernoso cerebral | |
| Linfedema primario | Intraóseo familiar | ||
| Verrugosa (antes hemangioma verrucoso) |
También existen varias formas combinadas de malformaciones, definidas como 2 o más tipos de malformaciones vasculares evidenciadas simultáneamente en una misma lesión (capilar+venosa; capilar+linfática; capilar+linfática+venosa …).
Cabe mencionar que algunas anomalías vasculares aún no han sido identificadas de forma clara como tumores o malformaciones, por lo que, quizás, algunas de ellas podrían incluirse en el futuro bajo la denominación de malformación vascular. Por ejemplo, los hemangiomas de tipo capilar intramuscular (también llamados anomalía vascular de flujo rápido intramuscular); los angioqueratomas; el hemangioma sinusoidal; el tumor arteriovenoso acral; la linfangioendoteliomatosis multifocal con trombocitopenia/angiomatosis cutaneovisceral con trombocitopenia; el hamartoma de tejido blando de tipo PTEN/«angiomatosis» de tejido blando; o la anomalía vascular fibroadiposa (FAVA).
Patogenia de las malformaciones vascularesLas alteraciones genéticas que ocurren durante la vida embrionaria inducen una disregulación en la vasculogénesis con el resultado de vasos dismórficos. Se han identificado genes causales en muchas MV. La tabla 1 muestra una lista de las alteraciones genéticas conocidas hasta el momento23. Las MV de alto flujo muestran anomalías de la vía de señalización celular Ras/MAPK. Por el contrario, las anomalías de flujo bajo más comunes (malformaciones venosas y linfáticas) están causadas por mutaciones somáticas que involucran genes de la vía PI3K/AKT/mTOR.
También se producen MV de novo, y su patogenia sigue siendo desconocida y altamente especulativa. La hipótesis más aceptada es que podrían necesitar mutaciones acumulativas, es decir, mutaciones somáticas posnatales que ocurren en células con una mutación prenatal en un mecanismo de doble golpe10,11.
Entidades anteriormente conocidas como tumores vasculares que actualmente se consideran como malformaciones vascularesAlgunos textos aún incluyen en sus capítulos de tumores vasculares entidades como el hemangioma cavernoso, el linfangioma circunscriptum, el higroma quístico o el hemangioma cirsoide. Estas entidades fueron reconocidas como malformaciones vasculares por la ISSVA hace mucho tiempo.
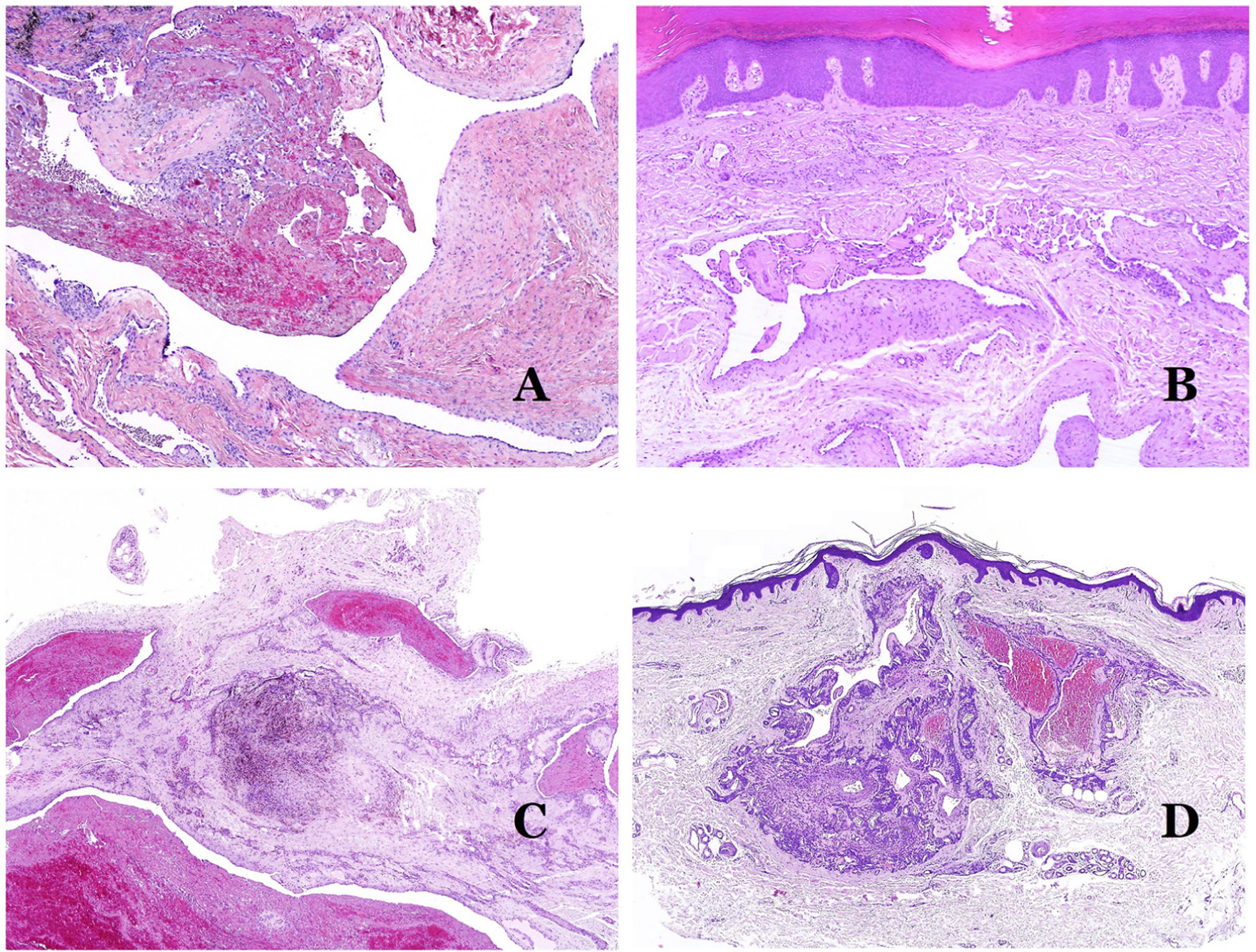
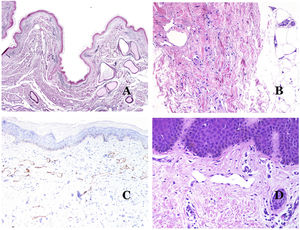
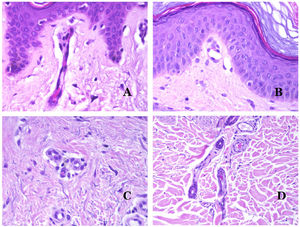
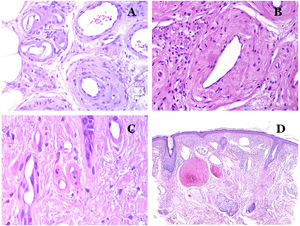
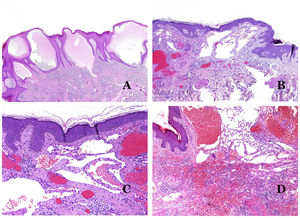
Por el contrario, hay algunas entidades que solo recientemente se han reconocido como malformaciones. Uno de los mejores ejemplos de este grupo es el hemangioma verrucoso. Este último término se puede encontrar como tal aún en la literatura reciente, aunque con menos frecuencia que en el pasado. La mayoría de los textos se refieren a él correctamente como «malformación venosa verrugosa». Esta última malformación conlleva una mutación somática en MAP3K324,25. Clínicamente se presenta como parches y placas eritematosas, muchas de las cuales muestran un aspecto verrucoso. Este aspecto se debe a las características hiperplásicas verrucosas de la epidermis, que aparece hiperqueratósica y con hipergranulosis, junto con la malformación vascular en sí, que está formada por vénulas alteradas que ocupan la dermis papilar (fig. 2A), y que en la mayoría de los casos se extienden por toda la dermis, llegando a afectar incluso al tejido subcutáneo.
A) Malformación venosa verrugosa. Las vénulas malformadas ocupan principalmente la dermis superficial, aunque en la mayoría de los casos se extienden profundamente en la dermis e hipodermis, donde forman agregados nodulares. La epidermis suprayacente aparece verrucosa y muchas veces hipergranulótica e hiperqueratósica (orceína ×20). B) Anomalía linfática progresiva adquirida. La imagen muestra vasos linfáticos malformados aplanados que permean toda la dermis (hematoxilina-eosina ×100). C) Anomalía linfática progresiva adquirida inmunoteñida con D2-40. Los endotelios son positivos, mostrando la forma angulada y aplanada de los vasos (D2-40 ×100). D) Vaso linfático en la dermis papilar (hematoxilina-eosina ×200).
Otro buen ejemplo es la anomalía linfática progresiva adquirida26. El término linfangioendotelioma se introdujo hace tiempo en la literatura para referirse ciertas anomalías linfáticas con una tendencia a la recurrencia27. Sin embargo, el linfangioendotelioma «benigno» se describió como una lesión vascular que se presenta como máculas y placas eritematosas de crecimiento lento, localizadas principalmente en extremidades u hombros en pacientes jóvenes28. Histopatológicamente muestra vasos linfáticos malformados de endotelios aplanados que permean toda la dermis y a veces incluso la hipodermis29 (fig. 2B). Estos vasos se tiñen con D2-40 (fig. 2C). Para enfatizar su comportamiento clínico «de progresión», esta entidad se denominaba hasta no hace mucho tiempo linfangioma progresivo adquirido, pero la clasificación actual de la ISSVA lo incluye como una malformación.
Malformaciones vasculares asociadas a otras anomalíasAlgunas malformaciones vasculares pueden presentarse en el contexto de ciertos síndromes en los que las anomalías vasculares se asocian con otras anomalías, ya sea de los tejidos blandos, del hueso o de sobrecrecimientos generales o parciales de ciertos tejidos (tabla 2)30. La tabla 3 muestra los principales síndromes en los que se han identificado tales situaciones.
Síndromes con malformaciones vasculares
| Síndrome | Anomalías | Tipos de MV encontrados |
|---|---|---|
| Klippel-Trénaunay | MV de flujo bajo con sobrecrecimiento de extremidades | Capilar y venoso con o sin linfático |
| Parkes-Weber | MV de alto flujo con sobrecrecimiento de extremidades | Capilar y arteriovenoso |
| Servelle-Martorell | MV con hipoplasia ósea | Venoso |
| Sturge-Weber | MV facial y lepromíngea con anomalías oculares con o sin sobrecrecimiento óseo y/o de partes blandas | Capilar |
| Malformación capilar de las extremidades asociada a hipertrofia congénito no progresiva de las extremidades | Malformación de los capilares de las extremidades con sobrecrecimiento congénito no progresivo de las extremidades | Capilar |
| Maffucci | MV con o sin hemangioma de células fusiformes con encondroma | Venoso |
| Macrocefalia con malformación capilar | Macrocefalia con malformación capilar | Capilar |
| Microcefalia con malformación capilar | Microcefalia con malformación capilar | Capilar |
| CLOVES | MV con sobrecrecimiento lipomatoso | Linfático, venoso y capilar con o sin arteriovenoso |
| Proteus | MV con sobrecrecimiento corporal asimétrico | Capilar, venoso y/o linfático |
| Bannayan-Riley-Ruvalcaba | MV con macrocefalia y sobrecrecimiento lipomatoso | Arteriovenoso y venoso |
| CLAPO | MV del labio inferior, cara y cuello con asimetría y sobrecrecimiento parcial o generalizado | Capilar y linfático |
MV: malformaciones vasculares.
Principales malformaciones vasculares que tienen un gen identificado implicado en su patogenia
| Malformaciones capilares |
| MC cutánea y/o mucosa (también conocida como mancha en «vino de Oporto»): |
| MC no-sindrómica (GNAQ) |
| MC con anomalías del sistema nervioso central y/o oculares (síndrome de Sturge-Weber) (GNAQ) |
| MC con sobrecrecimiento de huesos y/o tejidos blandos (GNA11) |
| MC difusa con sobrecrecimiento (DCMO) (GNA11) |
| MC reticuladas: |
| MC de microcefalia-malformación capilar (STAMBP) |
| MC de megalocefalia-malformación capilar-polimicrogiria (PIK3CA) |
| MC de MC-MAV (RASA1/EPHB4) |
| Telangiectasia hemorrágica hereditaria (HHT) (HHT1: ENG; HHT2: ACVRL1; HHT3, JPHT SMAD4) |
| Malformaciones linfáticas |
| Común (quística) ML (PIK3CA) |
| Linfedema primario |
| Síndrome de Nonne-Milroy (FLT4/VEGFR3) |
| Linfedema hereditario primario (VEGFC) |
| Linfedema hereditario primario (GJC2)/Connexin 47 Gen |
| Linfedema-distiquiasis (FOXC2) |
| Hipotricosis-linfedema-telangiectasia (SOX18) |
| Linfedema primario con mielodisplasia (GATA2) |
| Anomalía linfática generalizada primaria (síndrome de Hennekam linfangiectasia-linfedema) (CCBE1) |
| Síndrome de microcefalia con o sin coriorretinopatía, linfedema o retraso mental (KIF11) |
| Linfedema-atresia de coanas (PTPN14) |
| Malformaciones venosas |
| MVe común TEK (TIE2)/PIK3CA |
| MVe familiar cutáneo-mucosa: TEK (TIE2) |
| MVe esporádica multifocal: TEK (TIE2) |
| MV del síndrome del nevus azul en tetina de goma (BRBNS): TEK (TIE2) |
| Malformación glomovenosa (Glomulin gen) |
| Malformación cavernosa cerebral (MCC) (CCM1: KRIT1, CCM2: Malcavernin gen, CCM3: PDCD10) |
| Malformación vascular intraósea familiar (ELMO2) |
| Malformación venosa verrugosa (antes hemangioma verrucoso) (MAP3K3) |
| Malformaciones arteriovenosas y fistulas |
| Esporádica (MAP2K1) |
| En THH (HHT1: ENG; HHT2: ACVRL1; HHT3: JPHT SMAD4) |
| En MC-MAV: RASA1/EPHB4 |
MAV: malformación arteriovenosa; MC: malformación capilar; MCC: malformación cavernosa cerebral; ML: malformación linfática; MVe: malformación venosa; THH: telangiectasia hemorrágica hereditaria.
En los seres humanos se describen 2 tipos principales de redes vasculares: el sistema linfático y el sistema sanguíneo. El primero es un sistema abierto por el que circula la linfa y desde donde la linfa pasa al tejido conjuntivo. Por el contrario, el sistema de vasos sanguíneos es un circuito cerrado en el que solo células y productos seleccionados atraviesan las paredes de los vasos sanguíneos.
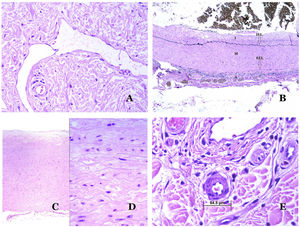
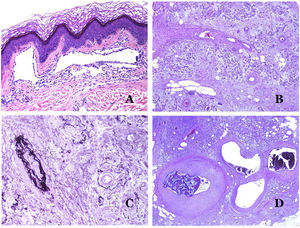
Los vasoslinfáticos están hechos de un endotelio discontinuo debajo del cual hay una membrana basal (fig. 2D). Los vasos linfáticos carecen de una red prominente de fibras elásticas (como las venas) y, por lo tanto, la circulación de la linfa no puede depender de las propiedades elásticas de su pared. Por el contrario, la linfa circula por estos vasos ayudada principalmente por la acción de la musculatura circundante que comprime las paredes linfáticas mientras nos movemos. Las válvulas linfáticas evitan con éxito el retorno de la linfa. Si tenemos suerte en nuestro corte histológico, estas válvulas pueden a veces verse en las secciones de los vasos linfáticos (fig. 3A), lo que es una pista importante para identificarlas como tales. Mientras que los vasos linfáticos más pequeños muestran una pared muy delgada (formada únicamente por endotelio y membrana basal), algunos vasos más grandes pueden mostrar focos de capa muscular. Además, focos de infiltrados linfocitarios cerca de las paredes de los vasos son una característica común de los vasos linfáticos.
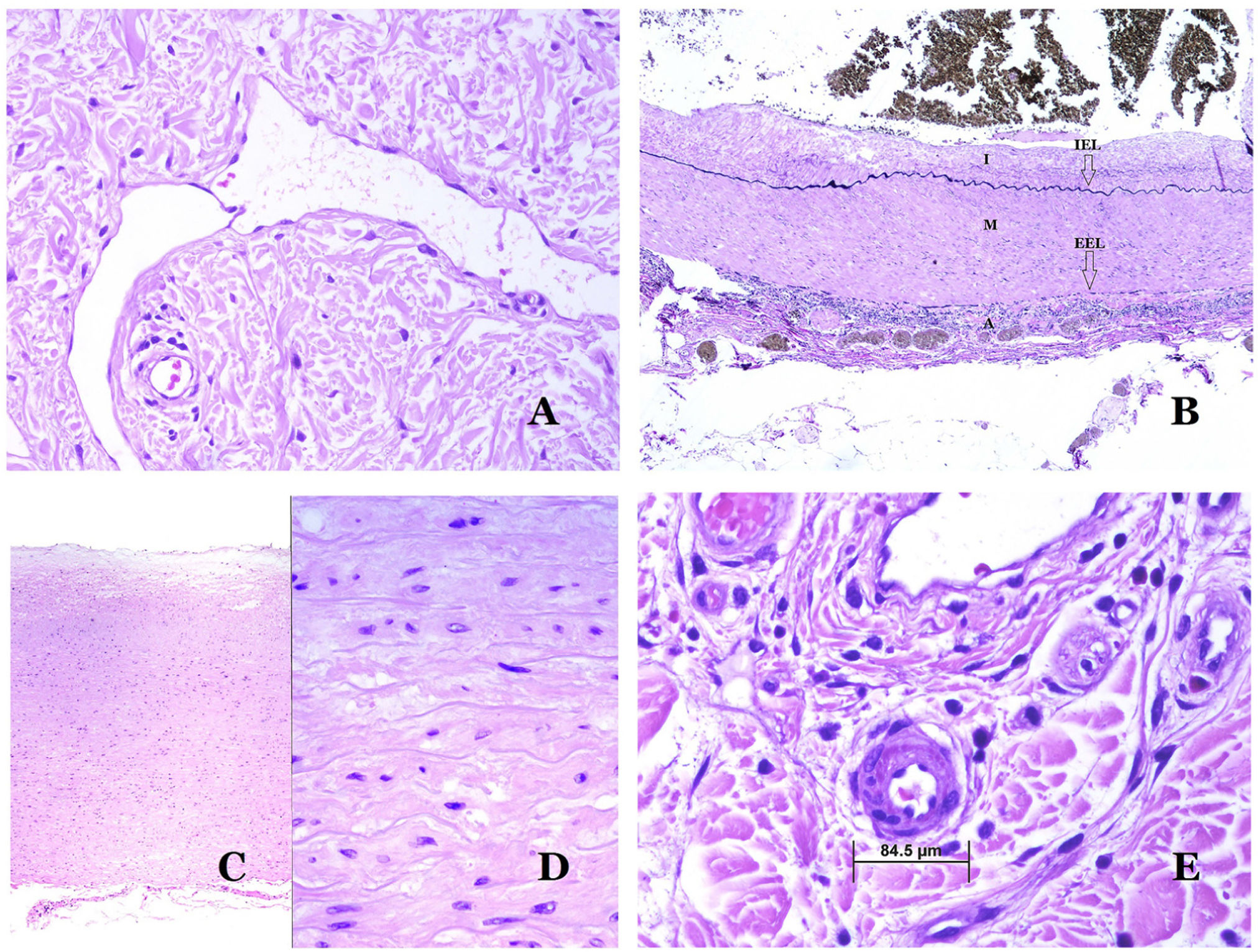
A) Vaso linfático. El endotelio se encuentra directamente sobre la membrana basal. Se ven fácilmente dos válvulas en el vaso (hematoxilina-eosina ×200). B) Arteria. Esta tinción histoquímica para tejido elástico muestra las 3 capas de una arteria normal: la íntima (I), la media (M) y la adventicia (A). Dos bandas elásticas gruesas dividen estas 3 capas: la lámina elástica interna (LEI) y la lámina elástica externa (LEE) (tinción elástica de Van Gieson ×20). C) Aorta. La capa media es rica en fibras elásticas (hematoxilina-eosina ×20). Tal característica se aprecia mejor a gran aumento (hematoxilina-eosina ×200). D) Arteriola (hematoxilina-eosina ×400).
El sistema sanguíneo tiene que llevar la sangre a través de un sistema cerrado que garantice su distribución desde el corazón a los pulmones, de los pulmones a todos los órganos, y de estos, de vuelta al corazón. Aunque hay un intercambio selectivo de células y de productos a través de las paredes de los vasos sanguíneos a lo largo de este circuito, el escape de grandes cantidades de sangre (es decir, hemorragia) no es un fenómeno fisiológico. Para cumplir con todos estos requisitos, el sistema sanguíneo está formado por 5 tipos principales de vasos sanguíneos: arterias, arteriolas, capilares, vénulas y venas.
Las arterias son las más grandes de todos estos vasos. Tienen 3 capas: íntima, media y adventicia31 (fig. 3A). Entre las capas íntima y media se encuentra una banda elástica, y hay otra entre la capa media y la adventicia31. Estas 2 bandas se conocen como láminas elásticas interna y externa, respectivamente (fig. 3B). Las arterias pueden ser elásticas o musculares, dependiendo de la abundancia o no de fibras elásticas en la capa media. Mientras que las arterias alejadas del corazón son musculares, el componente elástico de la capa media aumenta progresivamente con la proximidad de los vasos al corazón (fig. 3C). Las grandes arterias en contacto directo con el corazón (como la aorta) tienen una capa media con abundantes fibras elásticas. Aunque la íntima es un espacio virtual al nacer, esta capa se hace más gruesa lentamente con la edad, lo que se debe principalmente a un aumento en la cantidad de colágeno intimal. Tal aumento puede mostrar una apariencia desorganizada con el envejecimiento, y conferir un aspecto fibrótico a la íntima.
Aunque el término arteriola está ampliamente aceptado en la literatura para referirse a vasos con estructura de arteria pero con un diámetro inferior a 100μm, no existe un signo histológico que distinga a las arterias pequeñas de las arteriolas grandes32. La capa media de estas está formada por una o dos capas circulares de músculo liso, que pueden actuar como un esfínter precapilar (fig. 3D). Cuando las arteriolas son muy pequeñas, pueden carecer de la capa elástica interna32.
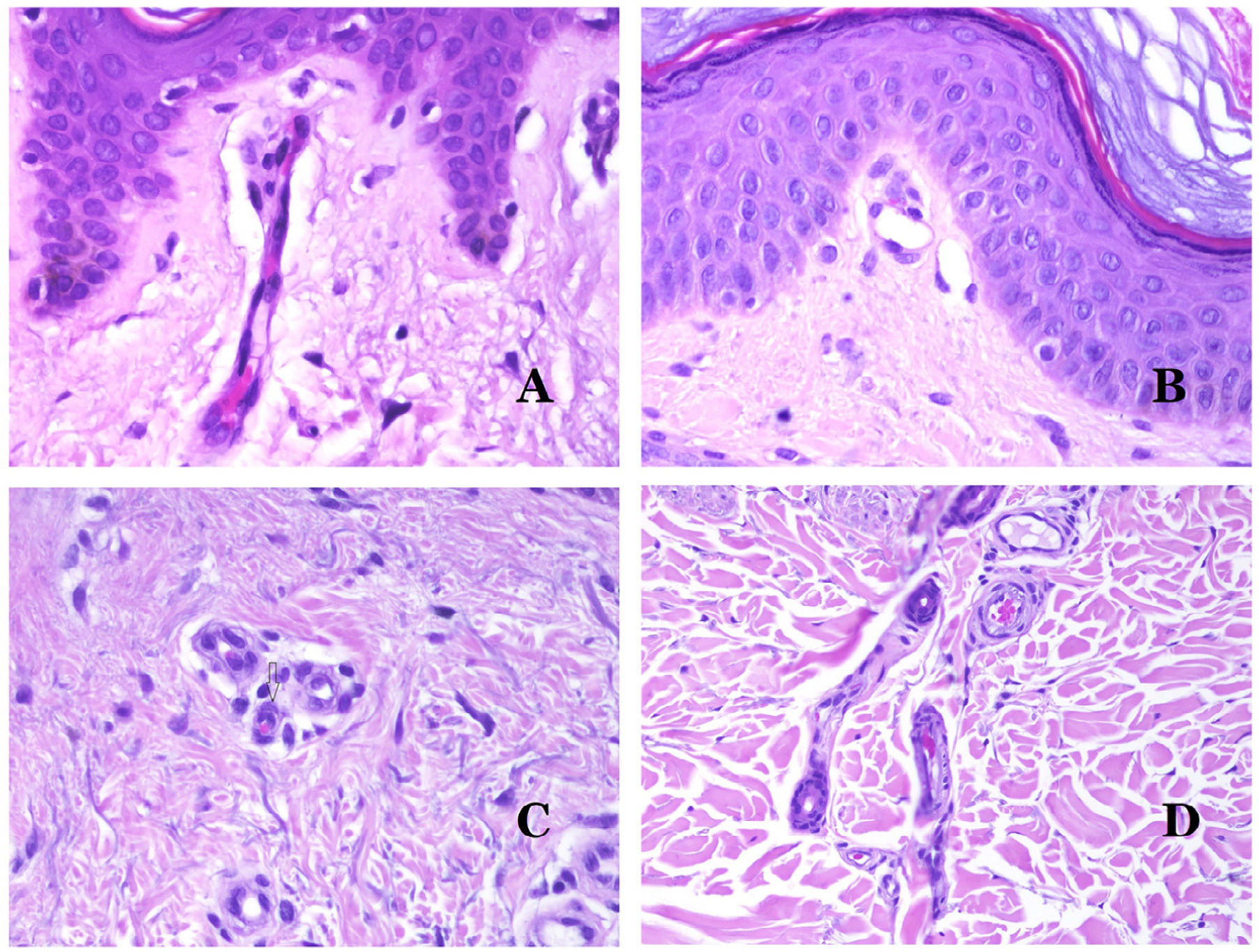
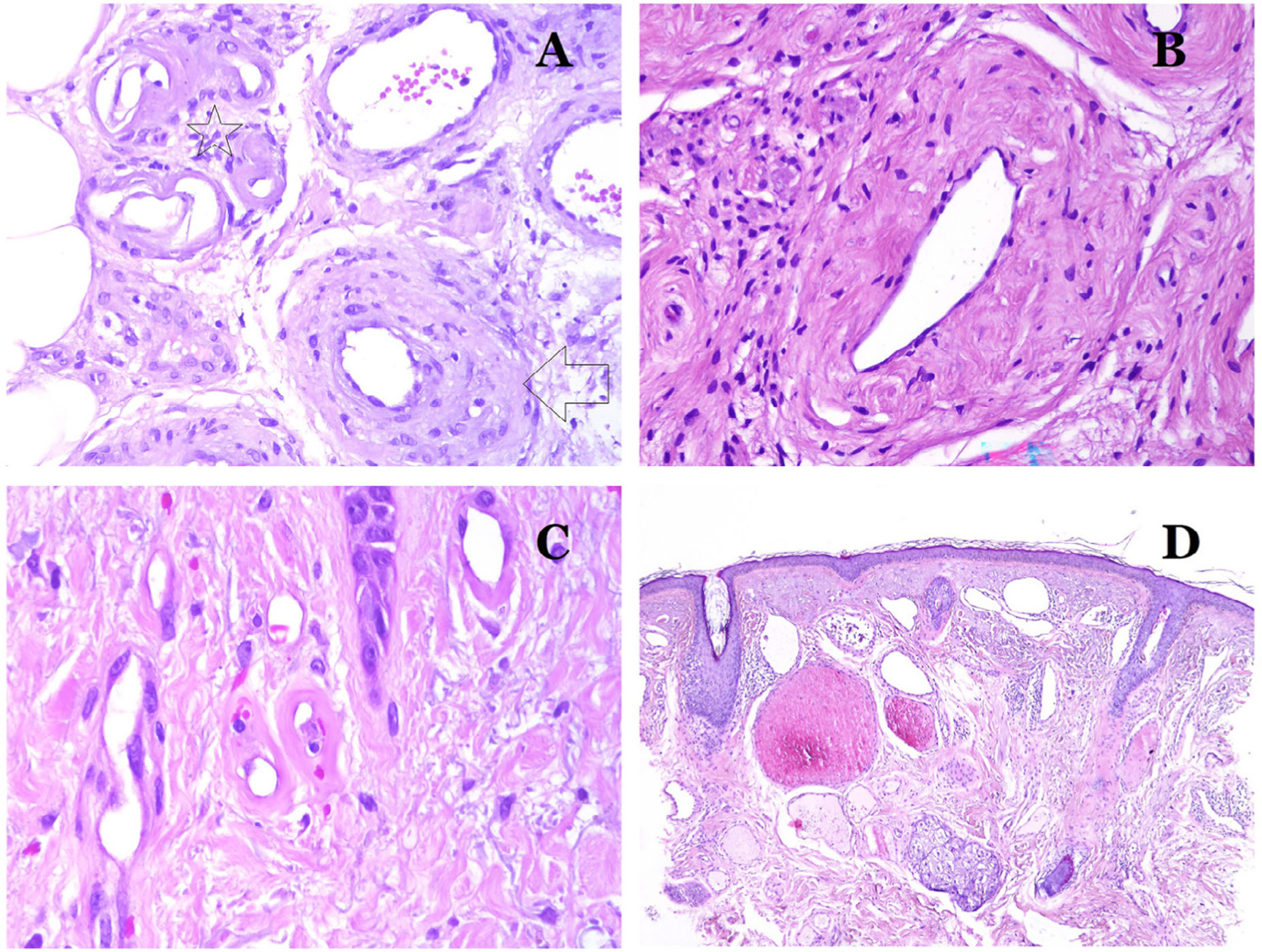
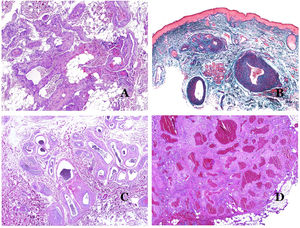
Los capilares son pequeños vasos sanguíneos (5-15μm) que no tienen una capa media ni fibras elásticas (fig. 4A). Su pared está formada por una capa endotelial que descansa directamente sobre la membrana basal33 (fig. 4B). Rodeando la membrana basal, se pueden encontrar pericitos en algunos capilares (fig. 4C).
A) Vaso sanguíneo capilar. Estos vasos tienen un diámetro estrecho y su pared está formada por células endoteliales más la membrana basal (hematoxilina-eosina ×400). B) Capilar. La pared se compone únicamente de endotelio colocado directamente sobre la membrana basal (hematoxilina-eosina ×400). C) Los pericitos (flecha) a veces se evidencian claramente en algunos capilares con la tinción de hematoxilina-eosina (hematoxilina-eosina ×400). D) Vénula. Se observa una fina capa de tejido conjuntivo debajo de la membrana basal (hematoxilina-eosina ×200).
Las venas pequeñas que aparecen inmediatamente después de los capilares se llaman vénulas. A diferencia de los capilares, muestran un tejido conectivo debajo de la membrana basal (fig. 4D). Tienen, además, una capa media constituida por células musculares lisas, irregularmente distribuidas. Algunas vénulas también pueden mostrar pericitos. En algunos órganos, ciertas vénulas aparecen dilatadas y grandes, y están especializadas en recolectar sangre (fig. 5A). Estas vénulas se llaman sinusoides.
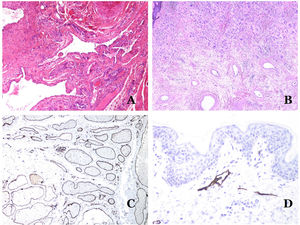
A) Venas del glande. En este lugar, las venas se especializan en recolectar sangre y aparecen dilatadas y organizadas en el cuerpo esponjoso. Esto no debe confundirse con una malformación venosa (hematoxilina-eosina ×20). B) Pequeña vena con una capa muscular continua (hematoxilina-eosina ×100). C) Tinción histoquímica para tejido elástico que muestra las múltiples bandas elásticas discontinuas concéntricas evidenciadas en la capa muscular de una vena (orceína ×200). D) Comparación entre una arteria (derecha) y una vena (izquierda). La arteria muestra una pared gruesa en comparación con el diámetro del vaso. Por el contrario, la vena (derecha) tiene una pared más delgada. Si bien se identifica una laminilla elástica interna prominente en la arteria, no es evidente en las venas. En cambio, las venas tienen muchas fibras elásticas discontinuas en toda su pared (orceína ×20).
Las pequeñas venas periféricas ya muestran una capa continua y regular de músculo liso en espiral (fig. 5B) con muchas bandas concéntricas discontinuas de fibras elásticas (fig. 5C). Además, se pueden ver válvulas en ellas. Dado que las venas son más elásticas que contráctiles, estas válvulas son importantes para garantizar el flujo sanguíneo, evitando el retorno de la sangre. Las válvulas están hechas de pliegues emparejados de la capa íntima. Sin embargo, las venas de algunos órganos no tienen válvulas. Las venas medianas y grandes tienen una pared bien estructurada en 3 capas: íntima, media y adventicia.
¿Cómo distinguir una arteria de una vena?En una sección transversal del vaso sanguíneo, las arterias son redondas y simétricas, mientras que las venas a veces pueden mostrar una sección ovalada. Las arterias suelen tener una pared más gruesa en comparación con el diámetro del vaso (fig. 5D), mientras que, por el contrario, las venas tienen una pared más delgada en comparación con el diámetro del vaso34,35.
Las arterias comúnmente tienen una lámina elástica interna prominente que no es evidente en las venas (fig. 6A). En cambio, las venas tienen muchas fibras elásticas discontinuas a lo largo de su pared34,35. Por último, en la capa muscular de las venas, los fascículos musculares están interrumpidos por haces de tejido colágeno, cosa que no sucede en las arterias.
A) Pequeña arteria en una biopsia de piel. Es evidente una lámina elástica interna prominente incluso sin técnicas auxiliares especiales (hematoxilina-eosina ×100). B) Esta arteria muestra cambios claros debido al envejecimiento: la capa interna muestra un engrosamiento zonal. La lámina elástica interna muestra reduplicación (orceína ×40). C) La reduplicación de la lámina interna elástica es un fenómeno común en las arterias envejecidas (orceína ×40). D) Arteria temporal que muestra un foco de calcificación. Dichos focos son comunes con el envejecimiento (hematoxilina-eosina ×100).
Todos los vasos sanguíneos sufren cambios morfológicos con la edad, tanto es así que se debate si deben ser considerados como variantes de la normalidad.
En las arterias, la íntima se ve engrosada con la edad, principalmente por fibrosis31 (fig. 6B). Además, la fragmentación y la duplicación de la lámina elástica interna son comunes con la edad32 (fig. 6C). Estos cambios adquiridos pueden ser la fuente de puntos débiles en la pared de la arteria, facilitando la dilatación y tortuosidad zonal, lo que no debe confundirse con la dismorfia vascular que se evidencia en las MV. La calcificación es otro cambio común con la edad (fig. 6D). Al principio se aprecian pequeños depósitos de calcio en la lámina elástica interna, pero, con la progresión, se evidencian depósitos más gruesos en toda la pared. La cantidad de colágeno y elastina también aumenta con la edad, en la capa muscular de las arterias. Todos estos cambios por envejecimiento de las arterias pueden provocar dilatación y tortuosidad del vaso.
Además de la fibrosis de la íntima y la reduplicación del tejido elástico, la hialinización de la pared es un hallazgo común en las arteriolas envejecidas (fig. 7A), especialmente en el contexto de la hipertensión o la diabetes.
A) Esta imagen muestra cambios en los vasos sanguíneos debido al envejecimiento. Las arteriolas muestran hialinización de su pared (estrella) y una vena muestra engrosamiento de la capa muscular (flecha) (hematoxilina-eosina ×200). B) Fibrosis íntima en una vena. Este cambio es común con la edad (hematoxilina-eosina ×200). C) Engrosamiento de la membrana basal de los capilares, evidenciado con el envejecimiento (hematoxilina-eosina ×400). D) Malformación capilar-venosa. Los capilares dismórficos aparecen dilatados y en una distribución desordenada (hematoxilina-eosina ×20).
Los cambios observados en las venas con el envejecimiento incluyen fibrosis de la íntima (fig. 7B) e hipertrofia muscular32,33. Además, algunas venas están bajo la influencia de una alta presión ortostática (como las de las piernas) y, como consecuencia, pueden mostrar una «arterialización» de su pared, es decir, cambios anatómicos que las hacen parecer arterias, con prominencia de una lámina elástica interna y una gruesa capa muscular35.
En los capilares, la membrana basal aumenta su grosor con la edad32,33 (fig. 7C).
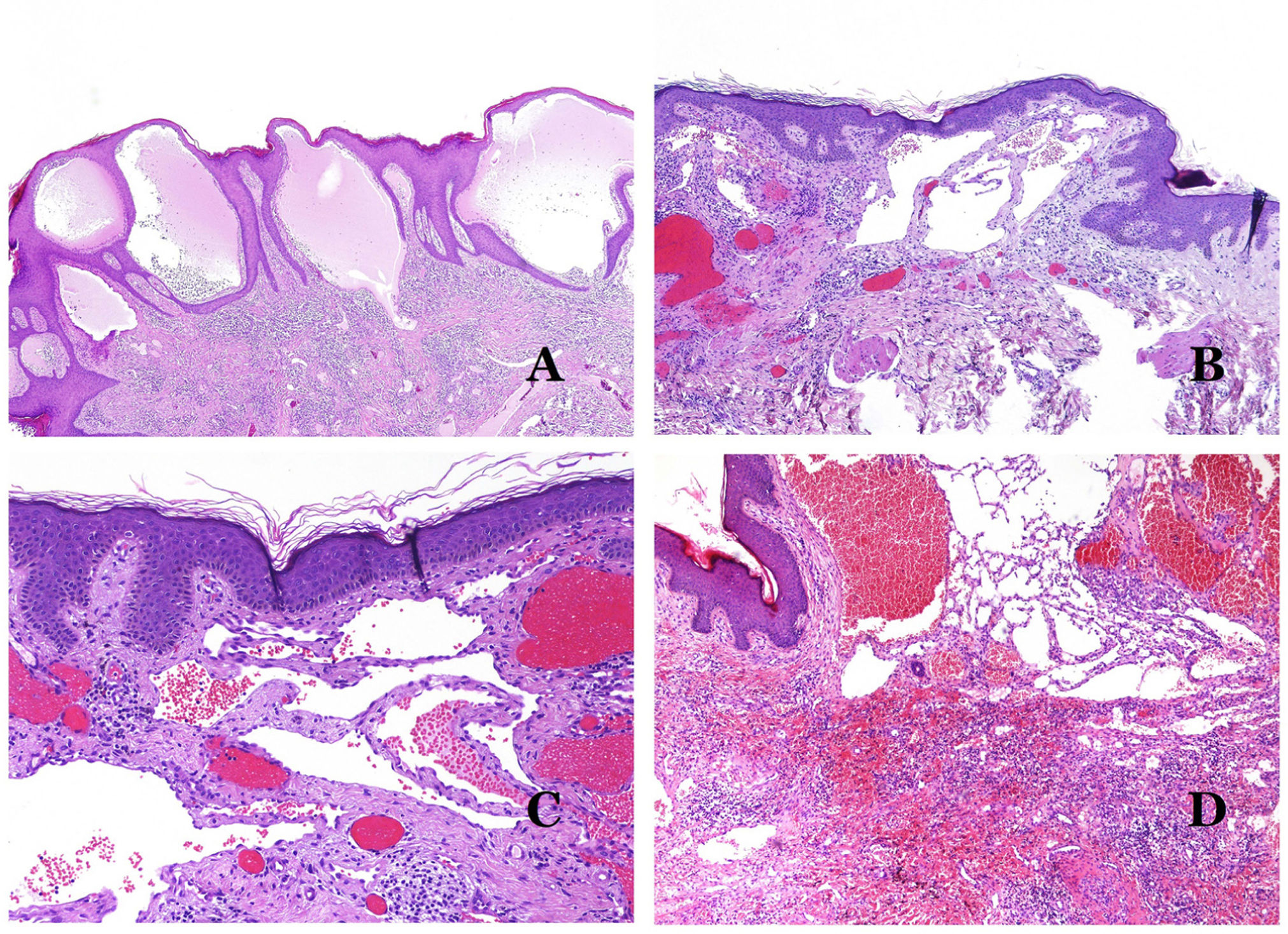
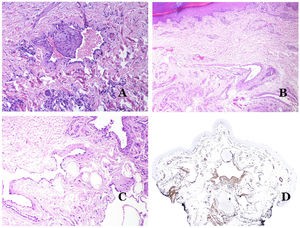
Principales signos morfológicos de vaso dismórfico de las malformaciones vascularesLos capilares dismórficos (en las malformaciones capilares) aparecen muchas veces dilatados y ectásicos, con una distribución desordenada (fig. 7D). Sus paredes pueden estar engrosadas, con pequeñas cantidades de músculo y de tejido fibroso. Estos cambios vasculares pueden ir acompañados de cambios epidérmicos y mesenquimatosos, como hiperplasia epidérmica, depósito de mucina dérmica focal, aumento de colágeno y de tejido elástico, cambios hamartomatosos foliculares, quistes infundibulares, cambios similares a tricofoliculomas y cambios hamartomatosos neurales. Los cambios son muy sutiles en las biopsias de niños más pequeños y se vuelven más prominentes con la edad.
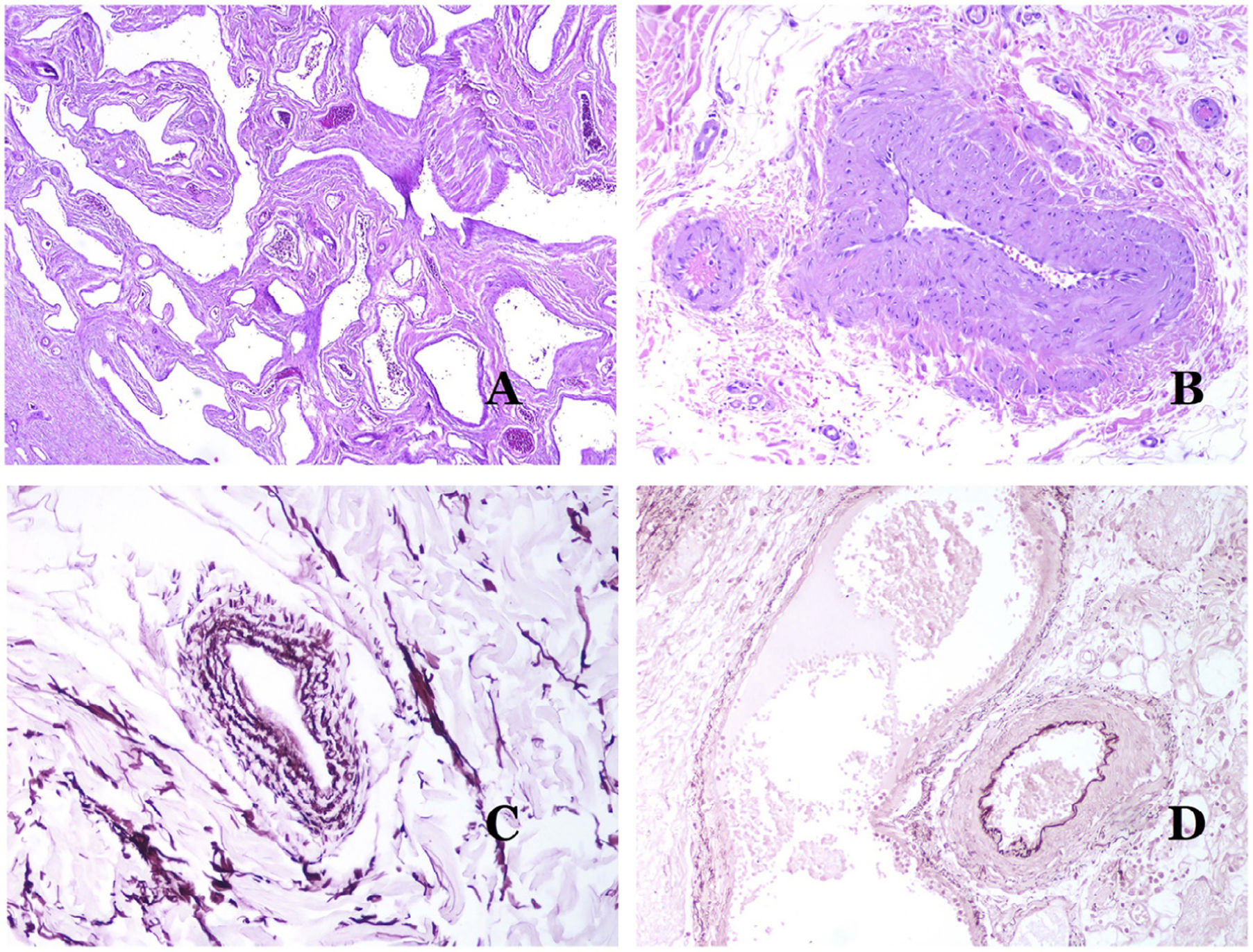
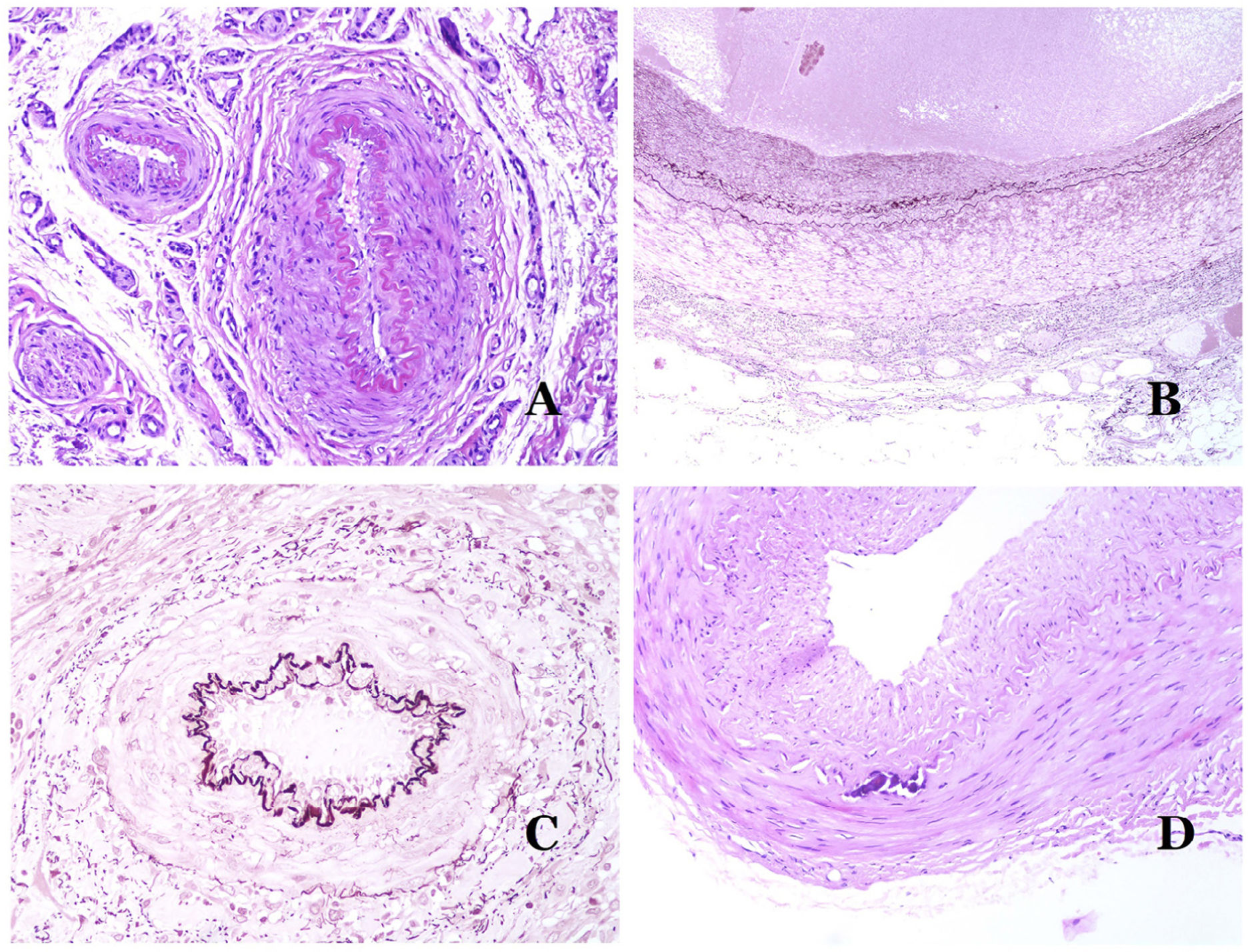
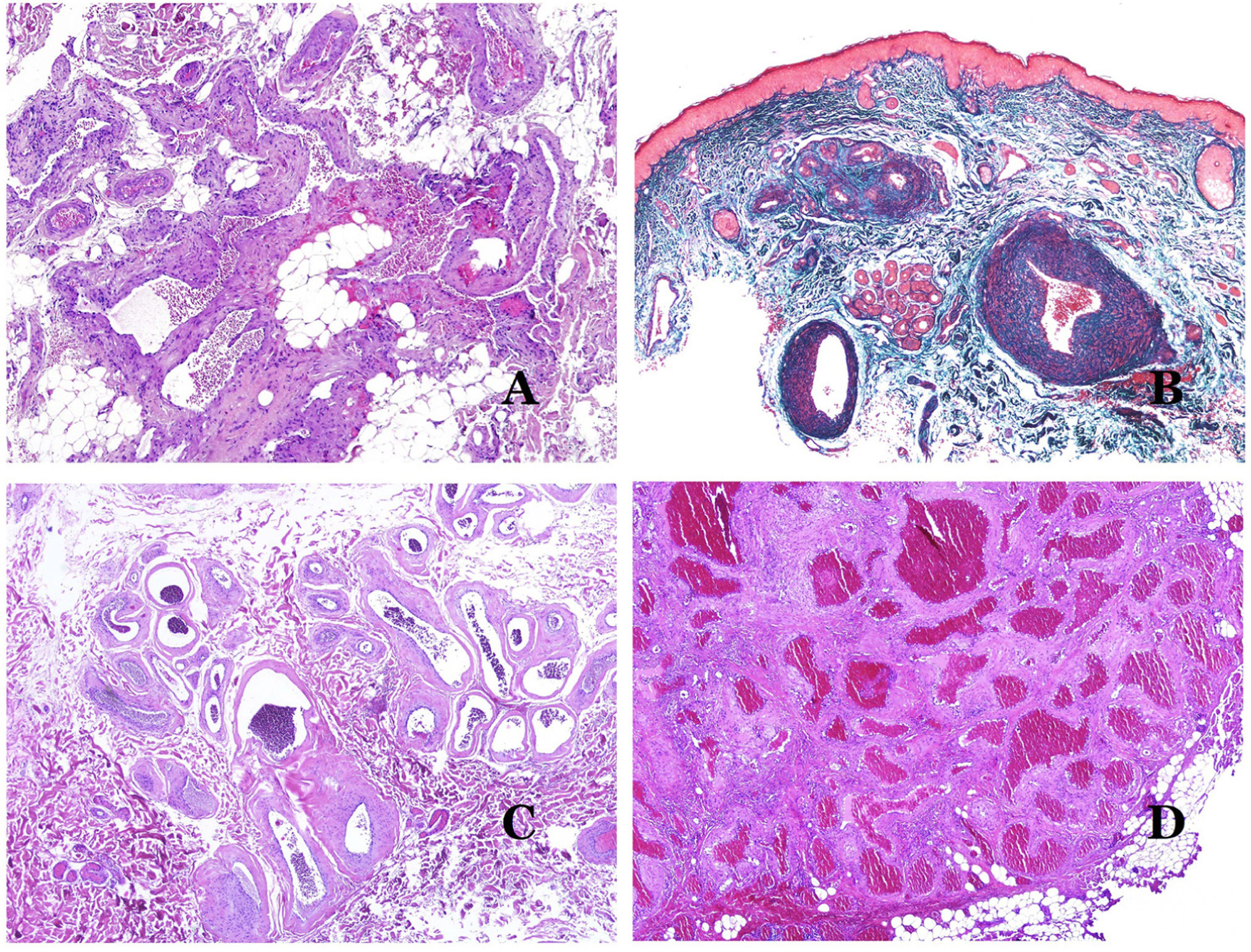
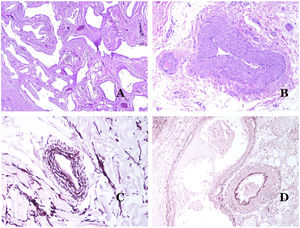
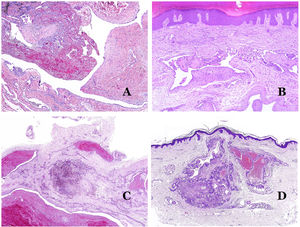
Las venas dismórficas (en las malformaciones venosas) se reconocen por formas irregulares, a veces anguladas, con también irregularidades en sus paredes (fig. 8A). Esto se debe principalmente a variaciones en el grosor de la capa muscular25 (fig. 8B), que en zonas puede ser muy delgada o incluso ausente, mientras que en otras está agrandada y pronunciada (fig. 8C). Esta última característica se puede demostrar mejor con una inmunotinción para actina de músculo liso (fig. 8D). Los vasos dismórficos pueden extenderse por todas las capas de la piel, involucrando muchas veces la hipodermis (fig. 9A). La pared venosa, sin embargo, conserva la estructura normal de los fascículos musculares separados por colágeno, lo que se evidencia fácilmente con las técnicas histoquímicas adecuadas (fig. 9B). Estas venas malformadas muchas veces muestran una distribución aleatoria, incluso formando grupos (fig. 9C) o una disposición en «espalda con espalda» (del inglés back to back) (fig. 9D). Los fenómenos trombóticos no son raros (fig. 10A) y, en ocasiones, van seguidos de recanalización parcial e hiperplasia endotelial papilar intravascular (fig. 10B), así como de áreas de hemorragia, a veces con depósitos de hemosiderina (fig. 10C). Cuando los trombos se incorporan a la pared de la vena, pueden formarse nódulos fibromixoides. Los trombos también pueden calcificarse formando flebolitos. Las malformaciones glomuvenosas se incluyen dentro de las malformaciones venosas en la clasificación ISSVA. Sin embargo, muestran características muy distintivas: las venas malformadas están rodeadas por una o más capas de células glómicas (fig. 10D).
A) Venas dismórficas de una malformación venosa. Las venas aparecen irregulares y anguladas. Sus paredes muestran un grosor irregular con algunas zonas en las que la capa muscular está ausente, mientras que en otras está engrosada (hematoxilina-eosina ×100). B) Malformación venosa. Las venas dismórficas muestran una gran variación en el grosor de sus paredes. Esto se debe principalmente a las irregularidades del grosor de la capa muscular (hematoxilina-eosina ×40). C) Malformación venosa. Las venas dismórficas muestran una pared irregular con irregularidades en su capa muscular: mientras que el músculo es delgado o incluso inexistente en algunas áreas, y está hipertrofiado en otras. D) Malformación venosa. Una inmunotinción para actina de músculo liso marca la capa muscular irregular de las venas dismórficas (actina de músculo liso ×20).
A) Malformación venosa. Las venas dismórficas se identifican en lo profundo del tejido subcutáneo (hematoxilina-eosina ×40). B) Malformación venosa. Las venas dismórficas muestran una capa muscular en la que los músculos están divididos en fascículos por haces de colágeno, similar a lo que ocurre en las venas normales (tricrómico de Masson ×20). C) Malformación venosa con disposición en racimo de las venas dismórficas (hematoxilina-eosina ×20). D) Malformación venosa con disposición contigua de las venas dismórficas (hematoxilina-eosina ×20).
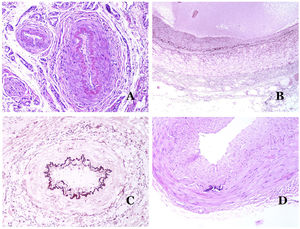
A) Malformación venosa con un trombo parcialmente recanalizado en su interior (hematoxilina-eosina ×40). B) Malformación venosa con hiperplasia intravascular papilar endotelial (hematoxilina-eosina ×40). C) Malformación venosa con depósitos de hemosiderina en un área de hemorragia antigua (hematoxilina-eosina ×20). D) En este ejemplo de malformación glomovenosa, las venas dismórficas se acompañan de células glómicas monomorfas redondeadas distribuidas irregularmente (hematoxilina-eosina ×20).
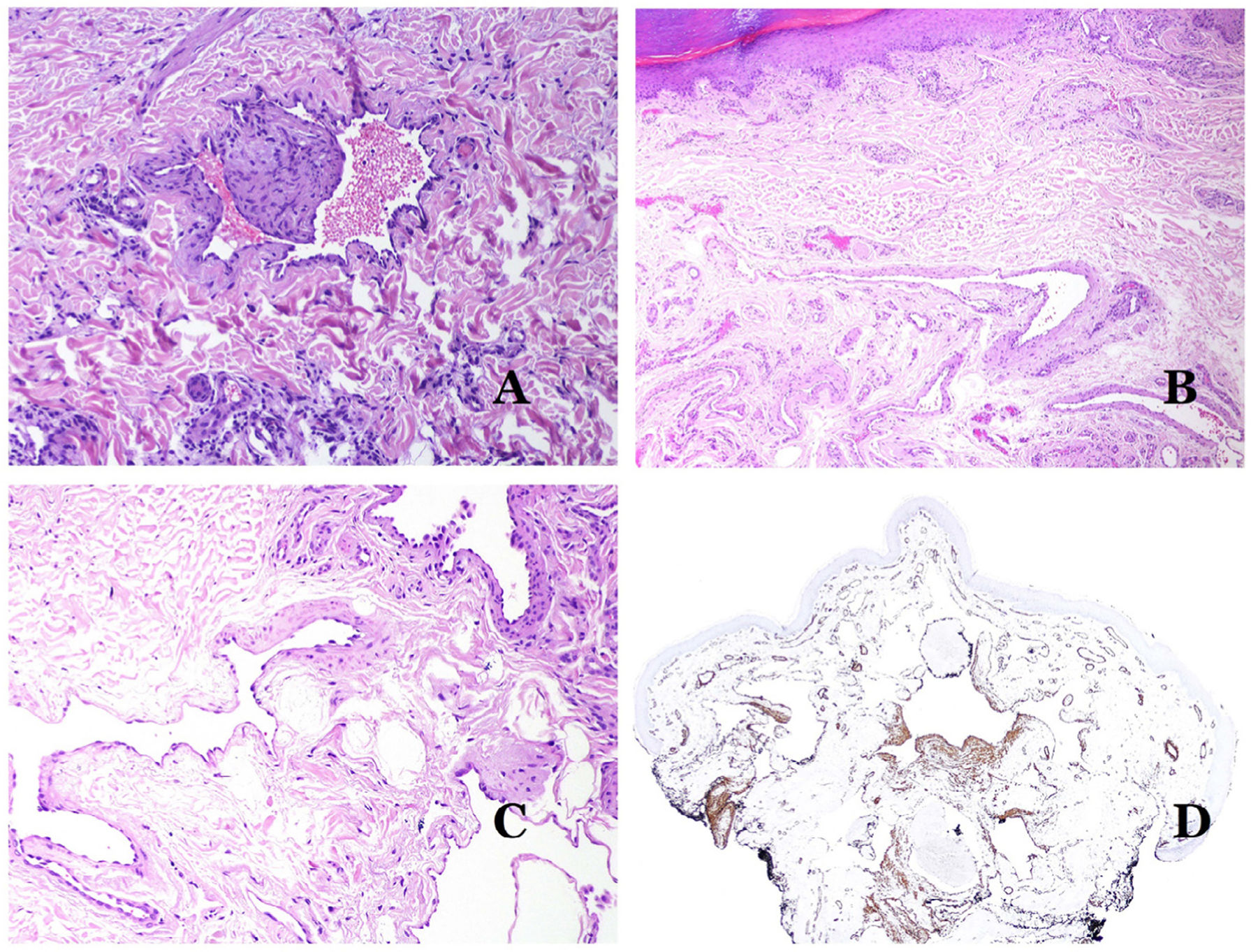
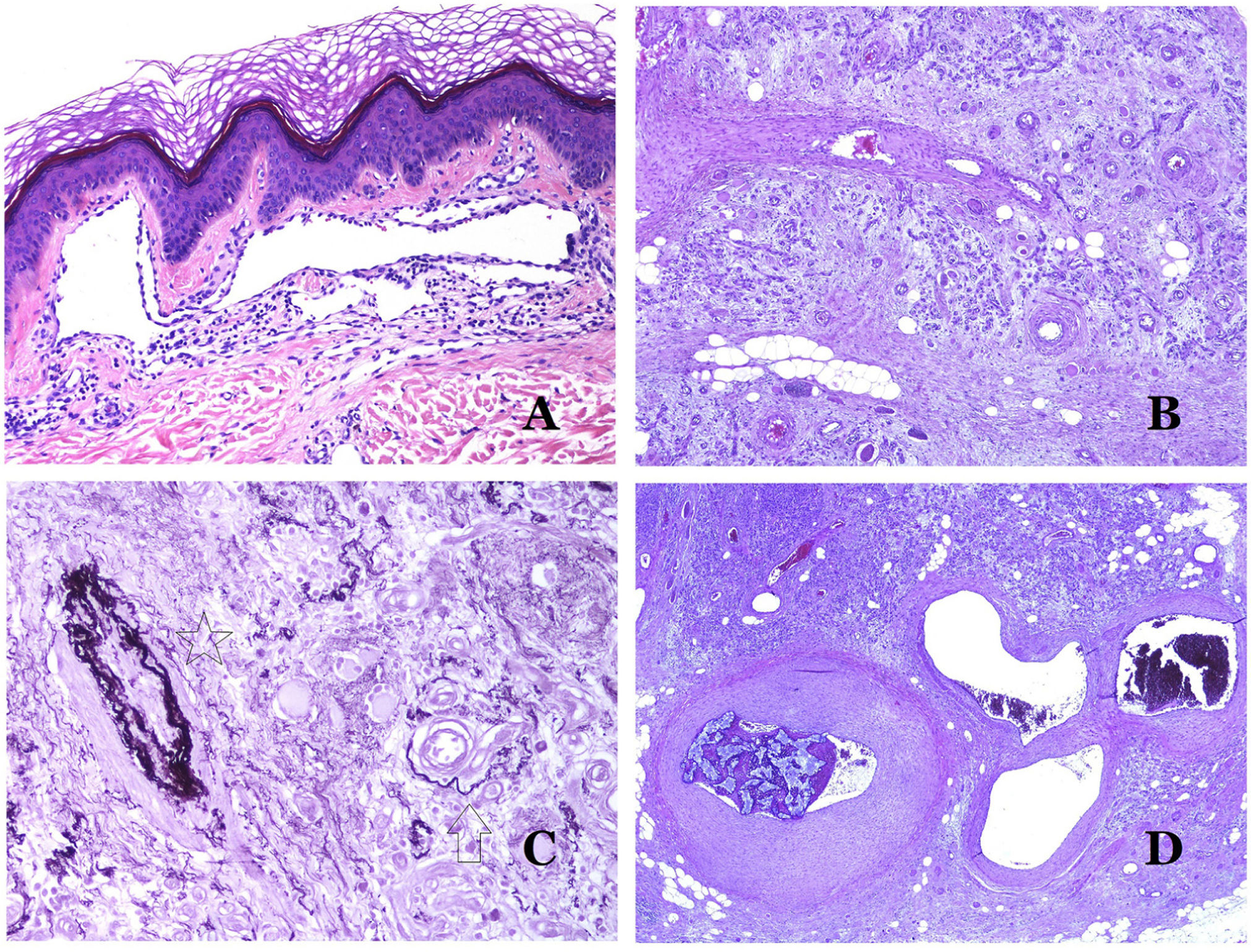
Los vasos linfáticos dismórficos (en las malformaciones linfáticas) aparecen dilatados (fig. 11A), a veces extremadamente. En ocasiones se ven válvulas, lo que ayuda a identificar a los vasos linfáticos (fig. 11B). Las paredes linfáticas son comúnmente muy delgadas pero muchas veces pueden presentar focos de engrosamiento, con músculo liso y tejido fibroso mixoide. No es raro ver fascículos desorganizados de músculo liso entre los canales malformados. Las luces linfáticas a veces pueden mostrar glóbulos rojos, lo que no es incompatible con la naturaleza linfática de estos vasos: la sangre puede entrar accidentalmente en estos vasos linfáticos malformados (fig. 11C), pero este acontecimiento en muchas ocasiones termina como hemorragias con depósitos estromales de hemosiderina (fig. 11D). Otros posibles cambios acompañantes son la hiperqueratosis, la hiperplasia epidérmica (a veces incluso verrugosa), la ulceración o los infiltrados inflamatorios (fig. 12A). El tamaño del vaso malformado es variable, desde canales microscópicos en forma de hendidura que diseccionan las bandas dérmicas de colágeno, hasta quistes muy grandes.
A) Malformación linfática. El vaso linfático dismórfico aparece dilatado en la dermis papilar. Esta presentación se denominó en el pasado como «linfangioma circunscrito» (hematoxilina-eosina ×20). B) Malformación linfática. Las válvulas son evidentes en algunos de los vasos linfáticos dismórficos (hematoxilina-eosina ×20). C) Malformación linfática. Vasos linfáticos dismórficos, algunos de ellos con sangre. También se ve una válvula en uno de los vasos. El infiltrado linfocítico estromal también es una característica común (hematoxilina-eosina ×40). D) Área hemorrágica además de una malformación linfática. Este es un fenómeno frecuente debido a la baja resistencia de la pared linfática para mantener la sangre dentro del vaso. Las hemorragias de larga duración a veces pueden dar lugar a depósitos hemosideróticos (hematoxilina-eosina ×20).
A) Malformación linfática. Un infiltrado linfocítico inflamatorio acompañante es un hallazgo común en las malformaciones linfáticas (hematoxilina-eosina ×100). B) Malformación arteriovenosa. En este tipo de malformación, algunos vasos se reconocen como arterias dismórficas, algunos como venas dismórficas e incluso algunos con características intermedias entre una arteria y una vena (hematoxilina-eosina ×100). C) Malformación arteriovenosa. En esta tinción para fibras elásticas, la arteria dismórfica (flecha) muestra rotura de la lámina elástica interna. En comparación, se muestra una vena dismórfica en el mismo campo (estrella) (orceína ×40). D) Malformación arteriovenosa. Las venas dismórficas aparecen agrandadas con una gruesa pared fibrótica. Una de las venas muestra material extraño utilizado para la esclerosis en su luz. También se observan grandes áreas de pequeños vasos sanguíneos proliferativos (hematoxilina-eosina ×20).
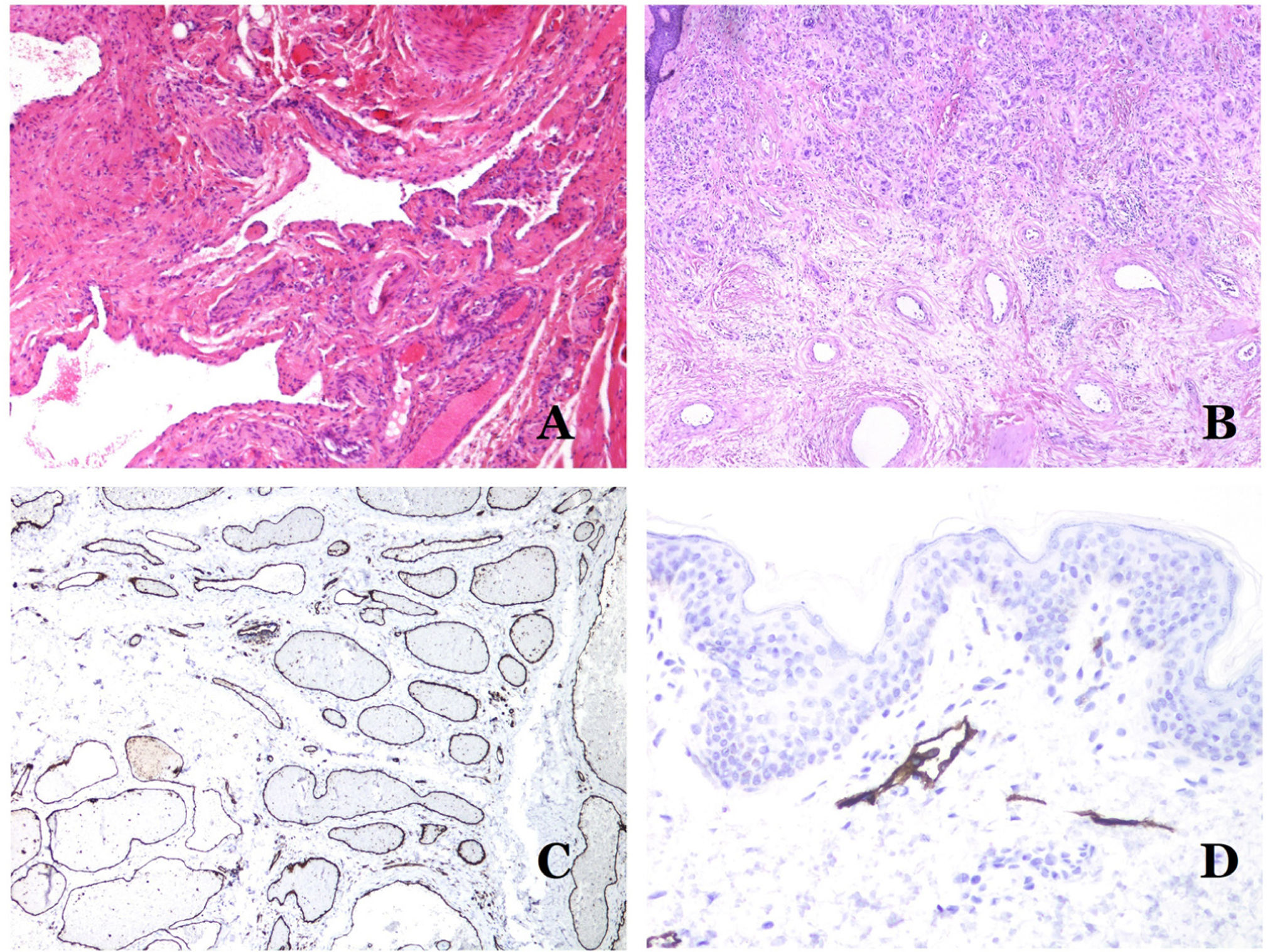
Las malformaciones arteriovenosas están formadas por arterias y venas dismórficas, así como por vasos con características morfológicas intermedias entre una vena y una arteria (fig. 12B). Las arterias dismórficas muestran rotura de la capa elástica interna (fig. 12C). Debido a la elevada presión arterial, los conductos venosos muchas veces desarrollan una pared fibrótica, desprovista de fibras elásticas (fig. 12D). Por el contrario, debido al alto flujo, los fenómenos trombóticos no son una característica de las MAV (fig. 13A). Sin embargo, los focos de proliferación microvascular son muy frecuentes36 (fig. 13B). Supuestamente son focos reactivos proliferativos en expansión. La mayoría de las veces se ven como grupos capilares, pero también pueden mostrar una morfología similar a un granuloma piógeno, o incluso cambios seudokaposiformes.
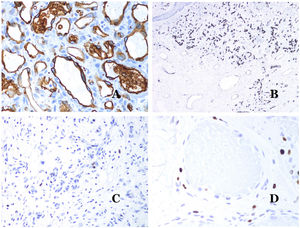
A) Malformación arteriovenosa (hematoxilina-eosina ×40). B) Foco de pequeños vasos proliferativos vasculares en una malformación vascular arteriovenosa (hematoxilina-eosina ×40). C) Malformación venosa inmunoteñida con CD31. Los endotelios positivos destacan la morfología anormal de los vasos dilatados (CD31 ×40). D) Inmunotinción para D2-40 que muestra un endotelio positivo en los linfáticos de la dermis papilar (D2-40 ×200).
Existen varios anticuerpos que pueden ayudar en el diagnóstico de las MV.
La forma irregular o dilatada de los vasos se puede resaltar utilizando marcadores endoteliales comunes como el ERG, el CD31, el Factor VIII o el CD34 (fig. 13C)25. Los 4 tiñen el endotelio tanto de los vasos sanguíneos como de los vasos linfáticos, sin embargo, el CD34 puede ser solo focalmente positivo o completamente negativo en algunos vasos linfáticos malformados, particularmente en los más grandes.
Los endotelios de los vasos linfáticos son positivos para D2-40 (fig. 13D), el receptor de hialuronano endotelial de los vasos linfáticos (LYVE-1), el PROX1 y el receptor del factor de crecimiento endotelial vascular-3 (VEGFR-3)32. La podoplanina es una proteína transmembrana que se encuentra en el endotelio de los vasos linfáticos. Varios anticuerpos comercializados reaccionan con la podoplanina, entre los cuales, el D2-40 es el más utilizado. La expresión de podoplanina está regulada por el gen PROX1. Existen anticuerpos contra la proteína transcrita por el gen y la positividad citoplasmática del endotelio se considera un marcador de naturaleza linfática37. Hay anticuerpos contra PROX1 y la inmunotinción es nuclear en lugar de citoplasmática. LYVE-1 es un receptor de hialuronano y algunos estudios han encontrado que es tan eficaz como D2-40 en la tinción del endotelio de las malformaciones linfáticas38. VEGFR-3 se expresa en el endotelio linfático y podría desempeñar un papel importante en la linfangiogénesis39. Este también se ha encontrado en la angiogénesis de los vasos sanguíneos. Por lo tanto, este marcador es mucho menos utilizado que el D2-40 o el LYVE-1 en la identificación de los vasos linfáticos.
La isoforma 1 del transportador de glucosa (GLUT-1) es un miembro de la familia de transportadores de glucosa a través de las membranas celulares. La regulación positiva de GLUT-1 se ha identificado en varias neoplasias y, por lo tanto, se ha encontrado útil para distinguirlas de ciertas entidades imitadoras, por lo que la inmunohistoquímica para GLUT-1 será útil en dichos casos. El diagnóstico diferencial entre el hemangioma infantil (GLUT-1-positivo)7 (fig. 14A) y la MV (GLUT1-negativo) es un buen ejemplo. Aunque hay que recordar que algunas malformaciones vasculares, como la malformación venosa verrugosa, son focalmente positivas para GLUT-1.
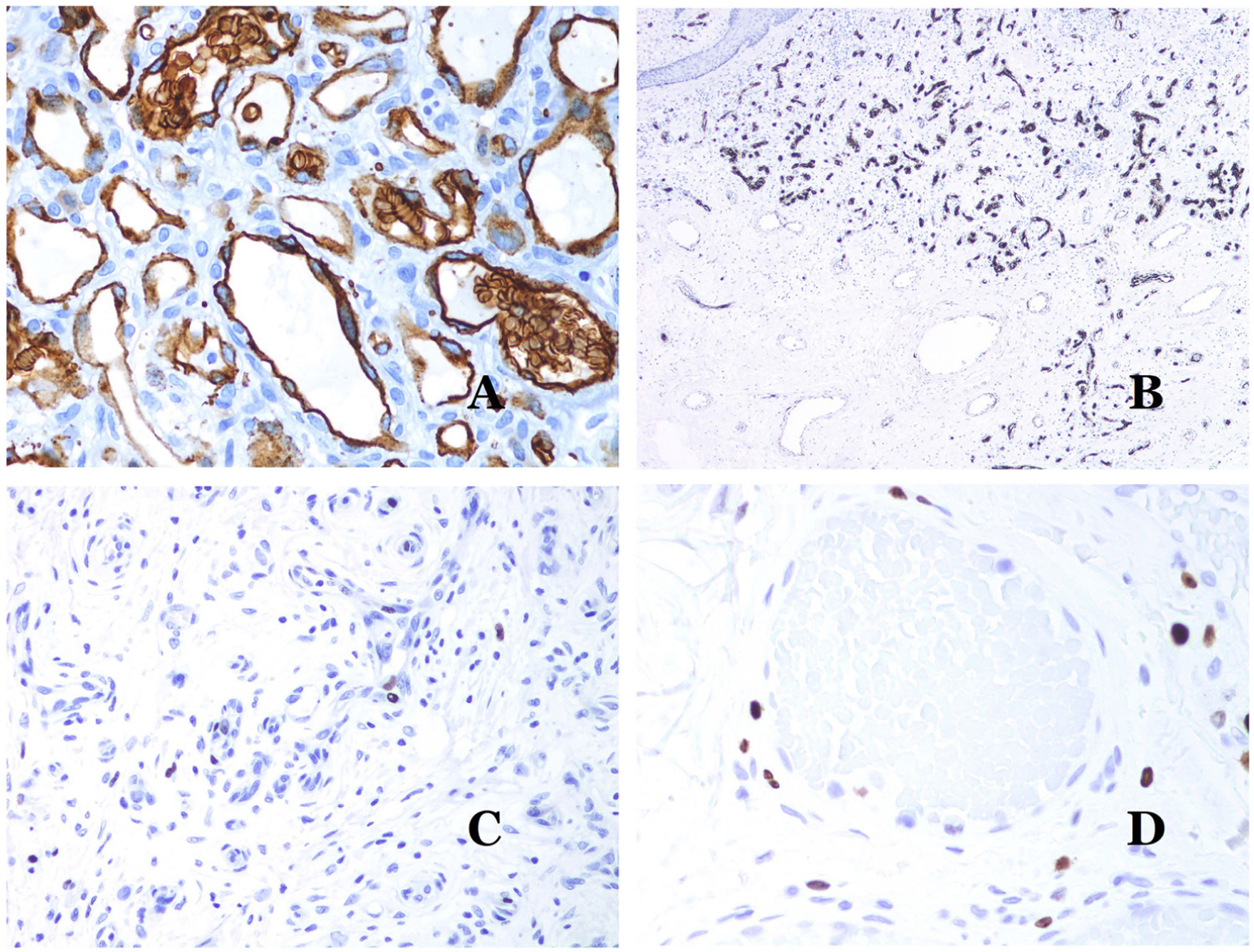
A) Hemangioma infantil positivo para GLUT-1. Los endotelios positivos se evidencian claramente. La positividad de los glóbulos rojos es útil como control (GLUT-1 ×400). B) Inmunoexpresión de WT1 en un área de pequeños vasos sanguíneos proliferativos evidenciada en una malformación arteriovenosa (hematoxilina-eosina ×40). C) Las áreas proliferativas que se observan principalmente en las malformaciones arteriovenosas son positivas para Ki-67 en un pequeño número de núcleos endoteliales (Ki67 ×200). D) Malformación vascular. Inmunotinción con Ki67. Las células endoteliales son negativas. Se debe de tener cuidado de no leer mal las celdas positivas circundantes (Ki-67 ×400).
El anticuerpo del tumor de Wilms 1 (WT1) reconoce la proteína del tumor de Wilms, codificada por un gen ubicado en el cromosoma 11p13. La proteína es expresada por varios tumores con un patrón nuclear o citoplasmático. Durante mucho tiempo se afirmó que los tumores vasculares son positivos para WT1 (expresión citoplasmática) mientras que las MV eran negativas. Esta afirmación ya no es del todo cierta40,41. La proteína se expresa en las áreas proliferativas vasculares, ya sea que ocurran en un tumor o en una malformación. Las áreas de proliferación microvascular, que se observan comúnmente en las malformaciones arteriovenosas, son positivas para WT1, al igual que las células endoteliales de los vasos más grandes (fig. 14B). WT1 también podría ser positivo en malformaciones venosas verrugosas en algunos tipos de malformaciones capilares como las que se observan en el síndrome de malformación capilar-malformación arteriovenosa. En la evaluación de la inmunotinción de WT1, se debe considerar otra dificultad frecuente: la positividad por parte de los pericitos y/o células de músculo liso. Los pericitos y las células del músculo liso se pueden marcar con actina de músculo liso (AML)42, en contraste con la capa endotelial que es AML negativa. Esto también es importante para identificar correctamente las mitosis y la expresión del Ki-67 en las células endoteliales (AML negativas) a partir de las mitosis que a veces se observan en los pericitos (AML positivas). Mientras que los tumores vasculares son lesiones proliferantes y, por lo tanto, sus células endoteliales se tiñen con Ki-67, las MV no se tiñen con Ki-67 o solo muestran proliferación en los pequeños vasos sanguíneos proliferantes recién formados (fig. 14C). Exceptuando dichos focos, las células endoteliales son negativas en las MV, en contraste con las células musculares y conectivas circundantes (fig. 14D).
ConclusionesCuando un dermatopatólogo identifica una anomalía vascular en una biopsia, varios signos deben alertarlo sobre la posibilidad de una MV, como la evidencia de vasos dismórficos o una tasa de proliferación baja o nula. La identificación del tipo de vaso dismórfico será fundamental para diagnosticar el tipo de malformación vascular. La morfología de una malformación arteriovenosa equivale a una MV de alto flujo, lo que puede corroborarse mediante una ecografía doppler o una resonancia magnética dinámica. La historia clínica completa ayudará a identificar aquellos casos en los que la MV forma parte de un síndrome. Por último, cuando sea necesario, los estudios genéticos pueden ayudar a identificar específicamente ciertas MV o síndromes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.