Los pacientes con melanoma parecen llevar al extremo las medidas de protección, lo que puede influir en los niveles de 25-hidroxivitamina D —25(OH)D—. El objetivo del estudio fue evaluar los niveles de 25(OH)D en pacientes con melanoma cutáneo e identificar factores relacionados con niveles inadecuados.
Material y métodosSe midieron prospectivamente los niveles séricos de 25(OH)D en pacientes diagnosticados de melanoma cutáneo durante un periodo de seguimiento de un año. Se evaluaron qué factores ambientales, fenotípicos y genotípicos se relacionaban con niveles insuficientes y deficientes mediante regresión logística.
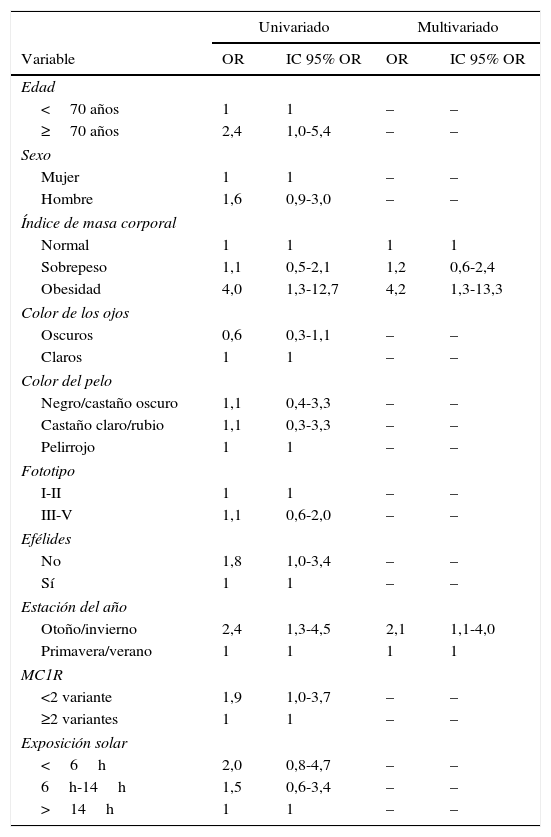
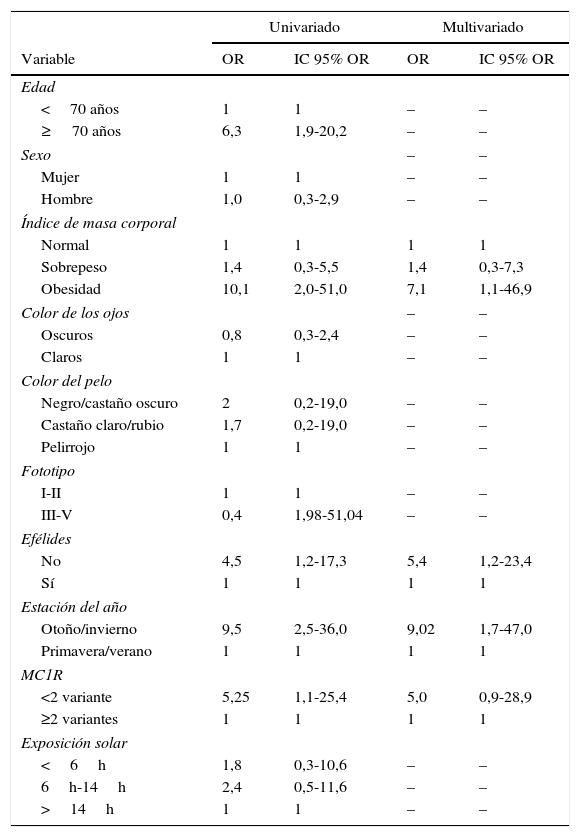
ResultadosDe un total de 215 pacientes solo un 24,7% tenían valores normales de 25(OH)D y un 8,8% tenían valores deficientes (<10ng/ml). La obesidad (OR: 4,2; IC 95% OR: 1,3-13,3) y la extracción de sangre realizada en otoño/invierno (OR: 2,1; IC 95% OR: 1,1-4) se asociaron a niveles insuficientes (<30ng/ml). Los niveles deficitarios (<10ng/m) se asociaron a la obesidad (OR: 7,1; IC 95% OR: 1,1-46,9), la extracción de sangre realizada en otoño/invierno (OR: 9,0; IC 95% OR: 1,7-47,0), la ausencia de efélides (OR: 5,4; IC 95% OR: 1,2-23,4) y, marginalmente, a la presencia de tener <2 polimorfismos no sinónimos en el receptor 1 de la melanocortina (MC1R) (OR: 5,0; IC 95% OR: 0,9-28,9).
LimitacionesNo se han incluido en el análisis algunos factores, como la alimentación, relacionados con los niveles de 25(OH)D.
ConclusionesSe deberían monitorizar los niveles de 25(OH)D en los pacientes con melanoma y valorar dar suplementos orales en los casos que lo precisen.
Patients with melanoma appear to take extreme sun-protection measures, which could influence 25-hydroxyvitamin D [25(OH)D] levels. The aim of this study was to measure 25(OH)D levels in patients with cutaneous melanoma and identify factors associated with inadequate levels.
Material and methodsOver a period of 1 year, we prospectively measured serum 25(OH)D in patients with cutaneous melanoma and used logistic regression analysis to identify environmental, phenotypic, and genotypic factors that were associated with insufficient and deficient levels.
ResultsOf 215 patients analyzed, 8.8% had deficient 25(OH)D levels (<10ng/mL) and just 24.7% had normal levels. Insufficient levels (<30ng/mL) were associated with obesity (odds ratio [OR], 4.2; 95% confidence interval [CI], 1.3-13.3) and blood sampling in autumn/winter (OR, 2.1; 95% CI, 1.1-4). Deficient levels (<10ng/mL) were associated with obesity (OR, 7.1; 95% CI, 1.1-46.9), blood sampling in autumn/winter (OR, 9.0; 95% CI, 1.7-47.0), absence of freckles (OR, 5.4; 95% CI, 1.2-23.4), and, with marginal significance, the presence of fewer than 2 nonsynonymous melanocortin-1 receptor (MC1R) polymorphisms (OR, 5.0; 95% CI, 0.9-28.9).
LimitationsSome factors related to 25(OH)D levels, such as food, were not included in the analyses.
Conclusions25(OH)D levels should be monitored in patients with melanoma and the need for oral supplements should be contemplated where appropriate.
La vitamina D es considerada como una verdadera hormona que es esencial para la homeostasis del cuerpo humano, especialmente por su función en el metabolismo óseo1. Además, su importancia en otras funciones está apoyada por diversos estudios epidemiológicos en los que se muestra una relación entre unos niveles de 25-hidroxivitamina D [25(OH)D] disminuidos en grado variable y procesos autoinmunes2–5, enfermedades cardiovasculares6–8, infecciones9 y en el desarrollo de cáncer10–13.
Se ha constatado que es relativamente frecuente encontrar un estado de deficiencia o insuficiencia de vitamina D en la población de casi todo el mundo14. El 90% de los requerimientos de vitamina D se obtienen mediante la síntesis en la piel inducida por los rayos ultravioleta de tipo B (290-320nm) de la exposición solar1. La segunda fuente de aporte de vitamina D es la dieta, principalmente a partir de alimentos como el pescado azul, los huevos y los productos lácteos, zumos o cereales que estén suplementados con vitamina D.
La síntesis de vitamina D y, por consiguiente, los niveles de 25(OH)D se pueden ver influenciados por numerosos factores tales como la latitud, el ciclo diario de exposición solar, los cambios anuales en la incidencia de la radiación solar, los factores ambientales, el color de la piel, la superficie cutánea expuesta y el empleo de filtros solares, entre otros15.
Una de las recomendaciones para la prevención del cáncer de piel es la protección frente a la radiación solar. Esta recomendación, que se realiza también en un ámbito poblacional general, recibe una mayor consideración por parte de los pacientes a los que se les ha diagnosticado un melanoma. En la práctica diaria habitual se constata, en una gran mayoría de estos pacientes, que existe un grado variable de fobia a la exposición solar que les induce a adoptar medidas de fotoprotección extremas y, por lo tanto, a una eventual influencia negativa en los niveles de 25(OH)D.
En el presente estudio el objetivo fue evaluar los niveles de 25(OH)D en una serie pacientes con melanoma cutáneo durante su seguimiento para conocer la prevalencia de insuficiencia o deficiencia e identificar qué posibles factores influyen en la presencia de niveles inadecuados o deficiencia.
Material y métodosSe diseñó un estudio observacional retrospectivo, de tipo casos-casos, sobre una muestra de 215 pacientes con melanoma cutáneo evaluados en el Servicio de Dermatología del Instituto Valenciano de Oncología durante el periodo comprendido entre el 1 de marzo de 2011 y el 31 de mayo de 2012. Los pacientes son residentes en la Comunidad Valenciana, territorio cuya latitud es 39°. El índice UV a lo largo del año oscila desde el 1 de media durante los meses de diciembre y enero hasta el 8 de media durante los meses de junio y julio16.
Se incluyeron en el estudio aquellos pacientes que fueron visitados durante su seguimiento y a los que estaba previsto incluir un análisis de sangre entre las pruebas previstas en su evaluación rutinaria.
La variable principal objeto del estudio fue el nivel de 25(OH)D, que se analizó mediante un inmunoanálisis de quimioluminiscencia en un autoanalizador Liaison®. (sensibilidad funcional<4ng/ml. Valor de normalidad 30ng/ml). Posteriormente se transformó esta variable de cuantitativa a cualitativa clasificándola en 3 niveles, de acuerdo a los establecidos en la literatura, en deficiencia (<10ng/ml), insuficiencia (10-30ng/ml) y normal (>30-88ng/ml)17,18.
A efectos del estudio se consideraron 2 situaciones. La primera, la presencia de valores inadecuados de 25(OH)D (deficitarios+insuficientes) respecto a los adecuados y la segunda la presencia de valores deficitarios respecto a niveles adecuados.
En todos los pacientes se recogieron sistemáticamente las características de la exposición solar en un cuestionario estructurado, previamente validado19, que fue cumplimentado mediante una entrevista telefónica realizada de forma ciega, sin conocer el valor de los niveles de 25(OH)D, durante el mes siguiente a la toma de la muestra sanguínea para minimizar el sesgo de memoria. Además, de la base de datos de melanoma se obtuvo la información fenotípica y genotípica del paciente. A efectos del estudio se seleccionaron las siguientes variables: la edad (<70 años vs. ≥70 años), el sexo, el índice de masa corporal (IMC) (bajo peso<18,5kg/m2; peso normal 18,5-24,99kg/m2; sobrepeso 25-29,9kg/m2 y≥30kg/m2 obesidad20), el color del pelo (pelirrojo, castaño claro/rubio o castaño oscuro/negro), el color de los ojos (oscuros o claros), el fototipo (i-ii vs. iii-v), la presencia o ausencia de efélides, los polimorfismos no sinónimos en el gen del receptor 1 de la melanocortina (MC1R) (la metodología de secuenciación Sanger por la que se analizó el gen y la distribución de polimorfismos en nuestra población ha sido descrita con detalle en un trabajo previo21; a efectos del presente estudio se clasificó en <2 polimorfismos, ≥2 polimorfismos), la cantidad relativa de exposición solar semanal durante los 4 meses previos a la fecha de la extracción (horas con una exposición de al menos un 25% del área corporal, calculada según el tiempo y la superficie corporal expuesta utilizando la regla de los 9 de Wallace y posteriormente categorizada en 3 grupos<6h, 6-14h o>14h) y la estación en la que se realizó la extracción sanguínea (otoño/invierno vs. primavera/verano).
Se comparó la distribución de las variables independientes en relación con la variable 25(OH)D mediante tablas de contingencia y la prueba estadística de la Chi-cuadrado de Pearson. El grado de asociación entre las variables con cada uno de los grupos definidos (niveles insuficientes y niveles deficientes) fue cuantificado mediante regresión logística uni- y multivariada, con la que se obtuvo las correspondientes odds ratio (OR) y su intervalo de confianza del 95%. En los modelos multivariados fueron evaluadas todas aquellas variables con un valor de p<0,1 en el estudio univariado y la significación estadística fue establecida para valores de p<0,05.
Los análisis estadísticos fueron realizados con el programa SPSS versión 15.0 (Statistical Package SPSS Inc, Chicago, IL).
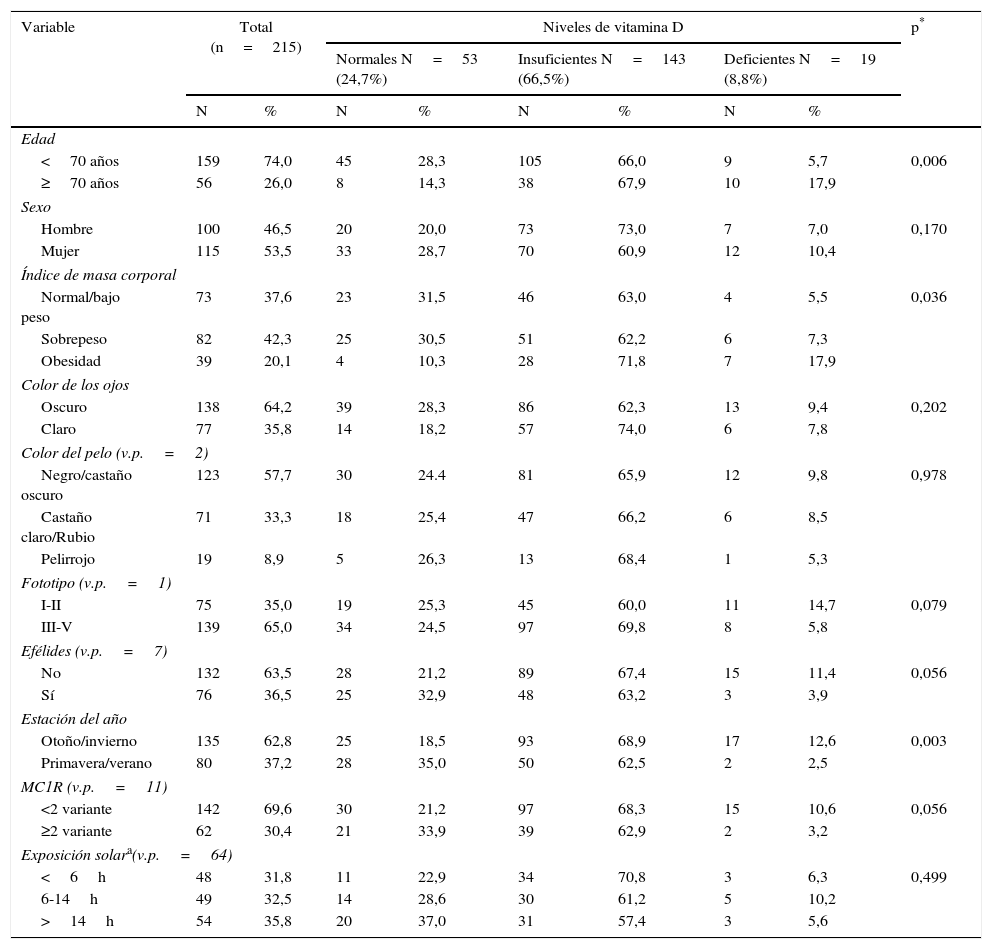
ResultadosEn el estudio se incluyeron 250 pacientes diagnosticados de melanoma, de los cuales 5 se negaron a participar y 30 no pudieron ser contactados para realizar la encuesta, por lo que la muestra final del estudio incluyó a 215 pacientes. Las características de la población final estudiada en relación con las variables de estudio y los niveles de 25(OH)D se detallan en la tabla 1. La mediana de edad de los pacientes en el momento de la toma de la muestra fue de 56 años (intervalo entre 19 y 93 años). Un 42,3% de los pacientes presentaba sobrepeso, no hubo ningún paciente con bajo peso y predominaban personas de ojos oscuros, con un color del cabello negro o castaño oscuro y sin efélides.
Características de la población estudiada según los niveles de vitamina D
| Variable | Total (n=215) | Niveles de vitamina D | p* | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Normales N=53 (24,7%) | Insuficientes N=143 (66,5%) | Deficientes N=19 (8,8%) | |||||||
| N | % | N | % | N | % | N | % | ||
| Edad | |||||||||
| <70 años | 159 | 74,0 | 45 | 28,3 | 105 | 66,0 | 9 | 5,7 | 0,006 |
| ≥70 años | 56 | 26,0 | 8 | 14,3 | 38 | 67,9 | 10 | 17,9 | |
| Sexo | |||||||||
| Hombre | 100 | 46,5 | 20 | 20,0 | 73 | 73,0 | 7 | 7,0 | 0,170 |
| Mujer | 115 | 53,5 | 33 | 28,7 | 70 | 60,9 | 12 | 10,4 | |
| Índice de masa corporal | |||||||||
| Normal/bajo peso | 73 | 37,6 | 23 | 31,5 | 46 | 63,0 | 4 | 5,5 | 0,036 |
| Sobrepeso | 82 | 42,3 | 25 | 30,5 | 51 | 62,2 | 6 | 7,3 | |
| Obesidad | 39 | 20,1 | 4 | 10,3 | 28 | 71,8 | 7 | 17,9 | |
| Color de los ojos | |||||||||
| Oscuro | 138 | 64,2 | 39 | 28,3 | 86 | 62,3 | 13 | 9,4 | 0,202 |
| Claro | 77 | 35,8 | 14 | 18,2 | 57 | 74,0 | 6 | 7,8 | |
| Color del pelo (v.p.=2) | |||||||||
| Negro/castaño oscuro | 123 | 57,7 | 30 | 24.4 | 81 | 65,9 | 12 | 9,8 | 0,978 |
| Castaño claro/Rubio | 71 | 33,3 | 18 | 25,4 | 47 | 66,2 | 6 | 8,5 | |
| Pelirrojo | 19 | 8,9 | 5 | 26,3 | 13 | 68,4 | 1 | 5,3 | |
| Fototipo (v.p.=1) | |||||||||
| I-II | 75 | 35,0 | 19 | 25,3 | 45 | 60,0 | 11 | 14,7 | 0,079 |
| III-V | 139 | 65,0 | 34 | 24,5 | 97 | 69,8 | 8 | 5,8 | |
| Efélides (v.p.=7) | |||||||||
| No | 132 | 63,5 | 28 | 21,2 | 89 | 67,4 | 15 | 11,4 | 0,056 |
| Sí | 76 | 36,5 | 25 | 32,9 | 48 | 63,2 | 3 | 3,9 | |
| Estación del año | |||||||||
| Otoño/invierno | 135 | 62,8 | 25 | 18,5 | 93 | 68,9 | 17 | 12,6 | 0,003 |
| Primavera/verano | 80 | 37,2 | 28 | 35,0 | 50 | 62,5 | 2 | 2,5 | |
| MC1R (v.p.=11) | |||||||||
| <2 variante | 142 | 69,6 | 30 | 21,2 | 97 | 68,3 | 15 | 10,6 | 0,056 |
| ≥2 variante | 62 | 30,4 | 21 | 33,9 | 39 | 62,9 | 2 | 3,2 | |
| Exposición solara(v.p.=64) | |||||||||
| <6h | 48 | 31,8 | 11 | 22,9 | 34 | 70,8 | 3 | 6,3 | 0,499 |
| 6-14h | 49 | 32,5 | 14 | 28,6 | 30 | 61,2 | 5 | 10,2 | |
| >14h | 54 | 35,8 | 20 | 37,0 | 31 | 57,4 | 3 | 5,6 | |
v.p.: valores perdidos.
Los grupos definidos para los niveles de 25(OH)D se relacionaban de forma estadísticamente significativa con la edad, el IMC y el periodo de extracción. Además, se observó una relación marginal con las efélides y los polimorfismos en MC1R (tabla 1).
En primer lugar se estudiaron las variables que se relacionaban con la presencia de valores inadecuados de 25(OH)D (deficientes+insuficientes). En el análisis univariado la edad superior a los 70 años, la obesidad y la extracción de sangre realizada en otoño/invierno (tabla 2). Tras el estudio multivariado solo se mantuvieron en el modelo final la obesidad (OR: 4,2; IC 95% OR: 1,3-13,3) y la extracción de sangre realizada en otoño/inverno (OR: 2,1; IC 95% OR: 1,1-4) (tabla 2).
Estudio de regresión logística uni- y multivariado para la evaluación de factores relacionados con niveles de 25-hidroxivitamina D inadecuados (insuficientes y deficientes) respecto a normales
| Univariado | Multivariado | |||
|---|---|---|---|---|
| Variable | OR | IC 95% OR | OR | IC 95% OR |
| Edad | ||||
| <70 años | 1 | 1 | – | – |
| ≥70 años | 2,4 | 1,0-5,4 | – | – |
| Sexo | ||||
| Mujer | 1 | 1 | – | – |
| Hombre | 1,6 | 0,9-3,0 | – | – |
| Índice de masa corporal | ||||
| Normal | 1 | 1 | 1 | 1 |
| Sobrepeso | 1,1 | 0,5-2,1 | 1,2 | 0,6-2,4 |
| Obesidad | 4,0 | 1,3-12,7 | 4,2 | 1,3-13,3 |
| Color de los ojos | ||||
| Oscuros | 0,6 | 0,3-1,1 | – | – |
| Claros | 1 | 1 | – | – |
| Color del pelo | ||||
| Negro/castaño oscuro | 1,1 | 0,4-3,3 | – | – |
| Castaño claro/rubio | 1,1 | 0,3-3,3 | – | – |
| Pelirrojo | 1 | 1 | – | – |
| Fototipo | ||||
| I-II | 1 | 1 | – | – |
| III-V | 1,1 | 0,6-2,0 | – | – |
| Efélides | ||||
| No | 1,8 | 1,0-3,4 | – | – |
| Sí | 1 | 1 | – | – |
| Estación del año | ||||
| Otoño/invierno | 2,4 | 1,3-4,5 | 2,1 | 1,1-4,0 |
| Primavera/verano | 1 | 1 | 1 | 1 |
| MC1R | ||||
| <2 variante | 1,9 | 1,0-3,7 | – | – |
| ≥2 variantes | 1 | 1 | – | – |
| Exposición solar | ||||
| <6h | 2,0 | 0,8-4,7 | – | – |
| 6h-14h | 1,5 | 0,6-3,4 | – | – |
| >14h | 1 | 1 | – | – |
En segundo lugar se evaluó qué factores se relacionaban con unos niveles deficitarios de 25(OH)D en relación con los normales (tabla 3). En el análisis univariado alcanzaron significación estadística la edad por encima de los 70 años, la obesidad, un fototipo iii-v, la ausencia de efélides, la extracción de sangre realizada en otoño/invierno y la presencia de <2 polimorfismos en el gen MC1R. Tras el análisis multivariado, permanecieron como variables significativamente asociadas a unos niveles deficitarios de 25(OH)D la obesidad (OR: 7,1; IC 95% OR: 1,1-46,9), la extracción de sangre realizada en otoño/invierno (OR: 9,0; IC 95% OR: 1,7-47,0), la ausencia de efélides (OR: 5,4; IC 95% OR: 1,2-23,4) y, aunque con un grado de significación marginal, también estaba incluida en el modelo predictivo la presencia de tener <2 polimorfismos en MC1R (OR: 5,0; IC 95% OR: 0,9-28,9) (tabla 3).
Estudio de regresión logística uni- y multivariado para la evaluación de factores relacionados con niveles de 25-hidroxivitamina D deficientes respecto a normales
| Univariado | Multivariado | |||
|---|---|---|---|---|
| Variable | OR | IC 95% OR | OR | IC 95% OR |
| Edad | ||||
| <70 años | 1 | 1 | – | – |
| ≥70 años | 6,3 | 1,9-20,2 | – | – |
| Sexo | – | – | ||
| Mujer | 1 | 1 | – | – |
| Hombre | 1,0 | 0,3-2,9 | – | – |
| Índice de masa corporal | ||||
| Normal | 1 | 1 | 1 | 1 |
| Sobrepeso | 1,4 | 0,3-5,5 | 1,4 | 0,3-7,3 |
| Obesidad | 10,1 | 2,0-51,0 | 7,1 | 1,1-46,9 |
| Color de los ojos | – | – | ||
| Oscuros | 0,8 | 0,3-2,4 | – | – |
| Claros | 1 | 1 | – | – |
| Color del pelo | ||||
| Negro/castaño oscuro | 2 | 0,2-19,0 | – | – |
| Castaño claro/rubio | 1,7 | 0,2-19,0 | – | – |
| Pelirrojo | 1 | 1 | – | – |
| Fototipo | ||||
| I-II | 1 | 1 | – | – |
| III-V | 0,4 | 1,98-51,04 | – | – |
| Efélides | ||||
| No | 4,5 | 1,2-17,3 | 5,4 | 1,2-23,4 |
| Sí | 1 | 1 | 1 | 1 |
| Estación del año | ||||
| Otoño/invierno | 9,5 | 2,5-36,0 | 9,02 | 1,7-47,0 |
| Primavera/verano | 1 | 1 | 1 | 1 |
| MC1R | ||||
| <2 variante | 5,25 | 1,1-25,4 | 5,0 | 0,9-28,9 |
| ≥2 variantes | 1 | 1 | 1 | 1 |
| Exposición solar | ||||
| <6h | 1,8 | 0,3-10,6 | – | – |
| 6h-14h | 2,4 | 0,5-11,6 | – | – |
| >14h | 1 | 1 | – | – |
En este estudio, sobre una serie de 215 pacientes, se ha constatado que solo el 25% de los pacientes con melanoma tiene unos niveles de 25(OH)D adecuados, al menos para los valores de referencia establecidos para la homeostasis del metabolismo óseo. Además, se ha observado que la obesidad y la estación del año son los factores que más influyen en los niveles de 25(OH)D. Por otra parte, que el sujeto tenga unas características pigmentarias más oscuras, reflejado en la ausencia de efélides y en el patrón de polimorfismos en MC1R, tiene un impacto relevante especialmente para los estados deficientes.
El hallazgo de que los pacientes con melanoma tengan un porcentaje elevado de niveles insuficientes de 25(OH)D ya ha sido descrito previamente en la literatura. Así, en un estudio realizado en Barcelona sobre 81 pacientes recientemente diagnosticados de melanoma se encontraron unos niveles insuficientes en un 68% de los casos, con una relación exclusiva con la estación del año de la extracción22. En la presente serie, con un número mayor de casos, pero evaluando los niveles en pacientes en seguimiento, el porcentaje es discretamente superior, lo que puede evidenciar que tras el diagnóstico los pacientes incrementan, a veces de forma extrema, las medidas de protección solar, y ello puede repercutir en los niveles de 25(OH)D. En cualquier caso, el porcentaje de pacientes con niveles insuficientes exceden el 33% encontrado en España en la población general23. Además, conviene subrayar que el 8,8% de los pacientes presentaban niveles inferiores a <10ng/ml (deficientes), un porcentaje que es discretamente superior respecto al encontrado en estudios nacionales e internacionales14,23,24. Desde hace años existe un consenso universal de que la medición en sangre para valorar los niveles de vitamina D debe ser a partir del metabolito 25(OH)D. Sin embargo, hay que ser cuidadosos con la interpretación de los estudios epidemiológicos o ensayos clínicos aleatorizados y su comparación con nuestros resultados, ya que la precisión y exactitud de las mediciones, así como el porcentaje, varía de unos estudios a otros22. Además, la mayoría de los estudios incluyen poblaciones por encima de los 65 años, ya que su objetivo es su implicación en el metabolismo óseo.
La relación inversamente proporcional encontrada entre los niveles y el IMC coincide con otras publicaciones, y subraya el secuestro que realiza el tejido adiposo de esta vitamina25–27. Hay estudios que evidencian que niveles subóptimos de vitamina D están implicados en el desarrollo de melanoma, en un mayor índice de Breslow, mayores tasas de recaídas e incluso una menor supervivencia, ya que la vitamina D parece inhibir la invasión y las micrometástasis locales durante el desarrollo tumoral precoz28–30, sin apreciar esta influencia en etapas posteriores de progresión. Más recientemente, otros autores han encontrado que los niveles bajos de vitamina D durante el seguimiento no parecen estar asociados a un peor pronóstico31. Por otra parte, se han publicado los resultados de ensayos clínicos en los que se ha evaluado el beneficio de la suplementación con vitamina D en adyuvancia al tratamiento del melanoma de alto riesgo, con resultados que sugieren que esta medida podría retrasar la recurrencia del melanoma y mejorar el pronóstico global32.
En la interpretación de nuestros resultados hay que hacer una serie de consideraciones. En primer lugar, una de las limitaciones de este estudio es que no se han recogido otros parámetros que pueden haber influido en los niveles de vitamina D, fundamentalmente la dieta, el uso de fotoprotectores, el índice UV del periodo de exposición solar y, en menor medida, el hábito tabáquico y el ejercicio físico. Tampoco se han estudiado las variantes genéticas en genes implicados en el metabolismo de la vitamina D, como por ejemplo el receptor VDR, que además de poder influir en los niveles, se ha relacionado directamente en diversos estudios con el desarrollo y progresión de melanoma33,34. Por otra parte, el tamaño muestral puede haber determinado que algunas variables que influyen en el nivel de 25(OH)D no hayan alcanzado la significación estadística.
En el estudio no se analizó el tiempo transcurrido desde el diagnóstico que potencialmente podría haber modificado los hábitos de exposición de los pacientes con una posible relajación de las medidas preventivas con el transcurso de los años. Sin embargo, la experiencia personal de los autores no parece indicar que haya un cambio sustancial en la mayoría de los pacientes en este aspecto a lo largo del tiempo de seguimiento.
En conclusión, aunque todavía se debate en la actualidad cuáles son los niveles de 25(OH)D necesarios y cuál es la dosis a emplear para conseguir esos niveles, los resultados de nuestro estudio sugieren que es importante estudiar los niveles de 25(OH)D en los pacientes con melanoma, especialmente durante los meses de otoño e invierno y en personas obesas, y que debería considerarse la suplementación en aquellos casos con niveles insuficientes para garantizar, al menos, un metabolismo óseo adecuado. El posible valor añadido en el pronóstico y en la disminución del riesgo de otras enfermedades respalda aún más la puesta en práctica de esta medida.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
AutoríaS. Hernández Ostiz y M.D. Pérez Ramada han contribuido por igual en el estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.