INTRODUCCION
El melanoma es el tumor maligno cuya incidencia está aumentando de forma más rápida en los últimos años. Las estadísticas indican que entre los años 1950 y 1970 el número de casos nuevos por año se triplicó en el mundo, siendo la neoplasia que experimentó un incremento más acentuado (1). Datos del registro de cáncer de Australia indican que en este país en 1993 la incidencia por 100.000 habitantes fue en hombres de 41,4 y en mujeres de 33,6 (2). En España carecemos de estadísticas amplias fiables. El único intento a nivel nacional fue realizado por la Academia Española de Dermatología y Venereología durante el año 1997 con el Registro Nacional de Melanoma. Los datos preliminares fueron presentados por Salvio Serrano en el Congreso Nacional de Santander (1998) con una cifra cercana a seis-siete casos nuevos por 100.000 habitantes (3). La experiencia de los hospitales que tienen unidades dedicadas a melanoma es bastante parecida. La Unidad de Tumores Pigmentarios del Hospital Gregorio Marañón de Madrid da cobertura sanitaria a una población aproximada de 650.000 habitantes. En ella la incidencia anual por 100.000 habitantes ha sido de 5,5 en 1997, seis en 1998 y siete en 1999. Si a esto unimos que afecta a personas jóvenes y que produce una alta mortalidad, podemos perfectamente entender que constituya un problema importante de salud pública en todo el mundo.
En el melanoma, la fase de enfermedad locorregional sigue siendo un paso intermedio clave entre la enfermedad localizada y la metastásica. La afectación locorregional empeora claramente el pronóstico, pero todavía existe la posibilidad de realizar un tratamiento curativo. Cuando las células tumorales rebasan los ganglios regionales el pronóstico del enfermo cambia radicalmente. Con metástasis a distancia no existe ningún tratamiento útil, sólo tratamientos paliativos (4). Lee y cols. (5) publicaron en febrero del 2000 un metaanálisis sobre la supervivencia media de los enfermos de melanoma cutáneo con metástasis a distancia basándose en todos los artículos publicados en lengua inglesa de 1985 a 1999. Incluye 85 trabajos y 6.322 pacientes. En ellos, con independencia del tratamiento realizado, la supervivencia media desde el diagnóstico de las metástasis fue de 8 meses viviendo a los 5 años solamente el 2,3% de los pacientes. Datos tan desalentadores hacen que se intente por todos los medios diagnosticar y tratar a los enfermos de melanoma cutáneo lo más precozmente posible, buscando eliminar todas las células tumorales antes de que hayan adquirido capacidad de sobrevivir a distancia.
LA LINFADENECTOMÍA REGIONAL EN EL MELANOMA
El tratamiento del melanoma es eminentemente quirúrgico. Hay acuerdo general de que la lesión primitiva debe ser extirpada, pero no sobre qué hacer con los ganglios linfáticos regionales. En los enfermos con metástasis en los ganglios regionales (estadio III), una vez descartada la presencia de metástasis a distancia, la linfadenectomía regional terapéutica ha demostrado mejorar la supervivencia (6). Sin embargo, la utilidad de la linfadenectomía en los enfermos en estadios I y II ha sido debatido durante décadas y aún hoy sigue siendo discutida. Se denomina linfadenectomía regional profiláctica a la que se realiza en todos los enfermos portadores de melanoma sin evidencia clínica de metástasis ganglionares regionales y linfadenectomía regional electiva a la realizada en algunos casos seleccionados de melanoma sin evidencia clínica de metástasis ganglionares regionales (7). Para resolver este conflicto se iniciaron en los últimos años varios ensayos clínicos quirúrgicos prospectivos y aleatorios intentando responder a tres preguntas: a)¿cuál es el momento más idóneo para realizar la linfadenectomía regional: de forma inmediata, junto a la extirpación de la lesión primitiva sin demostración de metástasis, o diferida al momento de apreciarse clínicamente metástasis regionales?; b)¿hay algún subgrupo de enfermos con alto riesgo de presentar metástasis regionales microscópicas que pudiera beneficiarse de la linfadenectomía regional electiva?, y c) ¿si lo hay, cómo podemos identificarlo? (8). En la actualidad disponemos de la información de cuatro amplios estudios que aportan datos importantes y algunas conclusiones. Cronológicamente, el primero fue el realizado por la OMS (Melanoma Group Trial n.° 1) iniciado en 1967; en él se incluyeron 553 enfermos con melanoma localizado en las extremidades inferiores. De ellos, el 52% recibieron sólo amplia excisión y el resto, además, linfadenectomía. En este estudio no se obtuvieron diferencias significativas en la supervivencia entre ambos grupos considerados globalmente ni al ser evaluados en función del sexo, grosor del tumor y presencia de ulceración (9, 10). El segundo fue iniciado en la Clínica Mayo en 1971, incluyendo 171 pacientes con melanoma en estadios I y II. Fueron divididos en tres grupos según el tratamiento realizado: a) sólo extirpación; b) extirpación y linfadenectomía diferida entre 30 y 60 días, y c) extirpación y linfadenectomía conjunta. Los resultados tampoco fueron concluyentes (11). En los dos trabajos más recientes ha habido subgrupos de enfermos que se han beneficiado de la linfadenectomía regional profiláctica. El estudio del Intergroup Melanoma Surgical Trial, coordinado por Balch, fue iniciado en 1983 incluyendo un total de 737 pacientes con melanoma localizado con un grosor de entre 1 y 4 mm. Es el primer ensayo clínico prospectivo en el que a todos los pacientes les fue realizada linfografía isotópica previa a la linfadenectomía para detectar con exactitud cual era la cadena ganglionar regional. Globalmente no hubo diferencia en la supervivencia a los 5 años entre el grupo control y los tratados con linfadenectomía regional profiláctica; sin embargo, cuando la comparación se realizaba en subgrupos pronósticos, sí había diferencia estadísticamente significativa en los enfermos de menos de 60 años con tumor entre 1 y 2 mm de Breslow o no ulcerado (12). Finalmente tenemos el trabajo organizado por la OMS (Melanoma Group Trial n.° 14) (13), iniciado en 1982, en el que se han incluido 227 pacientes con lesión de más de 1,5 mm de profundidad localizada en el tronco. Los enfermos fueron aleatorizados en dos grupos: a) linfadenectomía regional profiláctica, y b) linfadenectomía regional diferida al momento de aparecer metástasis ganglionares regionales. A los 5 años la supervivencia de los pacientes tratados con linfadenectomía regional profiláctica fue del 61,7% frente a un 51,3% del grupo diferido, aunque esta diferencia no fue estadísticamente significativa. Pero la diferencia fue altamente significativa al comparar la supervivencia de los enfermos con metástasis ocultas en los ganglios extirpados de manera profiláctica (48,2%) frente a aquellos en los que la extirpación fue diferida (26,6%). Cascinelli y cols. concluyeron el resumen del trabajo diciendo: «La extirpación ganglionar aumenta solamente la supervivencia de los enfermos con metástasis ganglionares. La biopsia del ganglio centinela (BGC) puede llegar a ser una herramienta para identificar aquellos pacientes con metástasis ganglionares ocultas a los que se les podría realizar entonces la disección ganglionar.» Estos datos coinciden con los de varios estudios previos en los que se comparó la supervivencia de los enfermos con metástasis clínicamente ocultas, detectadas por una linfadenectomía regional profiláctica, y los que fueron tratados con una linfadenectomía regional terapéutica al presentar metástasis ganglionares clínicamente palpables. En casi todos hay una diferencia en la supervivencia a los 5 años del 25% (14-19). Como apuntan Morton y cols., la mejoría de la supervivencia probablemente es debida a la extirpación de enfermedad metastásica en una fase inicial de su historia natural, cuando todavía el melanoma está confinado a los linfáticos regionales (20).
En resumen, no está indicado realizar linfadenectomía regional profiláctica de manera rutinaria a todos los pacientes con melanoma, pero parece que hay un subgrupo de enfermos que sí pueden beneficiarse de ella. Son aquellos que presentan micrometástasis en los ganglios regionales en el momento del tratamiento de la lesión primitiva. Si tuviéramos algún método objetivo de demostrar la presencia de estas micrometástasis mejoraríamos la supervivencia de estos enfermos. La BGC probablemente nos permita identificarlos.
CONCEPTO DE GANGLIO CENTINELA. ESTUDIOS EN ANIMALES
En 1990, durante el congreso de la estadounidense Society of Surgical Oncology, Morton propuso una nueva técnica para demostrar la presencia de metástasis en los ganglios regionales y aportar con ello una potencial solución a la discusión sobre la realización o no de una linfadenectomía regional profiláctica en pacientes con melanoma en estadio I. La técnica fue denominada «mapeo linfático intraoperatorio y linfadenectomía del ganglio centinela» (intraoperative lymphatic mapping and sentinel lymphadenectomy) (21). Se basaba en unos principios anatómicos y fisiológicos lógicos para identificar la presencia de metástasis en los ganglios regionales: el concepto de ganglio centinela. Según esta idea cada zona de la piel tiene su patrón específico de drenaje linfático siguiendo unas vías linfáticas constantes. El flujo linfático llega a los linfáticos regionales de forma secuencial no aleatoria. Se denomina ganglio centinela al primer ganglio de los linfáticos regionales que recibe de forma directa el drenaje linfático desde la piel (20, 22). Para confirmar esta hipótesis de trabajo su grupo había realizado previamente diferentes estudios en un modelo felino. La elección de este animal se debe a que el gato tiene una anatomía linfática regional más parecida al ser humano que los otros animales de laboratorio. La inyección intradérmica de varias sustancias en diferentes zonas de la piel de los gatos adultos demostraba repetidamente en todos ellos que el flujo linfático tiene un patrón específico de drenaje, primero a un ganglio linfático dentro de los ganglios regionales. También ya entonces comprobaron que el ganglio centinela no era obligatoriamente el ganglio más cercano a la zona de la piel donde se introducía la inyección intradérmica. De los colorantes utilizados el azul de isosulfán fue el más adecuado (23). Posteriormente, utilizando también modelos animales, otros autores han demostrado que las inyecciones de radiocoloides en la piel siguen las mismas vías linfáticas y marcan los mismos ganglios que el azul de isosulfán (24).
La aplicación del concepto de ganglio centinela en los tumores malignos tendría una clara consecuencia práctica: el ganglio centinela sería el primer escalón en el tránsito de las células neoplásicas desde la lesión primitiva cutánea hasta la cadena ganglionar locorregional. Su extirpación y posterior demostración de presencia o ausencia de células tumorales permitiría afirmar la existencia o no de afectación ganglionar y tomar una actitud terapéutica en consecuencia.
BIOPSIA DEL GANGLIO CENTINELA EN EL MELANOMA
En 1992, Morton y cols. publicaron su primer trabajo sobre la utilización de la BGC en el melanoma (20). Su hipótesis de trabajo fue simple: el melanoma produce metástasis ganglionares de forma ordenada, secuencial, no aleatoria; el estudio histológico del ganglio centinela reflejaría de manera cierta y segura la del resto de los ganglios de la cadena linfática regional. Por tanto, estos pacientes podrían estar efectivamente estadiados a nivel ganglionar con una técnica quirúrgica mucho más conservadora que la linfadenectomía regional completa. En su primer trabajo incluyó 223 pacientes a los que les fue realizada la extirpación del ganglio centinela e inmediatamente linfadenectomía regional. El 21% de los ganglios centinelas estudiados presentaban micrometástasis; en menos del 1% de los casos con ganglio centinela negativo hubo metástasis en el resto de la cadena ganglionar.
Confirmando la progresión ordenada de la metástasis ganglionares en el melanoma aparecieron casi inmediatamente varios trabajos provenientes de otros centros de prestigio en el tratamiento del melanoma: Anderson Cancer Center (25), Le Moffit Cancer Center (26), Sidney Melanoma Unit (27), Universidad de Vermont (28).
Casi todos los trabajos posteriores han confirmado que la ausencia de células tumorales en el ganglio centinela excluye la presencia de metástasis en el resto de los ganglios regionales salvo por error en la detección, pero algunos aportan datos discrepantes. Blaheta y cols. (29) han publicado en Alemania a finales de 1999 un trabajo basado en los resultados del estudio de 73 enfermos utilizando para la detección de micrometástasis la RT-PCR de la tirosinasa. En total estudiaron 148 ganglios centinela y 646 ganglios no centinela obtenidos mediante la linfadenectomía regional realizada en el mismo acto quirúrgico, inmediatamente después de la extirpación del ganglio centinela. En 8 enfermos (11%) el ganglio centinela fue negativo y los otros ganglios positivos. Ellos no analizan en la discusión si el motivo de esta diferencia fue por fallos técnicos en la obtención del ganglio centinela o si realmente piensan que hay algunos casos en los que las metástasis ganglionares se saltan el ganglio centinela. Hatta y cols. (30) realizaron el esquema completo de las metástasis microscópicas y submicroscópicas de los ganglios inguinales obtenidos en la linfadenectomía regional electiva o terapéutica de 13 enfermos con melanoma. Sus resultados muestran considerable variación en los patrones de distribución de las metástasis ocultas, detectadas mediante la RT-PCR de la tirosinasa. De una forma mucho más crítica con el concepto de ganglio centinela y progresión ordenada de las metástasis ganglionares, Lukowsky (31) ha publicado una revisión en la que mediante la RT-PCR de la tirosinasa encontraban en siete de 24 pacientes ganglio centinela negativo y otros ganglios positivos
INDICACIÓN DE LA BIOPSIA DEL GANGLIO CENTINELA
La BGC busca detectar la presencia de micrometástasis en los ganglios regionales. Está indicada en aquellos enfermos que clínicamente sólo tienen enfermedad localizada. Siguiendo el estadiaje los enfermos en estadio Ib y II, es decir, melanoma de más de 0,75 mm. Quedan excluidos los melanomas de menos de 0,75 mm ya que en ellos la probabilidad de encontrar una positividad es muy baja. Haddad y cols. (32) revisaron el resultado del estudio del ganglio centinela en 688 pacientes del Lee Moffitt Cancer Center correlacionándolo con la profundidad de invasión de la lesión primitiva. De ellos, 100 (14,52%) pacientes tuvieron ganglio centinela positivo, siendo los porcentajes: de < 0,76 mm el 0%, de 0,76-1,0 de mm el 5,3%, de 1,0-1,5 mm el 8%, de 1,5-4,0 mm el 19% y de > 4,0 mm el 29%. Lenisa y cols. (33), en Italia, recogieron los resultados de 540 enfermos tratados en Milán y Cesena. El ganglio centinela fue positivo en el 15% y la distribución de acuerdo con el grosor de la lesión primitiva fue: < 1 mm el 1%, 1-1,99 el 5%, 2-2,99 el 18% y > o = 3 mm el 27%. Una situación parecida se produce en los melanomas entre 0,75 y 1 mm. En algunos trabajos se incluyen y en otros no; en el ensayo clínico conjunto del grupo del Anderson Cancer Center y Lee Moffitt Cancer Center, con 612 enfermos, indican que sus criterios de inclusión son: tumores de más de 1 mm o, si tienen menos, que estén ulcerados o tengan un nivel IV de Clark (34). Habría que añadir aquellos enfermos con cualquier Breslow, pero con signos histológicos de regresión.
Un problema no resuelto es qué tipo de estudio de extensión se debe realizar previo a la BGC para asegurar que el enfermo tiene exclusivamente enfermedad localizada en la piel y, como mucho, micrometástasis en el ganglio centinela. En el estudio indicado anteriormente del grupo de Anderson Cancer Center y Lee Moffitt Cancer Center (34) sus autores dicen con referencia a los criterios de inclusión: sin haber evidencia de melanoma metastásico en los ganglios regionales ni a distancia por el examen físico y la evaluación del estadiaje (radiografía de tórax, fosfatasa alcalina y LDH). Nos parece insuficiente el estudio indicado para demostrar metástasis a un enfermo en una situación en la que dependiendo de su presencia realizaremos o no una intervención quirúrgica ya que no tendría sentido realizar la BGC en enfermos con presencia de metástasis locorregionales o a distancia, pues la información aportada ya no tendría ninguna utilidad. En ningún otro trabajo hemos encontrado información exacta del estudio que han realizado para descartar metástasis. Creo que debe evaluarse al enfermo con las mejores técnicas que disponemos en la actualidad para detectar metástasis con masas mínimas tumorales: la resonancia magnética (RM) y la tomografía axial computerizada (TAC) detectan alteraciones morfológicas secundarias a la presencia de masas tumorales de hasta 1 cm de diámetro; aunque mucho más útiles que otras no son totalmente sensibles ni específicas en el melanoma (35, 36); la tomografía por emisión de positrones (PET) utilizando fluorodeoxiglucosa es una técnica metabólica que tras múltiples estudios parece ser un indicador muy sensible de metástasis en el melanoma (37).
En la Unidad de Tumores Pigmentarios del Hospital Gregorio Marañón los criterios de inclusión en el protocolo de la BGC son: lesión de más de 1 mm de Breslow o de menos si está ulcerada o presenta signos de regresión histológica, y estudio de extensión con ausencia de metástasis por la clínica, exploración física, analítica y mediante el estudio con PET o en su defecto TAC toracoabdominal y RM cerebral.
BIOPSIA DEL GANGLIO CENTINELA: ASPECTOS TÉCNICOS
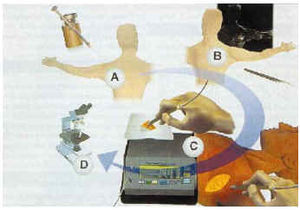
El éxito en la realización de la BGC depende de la integración de tres fases: 1) determinación preoperatoria de los ganglios linfáticos regionales, y dentro de ellos, una aproximación sobre el número y localización del o los ganglios centinelas (linfografía isotópica dinámica); 2) localización intraoperatoria y BGC (mapeo linfático), y 3) evaluación patológica cuidadosa del ganglio centinela obtenido para detectar células tumorales (Fig. 1).
FIG. 1.--Fases de la biopsia del ganglio centinela. A y B: Linfografía isotópica dinámica. C: mapeo linfático intraoperatorio y extirpación del ganglio. D: Evaluación patológica del ganglio extirpado.
Es una técnica en la que es imprescindible la coordinación de médicos de diferentes especialidades: medicina nuclear, dermatología y/o cirugía plástica, cirugía oncológica y anatomía patológica. Morton y cols. (38) han querido evaluar los resultados de diferentes hospitales de Estados Unidos donde se realizan de forma casi rutinaria el mapeo linfático intraoperatorio, la extirpación del ganglio centinela y la linfadenectomía regional electiva. Como punto de referencia han utilizado los datos obtenidos en el John Wayne Cancer Institute donde trabajan y que ha sido pionero en la técnica. El resultado del estudio demuestra que ésta puede ser aprendida con éxito y aplicada de forma estandarizada tras una fase de aprendizaje de 30 intervenciones. La identificación útil del ganglio centinela se produce en más del 97% de los casos. También comprueban algo por todos conocido: la técnica es mucho más fácil y se obtiene mejores resultados cuando se realiza con sonda radiactiva en lugar de con colorante azul. Por tanto es una técnica fácilmente estandarizable en todos los hospitales del mundo. Similares conclusiones en cuanto a facilidad de aprendizaje obtuvieron Testori y cols. en Italia (39). Bongers y cols. (40) realizaron una revisión de la aplicación de la técnica en 17 países europeos mediante el envío de un cuestionario a 136 centros y comprobó que se realizaba de muy diferentes maneras. Para que hubiera una uniformidad en los resultados hizo las siguientes recomendaciones: a) se deben inyectar en la dermis, alrededor de la cicatriz de la biopsia del melanoma, 40 MBq de albúmina nanocoloidal marcada con tecnecio 99; b) la linfografía isotópica debe tener dos fases: imágenes dinámicas (20 imágenes una cada minuto) seguidas de imágenes estáticas 1-2 horas después; c) la obtención intraoperatoria del ganglio centinela debe realizarse mediante sonda radiactiva, y d) el examen histopatológico del ganglio centinela debe hacerse mediante cortes seriados.
Fase preoperatoria: linfografía isotópica
La linfografía isotópica o linfoescintigrafía es un tipo de prueba de medicina nuclear con la que se determina de forma funcional los vasos linfáticos por los que drena y los ganglios linfáticos a los que drena una zona anatómica. Antes del estudio del ganglio centinela, la linfografía isotópica había sido utilizada en el melanoma, por algunos autores, para determinar con seguridad los ganglios linfáticos regionales correspondientes a la localización del tumor, antes de hacer una linfadenectomía regional profiláctica (12, 13). El propósito de la linfografía isotópica preoperatoria en la BGC es: a) identificar y definir todas las cadenas ganglionares regionales con riesgo de presentar metástasis, sobre todo, en aquellos enfermos con melanoma en localizaciones de drenaje ambiguo, por ejemplo, áreas axiales (cabeza, cuello y zona media del tronco); b) identificar la presencia de ganglios centinelas en tránsito localizados fuera de las cadenas ganglionares regionales; c) identificar la localización del ganglio centinela en relación con el resto de los ganglios de la cadena regional, y d) estimar el número de ganglios centinelas en la cadena ganglionar regional que tendrán que ser extirpados (41).
La linfografía isotópica se realiza mediante la inyección intradérmica de un trazador coloidal marcado con 99mTc en los cuatro cuadrantes alrededor de la lesión primitiva o de la cicatriz de la biopsia. Posteriormente se obtienen las imágenes mediante una gammacámara. La exploración se efectúa en dos fases: dinámica y estática. La fase dinámica se realiza tomando imágenes secuenciales cada minuto durante 30 minutos, inmediatamente después de la inyección del trazador; esto permite ver los vasos linfáticos cutáneos y conocer el número y la localización del ganglio o de los ganglios centinela (42). La fase estática se realiza a las 2 horas y nos confirma la localización del ganglio o de los ganglios centinela, su marcaje en piel, e indica las cadenas ganglionares de drenaje.
El transporte del trazador y la progresión a través de los linfáticos está estrictamente relacionada con el tamaño de la partícula del coloide. Partículas muy pequeñas (< 5 nanómetros) penetran en la membrana capilar y se incorporan a la circulación mientras que partículas muy grandes (500 nanómetros) son incapaces de migrar del punto de inyección.
El nanocoloide de albúmina marcado con tecnecio 99 tiene el 80% de las partículas de un tamaño inferior a 30 nanómetros, lo que permite la visualización de los linfáticos, y el 20% restante están entre 30 y 80 nanómetros, con lo que se produce una prolongada retención en los ganglios linfáticos. Esto facilita su detección por la gammacámara. Revisiones recientes de Wilhelm y cols. (43) y Glass y cols. (44) sobre los diferentes radiocoloides indican la utilidad de todos ellos para el estudio del ganglio centinela. En España se utiliza habitualmente albúmina nanocoloidal marcada con 99mTc (45).
Para tener mayor seguridad en la detección de los auténticos ganglios centinelas de la zona donde estaba el melanoma, la linfografía isotópica debe ser realizada antes de la ampliación de los márgenes de seguridad en la extirpación del melanoma. Se recomienda que los márgenes de la biopsia-extirpación de la lesión primitiva no superen los 2 mm para que cuando se introduzca el radiocoloide de la linfografía isotópica éste sea absorbido por las mismas vías linfáticas que el melanoma (46). Tampoco es recomendable hacer una biopsia muy profunda, eliminando gran cantidad de grasa subcutánea, pues la reacción inflamatoria postquirúrgica puede producir un taponamiento temporal de los linfáticos impidiendo la absorción del radiocoloide y por ello la realización de la linfografía. Karakousis y Grigoropoulos (47) han publicado recientemente un trabajo acerca de la BGC que fue realizada en 26 enfermos tras la extirpación amplia del melanoma sin cierre del defecto mediante injerto ni colgajo y llega a la conclusión de que no influye en los resultados. No creemos que sea muy valorable dado el escaso número de pacientes en los que se basa este trabajo.
Los estudios previos sobre el flujo linfático cutáneo se basaban en disecciones anatómicas de cadáveres. Sappey en el siglo pasado realizó estudios de los linfáticos cutáneos mediante inyecciones con oro en la piel de cadáveres y delineó una estrecha banda de 2,5 cm de ancho a cada lado de la línea media del tronco que va del ombligo a la vértebra L2 delimitada por las denominadas líneas de Sappey. Según sus trabajos estas líneas delimitaban áreas cutáneas cuyo drenaje podría corresponder a más de una región ganglionar o bien a una región distinta de la esperada (48). Con la linfografía isotópica se ha visto que la discordancia entre la localización anatómica y el flujo real funcional de los linfáticos cutáneos es muy alta, sobre todo en cabeza, cuello y zona media del tronco (49, 50). Ya en el primer trabajo de Morton y cols. (20) 14 enfermos presentaban ganglio centinela con un doble drenaje, lo que motivó que tuviera que realizar dos linfadenectomías en cada uno de ellos. La realización masiva de linfografías isotópicas ha permitido comprender y conocer mucho más a fondo la anatomía y fisiología de la red linfática cutánea (51). Con relación a los conceptos anatómicos clásicos hay variaciones importantísimas; en un porcentaje muy elevado el sitio esperado por la zona donde se localiza el melanoma no coincide con los resultados obtenidos por la linfografía isotópica. Leong y cols. (49) evaluaron la discordancia entre la predicción clínica y el patrón de drenaje linfático real obtenido con la linfografía isotópica y la extirpación del ganglio centinela en 226 pacientes. En el 20% de los casos la predicción estaba equivocada; en cabeza y cuello, en el 36,7%; en el tronco, en el 25,3%, y en las extremidades, en el 13,6% en las superiores y 5,3% en las inferiores. También se han publicado localizaciones excepcionales: de la piel periumbilical a los ganglios de la mamaria interna (52), del antebrazo directamente al ganglio supraclavicular (53), en el 26% de 42 enfermos con melanoma en la espalda el drenaje linfático se dirigía al espacio triangular intermuscular (54); en un paciente el drenaje fue directo de la espalda a los ganglios intraabdominales (55); en otro, con lesión en antebrazo, los ganglios centinela estaban en zona media del brazo (56), etc. Thompson y cols. (57) ha publicado recientemente una revisión exhaustiva aportando su experiencia tras el estudio de 1.759 pacientes.
En resumen, es imprescindible la linfografía isotópica previa a la intervención para determinar con exactitud la localización de la o las cadenas ganglionares regionales y dentro de ellas el o los ganglios centinela.
Fase intraoperatoria: mapeo linfático y extirpación del ganglio centinela
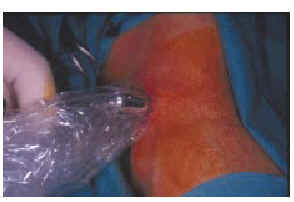
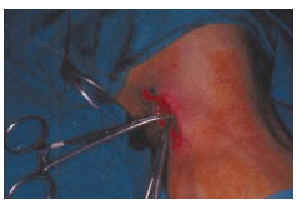
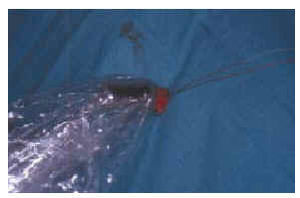
Inicialmente para el mapeo linfático intraoperatorio se utilizaron exclusivamente colorantes: azul patente, azul de isosulfán. En esquema la técnica es la siguiente: se introduce 1 ml de colorante mediante la inyección intradérmica en cuatro puntos alrededor del melanoma o de la cicatriz de la biopsia hasta producir un pequeño habón. Después se aplica un pequeño masaje en la zona para aumentar el paso del colorante a los linfáticos. Posteriormente se hace una incisión en el sitio marcado en la linfografía isotópica preoperatoria como zona aproximada de localización del ganglio centinela. Los linfáticos aferentes se observan como una línea de color azul pálido que va unida a una masa azulada que corresponde al ganglio centinela, que es extirpado. Si en el fondo se aprecia que queda alguna otra zona de color azul debe extirparse (20, 58). La técnica es lenta y laboriosa; en ocasiones la búsqueda de ganglios no muy superficiales puede necesitar una incisión amplia y manipulación en la grasa subcutánea y cerca de estructuras vasculares y nerviosas importantes. Además tiene un alto porcentaje de fracasos. En el trabajo original de Morton y cols. (20) en el que se intentó identificar el ganglio centinela en todos los casos mediante colorante azul se localizó en 194 de 237 cadenas ganglionares, es decir, en el 82% de los casos. Inmediatamente apareció el primer trabajo que propuso la utilización de una sonda radiactiva para detectar el ganglio centinela; Alex y Krad demostraron en ocho gatos que la búsqueda y localización de los ganglios inguinales con una sonda radiactiva tiene algunas ventajas con relación al colorante: a) sin necesidad de realizar incisión quirúrgica y gracias al contaje radiactivo se localiza con precisión en la superficie de la piel la posición del ganglio subyacente; b) guía intraoperatoriamente al cirujano durante la disección del ganglio; c) verifica que ha sido extirpado el ganglio correcto; d) determina la posible presencia de ganglios centinelas residuales; e) permite que la incisión sea mucho menor, y f) se realiza mucho más rápida y fácilmente (24). Múltiples trabajos han confirmado la gran utilidad de la sonda radiactiva para detectar intraoperatoriamente el ganglio centinela (39, 59-68), incluso en localizaciones complicadas como son la cabeza y el cuello (69-73). En la actualidad su uso es rutinario sola o combinada con colorantes azules. Muchos autores, sobre todo en Estados Unidos, consideran que se debe mantener la combinación de ambas técnicas para aumentar el porcentaje de éxitos en la localización del ganglio. En el Anderson Cancer Center realizaron un estudio publicado por Gershenwald y cols. (66) para determinar si la localización del ganglio centinela era más efectiva cuando se asociaba sonda radiactiva y azul de isosulfán que con colorante solamente. De 626 pacientes se realizó mapeo linfático con azul de isosulfán en 252 y con la combinación de azul de isosulfán y azufre coloidal marcado con tecnecio 99 y sonda radiactiva en 374. El ganglio centinela fue identificado sólo en el 87% de los pacientes del primer grupo frente al 99% del segundo. A pesar de que recomiendan la utilización combinada reconocen que en el 92% de los pacientes que tuvieron algún ganglio con presencia de metástasis éstas se producían en los ganglios que contenían mayor cantidad de radiocoloide. Bostick y cols.(67) encuentran en un estudio realizado en 87 pacientes que de los 144 ganglios extirpados ocho tenían radiactividad pero no estaban teñidos en azul y, a la inversa, 12 no tenían radiactividad y estaban teñidos de azul; de los 17 ganglios que presentaban metástasis, uno de ellos fue identificado sólo por el colorante azul; concluyen que debe mantenerse la utilización de ambas técnicas asociadas. En España, probablemente por las grandes dificultades para obtener el azul de isosulfán o el azul patente, en casi todos los hospitales donde se realiza la BGC se hace sólo mediante la sonda radiactiva. Nosotros con cerca de 100 biopsias realizadas sólo con sonda radiactiva no hemos tenido ningún caso en el que no se haya detectado el ganglio (Figs. 2, 3, 4, y 5).
FIG. 2.--Sonda radiactiva para la realización del mapeo linfático intraoperatorio.
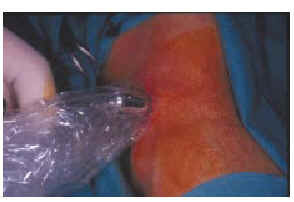
FIG. 3.--Localización del ganglio centinela mediante la aplicación de la sonda radiactiva en la superficie cutánea.
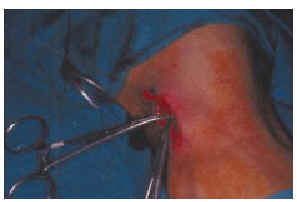
FIG. 4.--Extirpación del ganglio centinela previamente detectado por la sonda radiactiva mediante una mínima incisión.
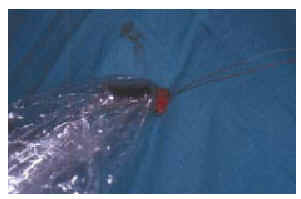
FIG. 5.--Una vez extraido de su lecho se comprueba el nivel de radiactividad del ganglio centinela.
Una vez demostrada la utilidad intraoperatoria de la sonda radiactiva para detectar la radiactividad generada por el radiocoloide se hacía necesario sincronizar la linfografía isotópica preoperatoria con la intervención quirúrgica para no tener que duplicar la exploración. Inicialmente tanto el grupo del Lee Moffitt Cancer Center (58) como el del Anderson Cancer Center (41) hacían la linfografía isotópica el día anterior, y en el quirófano, antes del intervención, inyectaban el radiocoloide para que fuera detectado con la sonda radiactiva. Thompson y cols. fueron los primeros en indicar que la técnica era más eficiente si se hacía la linfografía el día anterior sin necesidad de reinyectar el radiocoloide dentro del quirófano, aprovechando la radiactividad residual del radiocoloide (74). Mas recientemente, Essner y cols. (75) y White y cols. (76) demostraron que con hacer la linfografía isotópica entre 18 y 24 horas antes de la intervención hay suficiente radiactividad residual para detectar con la sonda radiactiva los ganglios centinela. Esto simplifica de forma notable la técnica, reduce costes y elimina potenciales problemas de salud y seguridad para el personal del quirófano y de anatomía patológica que manejan el material obtenido inmediatamente después. Nuestra experiencia es concordante con estos autores, y aunque inicialmente 2 horas antes de la intervención reinyectábamos radiocoloide pronto vimos que el exceso de radiactividad intraoperatorio dificultaba claramente la obtención del ganglio centinela.
Fase postoperatoria: búsqueda de células tumorales en el ganglio extirpado
Si la linfografía isotópica identifica todas las cadenas ganglionares con riesgo de tener metástasis y el mapeo linfático indica qué ganglio, o ganglios, dentro de estas cadenas tiene mayor riesgo de presentar metástasis, para un estadiaje preciso es imprescindible disponer de un método muy sensible y específico para descubrir las células de melanoma ocultas en el material obtenido. Siempre hay que tener presente que la BGC se realiza para detectar micrometástasis, dependiendo de su resultado el pronóstico y la actitud terapéutica posterior, incluyendo la linfadenectomía regional y el posible tratamiento adyuvante con interferón alfa-2. El estudio histológico rutinario con algunos cortes teñidos con hematoxilina eosina (H&E) examina menos del 1% del material obtenido, por lo que habrá enfermos en los que no se detectarán las células neoplásicas. La sensibilidad aumenta si el estudio con H&E incluye múltiples cortes seriados y además se realizan rutinariamente tinciones inmunohistoquímicas como mínimo para la proteína S-100 (77-79). Morton y cols. (20) en su primer trabajo examinaban todos los ganglios extirpados con H&E y con inmunohistoquímica frente a proteína S-100, MB45 y NK1C-3. Hay enfermos con ganglio centinela negativo que presentan recidivas. El posterior estudio seriado de los ganglios detectó células tumorales, demostrando que habían sido falsos negativos hasta en el 80% de los casos (46, 80, 81). Yu y cols. (77) revisaron 235 ganglios de 94 pacientes que con técnicas histológicas rutinarias habían sido informados como negativos. Tras el estudio de nuevos cortes con inmunohistoquímica para la proteína S-100, HMB-45, NK1C-3 y MART-1 encontraron 11 nuevos ganglios positivos (12% de los casos). En el protocolo del ganglio centinela que siguen en el Lee Moffitt Cancer Center incluyeron el estudio con H&E e inmunohistoquímica para la proteína S-100; Messina y cols. (78) han revisado sus resultados tras el estudio de 838 ganglios en 357 enfermos. Encontraron metástasis en 56 pacientes (16%); de ellos, 31 (55%) presentaban las células tumorales claramente visibles con H&E, pero en 25 (45%) fue la inmunohistoquímica la que detectó las metástasis que inicialmente no fueron apreciadas por H&E. Cochran (79), en la Universidad de UCLA, examinó 1.119 ganglios centinelas de 669 pacientes, encontrando metástasis en 126 pacientes (17,8%); en el 40% de los casos fue necesario la inmunohistoquímica para detectar pequeñas cantidades de células tumorales que la H&E no fue capaz de demostrar. Gibbs y cols. (82) compararon los resultados obtenidos en 69 pacientes mediante cortes congelados intraoperatorios, H&E e inmunohistoquímica para la proteína S-100 y HMB45; recomiendan, como los autores anteriores, la combinación de inmunohistoquímica y H&E. También observaron que los cortes intraoperatorios en fresco tienen una rentabilidad muy baja.
Para mejorar la detección de micrometástasis no demostrables con técnicas histológicas se utilizan test moleculares. La tirosinasa es uno de los marcadores más específicos de diferenciación melanocítica. Es una enzima clave en la síntesis de la melanina. La expresión del gen de la tirosinasa queda restringida a las células de la serie melanocítica y a algunas células derivadas de la cresta neural que normalmente no están presentes en los ganglios ni en la sangre. En los pacientes con melanoma se intentó demostrar la presencia de enfermedad residual detectando células neoplásicas en sangre periférica. Mediante la transcripción inversa seguida de la reacción en cadena de la polimerasa (RT-PCR) de la tirosinasa se pueden detectar en sangre 100 células neoplásicas entre 108 células sanguíneas (83).
Van der Velde-Zimmermann y cols. (84) fueron los primeros que utilizaron esta técnica en el estudio ganglionar del melanoma comparándola con la inmunohistoquímica. Estudiaron 28 ganglios de 16 pacientes, cuatro tras linfadenectomía y 16 tras la resección del ganglio centinela. Los cortes seriados fueron procesados alternativamente para la RT-PCR de la tirosinasa y para inmunohistoquímica. Con la RT-PCR detectaron seis ganglios centinelas positivos adicionales, es decir, un 21% más. Se ha comprobado que la técnica es altamente sensible, más todavía si se combina la RT-PCR de la tirosinasa con la RT-PCR de otras proteínas presentes en las células de melanoma como MART-1, MAGE-3 (85). Desde entonces todos los trabajos publicados comparando el número de ganglios positivos con inmunohistoquímica y con la RT-PCR de la tirosinasa han encontrado las mismas o mayores diferencias en el porcentaje de positividades: Joseph y cols. (62) en 595 pacientes detectaron el 73,8% de las metástasis con examen histopatológico de rutina; el resto fueron detectadas mediante cortes seriados con H&E (7,8%) y con inmunohistoquímica (18,4%). De los ganglios centinela histológicamente negativos el 47% fueron positivos para la RT-PCR de la tirosinasa. Goydos y cols. (86) encontraron en 55 pacientes 13 ganglios positivos: 10 mediante las técnicas estándar y tres tuvieron resultados positivos con la RT-PCR, habiendo sido negativos con el estudio histopatológico. Shivers y cols. (87) de 114 enfermos estudiados, 23 (20%) tuvieron el ganglio positivo por histopatología y RT-PCR; de los 91 que fueron negativos histológicamente 47 (50%) fueron positivos para la RT-PCR. Bieligk y cols. (88) analizaron los ganglios centinela de 26 pacientes con histología y RT-PCR de la tirosinasa; seis pacientes tuvieron ganglios positivos por histología y RT-PCR, pero 13 de los 20 restantes tuvieron ganglios histológicamente negativos pero positivos con RT-PCR. Si contabilizamos el total de ganglios positivos con RT-PCR vemos que fueron 19 de los 26 pacientes, es decir, que el 73% de los enfermos tenían teóricamente metástasis ganglionares. Blaheta y cols. (89) estudiaron 794 ganglios (148 centinela y 646 no centinela) provenientes de 79 pacientes. Con RT-PCR de la tirosinasa detectaron positividad en el 49% de los ganglios centinela frente al 18% de positividades con inmunohistoquímica utilizando MB-45 y la proteína S-100. Bostick y cols. (85) estudiaron los ganglios centinela de 125 pacientes mediante la RT-PCR de la tirosinasa, MAGE-3, MART-1 y paralelamente con H&E e inmunohistoquímica. Veinte (36%) de los 55 pacientes que tenían una histopatología negativa expresaron dos o más marcadores RT-PCR. En la tabla I se resumen los resultados.
Estos datos muestran que la RT-PCR tiene una alta sensibilidad, pero no queda claro que su especificidad sea del 100%. De hecho, Van der Velde-Zimmermann y cols. (90), en su último trabajo proponen que en el ganglio centinela se realice de forma rutinaria la RT-PCR de la tirosinasa y, sólo en aquellos que sea positivo, recomiendan que se realicen cortes seriados e inmunohistoquímica ya que estas técnicas son más caras y su realización es muy laboriosa.
Hay varias posibilidades para explicar tan alto porcentaje de positividades con la RT-PCR:
− Que sean falsos positivos. Al no ser la RT-PCR de la tirosinasa específica de las células de melanoma se están detectando melanocitos u otras células del sistema nervioso. Se denomina nevos ganglionar la presencia de melanocitos acumulados dentro de un ganglio, casi siempre localizados en su cápsula fibrosa. Se producen siempre en los ganglios que drenan territorios cutáneos. Los trabajos previos a la realización de la BGC registraban una frecuencia de nevos ganglionares entre el 0,33 y el 7,3% de los ganglio linfáticos provenientes de disecciones ganglionares de diferentes tumores (91). Carson y cols. (92) estudiaron los ganglios de 226 linfadenectomías provenientes de 208 pacientes con melanoma, encontrando que 49 (23,6%) presentaron nevos ganglionares, y éstos son más frecuentes en los ganglios centinela, llegando al 3,9% de los ganglios centinela estudiados. En 50 pacientes con cáncer de mama la frecuencia fue del 2% y ninguno en 50 con cáncer pélvico. Carson y cols. concluyen considerando que hay una clara asociación entre el melanoma y la presencia de células provenientes de nevos en los ganglios. Piensan que es debido a que ante el estímulo de un melanoma adyacente las células de los nevos melanocíticos cutáneos se desplazan al ganglio, produciendo las denominadas metástasis benignas. La teoría es discutible, pero en todo los trabajos publicados sobre los resultados de la BGC hay nevos ganglionares en un porcentaje que oscila del 5 al 15% (85, 78, 89). Pueden ser confundidos con metástasis del melanoma y es el estudio con H&E el que ayuda a diferenciarlos demostrando la citología benigna de las células, la localización subcapsular y su agrupación característica (78).
− Realmente son células de melanoma pero localizadas exclusivamente en el ganglio centinela. No podemos afirmar con rotundidad que el depósito de mínimas cantidades de células de melanoma en el ganglio centinela pueda ser definido como metástasis, es decir, desconocemos todavía el auténtico significado biológico de su presencia. Inclusive para algunos autores su presencia podría ser considerada beneficiosa al contribuir a la autoinmunización frente a la enfermedad (4).
− Detectan auténticas micrometástasis de melanoma. En tal caso, el pronóstico de los enfermos con RT-PCR negativa debe ser claramente superior a aquellos con RT-PCR positiva. Aunque se requieren resultados adicionales, tres trabajos han aportado ya resultados favorables a esta hipótesis. Bostick y cols., del John Wayne Cancer Institute, compararon el pronóstico a los 12 meses en 72 enfermos a los que se había realizado BGC; recidivaron ocho (11%), falleciendo dos de ellos. De los 35 enfermos con ganglio centinela negativo, mediante el estudio histológico y la RT-PCR ninguno presentaba recidiva, tres de los 20 (15%) con histología negativa y RT-PCR positiva tuvieron recurrencia y cinco de los 16 (31%) con histología y RT-PCR positivas tuvieron recidiva (85). Shivers y cols. en el Lee Moffitt Cancer Center realizaron un trabajo similar, pero en 114 enfermos y con un seguimiento de 28 meses. Encontraron recidivas en el 2% del primer grupo frente al 13% del segundo y 61% del tercero (87). Finalmente, Blaheta y cols. en la Universidad de Tubinga estudiaron 116 pacientes con un seguimiento medio de 19 meses. Hubo una diferencia estadísticamente significativa en el número de enfermos que tuvo recidiva, entre los que tuvieron el ganglio centinela negativo histológicamente y con la RT-PCR positivo sólo para la RT-PCR o positivo tanto histológicamente como con la RT-PCR (93).
FINALIDAD DE LA BIOPSIA DEL GANGLIO CENTINELA
La BGC fue propuesta inicialmente por Morton y cols. (20) como un método diagnóstico. Tras varios estudios prospectivos también ha quedado demostrada su utilidad pronóstica. Incluso hay posibilidades de que en un futuro cercano diversos trabajos confirmen que en algunos pacientes con ganglio centinela positivo éste sea el único tratamiento ganglionar sin necesidad de realizar linfadenectomía regional posterior.
Finalidad diagnóstica
La BGC es la técnica menos agresiva y más efectiva para demostrar la presencia de metástasis ganglionares. Ninguna de las otras posibles técnicas quirúrgicas tienen utilidad, salvo la linfadenectomía regional, que lógicamente es mucho más agresiva. Dentro de las técnicas no invasivas, el PET con fluorodeoxiglucosa es el que tiene capacidad de demostrar presencia de células neoplásicas de melanoma con una resolución espacial de aproximadamente 5 mm3 o un volumen tumoral de aproximadamente 65 mm3. Wagner y cols. (94) realizaron un estudio prospectivo comparativo entre PET y BGC en 70 pacientes. La sensibilidad de la BGC en la detección de metástasis ganglionares regionales ocultas fue del 94,4% y la especificidad como valor predictivo positivo fue del 100% y como valor predictivo negativo del 98,6%. El PET tuvo una sensibilidad del 16,7% y una especificidad como valor predictivo positivo del 50% y como valor predictivo negativo del 81,9%. En conclusión, el PET no es sensible para detectar las metástasis ganglionares ocultas que demuestra el estudio histológico del ganglio centinela. En el trabajo encuentran que el volumen medio tumoral en los ganglios centinela positivos fue de 4,3 mm3, muy por debajo de la resolución espacial que tiene capacidad de detectar el PET.
Finalidad pronóstica
El más poderoso indicador de supervivencia en el melanoma no metastásico es la presencia o ausencia de metástasis linfáticas. Una vez que el paciente desarrolla metástasis en los ganglios regionales los factores pronósticos basados en el tumor primitivo contribuyen muy poco al pronóstico. La presencia de metástasis ganglionares disminuye la supervivencia a los 5 años en aproximadamente el 40%. Puesto que la BGC refleja la presencia o ausencia de metástasis ganglionares, su resultado debería ser el principal factor pronóstico y, además, debería correlacionarse con la profundidad de invasión, principal factor pronóstico de la lesión primitiva.
Joseph y cols. (96) revisaron en 600 enfermos los resultados de la BGC correlacionándolos con el grosor de la lesión primitiva. La BGC era positiva en el 30% de los que tenían la lesión de un grosor mayor de 4 mm, en el 18% de grosor entre 1,5 y 4 mm, en el 7% en lesiones de entre 1 y 1,5 mm y en ninguno en tumores de grosor menor de 0,76 mm. En todos los que la BGC fue positiva realizaron linfadenectomía regional y el 7,8% de ellos tenían también los ganglios regionales afectados. Todos los pacientes con linfadenectomía regional positiva tenía un tumor primitivo de más de 3 mm de espesor. Otros autores han obtenido resultados similares, confirmando la correlación con la profundidad de invasión y la presencia de metástasis en los otros ganglios (32-34, 95).
En cuanto al valor pronóstico de la BGC, los resultados publicados por Bostick y cols. (85), Shivers y cols. (87), Blaheta y cols. (93), y, sobre todo, por Gershenwald y cols. (34) confirman que el factor pronóstico más importante para la presencia de recidivas es la histología del ganglio centinela en los pacientes con ganglios clínicamente negativos. El estudio de Gershenwald y cols. (34) se basa en el resultado del estudio de 612 pacientes, de los que 85 tuvieron el ganglio centinela positivo con H&E. El análisis de supervivencia fue realizado comparando, de forma univariable y multivariable, el grosor del tumor, la presencia de ulceración, el nivel de Clark, la localización, el sexo y el estado patológico del ganglio centinela para comprobar su influencia en el tiempo libre de enfermedad y la supervivencia total. El estado del ganglio centinela fue el factor pronóstico más significativo y cuando era positivo el resto de los factores no producían información adicional. El grosor del tumor y la ulceración también eran indicadores de pronóstico en los enfermos con ganglio centinela negativo. Realizaron linfadenectomía regional a 81 enfermos (95%) con ganglio centinela positivo; de ellos, el 79,3% no tuvieron evidencia de metástasis en estos ganglios. También les fue realizada linfadenectomía regional a 72 pacientes con ganglio centinela negativo; ésta no produjo ningún tipo de beneficio en la supervivencia. También comprobaron que los enfermos con ganglio centinela negativo tenían de forma muy significativa un riesgo mucho menor de presentar recidivas.
Finalidad terapéutica
La información temprana de la presencia de micrometástasis ganglionares obtenida mediante la BGC permite realizar inmediatamente la linfadenectomía regional influyendo en la supervivencia de los enfermos. Essner y cols. (97) compararon la supervivencia de 534 pacientes a los 5 años; la mitad de ellos fueron tratados mediante linfadenectomía regional profiláctica, el resto mediante BGC y si era positiva linfadenectomía regional. Los pacientes cuya disección ganglionar había sido positiva, presentaban una diferencia en la supervivencia a los 5 años estadísticamente significativa (p = 0,077). En los enfermos a los que les fue realizada la linfadenectomía tras BGC positiva la supervivencia era del 64% frente al 45% en los tratados con linfadenectomía regional profiláctica.
Todavía no existen datos de ensayos clínicos amplios sobre si la simple extirpación del ganglio centinela puede ser una intervención diagnóstica y terapéutica. Se deben destacar dos ensayos clínicos en curso que publicarán sus resultados en un tiempo relativamente breve:
− Morton es el investigador principal de un ensayo clínico multicéntrico internacional fase III iniciado en 1994 (21). El estudio compara la supervivencia de enfermos tratados sólo con excisión del tumor frente a excisión del tumor y extirpación del ganglio centinela obtenido mediante mapeo linfático intraoperatorio. Según el propio Morton aunque la extirpación del ganglio centinela ha demostrado utilidad diagnóstica y pronóstica, todavía no ha sido demostrada su utilidad terapéutica (98). Los resultados de este ensayo clínico se publicarán después del año 2000.
− En los enfermos cuyo ganglio centinela es histológicamente negativo pero positivo con RT-PCR se plantea el problema de tener que realizar o no tratamiento posterior (linfadenectomía regional, tratamiento adyuvante). Para responder a esta pregunta se ha iniciado en Estados Unidos un ensayo clínico multicéntrico denominado Sunbelt Melanoma Trial. En él los enfermos con ganglio centinela histológicamente negativo pero positivos para la RT-PCR son distribuidos aleatoriamente en tres grupos: a) observación; b) linfadenectomía regional, y c) linfadenectomía regional con tratamiento adyuvante con interferón (87).