La radioterapia es una técnica de uso creciente en el campo de la oncología. Debido al alto recambio celular cutáneo, la radiación ionizante afecta colateralmente a la piel y encontramos de forma frecuente dermatosis inflamatorias asociadas a radioterapia. Algunos de estos cuadros, como la radiodermitis o el fenómeno de recall, son bien conocidos por el dermatólogo. Es importante reconocer otros cuadros cutáneos asociados a radioterapia que aparecen de forma menos frecuente y que en muchas ocasiones son infradiagnosticados.
Radiotherapy for cancer is used increasingly. Because skin cells undergo rapid turnover, the ionizing radiation of radiotherapy has collateral effects that are often expressed in inflammatory reactions. Some of these reactions–radiodermatitis and recall phenomenon, for example–are very familiar to dermatologists. Other, less common radiotherapy-associated skin conditions are often underdiagnosed but must also be recognized.
La radioterapia (RT) es una técnica ampliamente usada en el ámbito oncológico, de modo que aproximadamente el 50% de estos pacientes es sometido a esta modalidad terapéutica, bien de forma aislada bien en combinación con otros tratamientos. La radiación ionizante afecta a la piel de forma colateral por ser un tejido con un alto recambio celular. Los efectos secundarios cutáneos son muy frecuentes, con incidencias descritas de hasta el 50% de los pacientes afectos de radiodermitis de grado leve1. No obstante, un porcentaje menor de pacientes también presentará cuadros cutáneos de mayor extensión y gravedad.
En este trabajo proponemos una clasificación que divide por un lado aquellas dermatosis que aparecen exclusivamente en el contexto de la radioterapia, que a su vez pueden ser o no dosis-dependientes (tabla 1). Por otro lado, mostramos una serie de cuadros radioinducidos o agravados por la RT en los que en muchos casos no encontramos una clara relación dosis-dependencia.
Clasificación propuesta de dermatosis inflamatorias asociadas a radioterapia
| Dermatosis inducidas exclusivamente por el efecto de la radioterapia |
| Dosis dependientes |
| Radiodermitis (aguda/crónica) |
| Sin clara relación con dosis de radioterapia |
| Fenómeno de recuerdo o recall |
| Síndrome de erupción pruriginosa polimorfa eosinofílica asociada a radioterapia |
| Paniculitis pseudoesclerodermiforme posirradiación |
| Dermatosis desencadenadas o agravadas por el efecto de la radioterapia |
| Eritema exudativo multiforme/síndrome de Stevens-Johnson/necrólisis epidérmica tóxica posradioterapia |
| Síndrome erythema multiforme associated with phenytoin and cranial radiation therapy |
| Enfermedades ampollosas autoinmunes radioinducidas |
| Liquen plano radioinducido |
| Morfea radioinducida |
| Otros: lupus eritematoso, dermatosis neutrofílica, EICH, quistes de millium, liquen escleroatrófico |
EICH: enfermedad injerto contra huésped.
Pese a que la presente revisión se centrará en las dermatosis inflamatorias posradioterapia, debemos recordar el mayor riesgo de aparición a largo plazo de tumores secundarios en el campo irradiado2, así como la aparición de angiosarcoma en pacientes irradiadas por cáncer de mama3, también de las denominadas lesiones vasculares atípicas4 y de linfangiectasias adquiridas5.
Es importante conocer las características de las siguientes entidades, ya que muchas de ellas probablemente están infradiagnosticadas y se encuadran erróneamente dentro de cuadros más conocidos como la radiodermitis. Más allá de las implicaciones diagnósticas, un adecuado manejo inicial de algunos de estos cuadros puede condicionar un mejor pronóstico.
Dermatosis inducidas exclusivamente por el efecto de la radioterapiaDosis dependientesRadiodermitisComprende una serie de manifestaciones cutáneas secundarias a la exposición a la radiación ionizante que dependen fundamentalmente de factores individuales de riesgo (tabla 2), de la dosis total recibida y de la profundidad de penetración de la radiación6.
| Factores externos | Factores endógenos |
|---|---|
| Esquema de radioterapia | Enfermedades genéticas |
| Dosis total | Ataxia telangiectasia/heterocigotos para gen ATM |
| Fraccionamiento de dosis | Síndrome Gorlin |
| Superficie/volumen aplicado | Anemia de Fanconi |
| Tipo de radiación | Síndrome de Bloom |
| Xeroderma pigmentoso | |
| Fármacos radiosensibilizadores | Enfermedades del tejido conectivo |
| Aumento del daño celular | Lupus eritematoso sistémico |
| Escleroderma | |
| Artritis reumatoide | |
| Factores físicos | Enfermedades infecciosas |
| Obesidad (pliegues corporales más marcados) | VIH |
| Tabaco | |
| Desnutrición | |
| Daño actínico previo | |
| Fotoexposición |
ATM: proteína de la ataxia telangiectasia mutada; VIH: virus de la inmunodeficiencia humana.
Se distingue cronológicamente entre radiodermitis aguda a aquella que ocurre en los primeros 90 días y radiodermitis crónica a la que aparece más allá de ese período.
Radiodermitis agudaAparece generalmente en forma de eritema en la zona irradiada, tras una media de 10-14 días después de la radioterapia6. En la actualidad, los cuadros de radiodermitis aguda suelen ser de una intensidad leve-moderada debido al uso de equipos modernos como los aceleradores lineales y la radioterapia de megavoltaje, que permiten un adecuado diseño del campo (conformal radiotherapy) y un mayor fraccionamiento de la dosis total.
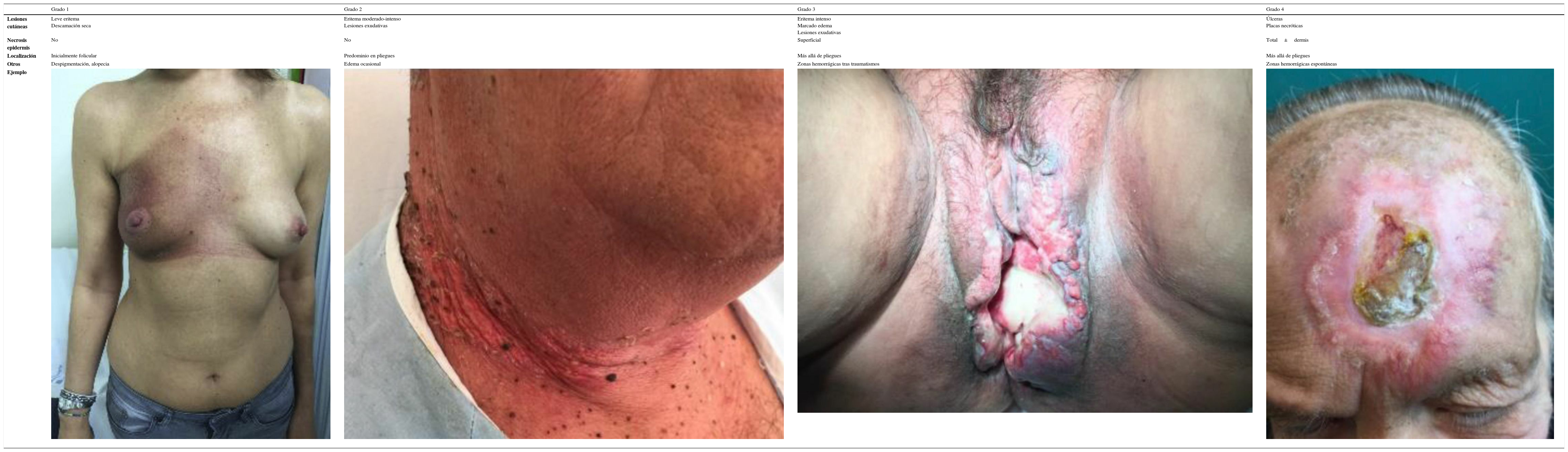
La clasificación más utilizada en función de la gravedad de la afectación cutánea se basa en los criterios unificados del National Cancer Institute (version 4)7 y la estadifica en 4 grados (tabla 3) Los estadios iniciales comprenden cuadros descamativos con escasa extensión, y progresivamente van presentando un aspecto más exudativo, extensión más allá de los pliegues y finalmente necrosis cutánea y ulceración.
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | |
|---|---|---|---|---|
| Lesiones cutáneas | Leve eritema Descamación seca | Eritema moderado-intenso Lesiones exudativas | Eritema intenso Marcado edema Lesiones exudativas | Úlceras Placas necróticas |
| Necrosis epidermis | No | No | Superficial | Total±dermis |
| Localización | Inicialmente folicular | Predominio en pliegues | Más allá de pliegues | Más allá de pliegues |
| Otros | Despigmentación, alopecia | Edema ocasional | Zonas hemorrágicas tras traumatismos | Zonas hemorrágicas espontáneas |
| Ejemplo |
El uso sinérgico de quimioterapia y RT para el tratamiento de tumores malignos conlleva en ocasiones un aumento de la toxicidad cutánea. El uso de nuevos fármacos diana, como los anticuerpos anti-EGFR (cetuximab, panitumumab) asociados a RT, suele desencadenar el desarrollo de radiodermitis aguda de alto grado y de forma más precoz, ya que se comportan como radiosensibilizadores8. También se ha descrito una mayor tasa de fibrosis cutánea tardía con estos fármacos9.
La radiodermitis aguda es consecuencia del daño estructural inmediato que produce la radiación ionizante a través de la liberación de radicales libres que dañan el ADN y que altera la maduración y reproducción de las células madre basales de la epidermis10. Esto se traduce en una alteración de la función barrera de la epidermis, con una mayor pérdida de agua transepidérmica y una necrosis parcial o total de la epidermis. Por otra parte, se genera un ambiente proinflamatorio con el reclutamiento local de leucocitos y la producción sostenida de IL-111. Asimismo se altera la angiogénesis, la fibrogénesis y la formación de tejido de granulación12,13. La pérdida de células de Langerhans, unida al ambiente proinflamatorio y a la pérdida de la función barrera, puede promover la sobreinfección14.
Se produce también un descenso en la actividad mitótica de las células germinales de las glándulas sebáceas, del folículo piloso y de la epidermis, que explica tanto la sequedad y alopecia asociadas en ocasiones, así como el resto de manifestaciones descritas.
Histopatológicamente existe afectación epidérmica con degeneración vacuolar de la basal y queratinocitos necróticos, así como espongiosis que, en ocasiones, puede llegar a formar ampollas subepidérmicas15. También pueden apreciarse infiltrados inflamatorios perivasculares, vasos sanguíneos dilatados con trombos y edema dérmico.
En cuanto a la prevención y tratamiento de la radiodermitis aguda, varias revisiones sistemáticas recientes describen extensamente su manejo1,16, con las siguientes recomendaciones:
- -
Realizar lavados en las zonas irradiadas, acompañados o no de champú/jabón suave, para evitar la sobreinfección.
- -
Anteriormente se contraindicaba el uso de desodorantes con sales de aluminio o apósitos que contuvieran metales, ya que se creía que podían aumentar la toxicidad aguda de la RT. Diversos ensayos clínicos han demostrado con un grado de evidencia IA que su uso no se traduce en una mayor gravedad de la radiodermitis16,17.
- -
El empleo de corticoides tópicos, por su papel antiinflamatorio, es controvertido. El uso de corticoides de media-alta potencia en el tratamiento de la radiodermitis aguda ya instaurada es eficaz18. En cuanto a su aplicación de forma profiláctica, distintos ensayos no han conseguido demostrar una clara reducción en el grado final de radiodermitis instaurada, pero sí una mejor calidad de vida con menor prurito y quemazón16.
- -
Ante la sospecha de sobreinfección, habrá que realizar cultivo bacteriano y comenzar tratamiento antibiótico tópico (crema de sulfadiazina argéntica o similares) o sistémico.
Hay que tener especial precaución en tumores ginecológicos o del canal anal, ya que suelen asociar radiodermitis de grado 3-4 y un mayor riesgo de sobreinfección.
- -
Debido a la mayor afectación en flexuras, se recomienda evitar el contacto entre los pliegues durante las sesiones de RT6. También debe evitarse ropa ajustada en la zona afectada, la fotoexposición y los traumatismos.
El uso de aloe vera, cremas con trolamina, ácido hialurónico, apósitos de plata o sucralfato no ha demostrado utilidad en el tratamiento o la prevención de la radiodermitis16.
El uso de amifostina, citoprotector usado en el contexto de la RT y en el tratamiento con cisplatino, demostró un menor grado de eritema final en un único estudio abierto con 30 pacientes19.
Radiodermitis crónicaSon los cambios cutáneos que aparecen meses o años después de la radioterapia. Hay que distinguirlos de los llamados «efectos tardíos consecuentes», que son debidos a la ausencia de curación de una radiodermitis aguda inicial de alto grado.
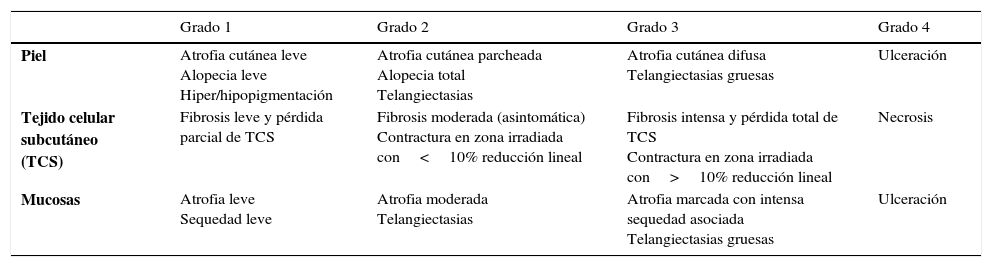
Según la clasificación RTOG/EORTC20 estos cambios cutáneos se dividen en distintos estadios según su extensión y gravedad (tabla 4).
| Grado 1 | Grado 2 | Grado 3 | Grado 4 | |
|---|---|---|---|---|
| Piel | Atrofia cutánea leve Alopecia leve Hiper/hipopigmentación | Atrofia cutánea parcheada Alopecia total Telangiectasias | Atrofia cutánea difusa Telangiectasias gruesas | Ulceración |
| Tejido celular subcutáneo (TCS) | Fibrosis leve y pérdida parcial de TCS | Fibrosis moderada (asintomática) Contractura en zona irradiada con<10% reducción lineal | Fibrosis intensa y pérdida total de TCS Contractura en zona irradiada con>10% reducción lineal | Necrosis |
| Mucosas | Atrofia leve Sequedad leve | Atrofia moderada Telangiectasias | Atrofia marcada con intensa sequedad asociada Telangiectasias gruesas | Ulceración |
Fuente: adaptada de Toxicity Criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC) (1995)20.
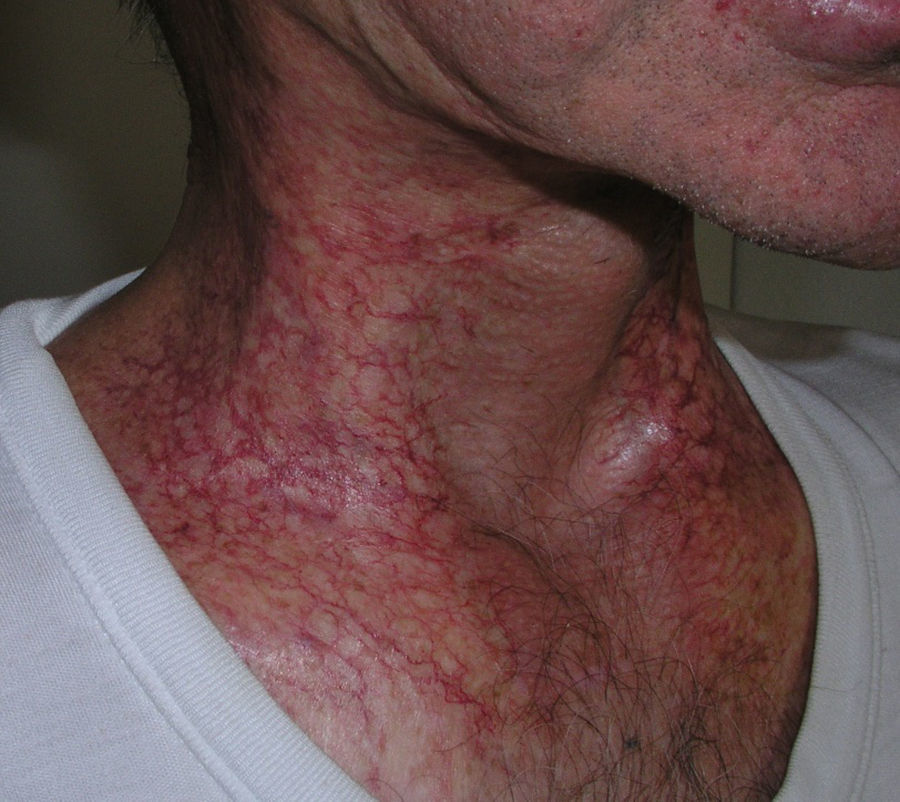
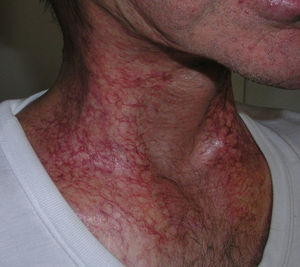
Suele presentarse en forma de poiquilodermia, con áreas hiper o hipopigmentadas, atrofia cutánea y telangiectasias (fig. 1). La aparición de telangiectasias, probablemente relacionada con daño en la microvasculatura, es más frecuente tras radiodermitis de grado 3 o mayor y tras dosis boost de refuerzo de RT21. También son frecuentes la descamación, la hiperqueratosis y la xerosis cutánea. Puede haber pérdida de uñas, anejos cutáneos, alopecia y zonas con menor sudoración.
Otra forma de presentación es la fibrosis cutánea, que puede ser localizada o generalizada. Puede llegar a asociar retracción y limitaciones en el movimiento. Dicha fibrosis está desencadenada por diversos factores, donde destaca el TGF-β. Este factor activa los fibroblastos, los cuales sintetizan y secretan procolágeno y otros componentes de la matriz extracelular22.
A nivel histológico, podemos encontrar atrofia epidérmica, hiperplasia endotelial, vasos esclerosados o trombosados. Si presenta fibrosis cutánea asociará sustitución de la dermis y del tejido subcutáneo por tejido fibroso y fibroblastos atípicos23.
En el tratamiento de las telangiectasias persistentes se ha descrito la utilidad del láser de luz pulsada24. La fibrosis cutánea es la complicación cutánea más difícil de tratar. Se ha usado pentoxifilina a dosis de 800mg/d, bien sola bien en combinación con vitamina E25. Este vasodilatador periférico también tiene propiedades antifibróticas al reducir la expresión del TGF-b y normalizar el fenotipo de fibroblastos alterados. No obstante, son escasos los estudios en humanos que demuestren claramente su eficacia16. Otras modalidades terapéuticas usadas de forma anecdótica son las inyecciones intramusculares de superóxido dismutasa liposomal con regresión de la fibrosis a las 3 semanas del inicio26, y también el IFN gamma a dosis bajas por el efecto inhibitorio de los fibroblastos dérmicos27.
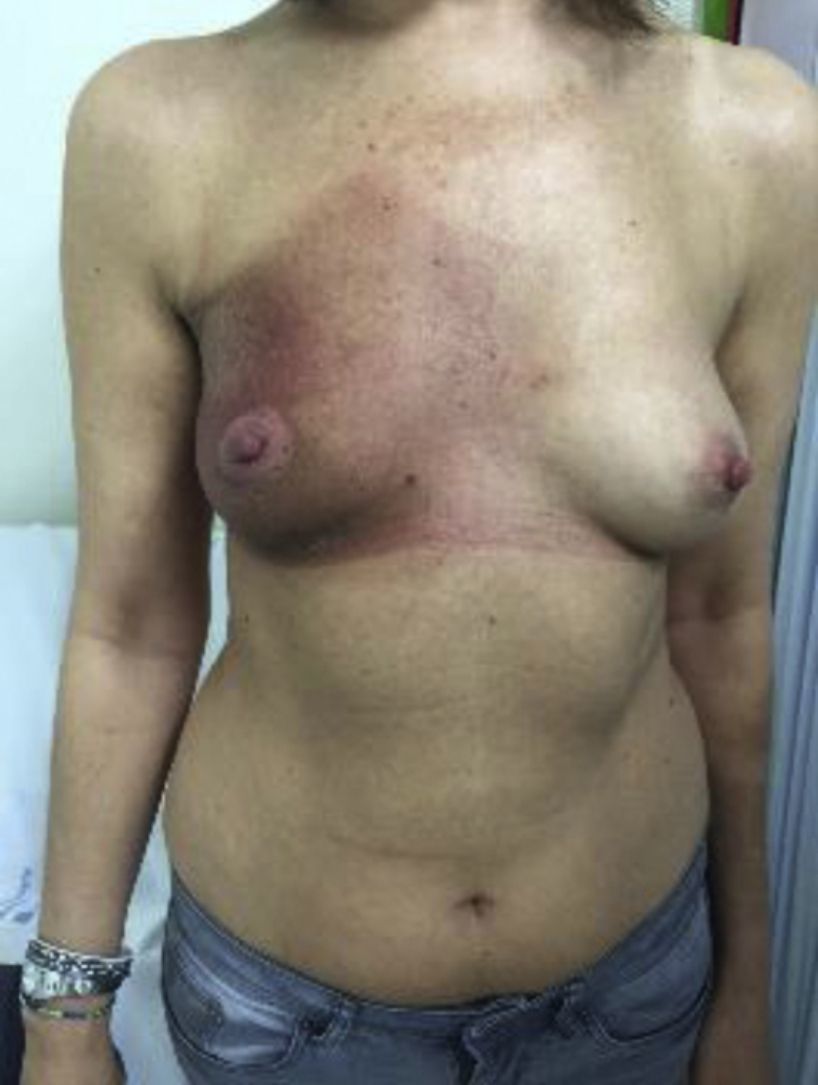
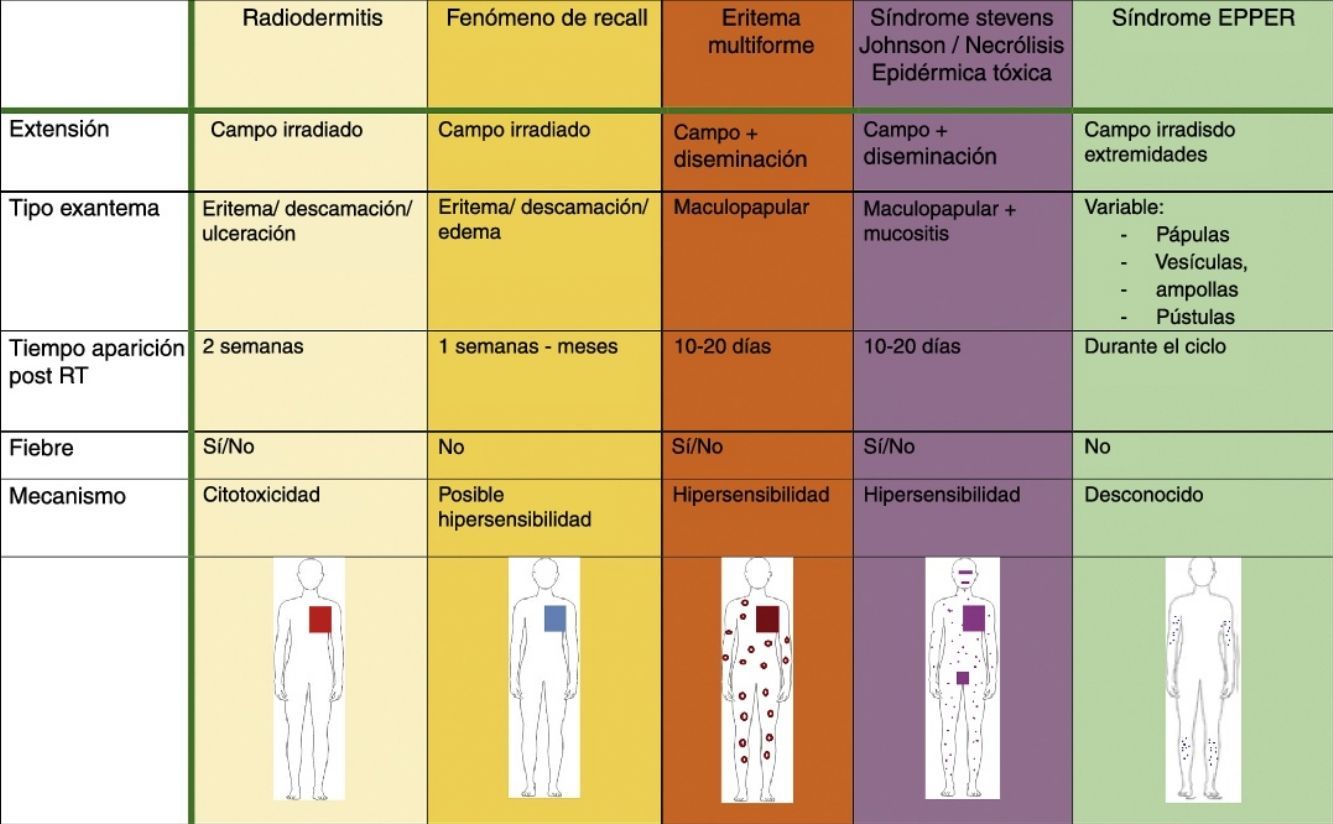
Sin clara relación con dosis de radioterapiaFenómeno de recallEl fenomeno de recall o de recuerdo consiste en la aparición de una dermatitis, limitada al campo irradiado, desencadenada por la administración de ciertos fármacos, generalmente quimioterápicos. Aparece tras un período de tiempo variable (desde días hasta años después) durante el cual la piel de dicho campo presentaba un aspecto sano, sin radiodermitis asociada28. Se considera dermatitis de recall cuando el intervalo mínimo entre RT y fármaco es de 7 días, ya que los cuadros que aparecen antes suelen estar producidos por sustancias radiosensibilizantes. Se han descrito casos de dermatitis de recall hasta 7 años después de la RT29. No obstante, el intervalo mediano de aparición es de 39,5 días28 tras la RT.
La piel es el órgano afectado en 2 de cada 3 pacientes, pero también se ha descrito fenómeno de recall en forma de neumonitis, mucositis, esofagitis y al nivel del sistema nervioso central o del intestino delgado28.
Los fármacos que desencadenan el fenómeno de recall suelen ser quimioterápicos, entre los que destacan por su frecuencia los taxanos (paclitaxel, docetaxel) y las antraciclinas (adriamicina, doxorrubicina), sumando ambos más de la mitad de los casos descritos. Otros quimioterápicos descritos son bleomicina, actinomicina D, gemcitabina, 5-fluoracilo, metotrexato y vinblastina. También hay casos asociados a fármacos no citotóxicos como fármacos antituberculosos30, tamoxifeno31, antibióticos32 o simvastatina33.
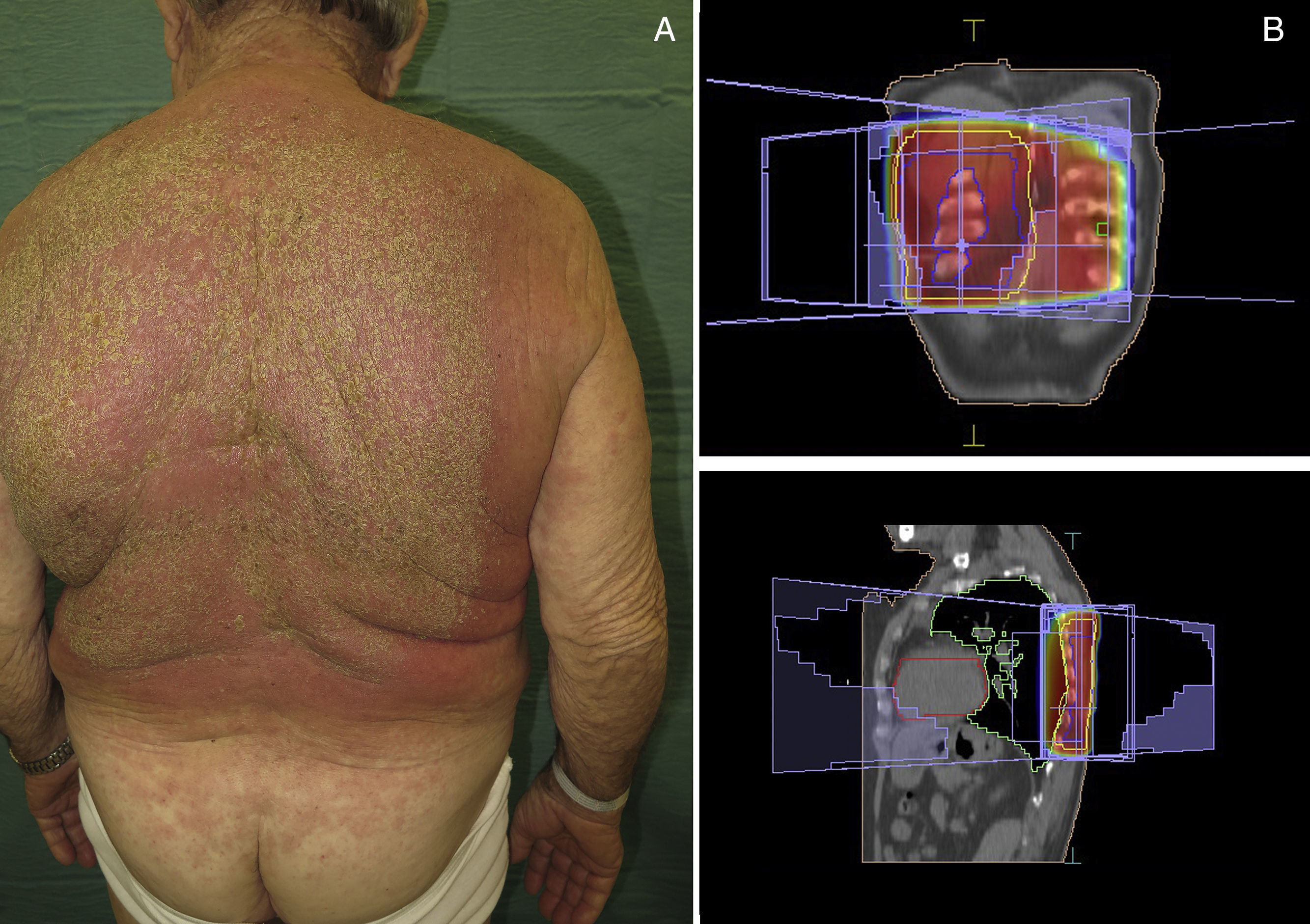
Las manifestaciones clínicas son superponibles a las de la radiodermitis aguda, en forma de una placa eritematosa más o menos exudativa de bordes bien delimitados coincidiendo con el campo irradiado (fig. 2). No obstante, se diferencia en que no es necesaria la aparición previa de radiodermitis y que previamente la piel de esa zona irradiada no presentaba lesiones cutáneas (tabla 5). En función de la gravedad, también pueden llegar a desarrollarse ampollas, úlceras, zonas hemorrágicas o necrosis. Cuanto menor es el período entre la administración de la RT y del fármaco desencadenante, el cuadro cutáneo es más intenso28.
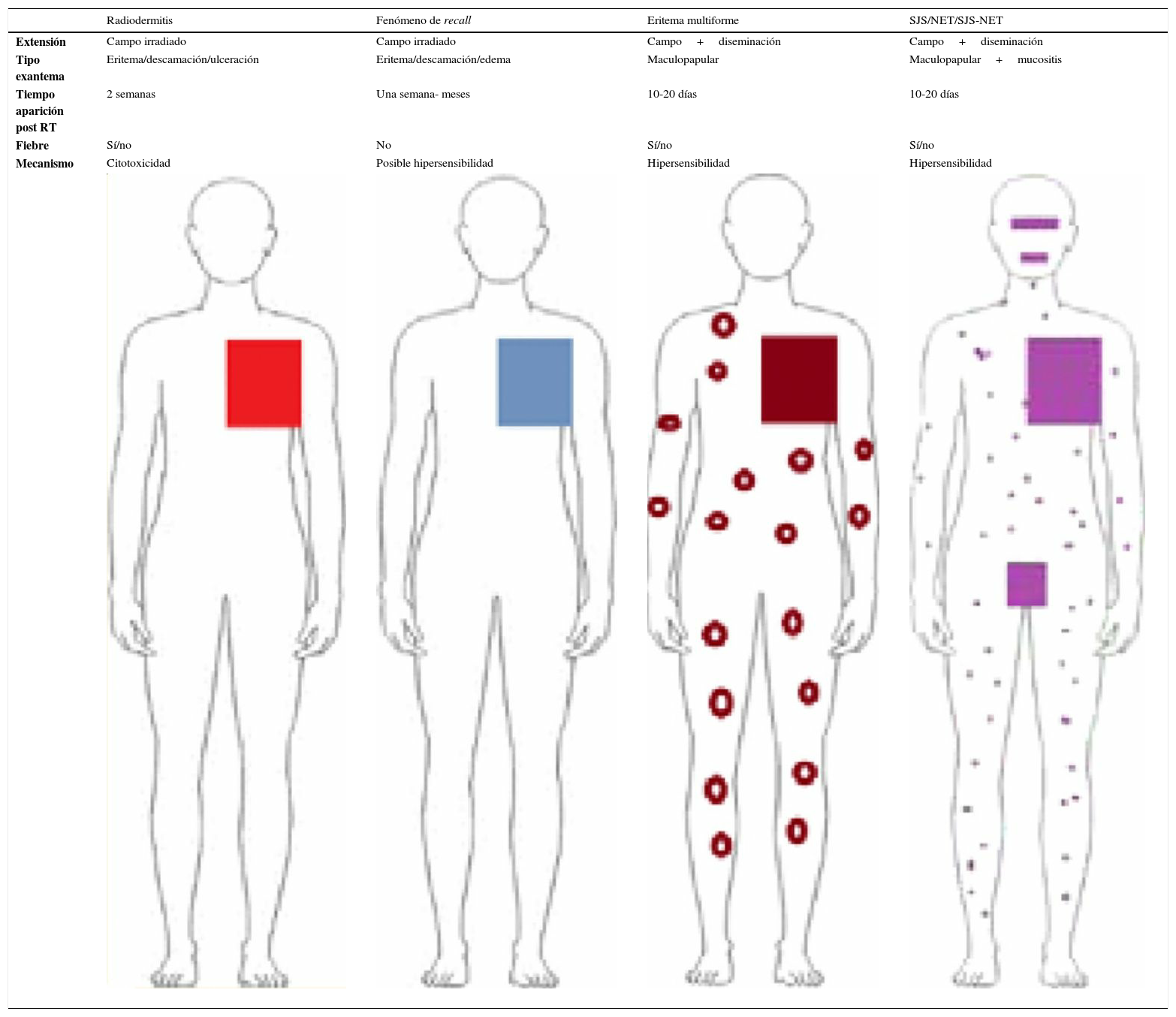
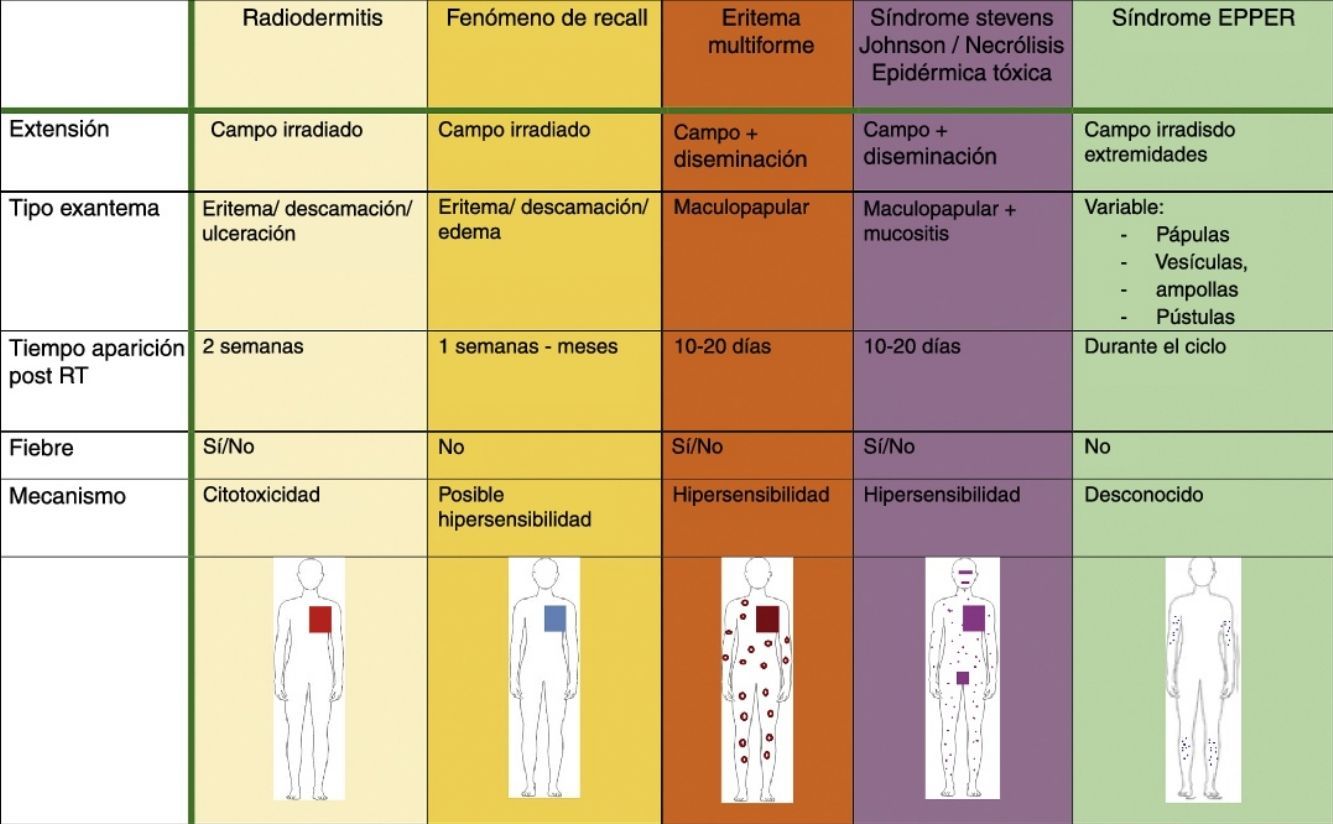
| Radiodermitis | Fenómeno de recall | Eritema multiforme | SJS/NET/SJS-NET | |
|---|---|---|---|---|
| Extensión | Campo irradiado | Campo irradiado | Campo+diseminación | Campo+diseminación |
| Tipo exantema | Eritema/descamación/ulceración | Eritema/descamación/edema | Maculopapular | Maculopapular+mucositis |
| Tiempo aparición post RT | 2 semanas | Una semana- meses | 10-20 días | 10-20 días |
| Fiebre | Sí/no | No | Sí/no | Sí/no |
| Mecanismo | Citotoxicidad | Posible hipersensibilidad | Hipersensibilidad | Hipersensibilidad |
NET: necrólisis epidérmica tóxica; RT: radioterapia; SJS: síndrome de Stevens-Johnson.
Parece existir un umbral de dosis de radiación recibida necesario para el desarrollo de dermatitis de recall. Varios autores han descrito cómo en pacientes que recibieron varios campos de RT a distintas dosis solo desarrollaron fenómeno de recall en aquellos campos con mayor dosis total recibida34.
Asimismo, la velocidad en la aparición del fenómeno de recall también depende de la dosis de RT recibida, de forma que a mayor dosis la dermatitis se instaura más rápidamente28. Si el fármaco desencadenante se administra por vía intravenosa el cuadro también se instaura de forma más rápida frente a la vía oral.
La histología suele ser superponible a la de la radiodermitis aguda y crónica. Están descritos cambios poco específicos, como degeneración vacuolar de la basal, queratinocitos necróticos y ectasia vascular superficial35. También es frecuente encontrar un infiltrado inflamatorio mixto, esclerosis dérmica y dermatitis de patrón psoriasiforme36.
Desde el punto de vista fisiopatológico, algunos autores han relacionado el fenómeno de recall con el daño vascular en la zona irradiada31 o con la reducción o alteración de las células basales de la epidermis37.
La teoría más aceptada actualmente es que se deba a una reacción de hipersensibilidad a fármacos35, similar al descrito en el exantema fijo medicamentoso. Se trataría de una reacción inflamatoria no mediada inmunológicamente (respaldado por la alta frecuencia de instauración tras la primera exposición al fármaco, así como la aparición del fenómeno en pacientes VIH con cifras de CD4<3038). Ello, favorecido a su vez por el papel proinflamatorio de la RT debido al aumento mantenido en la secreción de citoquinas como IL-1, IL-6 y TNF-alfa en el campo irradiado. Así pues, estos pacientes presentan un umbral inferior para desarrollar una respuesta inflamatoria. De este modo, al introducir el fármaco se desarrollaría el mecanismo responsable del fenómeno de recall.
En cuanto al tratamiento la medida fundamental es retirar el fármaco desencadenante, consiguiéndose una rápida mejoría. El uso de corticoides sistémicos, tópicos o antihistamínicos no ha demostrado asociar una mejoría más rápida del cuadro ya instaurado39. La reexposición al fármaco desencadenante vuelve a reproducir el fenómeno de recall en aproximadamente el 75% de los casos, aunque generalmente con una menor intensidad39. En el caso de optar por reintroducir dicho fármaco, puede administrarse con una dosis menor o acompañado de corticoides orales para intentar prevenir la respuesta inflamatoria28.
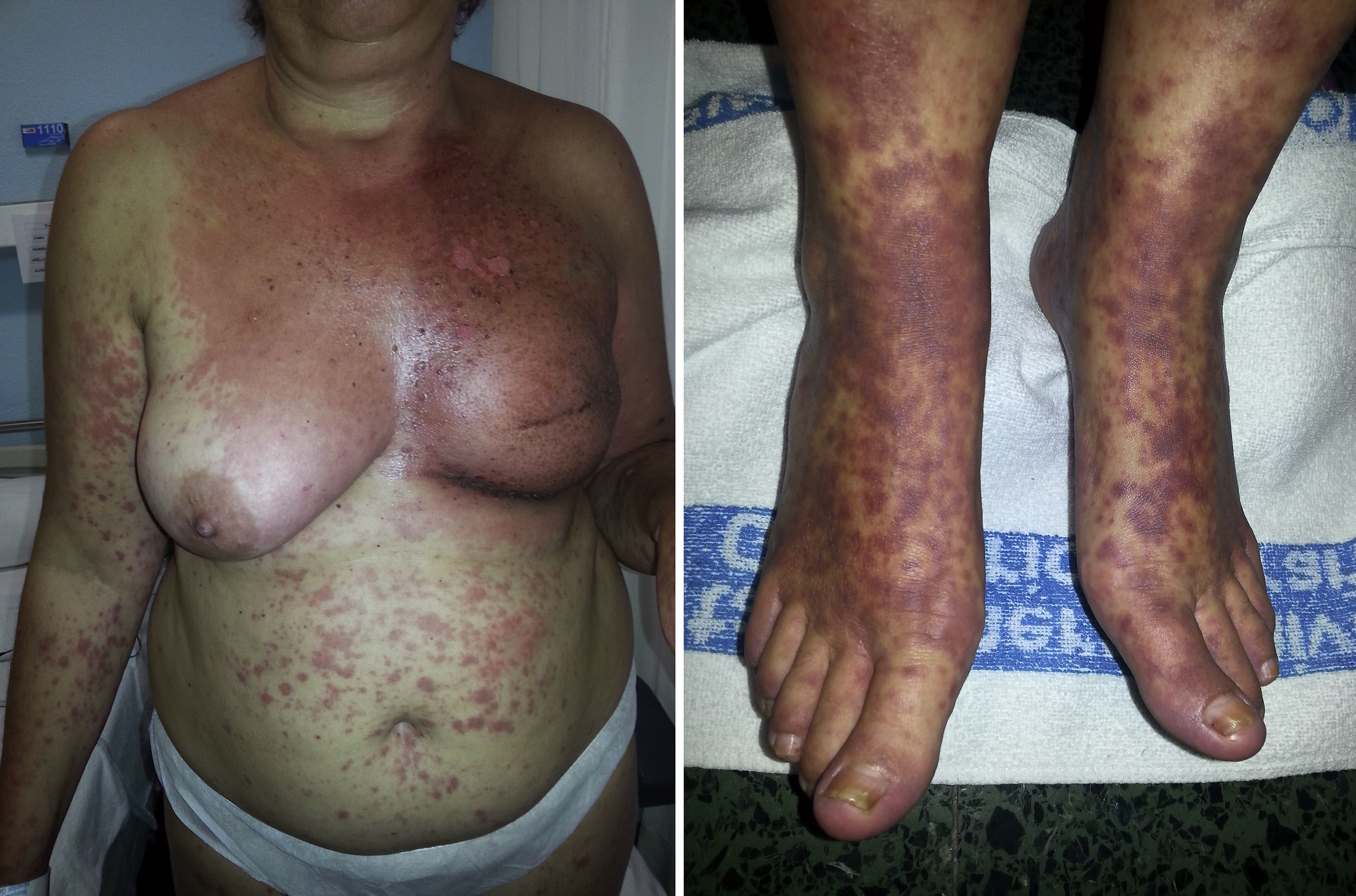
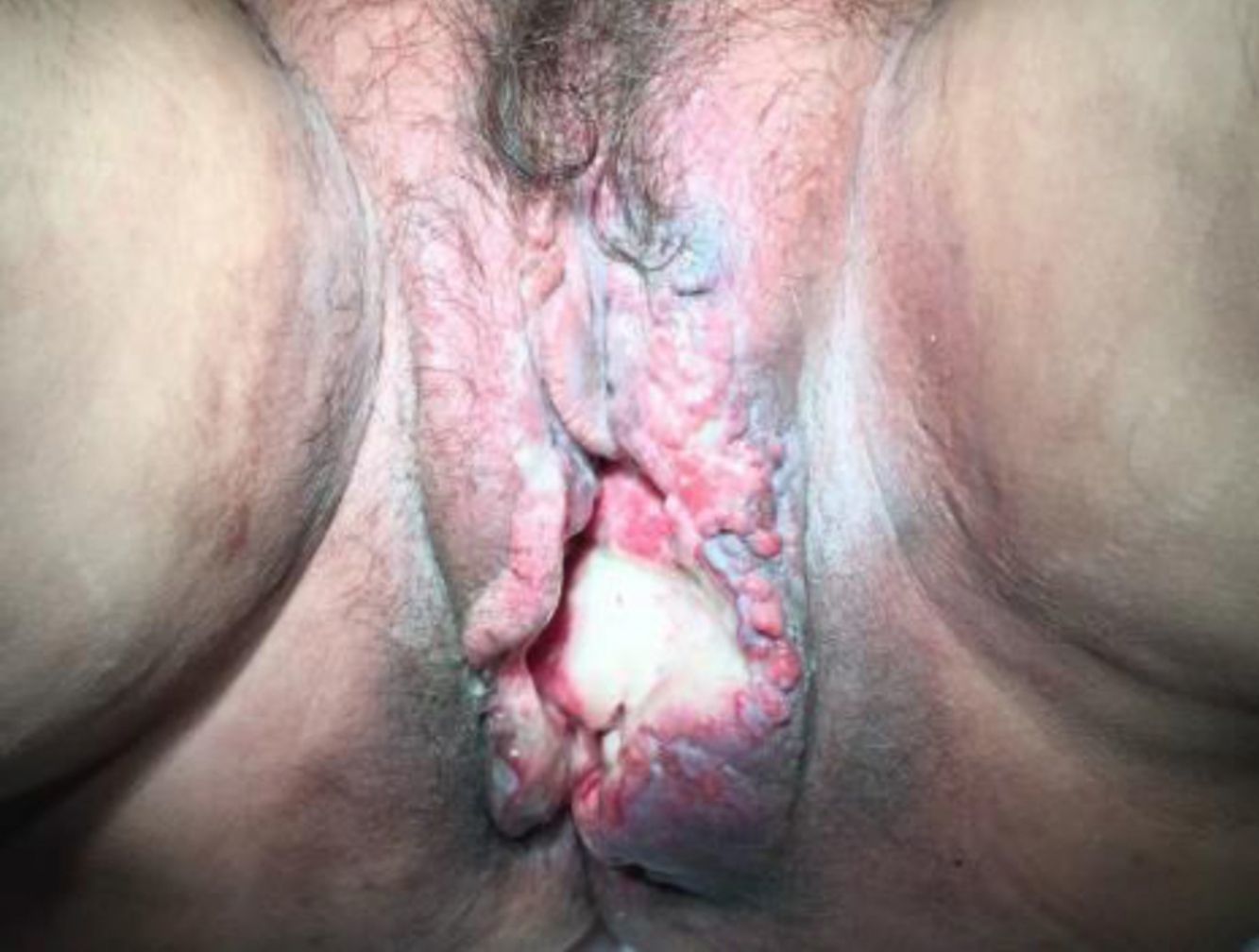
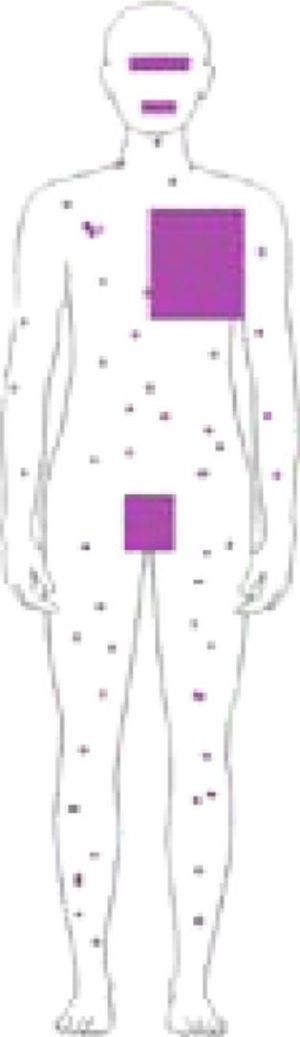
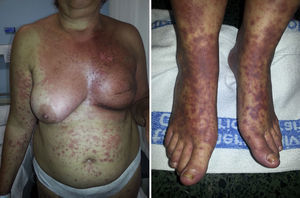
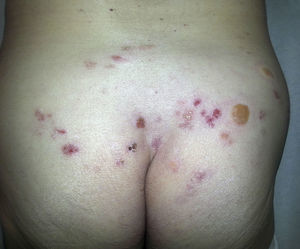
Síndrome erupción pruriginosa polimorfa eosinofílica asociada a radioterapiaEl nombre de este cuadro se basa en el acrónimo de erupción pruriginosa polimorfa eosinofilica asociada a radioterapia (EPPER), descrito en el año 1999 por Rueda et al.40. Estos autores incluyeron en su estudio a 83 pacientes oncológicos que recibieron RT, y el 17% de los mismos presentaron una erupción cutánea extensa y pruriginosa, cuyas lesiones presentaban histológicamente un llamativo infiltrado inflamatorio eosinofílico, similar al de otras dermatosis eosinofílicas. Este cuadro suele aparecer durante el ciclo de RT o inmediatamente después, pero también hay casos descritos de hasta 9 meses tras finalizar la misma41.
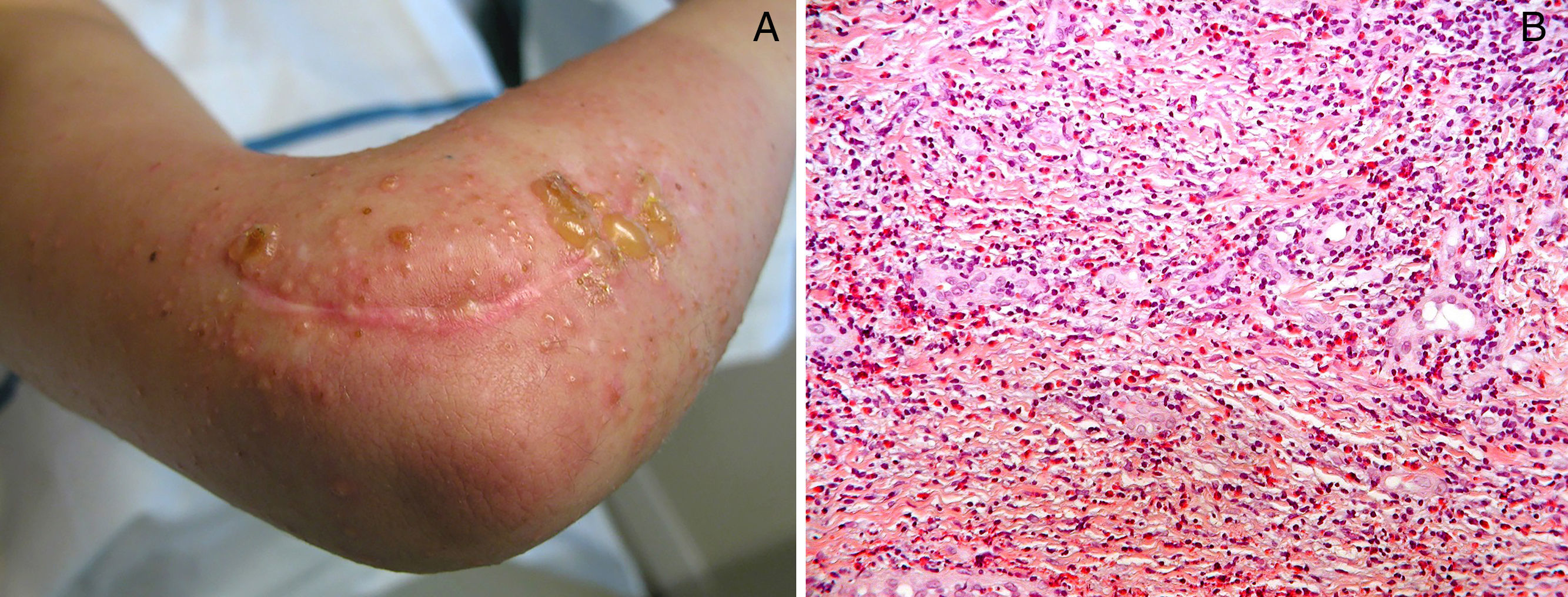
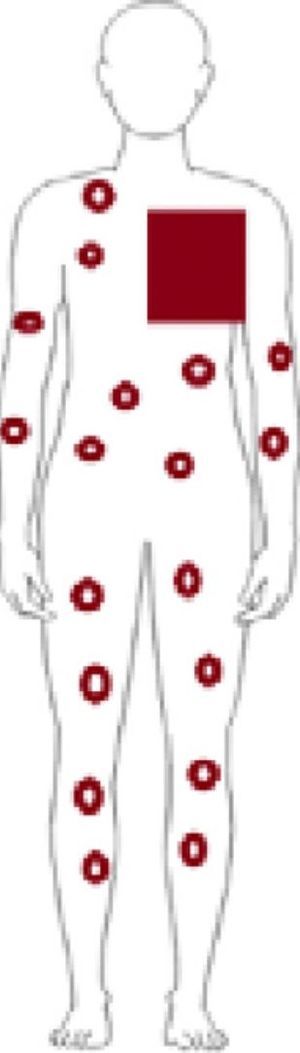
Inicialmente se describió como un cuadro clínico polimorfo formado por pápulas eritematosas y excoriaciones, aunque también, en ocasiones, lesiones habonosas, vesículas, ampollas tensas o nódulos (fig. 3). Las lesiones se extienden más allá del campo irradiado y presentan predilección por las extremidades. No hay afectación de mucosas ni palmoplantar. Es característico un prurito intenso generalizado acompañante y el cuadro suele persistir durante varias semanas o incluso meses40. Otros autores han descrito lesiones pustulosas42.
La mayor parte de los pacientes que desarrollaron el síndrome EPPER presentaban neoplasias derivadas del epitelio escamoso, fundamentalmente carcinoma de cérvix, pero también se ha descrito en otros tumores sólidos.
Se desconoce el mecanismo fisiopatológico de este fenómeno. Se ha planteado que pueda ser una reacción de hipersensibilidad tipo i (IgE mediada) a través de la producción de diversas citoquinas, o una reacción de hipersensibilidad tipo iv en relación con la expansión clonal de células Th2, similar al síndrome hipereosinofílico.
Histopatológicamente resulta imprescindible la presencia de un infiltrado inflamatorio denso eosinofílico perivascular superficial y profundo (fig. 3). Dicho infiltrado tiene una densidad de más de 10.000 eosinófilos/mm3. También pueden encontrarse vesículas intraepidérmicas con eosinófilos y ampollas subepidérmicas, indistinguibles histológicamente del penfigoide ampolloso, aunque con inmunofluorescencia directa negativa en la unión dermoepidérmica. No presenta queratinocitos necróticos ni otros signos sugestivos de eritema multiforme. La inmunofluorescencia directa únicamente muestra depósitos perivasculares superficiales ocasionales de IgM y C3, hallazgo común en muchas dermatosis inflamatorias.
En algunos pacientes se encuentra también eosinofilia en sangre, pero no de forma constante. De hecho, la eosinofilia asociada a tumores es un hecho ya conocido43 y podría ser un hallazgo casual en dicho contexto.
La resolución del cuadro suele ser espontánea.
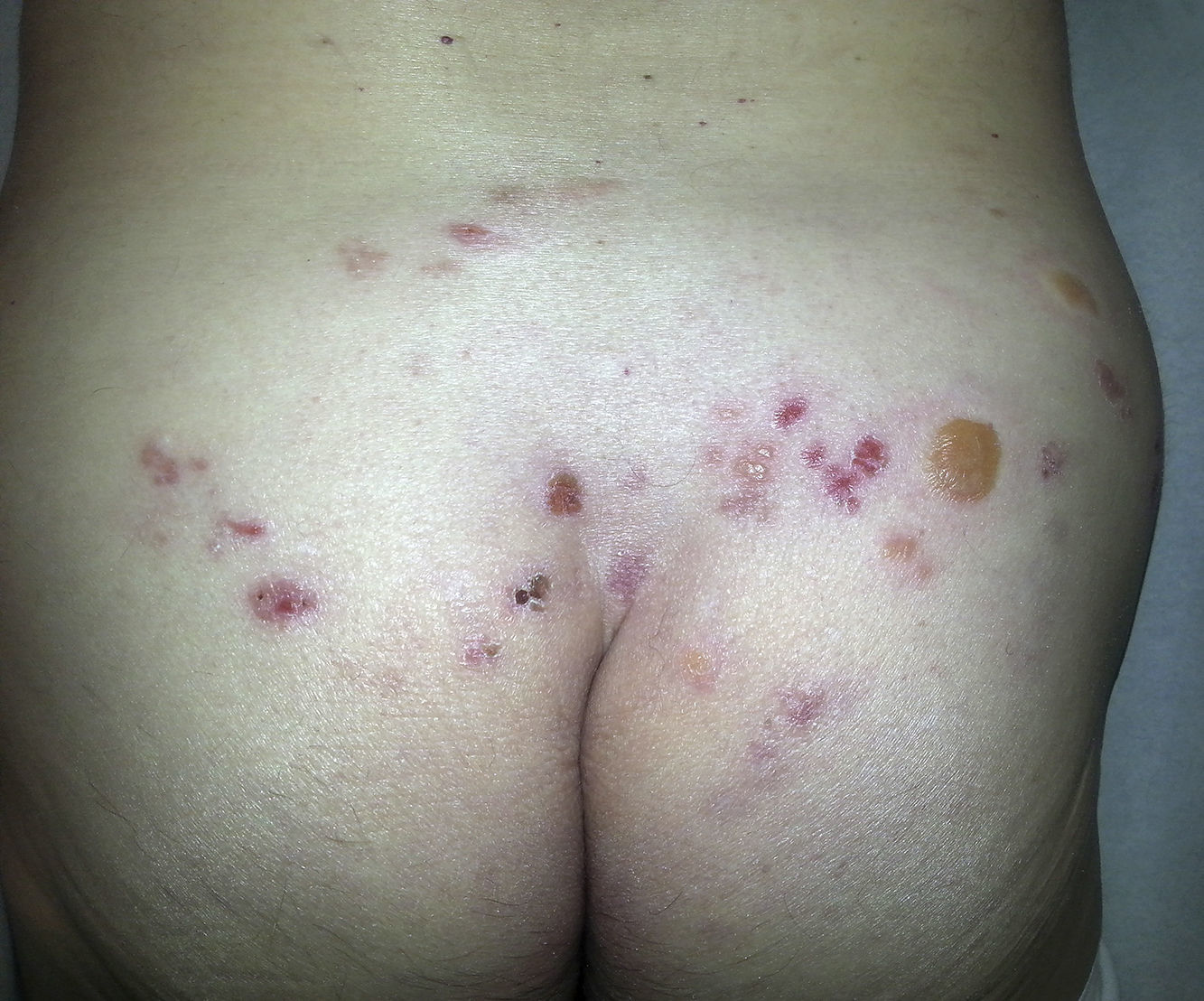
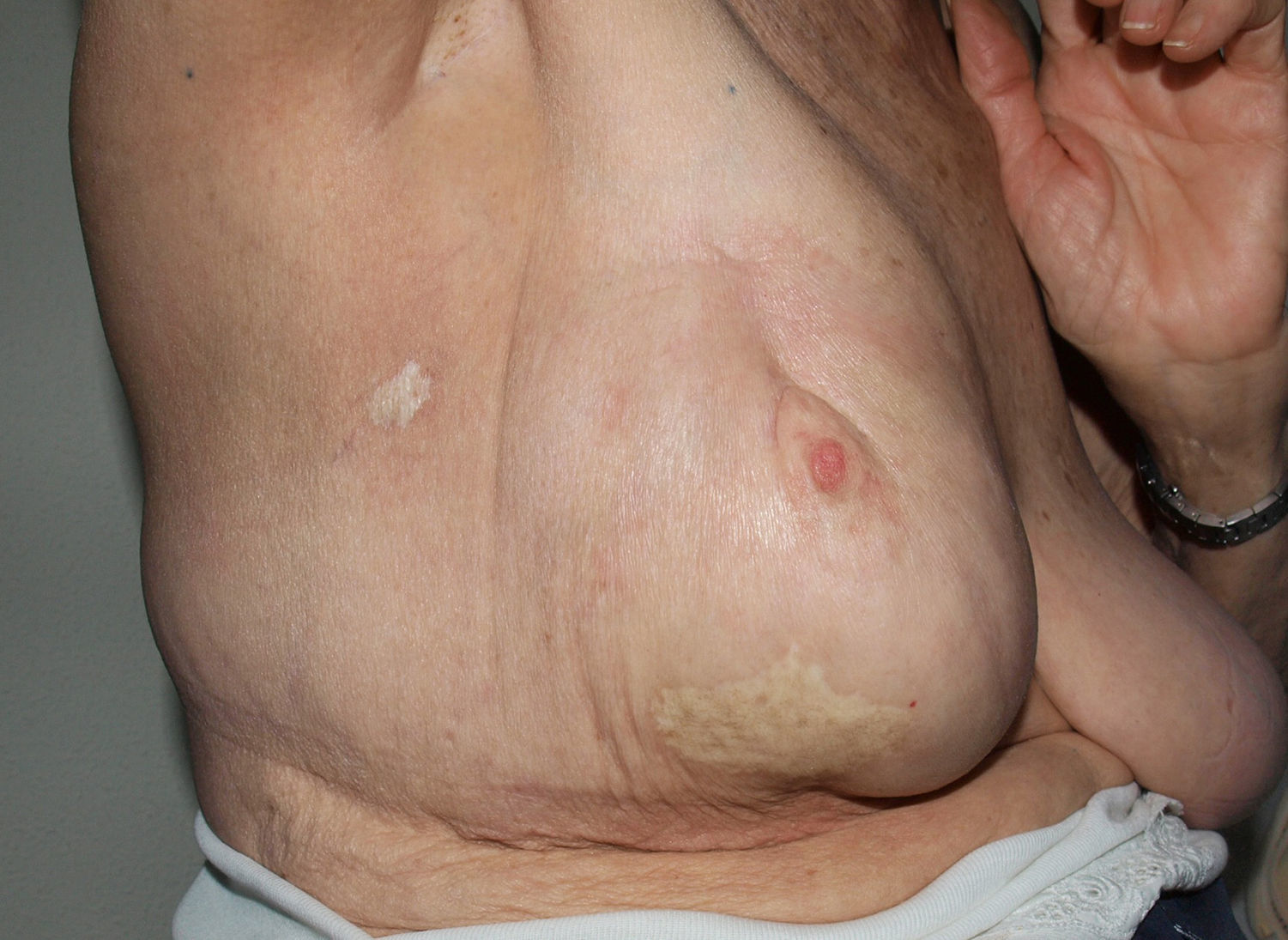
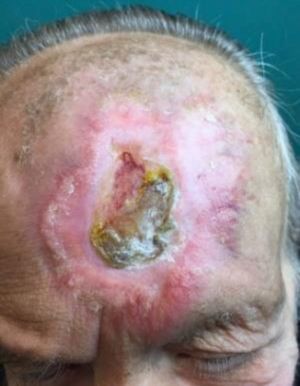
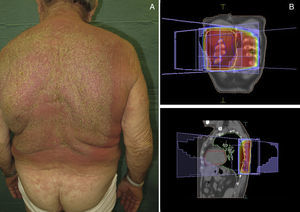
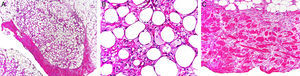
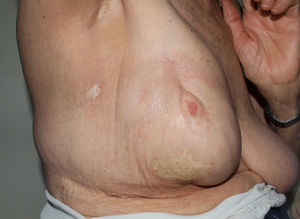
Paniculitis pseudoesclerodermiforme posradioterapiaTambién denominada paniculitis esclerosante posradioterapia. Se trata de un cuadro poco frecuente de paniculitis radioinducida que se manifiesta como induración progresiva del tejido subcutáneo limitada a la zona irradiada, sin alteraciones epidérmicas asociadas. Ha sido descrito en mujeres que recibieron tratamiento radioterápico por cáncer de mama44,45. El intervalo entre la radioterapia y la esclerosis cutánea suele ser de entre 4-8 meses, pero hay casos descritos de hasta 7 años después. Pese a poder aparecer tardíamente, no presenta signos típicos de radiodermitis crónica asociados. En numerosas ocasiones la sospecha inicial es la de una recidiva tumoral local o de metástasis subcutánea.
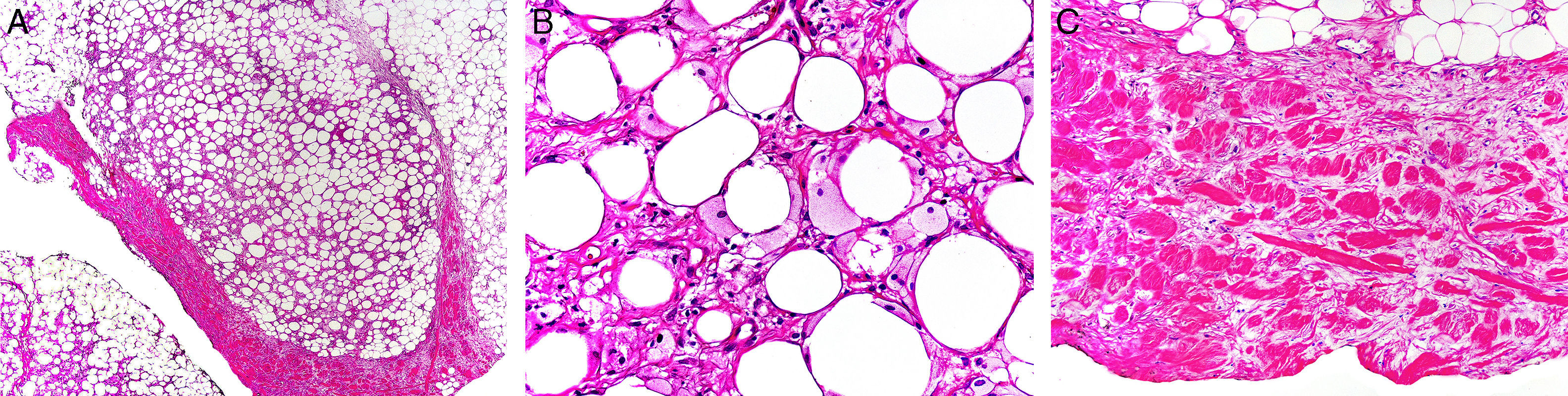
Histológicamente presenta característicamente una paniculitis predominantemente lobulillar sin vasculitis, con lóbulos que contienen adipocitos necróticos y un infiltrado inflamatorio denso formado por histiocitos espumosos46 (fig. 4). También pueden aparecer granulomas lipofágicos en forma de histiocitos alrededor de adipocitos necróticos. Asimismo, hay un engrosamiento de los septos de aspecto esclerosado, pero sin infiltrado inflamatorio asociado.
No existe un tratamiento específico, pero suele mejorar espontáneamente de forma progresiva.
Dermatosis desencadenadas o agravadas por el efecto de la radioterapiaFenómeno radioisotópicoSe ha planteado que la aparición de diversas dermatosis en campos previamente irradiados puede corresponder a un fenómeno isomórfico de Koebner. Sin embargo, la existencia de un período de latencia variable entre radioterapia y las dermatosis, junto con la ausencia del fenómeno de Koebner en condiciones normales en algunas de estas dermatosis, ha hecho pensar a otros autores que este fenómeno sea una entidad distinta, llamándola respuesta isorradiotópica47. Se trataría, por lo tanto, de un fenómeno exclusivo de la radiación ionizante empleada en el ámbito de la radioterapia que, a través de diversos mecanismos poco estudiados, desencadenaría diversas dermatosis en los campos irradiados. A continuación describimos algunas de estas dermatosis inducidas por la radioterapia.
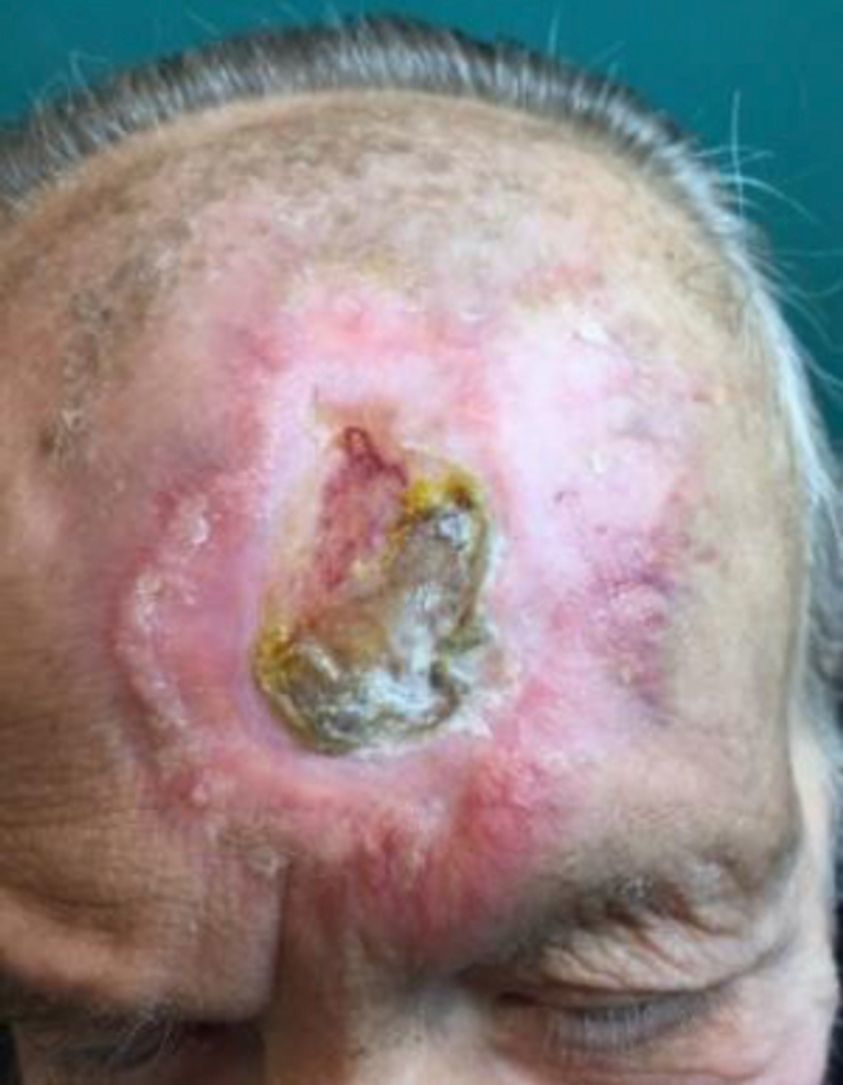
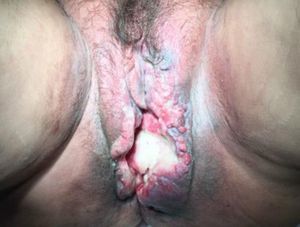
Eritema multiforme/síndrome Stevens-Johnson/necrólisis epidérmica tóxica posradioterapiaLa radiación ionizante puede inducir cuadros cutáneos del espectro del eritema multiforme/síndrome Stevens-Johnson/necrólisis epidérmica tóxica. Basándonos en una reciente revisión que engloba 165 casos descritos hasta 201148, la mayor parte de los casos cumplían criterios de eritema multiforme. En el grupo de EM, un elevado porcentaje de casos no asocia fármacos ni otros desencadenantes conocidos. Sin embargo, en los grupos de SJS y NET sí existe una clara relación farmacológica.
Los medicamentos más frecuentemente asociados son los antiepilépticos (fundamentalmente fenitoína y fenobarbital) y en segundo lugar la amifostina.
Es característica la aparición inicial del exantema maculopapular limitado a la zona irradiada, con posterior extensión al resto de la superficie corporal48,49 (tabla 4) (fig. 5).
De forma anecdótica, también se han descrito cuadros de SJS/NET que respetaban característicamente las zonas irradiadas50.
La mediana de tiempo desde la introducción del fármaco hasta la aparición del exantema en pacientes que reciben RT es de 28 días. En los casos sin fármacos implicados se constató un período previo de RT más largo48.
Existe un subgrupo de pacientes que desarrollan el llamado síndrome erythema multiforme associated with phenytoin and cranial radiation therapy (EMPACT)51. Son pacientes con metástasis cerebrales en tratamiento con fenitoína y RT craneal concomitante que desarrollan un cuadro de eritema multiforme. En todos los casos descritos la erupción comienza en el campo cefálico de RT y posteriormente se generaliza al resto del cuerpo. Tanto la RT como el fármaco antiepiléptico son cofactores, ya que la reintroducción aislada del fármaco no genera el cuadro cutáneo de nuevo.
Fisiopatológicamente, sabemos que un amplio grupo de fármacos son metabolizados a través del citocromo P450 3 A, lo que da lugar a una serie de metabolitos reactivos. Estos metabolitos son eliminados en condiciones normales por enzimas como la epóxido hidrolasa y la glutatión S transferasa. La radiación ionizante podría producir una inhibición enzimática, con el consiguiente cúmulo de metabolitos reactivos, los cuales actuarían como haptenos, desencadenando una reacción de hipersensibilidad52. Ante estos cuadros, el primer paso es identificar el fármaco más probablemente asociado e instaurar un tratamiento sintomático o medidas de soporte si el cuadro lo requiere.
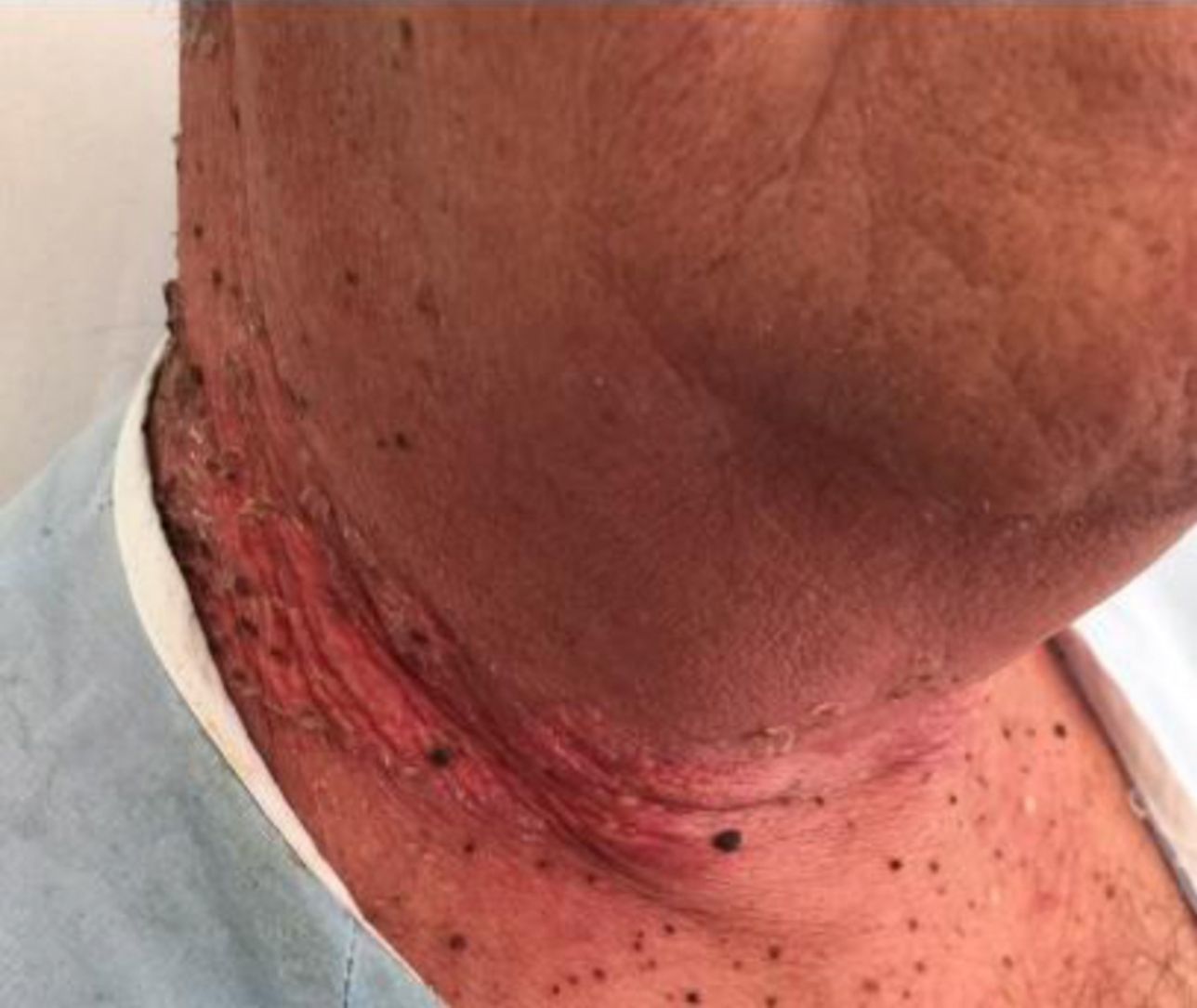
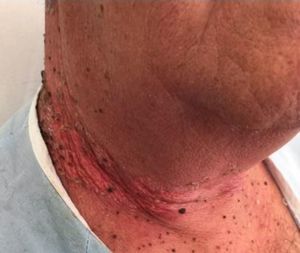
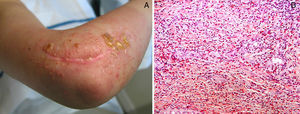
Enfermedades ampollosas autoinmunes radioinducidasSe han descrito más de 30 casos de penfigoide ampolloso desencadenados por la radioterapia53. La mayoría de estos cuadros comienzan inicialmente de forma delimitada en el campo irradiado (fig. 6), y en muchos casos se extienden posteriormente más allá del mismo54. Se ha descrito sobre todo en mujeres con antecedente de cáncer de mama y con una edad mediana de 75 años55. Es interesante conocer que la mayoría se desencadenaron más de un año después de haber finalizado la radioterapia, aunque también puede aparecer el cuadro durante la radioterapia o inmediatamente después.
El mecanismo fisiopatológico implicado no se conoce con exactitud, si bien se ha relacionado con la formación de autoanticuerpos, la alteración de la permeabilidad vascular radioinducida y con el uso de tamoxifeno53.
Histológicamente, encontramos los rasgos característicos de ampollas subepidérmicas con depósito de IgG y C3, así como inmunofluorescencia indirecta con títulos elevados de BP180 y BP230.
Los cuadros de pénfigo vulgar son algo menos frecuentes56. De manera similar al penfigoide ampolloso radioinducido, la aparición de ampollas flácidas y erosiones suele comenzar en la zona irradiada para después extenderse más allá de la misma. El período de latencia entre radioterapia y cuadro cutáneo es variable, desde una semana hasta un año después. Presentan las mismas características histológicas e inmunopatológicas del pénfigo vulgar, si bien se ha descrito además la presencia de necrosis focal de queratinocitos (hallazgo más común en el pénfigo paraneoplásico) y la reactividad frente a un antígeno queratinocítico de 110kDa en el inmunoblot56. Estos cuadros de pénfigo vulgar radioinducidos suelen tener buena respuesta al tratamiento convencional con corticoides sistémicos y otros inmunosupresores.
Asimismo, también se han descrito casos radioinducidos aislados de pénfigo foliáceo57 y pénfigo paraneoplásico58.
Liquen plano radioinducidoLa aparición de liquen plano exclusivamente en el campo irradiado previamente es poco frecuente59.
Aparece en el plazo de uno a 3 meses tras haber finalizado la radioterapia, y generalmente en pacientes sin antecedentes de liquen plano60. Aparece en forma de pápulas eritematovioláceas de morfología poligonal limitadas al campo de radioterapia, aunque también puede haber afectación en otras zonas a distancia61. Suele presentar buena respuesta a corticoides tópicos de alta potencia.
El papel de la RT podría explicarse por la alteración causada en la barrera cutánea con la expresión de autoantígenos y péptidos antigénicos en los queratinocitos que serían reconocidos por los linfocitos CD8 citotóxicos, fundamentales en la patogenia del liquen plano. Todo ello sumado a la liberación de numerosas citoquinas como IL-1, IL-6, TNF-a y TGF-b1 y a la liberación de metaloproteinasas de la matriz extracelular que dañen la membrana basal61.
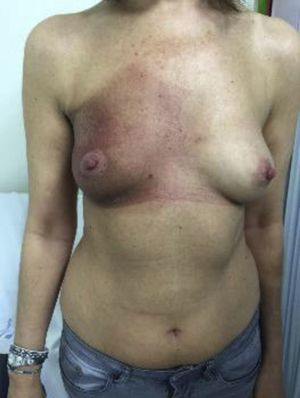
Morfea radioinducidaUna reciente revisión agrupa los 66 casos descritos hasta el año 2014 de esta entidad62. De forma similar a la paniculitis pseudoesclerodermatosa posradioterapia, se ha descrito sobre todo en pacientes afectas de cáncer de mama, aunque también puede aparecer en el contexto de otros tumores62. Suele presentarse como una zona eritematosa que progresivamente va indurándose (fig. 7). La zona afectada suele estar limitada al campo irradiado, aunque a diferencia de la paniculitis esclerosante puede extenderse más allá de la zona afectada inicialmente, sobre todo al nivel de las extremidades63. El cuadro no progresa a una esclerodermia sistémica, aunque sí puede conllevar limitaciones funcionales por la esclerosis producida. El intervalo entre radioterapia y el cuadro cutáneo varía desde semanas hasta años después de la RT, pero suele aparecer en el primer año postradioterapia62.
Histológicamente encontramos los hallazgos típicos de la morfea idiopática, es decir, un infiltrado dérmico linfohistocitario junto con un engrosamiento y esclerosis del colágeno dérmico.
El mecanismo fisiopatológico podría deberse al daño inicial provocado por la radiación al nivel de los fibroblastos con la creación de neoantígenos. Dichos neoantígenos serían reconocidos pasado un período de tiempo variable por los linfocitos B y T, desencadenando un ambiente proinflamatorio con liberación de citoquinas y activación de los fibroblastos, con aumento en la producción de colágeno62. También parece importante el papel del TGF-β62.
La induración cutánea puede mejorar espontáneamente, pero generalmente supone un reto terapéutico, como ocurre en la morfea idiopática. Ante casos que no mejoran con tacrolimus tópico se ha utilizado en algunos casos fototerapia (PUVA, UVB con acitretino)64, metotrexato o tetraciclinas.
Otras dermatosis radioinducidasEn la literatura también se ha descrito de forma anecdótica cuadros radioinducidos de lupus eritematoso65, síndrome de Sweet66, quistes de millium67 o liquen escleroatrófico68.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos la colaboración del Servicio de Oncología Radioterápica del HGU Gregorio Marañón y la iconografía aportada por los doctores mencionados previamente.