Los pacientes con psoriasis y hepatopatías son un reto terapéutico dado el mayor riesgo de efectos adversos que presentan con el tratamiento sistémico clásico y a que, aunque los fármacos anti-TNF-α son considerados más seguros, también se han descrito reactivaciones de hepatitis vírica y hepatitis tóxica en relación con los mismos. El ustekinumab (UTK) tiene un mecanismo de acción diferente y se sabe poco de sus efectos en el hígado, sobre todo a partir de los estudios pivotales. Nuestro objetivo ha sido estimar la incidencia de toxicidad hepática en los pacientes tratados con UTK en la práctica clínica habitual, y examinar los cambios hepáticos en aquellos pacientes tratados que tenían hepatopatía de base.
MétodoSe incluyeron todos los pacientes tratados con UTK según pauta habitual. Se analizaron la edad, el género, el tipo de psoriasis, la afectación ungueal, la artritis, los tratamientos previos, la hepatopatía previa, las serologías virales y el PASI (basal y a las 12, 16 y 52 semanas). Se analizaron también las transaminasas, los signos y síntomas de hepatopatía y los factores como el índice de masa corporal, el hábito enólico, la ferritina y la ecografía hepática.
ResultadosSe observaron hipertransaminasemias de grado 1 en solo 6 pacientes. Ninguno presentó hipertransaminasemias graves. Ninguno de los pacientes con hipertransaminasemia basal tuvo problemas durante el tratamiento.
ConclusionesLa hepatotoxicidad asociada a UTK es poco frecuente y grave, y parece seguro a nivel hepático, incluso en pacientes con hepatopatía basal o que habían presentado con anterioridad alteraciones hepáticas con otros fármacos.
The therapy of patients with psoriasis and liver disease can be a challenge due to the increased risk of adverse effects from traditional systemic treatments; in addition, although the anti-tumor necrosis factor agents are considered safer, they have also been associated with drug-induced liver injury and reactivation of viral hepatitis. Ustekinumab has a different mechanism of action and the little that is known of its effects on the liver comes from pivotal studies. The objectives of this study were to estimate the incidence of drug-induced liver injury in patients treated with ustekinumab in daily clinical practice and to analyze liver alterations in those patients with pre-existing liver disease.
MethodAll patients treated with the standard regimen of ustekinumab were included in the study. Variables gathered included age, sex, type of psoriasis, nail involvement, arthritis, previous treatments, history of liver disease, viral serology, Psoriasis Area Severity Index (at baseline and at 12, 16, and 52 weeks), transaminase levels, manifestations of liver disease, liver ultrasound, and factors such as body mass index, alcohol consumption, and ferritin levels.
ResultsGrade 1 elevation of the transaminases was only observed in 6 patients; no cases of severe hypertransaminasemia were observed. None of the patients with elevation of the transaminases at baseline developed problems during treatment.
ConclusionsUstekinumab-related liver injury is uncommon and mild. From a hepatic point of view, the drug appears safe, even in patients with pre-existing liver disease and those who have developed altered liver function previously with other drugs.
La mayor frecuencia de efectos adversos con tratamientos sistémicos clásicos en los pacientes psoriásicos que tienen enfermedad hepática limita las opciones terapéuticas disponibles1. En caso de hepatitis víricas, algunos tratamientos (interferón y ribavirina) pueden desencadenar o empeorar una psoriasis preexistente2, y los inmunosupresores o hepatotóxicos están relativamente contraindicados2. Los fármacos anti-factor de necrosis tumoral alfa (anti-TNF-α) han sido considerados más seguros3. Estos fármacos, y en especial etanercept, han sido usados en general sin problemas en pacientes con hepatitis C (HC)2,4,5. En cambio, en hepatitis B (HB) se han descrito algunos casos de reactivación viral en pacientes con psoriasis tratados con anti-TNF-α3, incluso con HB pasada6–8, por lo que estos últimos pese a tener Ag HB negativo deben ser estrechamente vigilados9. Además, excepcionalmente los fármacos anti-TNF-α han sido asociados a daño hepático grave (fallo hepático, colestasis y hepatitis autoinmune).
El efecto de ustekinumab (UTK), antip40 eficaz en psoriasis, en el hígado ha sido poco estudiado. El estudio PHOENIX 1 mostraba normalidad de las transaminasas10. En el estudio PHOENIX 2 un paciente del grupo placebo desarrolló un carcinoma hepatocelular y no se encontraron diferencias significativas entre los pacientes tratados con placebo y los tratados con UTK11. Tampoco se encontraron diferencias en los niveles de transaminasas entre el UTK y el etanercept en el estudio ACCEPT12. Centrándonos en la práctica clínica, varias series recientes de pacientes tratados con UTK no comentaban efectos adversos hepáticos13–15, y solo un estudio encontraba un 44% de hipertransaminasemia sin concretar ni sus niveles ni su duración16.
El objetivo principal de nuestro estudio ha sido estimar la frecuencia de hepatotoxicidad en los pacientes con psoriasis tratados con UTK según las pautas de práctica clínica habitual y, en segundo lugar, examinar la influencia del UTK en la afectación hepática en aquellos pacientes con hepatopatía o hipertransaminasemia previa al inicio del tratamiento.
Materiales y métodosEstudio observacional, retrospectivo con inclusión consecutiva de todos los pacientes con psoriasis moderada-grave que iniciaron tratamiento con UTK entre el 1 de marzo de 2009 y el 30 de junio de 2011 en la Unidad de Psoriasis del Hospital Universitario de la Princesa. El estudio fue aprobado por el Cómite Ético de la Fundación de Investigación Biomédica de La Princesa. Se excluyeron los pacientes menores de 18 años o con ausencia de información válida en la historia clínica. Se revisaron las historias y pruebas complementarias. A nivel basal se registraron la altura, el peso, el tipo de psoriasis, la edad al diagnóstico, la duración de la enfermedad, la afectación ungueal, la artritis psoriásica, el Psoriasis Area and Severity Index (PASI), el Body Surface Area (BSA) y el Dermatology Life Quality Index (DLQI), la historia de ingesta enólica, el tabaquismo, la historia previa de hepatopatía, los fármacos sistémicos y biológicos previos y la medicación concomitante (tabla 1). Además, se revisaron la analítica incluyendo hemograma, bioquímica con perfil hepático (aspartato aminotransferasa [AST] normal: 7-35U/l; alanina aminotransferasa [ALT] nomal: 8-40U/L; y gamma glutamil transpeptidasa [GGT] normal: 6-50U/l) y lipídico, las serologías para HB, HC y virus de la inmunodeficiencia humana (VIH), el Mantoux con booster y la radiografía de tórax. En todos los casos se administró UTK (45mg inyección subcutánea) en las semanas 0, 4 y posteriormente cada 12 semanas. Se hicieron analíticas con perfil hepático a todos los pacientes en las 4 y 16 semanas de tratamiento, así como en la mayor parte de las visitas de seguimiento. La ecografía hepática se realizó basalmente a aquellos pacientes con historia previa de hepatopatía o hipertransaminasemia y, durante el seguimiento, a todos los que presentaron alteración de las transaminasas o signos o síntomas sugestivos o compatibles con hepatopatía.
Datos basales de nuestra cohorte de 44 pacientes en tratamiento con ustekinumab
| Denominación de la variable | Resultados (n=44) |
|---|---|
| Edad (años) Media (DS) [rango]///Género (%) | 47,76 (17,99) [18-87]///59,1% hombres y 40,9% mujeres |
| Duración de la psoriasis (años) Media (DS) [rango] | 25,58 (15,94) [4-74] |
| Tipo de psoriasis (%) | |
| En placa | 84,1 |
| En gotas | 2,4 |
| Eritrodérmica | 13,6 |
| Artropatía psoriásica (%) total | 15,9 |
| Axial | 28,6 |
| Periférica | 57,1 |
| Axial y periférica | 14,3 |
| PASI basal media(DS) [rango] | 23,4 (14,09) [2,4-56,8] |
| PASI 12 semanas mediana (DS) [rango] | 2,5 (6,1) [0-35] |
| PASI 16 semanas mediana (DS) [rango] | 2,22 (2,4) [0-22,5] |
| Peso (kg) media (DS)[rango] | 75,3 (13,82) [47-100] |
| Índice de masa corporal media(DS) (rango) | 26,62 (4,43) [18,12-37] |
| Diabetes mellitus (%) | 18,2 |
| Hipertensión (%) | 27,9 |
| Dislipidemia (%) | 40,9 |
| Tratamientos previos (nombre del fármaco//número total de pacientes) | Metotrexato (22) |
| Ciclosporina (22) | |
| Etanercept (18) | |
| PUVA (14) | |
| Acitretina (14) | |
| Adalimumab (14) | |
| Infliximab (9) | |
| Efalizumab (8) | |
| Etretinato (5) | |
| Onercept (1) | |
| Hidroxiurea (1) | |
| Hepatitis B pasadaa(%) (número de pacientes) | 9,3 (4] |
| Ingesta enólica (g/día). Media (DS) [rango] | 6,4 (19,72) [0-82] |
| Niveles basales de enzimas hepáticas (U/l) Media (SD) | |
| AST | 20,9 (8,99) |
| ALT | 22,8 (16,22) |
| Ecografía hepáticab(%) | |
| Normal | 55,6 |
| Esteatosis hepática | 44,4 |
| Fibrosis | 0,0 |
| Cirrosis | 0,0 |
ALT: alanina aminotransferasa; AST: aspartato aminotransferasa; DS: desviación estándar; PASI: Psoriasis Area Severity Index.
Los pacientes con Mantoux positivo fueron tratados con isoniazida (300mg/día) durante 9 meses iniciando el tratamiento profiláctico un mes antes que el UTK.
Se evalúo la gravedad de la hipertransaminasemia como grado 1 (hasta 3 veces por encima de la normalidad), grado 2 (entre 3 y 5 veces por encima de lo normal) y grado 3 (entre 5 y 10 veces por encima de lo normal o hepatitis aguda)17. La ecografía hepática permitió la clasificación del hígado de los pacientes en normal o patológico (esteatosis, fibrosis o cirrosis).
El análisis estadístico se realizó con SPSS/PC software (SPSS Inc., Chicago, IL, versión 19.0 para Windows). Las variables cuantitativas fueron analizadas mediante el test «t» Student, y las binomiales mediante el Chi cuadrado con la corrección de Fisher.
ResultadosSe incluyeron un total de 44 pacientes, de los cuales el 59% eran hombres, la mayoría no fumadores (57,5%). El tiempo medio de seguimiento con UTK fue de 46,2 meses (rango: 25,3-63,4).
La mayoría de los pacientes tratados con UTK tenían psoriasis en placas y un 58,8% afectación ungueal. Algunos datos basales de la población, los fármacos sistémicos y biológicos usados previamente para su psoriasis, así como el porcentaje de pacientes con comorbilidades relevantes se muestran en la tabla 1. Tres pacientes habían recibido una dosis acumulada de metotrexato superior a 2g, pero ninguno había llegado a los 3g, siendo la dosis media acumulada de de 190mg. Algunos pacientes recibían simultáneamente fármacos hepatotóxicos como estatinas (5), metotrexato (2), hipoglucemiantes (2) y antagonistas de la angiotensina ii (1).
Se analizaron posibles factores confusores en cuanto a hepatotoxicidad. Solo 4 pacientes tenían HB pasada, ninguno HC, VIH o HB activa. El nivel medio de ferritina era 108,92mg/l (rango: 15-366mg/l) en los 24 pacientes estudiados, siendo los niveles normales en nuestro centro de 15 a 150mg/ml. Solo uno tenía un nivel alto de ferritina, de 366mg/l, y en él se descartó hemocromatosis. Doce pacientes eran obesos (índice de masa corporal [IMC] superior 30). Se demostró esteatosis hepática en 9 pacientes con ecografía hepática. Ninguno tenía fibrosis o cirrosis basalmente.
En cuanto a la historia de hepatopatía previa, un 41,9% de los pacientes habían tenido hipertransaminasemia en relación con otros tratamientos como infliximab (5 casos), etanercept (3 casos), adalimumab (2 casos) e isoniazida (2 casos).
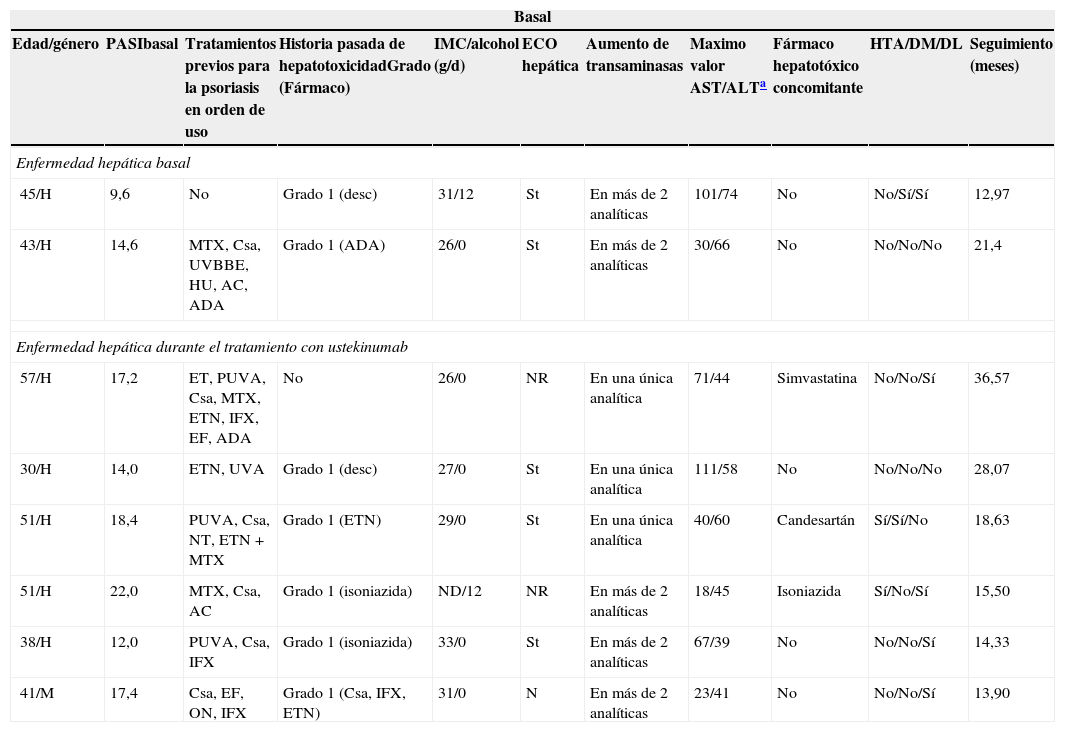
Dos pacientes iniciaron tratamiento con UTK con una elevación basal de transaminasas (tabla 2). El primero, un hombre de 45 años con psoriasis moderada-grave de 15 años de duración y con historia médica irrelevante, salvo por enolismo crónico y obesidad (IMC=31,5). Cuando se inició tratamiento con UTK el paciente presentaba los siguientes parámetros de gravedad de la psoriasis: PASI basal de 9,6, BSA de 7,1% y DLQI de 13. A las 16 semanas de tratamiento su PASI era 3, BSA 3% y un DLQI de 1. Los niveles de AST y ALT se mantuvieron estables durante el tratamiento, con una ligera tendencia al aumento. El segundo paciente era un varón de 43 años con esteatosis hepática e IMC de 26,2, sin ingesta enólica conocida y que había sido tratado con ciclosporina, retinoides, ultravioleta B de banda estrecha (UVBBE) y metotrexato con hipertransaminasemia. En este paciente se observó una progresiva disminución de sus niveles de transaminasas, con normalización de los mismos tras 19 meses de tratamiento con UTK.
Datos relevantes demográficos, de hepatotoxicidad previa, IMC, así como de otras comorbilidades y de valores máximos de transaminasas alcanzados en pacientes tratados con ustekinumab que presentaban hepatopatía basal o que la desarrollaron durante el tratamiento
| Basal | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Edad/género | PASIbasal | Tratamientos previos para la psoriasis en orden de uso | Historia pasada de hepatotoxicidadGrado (Fármaco) | IMC/alcohol (g/d) | ECO hepática | Aumento de transaminasas | Maximo valor AST/ALTa | Fármaco hepatotóxico concomitante | HTA/DM/DL | Seguimiento (meses) |
| Enfermedad hepática basal | ||||||||||
| 45/H | 9,6 | No | Grado 1 (desc) | 31/12 | St | En más de 2 analíticas | 101/74 | No | No/Sí/Sí | 12,97 |
| 43/H | 14,6 | MTX, Csa, UVBBE, HU, AC, ADA | Grado 1 (ADA) | 26/0 | St | En más de 2 analíticas | 30/66 | No | No/No/No | 21,4 |
| Enfermedad hepática durante el tratamiento con ustekinumab | ||||||||||
| 57/H | 17,2 | ET, PUVA, Csa, MTX, ETN, IFX, EF, ADA | No | 26/0 | NR | En una única analítica | 71/44 | Simvastatina | No/No/Sí | 36,57 |
| 30/H | 14,0 | ETN, UVA | Grado 1 (desc) | 27/0 | St | En una única analítica | 111/58 | No | No/No/No | 28,07 |
| 51/H | 18,4 | PUVA, Csa, NT, ETN+MTX | Grado 1 (ETN) | 29/0 | St | En una única analítica | 40/60 | Candesartán | Sí/Sí/No | 18,63 |
| 51/H | 22,0 | MTX, Csa, AC | Grado 1 (isoniazida) | ND/12 | NR | En más de 2 analíticas | 18/45 | Isoniazida | Sí/No/Sí | 15,50 |
| 38/H | 12,0 | PUVA, Csa, IFX | Grado 1 (isoniazida) | 33/0 | St | En más de 2 analíticas | 67/39 | No | No/No/Sí | 14,33 |
| 41/M | 17,4 | Csa, EF, ON, IFX | Grado 1 (Csa, IFX, ETN) | 31/0 | N | En más de 2 analíticas | 23/41 | No | No/No/Sí | 13,90 |
AC: acitretino; ADA: adalimumab; Csa: ciclosporina; desc: desconocido; DM: diabetes mellitus; EF: efalizumab; ET: etretinato; ETN: etanercept; H: hombre; HTA: hipertensión arterial; HU: hidroxiurea; IFX: infliximab; IMC: índice de masa corporal; M: mujer; MTX: metotrexato; N: normal, sin alteraciones; NR: no realizado; ON: onercept; PUVA: psoraleno más luz ultravioleta A; St: esteatosis hepática,;UVBBE: ultravioleta B de banda estrecha.
Durante el tratamiento con UTK 6 pacientes tuvieron hipertransaminasemia grado 1 (tabla 2). Cinco de ellos habían tenido hepatotoxicidad previa en relación con otros fármacos usados para tratar su psoriasis, 3 presentaban esteatosis hepática y 3 de ellos estaban recibiendo fármacos hepatotóxicos concomitantemente con su tratamiento con UTK. La elevación de las transaminasas sucedió entre uno y 17 meses tras el inicio del tratamiento, con una media de 3 y una desviación estándar de 1,4. Otro paciente tuvo un ligero aumento de GGT. Ninguno de ellos mostró signos ni síntomas de hepatopatía ni necesitó suspender o modificar el tratamiento por este motivo. No se encontraron efectos adversos hepáticos graves durante el tratamiento con UTK ni ninguna reactivación viral.
El análisis estadístico realizado no mostró diferencias estadísticamente significativas entre los pacientes con o sin alteración de las transaminasas respecto a su edad (p=0,592), grado de ingesta enólica (p=0,541) o IMC (p=0,116). Tampoco mostró diferencias en el porcentaje de pacientes que alcanzaron PASI 75 a las 16 semanas (p=0,597).
DiscusiónDebido al mecanismo de acción del UTK18,19 algunos efectos hepáticos son esperables durante el tratamiento. En la HB el aumento de IL-12 se correlaciona con hepatólisis, con el aclaramiento viral18 y con el control sostenido de la viremia en pacientes con HB crónica19. El mecanismo exacto es desconocido porque la actividad de la vía proinflamatoria IL-23/IL-17 está también sobreexpresada en la HB y podría facilitar la cronicidad del proceso20. Las células Th17 están aumentadas en la HB crónica y el incremento del cociente Th17/T reguladoras puede ser un marcador pronóstico adverso21. En HC la activación de células Th17 inducida por el virus puede contribuir al aclaramiento del mismo, porque los niveles de IL12p40 son superiores en los pacientes respondedores IFN-α22, aunque Zhang et al. no corroboran este hecho23. Los polimorfismos genéticos en IL-12p40, que podrían modular la HC24, también explican la ausencia de concordancia en distintas publicaciones. El UTK debería ser usado con precaución en pacientes con hepatitis víricas dados los datos de investigación básica, y aunque parece seguro en algunas series en la práctica clínica25, ya se han publicado casos de reactivación de HB y HC26,27. En nuestra serie no ha habido reactivación de ninguna HB pasada.
En el hígado de los pacientes con esteatosis hepática no alcohólica se detectan niveles aumentados de IL-17, que pueden facilitar la transición desde esteatosis hasta esteatohepatitis28.
La IL-12 está también implicada en otras hepatopatías y es esencial en el desarrollo de colangitis autoinmune en un modelo murino de cirrosis biliar primaria29. Por último, las células Th17 están implicadas en el rechazo de los aloinjertos hepáticos en ratas30. Por tanto, la modulación de Th17 podría mejorar muchas enfermedades hepáticas. Nuestro estudio no muestra empeoramiento de las hepatopatías presentes al iniciar el tratamiento con UTK.
Las comorbilidades en los pacientes con psoriasis han sido ampliamente estudiadas31,32. Un 42% de pacientes de nuestra serie fumaban, porcentaje similar a lo descrito33. En los pacientes estudiados la ingesta enólica media fue de 6,36g/d de alcohol, menor a lo descrito habitualmente, lo que discrepa con estudios previos mostrando ingestas enólicas superiores en pacientes con psoriasis34. El alcohol es citotóxico en el hígado y en la médula ósea e inmunosupresor; además, el consumo de más de 2,3 bebidas alcohólicas semanales aumenta de forma significativa el riesgo de desarrollar una psoriasis34,35, y consumos superiores a 100g/día en varones son un factor de riesgo para mayores niveles de actividad de la psoriasis36. Otros estudios no han encontrado relación entre ingesta enólica y gravedad de la psoriasis. En los pacientes de nuestra serie la anamnesis directa puede haber influido en los niveles de ingesta enólica reconocida.
Se ha descrito una prevalencia de obesidad del doble en pacientes con psoriasis y una asociación entre el IMC y el PASI, con un peor control de la enfermedad en pacientes con IMC altos33. Un 20,5% de nuestros pacientes eran obesos, siendo un 13,3% la prevalencia de obesidad en la población general en España en el mismo período37, lo que concuerda con lo descrito.
La esteatosis hepática no alcohólica, enfermedad metabólica crónica relacionada tanto con el síndrome metabólico como con la resistencia a la insulina, es la principal causa de hipertransaminasemia en Europa33. En nuestros 8 pacientes con esteatosis hepática no alcohólica solo el mayor (de 62 años) había desarrollado ya diabetes y dislipidemia. Gisondi et al. publicaron que hasta el 50% de las esteatosis hepáticas no alcohólicas no son diagnosticadas, algo que hemos comprobado en nuestra serie, y sugieren que la psoriasis podría ser un factor de riesgo implicado en su aparición38, aunque otros autores exigirían descartar a los pacientes con ingesta enólica importante39. Ninguno de nuestros pacientes con esteatosis hepática no alcohólica tenía una alta ingesta enólica, aunque 5 eran obesos, lo que concuerda con lo publicado por Gisondi et al.
La hepatotoxicidad inducida por fármacos se define por un aumento de al menos 3 veces los niveles de transaminasas normales o del doble de los niveles de bilirrubina40. No hubo casos en nuestra serie. En cuanto a la hipertransaminasemia puede verse durante el tratamiento con fármacos anti-TNF-α41, sobre todo con infliximab3, pero también con etanercept y adalimumab42. Hemos encontrado un 14,3% de hipertransaminasemia durante el tratamiento con UTK en nuestra serie. Aunque hay casos de hepatotoxidad por un anti-TNF-α tratados con otro fármaco de la familia sin recurrencia41,43–45, la posibilidad de usar un fármaco con distinto mecanismo de acción parece más seguro.
Por último, 5 de nuestros pacientes fueron tratados con estatinas, fármacos hepatotóxicos con una incidencia de daño hepático del 1%. Solo uno de ellos tuvo una hipertransaminasemia en una única analítica y de grado 1, recuperada sin secuelas. Por tanto, no parece que haya contraindicación para el uso de estatinas ni en nuestra serie ni en la literatura revisada21.
Limitaciones de nuestro estudio son el número de pacientes, un período de seguimiento relativamente corto, así como la ausencia de algunos datos de dosificación de fármacos hepatotóxicos usados con anterioridad.
De nuestro estudio se concluye que la hepatotoxicidad asociada al tratamiento con UTK es poco frecuente y leve. Asimismo, el UTK parece ser una alternativa segura en pacientes con hepatopatía previa o que hayan desarrollado alteraciones hepáticas durante el tratamiento con fármacos antipsoriásicos, incluyendo los fármacos anti-TNF-α.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesM. Llamas-Velasco: participación en ensayos clínicos y advisory boards de Abbvie, Janssen-Cilag y Novartis.
E. Daudén: parte de advisory board, consultor, becas, ayuda a la investigación, participación en ensayos clínicos y honorarios por charlas de las siguientes compañías: Abbvie Astellas, Biogen, Centocor Ortho Biotech Inc., Galderma, Glaxo, Janssen-Cilag, Leo Pharma, Merck-Serono, Novartis, Pfizer, Schering-Plough, Stiefel, Wyeth Pharmaceuticals, 3M, Celgene.
A. García-Diez está actualmente jubilado y no tiene conflicto de intereses actuales.
María José Concha-Garzón tampoco refiere conflictos de intereses actuales.