El lupus eritematoso túmido (LET) es una forma de lupus eritematoso cutáneo (LEC) ya descrita en la literatura hace años. Sin embargo, no ha sido hasta la última década en que esta entidad ha generado un mayor interés, dando lugar a la publicación de numerosos trabajos que han permitido caracterizarlo como un subtipo de LEC con unos rasgos particulares. Dichos rasgos son, desde el punto de vista clínico, la ausencia de alteraciones en la superficie epidérmica (erosión, atrofia, descamación y taponamiento folicular) y la curación sin dejar cicatriz. Las lesiones son, por otra parte, fácilmente inducibles por la fotoexposición, por lo que suelen cursar a brotes. Sin embargo, algunas cuestiones acerca del LET, como son su clasificación, ciertas características microscópicas y el diagnóstico diferencial con otras entidades, como la erupción polimorfa lumínica o la infiltración linfocitaria de Jessner, siguen siendo objeto de controversia a día de hoy y dificultan el diagnóstico de estos pacientes.
Lupus erythematosus tumidus (LET), a form of cutaneous lupus erythematosus that was described some years ago, has begun to receive more attention in the past decade as many published studies have helped to define the particularities of this subtype.The clinical features of LET include the absence of changes on the surface of the epidermis (such as erosion, atrophy, scaling, or follicular plugging) and the lack of scarring on resolution.Because flares are easily induced on exposure to sunlight, eruptions tend to occur in episodes.The diagnosis of LET remains difficult, however, as we continue to debate such issues as the classification of this disease, certain of its microscopic features, and the differential diagnosis of LET in relation to such entities as polymorphic light eruption or Jessner lymphocytic infiltration.
El término lupus eritematoso túmido (LET) fue introducido en la literatura por primera vez en 19301 por Gougerot y Burnier para describir 5 pacientes que desarrollaron unas lesiones eritematosas, infiltradas, lisas, sin descamación ni otro cambio en la superficie. Sin embargo, en los años posteriores a su descripción esta entidad recibió una escasa atención en la literatura, publicándose tan sólo algunos casos clínicos aislados2–6. De hecho, en la clasificación de las lesiones cutáneas de lupus eritematoso propuesta por Gilliam en los años 707 se contemplaron tres tipos clínicos principales: el lupus eritematoso cutáneo crónico (LECC) —que incluye el lupus eritematoso discoide (LED) como el subtipo más importante—, el lupus eritematoso cutáneo subagudo (LECS) y el lupus eritematoso cutáneo agudo (LECA). El LET no aparecía en esta clasificación, hecho que sin duda contribuyó a que se considerara una forma de lupus infrecuente, a la vez que poco conocida. Estos pacientes solían ser diagnosticados de forma genérica como LECC o como lo que algunos autores denominaron «lesiones papulares», cuya descripción clínica e histopatológica no es otra que la del LET8.
No obstante, en la última década varios autores han recuperado el interés por esta entidad y han hecho esfuerzos por caracterizarla. De esta manera, se ha ido perfilando como un subtipo de lupus eritematoso cutáneo (LEC) con unas características clínicas, pronósticas y microscópicas particulares. Además, se ha hecho patente que la frecuencia del LET con toda probabilidad se encontraba subestimada9,10; de hecho, existe la impresión generalizada de que podría ser incluso más prevalente que el LED clásico.
Sin embargo, algunas cuestiones acerca del LET, como son su clasificación, ciertas características microscópicas o el diagnóstico diferencial con otras entidades siguen siendo objeto de controversia a día de hoy. Como veremos, algunos autores incluso han puesto en duda que se trate de un auténtico lupus. Todos estos aspectos se discutirán de forma detallada en los siguientes apartados.
EpidemiologíaTal y como se ha comentado con anterioridad, la mayoría de autores están de acuerdo en que el LET no es una forma clínica ni mucho menos excepcional, sino que su frecuencia es mayor de lo que se pensaba hace unos años. Si bien no hay estudios que aporten datos sólidos acerca de su prevalencia o su incidencia, hasta la fecha han sido descritos en la literatura unos 250 pacientes11. Hay que tener en cuenta que la gran mayoría corresponden a publicaciones de los últimos 10 años, con lo que se trata de una cantidad considerable de casos.
En cuanto a la distribución por sexos el LET afecta a un porcentaje similar de hombres y mujeres9–12, a diferencia de lo que sucede en el LECS y el LECA.
La edad media de inicio de la enfermedad oscila entre los 36,4 y los 38,5 años11,12, siendo similar a la del LED11. Hay que destacar que se han descrito algunos casos en niños, los cuales mostraron las mismas características clínicas e histopatológicas que los pacientes adultos13.
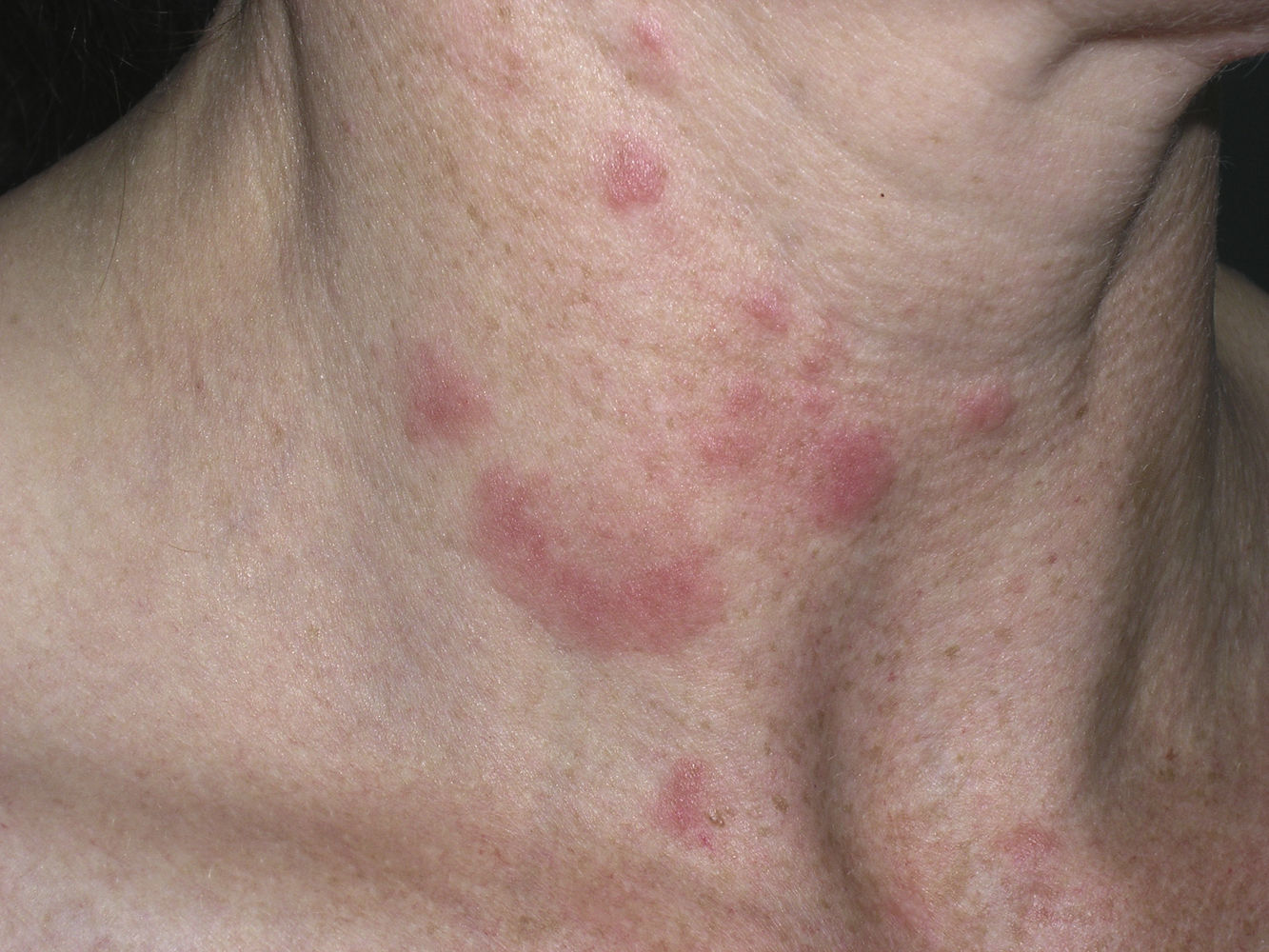
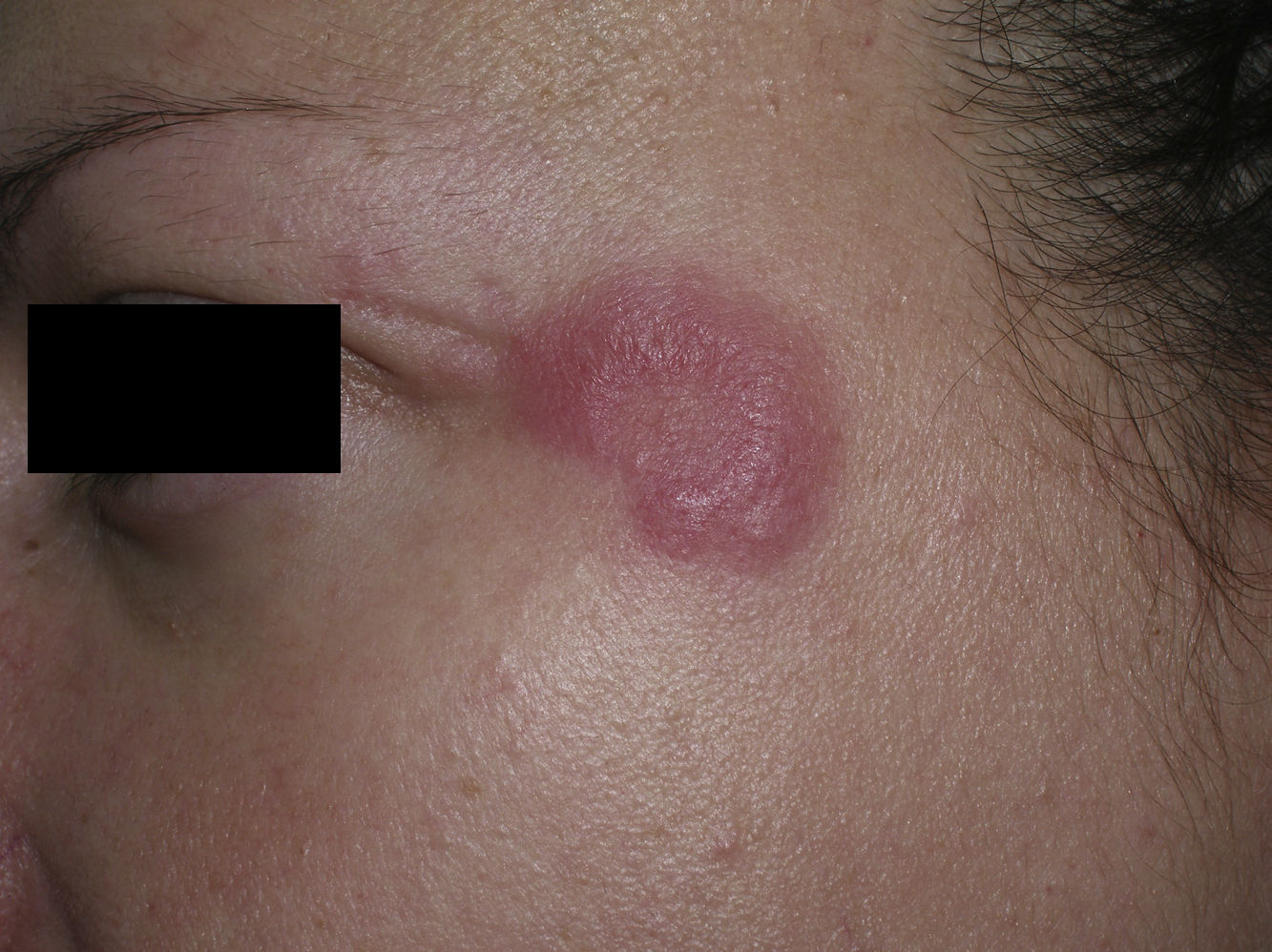
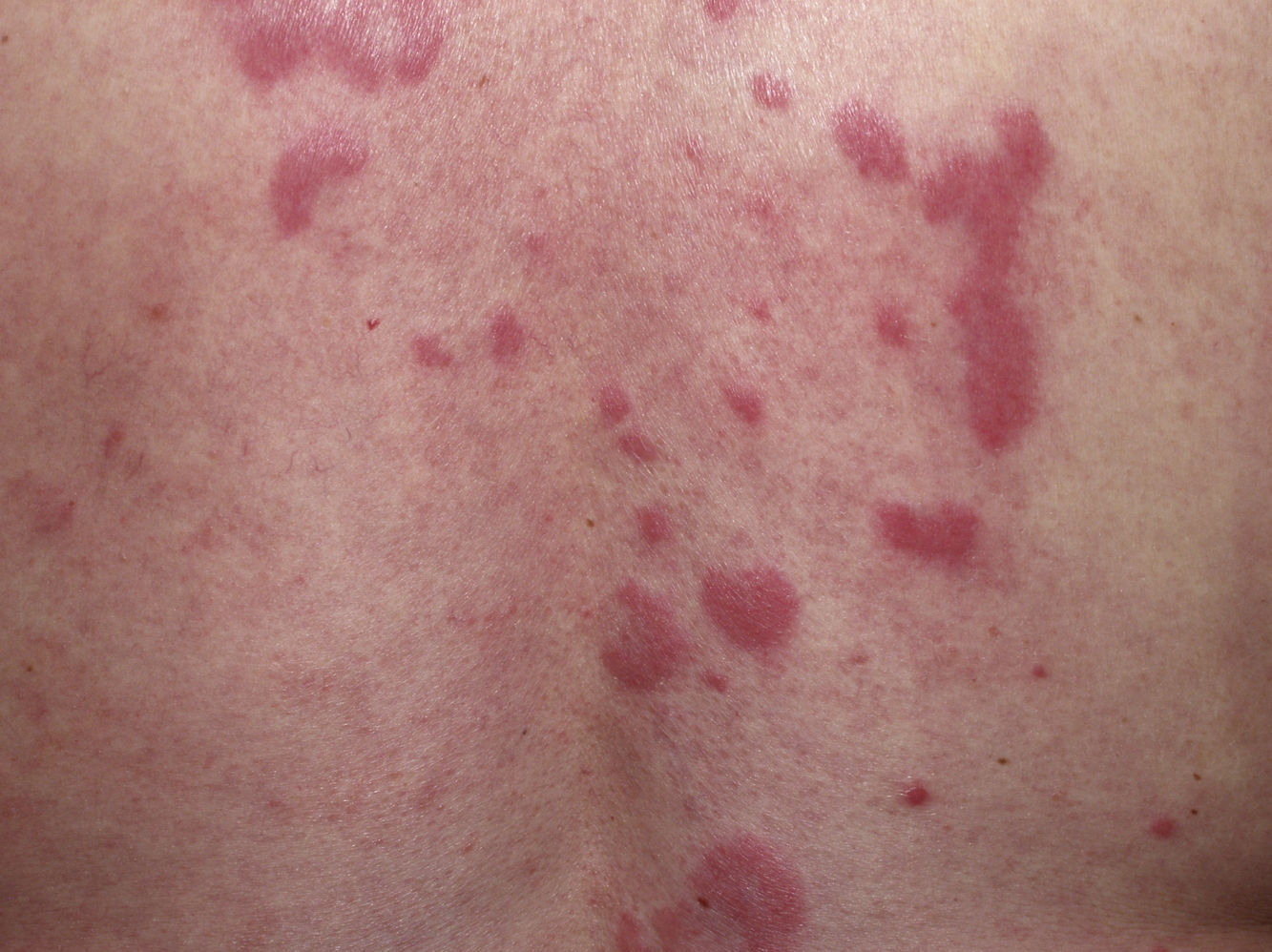
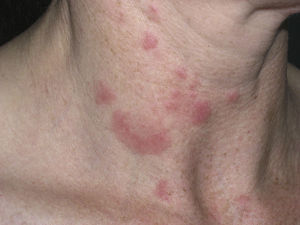
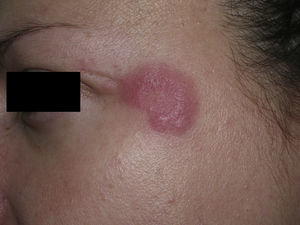
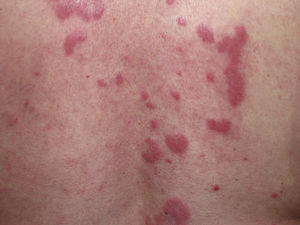
ClínicaLas lesiones del LET consisten en pápulas, placas o lesiones anulares, eritematosas, de aspecto suculento, que aparecen de forma predominante en las zonas fotoexpuestas como el escote, los hombros, la cara o los brazos. Los rasgos que diferencian las lesiones del LET de las del LED y el LECS son la ausencia de descamación, de tapones foliculares y de atrofia (figs. 1-3); además curan sin dejar cicatriz ni hipopigmentación9–12,14–16. Las lesiones tienden a aparecer en forma de brotes, casi siempre en relación con la exposición solar, de forma predominante en la primavera y el verano. Es importante tener en cuenta el curso que siguen las lesiones tras la fotoexposición, pues nos permitirá ayudar a diferenciar al LET de la erupción polimorfa lumínica. En el LET las lesiones no aparecen de forma inmediata, sino tras un tiempo de latencia que varía entre las 24 horas y varias semanas11,12,17,18. Además, suelen persistir a lo largo de todo el período estival e incluso más allá del mismo. Unas líneas más adelante trataremos en profundidad algunos aspectos sobre la fotosensibilidad del LET y los posibles factores etiopatogénicos implicados.
Otro rasgo distintivo del LET es su escasa asociación a anticuerpos antinucleares (ANA), así como a anti-Ro, anti-La y anti-ADN9–12,14–16. Los pacientes no suelen mostrar tampoco alteraciones en los análisis, tales como citopenias o anomalías de la función renal. Todo ello, unido a la escasa asociación a complicaciones sistémicas propias del lupus eritematoso sistémico (LES), hace que LET resulte muy similar al LED en cuanto a su comportamiento desde el punto de vista sistémico.
Fotosensibilidad del lupus eritematoso túmido y teorías acerca de su etiopatogeniaEl LET se caracteriza por una gran fotosensibilidad que ha sido corroborada de forma experimental por varios estudios fotobiológicos. De hecho, a la luz de estas investigaciones es considerado el tipo de LEC más fotosensible, incluso más que el LECS. Así, en el LET el porcentaje de lesiones fotoinducidas es del 70-76%11,15,17,18, superior al 62-63% que se da en los pacientes con LECS11,17. Como bien es sabido, durante muchos años la fotosensibilidad del LEC ha sido vinculada de manera muy estrecha a la presencia de autoanticuerpos en la sangre, fundamentalmente al anti-Ro19,20. Aunque no se ha podido demostrar in vivo una relación directa entre la presencia de estos anticuerpos y la fotosensibilidad21, es más que probable su participación en al menos algunos tipos de lupus eritematoso; un dato a favor de esta teoría es el desarrollo de lesiones cutáneas en el lupus neonatal, ligado a la presencia del anti-Ro, procedente de la madre, en la sangre del niño22.
Sin embargo, la elevada fotosensibilidad del LET, que no se asocia en general a la presencia de ANA, anti-Ro ni anti-La en la sangre, obliga a pensar en mecanismos alternativos que den lugar a la aparición de las lesiones. En este sentido, en los últimos años se han realizado diversos estudios que han apuntado a un tipo celular, las células dendríticas plasmocitoides (CDp), y su producto, el interferón tipo I (α y β) como un elemento clave en la etiopatogenia de las lesiones del lupus. Su presencia se ha demostrado en las biopsias de lesiones cutáneas de LES23–26, LECS y LED23–25,27, así como también de LET23,27–29. El interferón α, junto con el interferón γ producido por los linfocitos T, induce la producción de una serie de quimiocinas (CXCL 9, 10 y 11) por parte de las células estructurales de la piel (queratinocitos, células endoteliales y fibroblastos), que a su vez atraen a más linfocitos T y CDp. De esta manera se establece un sistema de amplificación de la respuesta inflamatoria23. El mecanismo de activación de estas CDp permanece por el momento poco claro, pero podría tener su origen en la apoptosis celular y la consiguiente exposición de ADN autólogo, producida por la radiación ultravioleta. Se ha propuesto que en los pacientes con LES este ADN autólogo se uniría a autoanticuerpos, dando lugar a inmunocomplejos que son internalizados en las CDp, activando un receptor intracelular30. Sin embargo, este mecanismo no es extrapolable a las formas de LEC que cursan sin autoanticuerpos en sangre como el LED o el LET31. En estos, el mecanismo de activación de las CDp podría ser similar al descrito por Lande et al en la psoriasis32. Estos autores identificaron un péptido antimicrobiano llamado LL37 capaz de formar complejos con ADN autólogo que son internalizados en las CDp para activar el receptor TLR 9.
Así pues, en el LET la aparición de lesiones desencadenadas por la fotoexposición podría darse a partir de la unión de ciertos péptidos con el ADN autólogo, formando complejos que activarían a las CDp, las cuales darían lugar a la producción de interferón tipo I. Se trata, no obstante, de una hipótesis que no ha sido confirmada por el momento.
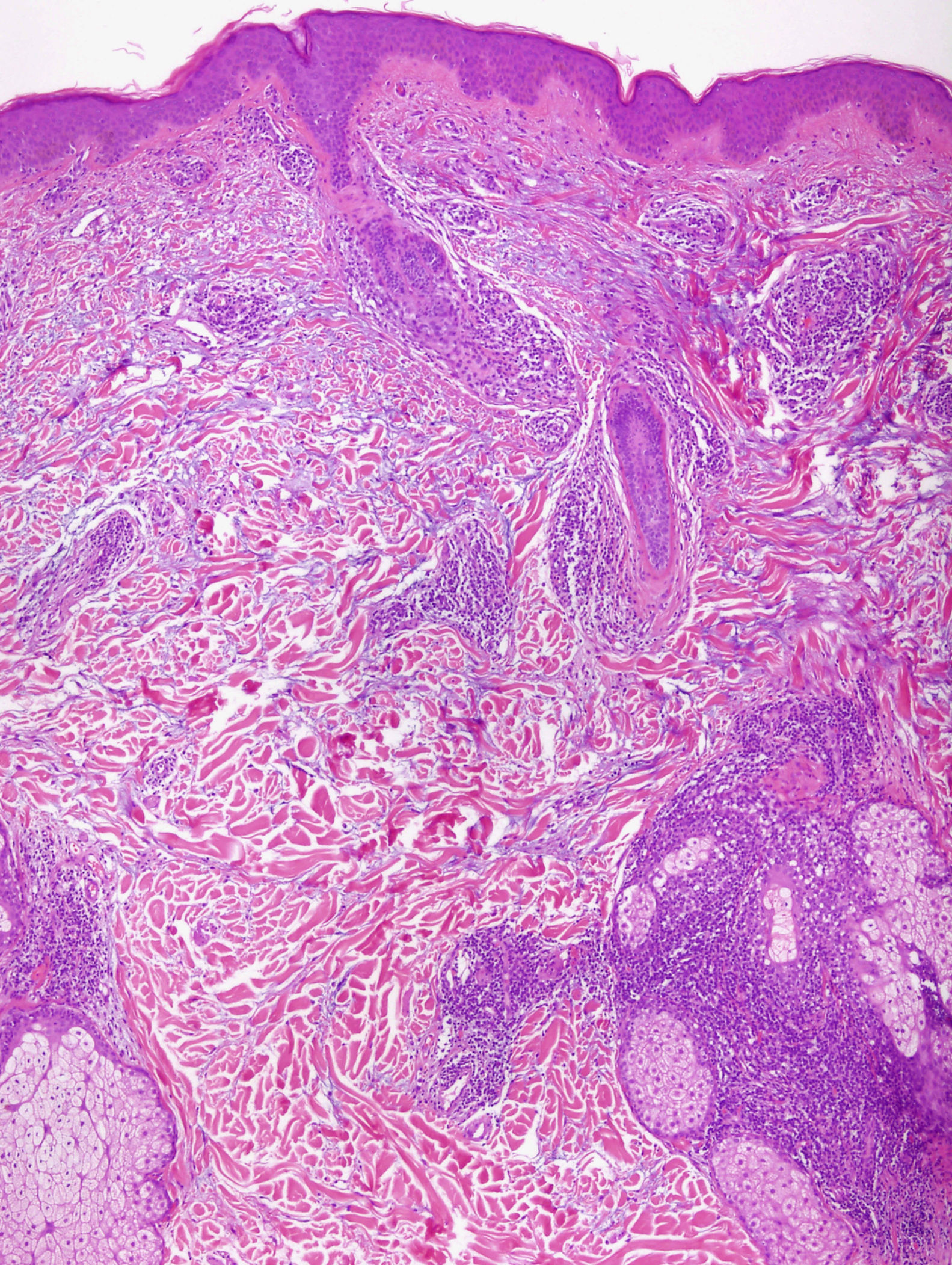
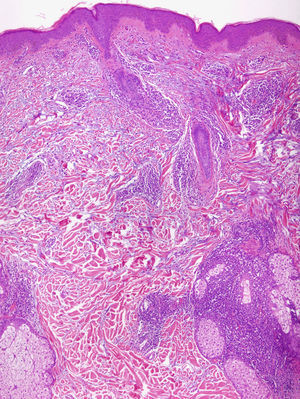
MicroscopíaMientras que la mayoría de autores muestran acuerdo acerca de las características clínicas y pronósticas del LET, no sucede lo mismo con las histopatológicas. Existe consenso acerca de los hallazgos microscópicos en la dermis, en la que se observa un infiltrado linfocitario perianexial y perivascular y un depósito intersticial de mucina. También coinciden diferentes estudios en que la inmunofluorescencia directa no suele mostrar depósitos significativos de inmunoglobulinas ni complemento en la membrana basal10–12,14,16,33. Sin embargo, existe diversidad de opiniones en cuanto a la definición de las características de la epidermis. Según Kuhn et al12,33 la epidermis se encuentra intacta en prácticamente todos los casos. Estos hallazgos son similares en otros trabajos11,16 (fig. 4). No obstante, algunos estudios recientes han demostrado que las alteraciones epidérmicas leves, incluyendo la vacuolización focal de la basal, la hiperqueratosis, la atrofia o el taponamiento folicular se observan en un porcentaje de casos considerable, que alcanza el 61-70%; en concreto, la vacuolización de la basal se puede observar en el 19-46% de las biopsias10,14. De hecho, McHugh et al8 en su descripción de las «lesiones papulares», las cuales hoy en día podemos considerar como un LET, observaron que un grupo de pacientes presentaba en las biopsias alteraciones epidérmicas propias del lupus, mientras que en el resto de casos la epidermis se encontraba intacta. Bajo nuestro punto de vista es posible que estas últimas observaciones se ajusten más a la realidad, puesto que no es infrecuente ver en la práctica clínica pacientes con lesiones típicas de LET cuya biopsia muestra cambios epidérmicos. La definición y el consenso acerca de este punto es importante, por las implicaciones que tiene a la hora de establecer el diagnóstico de los pacientes con LET.
Criterios diagnósticos de lupus eritematoso túmidoLa heterogeneidad de opiniones acerca de las características microscópicas epidérmicas en el LET ha dado lugar a la formulación de varias propuestas de criterios diagnósticos, que difieren de forma fundamental en el aspecto histopatológico. De esta manera, Kuhn et al12 establecieron en el año 2000 unos criterios que incluían la ausencia de alteraciones epidérmicas o de la unión dermoepidérmica.
Tal y como hemos comentado con anterioridad, en nuestra práctica clínica una parte de los pacientes que presentan lesiones propias de LET no se ajustan de forma estricta a los criterios propuestos por Kuhn, dado que presentan alteraciones epidérmicas leves o moderadas en la biopsia. Es por este motivo que los criterios diagnósticos que se recogen en el trabajo de Vieira et al10 nos parecen más aproximados a la realidad. De hecho, algunos estudios posteriores admiten también estas alteraciones epidérmicas focales o leves a la hora de hacer el diagnóstico de LET11,14. En la tabla 1 se recoge una adaptación personal de los criterios diagnósticos propuestos por estos autores. Hemos añadido los aspectos referentes a la fotosensibilidad, que tienen su importancia, no para diferenciarlo del resto de formas de LEC, pero sí para distinguirlo de algunas fotodermatosis, fundamentalmente de la EPL.
Criterios diagnósticos del LETa
| 1. Clínica |
| - Pápulas o placas eritematosas, de aspecto urticarial o infiltrado, sin cambios en la superficie (atrofia, descamación, erosiones, costras o taponamiento folicular) |
| - Las lesiones curan sin dejar cicatriz |
| - Suelen aparecer con un tiempo de latencia variable (> 24 horas) tras la exposición solar y persistir un tiempo prolongado |
| 2. Microscopía |
| - Infiltrado dérmico linfocitario perivascular y perianexial |
| - Depósito de mucina en la dermis |
| - Alteraciones epidérmicas ausentes o en grado leve |
| •Atrofia epidérmica |
| •Degeneración vacuolar de la capa basal |
| •Taponamiento folicular |
| •Hiperqueratosis |
| •Engrosamiento de la membrana basal |
| - Inmunofluorescencia directa normalmente negativa |
| 3. En general, ausencia de criterios de LES |
| 4. ANA, anti-Ro, anti-La y anti-ADN normalmente negativos |
En resumen, en la clínica, el diagnóstico de sospecha de LET se establece en un paciente con pápulas, placas o lesiones anulares eritematosas e infiltradas que a diferencia de lo que se observa en las lesiones de LED o LECS no presentan cambios en la superficie como descamación, atrofia o erosiones. El diagnóstico se confirma mediante una biopsia que muestre nulos o leves cambios epidérmicos propios del lupus eritematoso, un infiltrado linfocitario perianexial y perivascular y el depósito intersticial de mucina. Todo ello en el contexto de un paciente que, en general, no presenta clínica sistémica de LES ni autoanticuerpos.
No obstante, en la práctica siguen existiendo algunos problemas a la hora de establecer el diagnóstico de LET. En primer lugar, la subjetividad que implica tanto el definir un grado «leve» de alteraciones epidérmicas microscópicas como el establecer la ausencia de cambios superficiales en la clínica. En segundo lugar, la existencia de pacientes que presentan lesiones características de LET asociadas a autoanticuerpos o a una afectación sistémica propia del LES16; en estas situaciones se nos plantearía la duda sobre si son casos excepcionales de LET o debería descartarse dicho diagnóstico. Por último, como trataremos más adelante, el diagnóstico diferencial con otras entidades no siempre es fácil.
¿Es el lupus eritematoso túmido realmente un lupus?Algunos autores han cuestionado el origen «lúpico» del LET basándose en la ausencia de manifestaciones sistémicas de lupus eritematoso, de autoanticuerpos y de una dermatitis de interfase en su histología. De esta manera, abogan por considerar al LET una fotodermatosis fuera del espectro del LEC34. No obstante, existen varios datos que van en contra de esta afirmación. En primer lugar, como ya hemos visto, una gran proporción de los casos de LET sí presentan una dermatitis de interfase8,10,14. Por otra parte, la escasa frecuencia de autoanticuerpos y manifestaciones de LES se da también en el LED, por lo que no es un argumento sólido para descartar la inclusión del LET dentro del espectro del LEC. Hay que destacar también que en algunos pacientes se ha descrito la asociación de lesiones de LET y LED11,12,16, hecho que va a favor de que ambas entidades formen parte del espectro de una misma enfermedad. Por último, la presencia de CDp y proteínas inducidas por el interferón α23,27–29 en las biopsias de LET da pie a suponer un mecanismo etiopatogénico común al del resto de formas de LEC. Así pues, en nuestra opinión, existe evidencia en la literatura para considerar al LET una forma de lupus eritematoso.
Lugar del lupus eritematoso túmido en la clasificación del lupus eritematoso cutáneoTal y como se ha comentado con anterioridad, la clasificación original de Gilliam no incluía el LET. En las sucesivas adaptaciones y modificaciones que se han ido elaborando de dicha clasificación el LET ha quedado englobado dentro del LECC35,36 (tabla 2). El principal motivo que justifica dicha clasificación es la similitud del LET y el LECC en cuanto al pronóstico y a la escasa asociación a autoanticuerpos. Sin embargo, sus características clínicas son muy diferentes y es por este motivo que existen partidarios de considerar al LET como un subtipo aparte. En este sentido, Kuhn et al9 proponen incluirlo dentro de un cuarto subtipo denominado «lupus eritematoso cutáneo intermitente» (tabla 3). Ello, bajo nuestro punto de vista, es razonable, teniendo en cuenta que todos los tipos de LECC se caracterizan, en esencia, por dar lugar a lesiones persistentes, que dejan cicatriz o atrofia, a diferencia de lo que sucede en el LET. Sin embargo, la propuesta de Kuhn et al no se acepta por el momento de forma generalizada, y las revisiones más recientes siguen situando al LET dentro del grupo del LECC36.
Clasificación «clásica» de LEC que incluye LET como un subtipo de LECC
| 1. Lupus eritematoso cutáneo agudo (LECA) |
| - Localizado (erupción malar) |
| - Generalizado |
| 2. Lupus eritematoso cutáneo subagudo (LECS) |
| - Anular |
| - Papuloescamoso |
| - Patrones mixtos |
| 3. Lupus eritematoso cutáneo crónico (LECC) |
| - Lupus eritematoso cutáneo discoide (LECD) |
| i. Localizado |
| ii. Generalizado |
| - LECD hipertrófico o verrucoso |
| - Paniculitis lúpica |
| - Lupus eritematoso de mucosas |
| - Lupus eritematoso túmido (LET) |
Tomada de Obermoser G et al36.
Clasificación de LEC propuesta por, Tomada de Kuhn et al9, en la que se incluye el LET como un subtipo aparte
| 1. Lupus eritematoso cutáneo agudo (LECA) |
| a. Localizado |
| b. Generalizado |
| 2. Lupus eritematoso cutáneo subagudo (LECS) |
| a. Anular |
| b. Papuloescamoso |
| 3. Lupus eritematoso cutáneo crónico (LECC) |
| a. Lupus eritematoso cutáneo discoide (LECD) |
| i. Localizado |
| ii. Generalizado |
| b. Lupus eritematoso profundo (LEP) |
| 4. Lupus eritematoso cutáneo intermitente (LECI) |
| - Lupus eritematoso túmido (LET) |
Existen algunas entidades cuyo diagnóstico diferencial con el LET supone un problema, dadas sus similitudes clínicas y microscópicas. Estas son la infiltración linfocitaria de Jessner (ILJ), la erupción polimorfa lumínica (EPL) y la mucinosis reticular eritematosa (MRE).
La ILJ fue descrita en la década de los 50 por Jessner y Kanof37 como una entidad que daba lugar a lesiones no cicatriciales, predominantemente en la cara, cuya microscopía mostraba un infiltrado linfocitario perianexial y perivascular sin alteración en la epidermis38. En sus orígenes se consideró como una entidad diferente al lupus, pues los pacientes no presentaban fotosensibilidad y no parecían responder al tratamiento con antipalúdicos. Sin embargo, algunos trabajos publicados durante los siguientes años pusieron en duda ambas afirmaciones39,40. Ya en la última década se han realizado algunos estudios que, en líneas generales, concluyen que la ILJ se encuentra dentro del espectro del lupus y, en particular, se podría considerar una forma de LET. Weber et al41 realizaron un estudio fotobiológico en 10 pacientes con ILJ. Demostraron en todos ellos el desarrollo de lesiones tras la fotoprovocación, y además observaron un período de latencia mayor a 48 horas hasta la aparición de las lesiones, de la misma manera que sucede en todas las formas de LEC. Por otra parte revisaron las biopsias de los pacientes, observando, de forma indistinguible al LET, un infiltrado perivascular y perianexial, un depósito intersticial de mucina y una epidermis sin alteraciones. Por todo ello concluyeron que la ILJ y el LET no presentan diferencias clinicopatológicas ni fotobiológicas significativas. De la misma manera, Rémy-Leroux et al42 realizaron un estudio comparativo de 32 casos de ILJ y 14 de LET. Tras analizar las características clínicas, microscópicas y la respuesta al estudio fotobiológico de ambos grupos de pacientes concluyeron que la IJL y el LET son indistinguibles. Por tanto, en función de los anteriores estudios, la tendencia actual es considerar la ILJ no como una entidad aparte, sino como un LET.
La EPL es una fotodermatosis que puede dar lugar a una amplia variedad de lesiones cutáneas, pero en general monomorfas en un mismo paciente. Así, los pacientes pueden presentar lesiones vesiculares o pseudovesiculares, pero también pápulas o placas difíciles de diferenciar del LET. En estos casos algunas diferencias en cuanto a la evolución de las lesiones son claves para ayudar al diagnóstico diferencial. A diferencia del LET las lesiones de EPL se desarrollan de forma precoz tras la fotoexposición, mejoran a los pocos días si se evita el sol y los brotes van disminuyendo en intensidad a medida que el paciente se expone al sol, ya que se genera un fenómeno de tolerancia muy característico12. Por otra parte, mientras que en los pacientes con LET es habitual la persistencia de lesiones más allá del verano, en el caso de la EPL los brotes quedan muy limitados al período primaveral y estival. No obstante, hay que decir que, a diferencia de lo que sucede con el ILJ, no se han publicado estudios clínicos o fotobiológicos que comparen las características de los pacientes afectos de una y otra entidad. Desde el punto de vista microscópico la EPL puede ser también difícil de diferenciar del LEC, puesto que puede mostrar algunas características comunes, como son el infiltrado linfocitario perivascular, la alteración vacuolar de la membrana basal (en grado leve y sin queratinocitos necróticos), la atrofia epidérmica o el taponamiento folicular43–45. Por otra parte se ha demostrado una inmunofluorescencia directa positiva en algunos casos46. Un rasgo que había sido considerado como característico de esta entidad es el edema en la dermis papilar. Sin embargo, en un estudio reciente, Pincus et al47 demuestran su presencia también en biopsias de LEC (LECS y LED). Estos autores, tras revisar la literatura, concluyen que las características histopatológicas que permiten diferenciar el LEC de la EPL son el depósito intersticial abundante de mucina, el infiltrado linfocitario perianexial y la degeneración vacuolar intensa de la capa basal; en el caso del LET deberíamos tener en cuenta las dos primeras características.
Por tanto, si bien el LET y la EPL pueden ser similares en algunos aspectos, se diferencian en otros, y deben ser considerados dos entidades distintas. De hecho, Wackernagel et al29 demostraron la presencia de CDp en la mayoría (91%) de las biopsias de LEC (incluyendo LET, LECC y LECS) y en ninguna de las de EPL, con lo que concluyen que ambas entidades tienen probablemente una etiopatogenia diferente.
La MRE afecta de forma más frecuente a mujeres jóvenes, y su presentación clásica es como un eritema reticulado macular o papular. En la microscopía de estas lesiones se puede observar un infiltrado linfocitario perianexial y perivascular, acompañado del déposito intersticial de mucina48. Los pacientes suelen referir además una fotosensibilidad marcada. Por todo ello algunos autores han considerado la MRE una variante de LECC o un LET12. En este sentido, es importante destacar el hallazgo del depósito de IgM en la membrana basal de algunos casos de MRE49. No obstante, no se han publicado estudios comparativos entre ambas entidades que permitan confirmar esta teoría.
ConclusionesEl LET es una forma de lupus eritematoso con una clínica particular que lo diferencia de las formas «clásicas» de LEC. Por lo que respecta a la microscopía, si bien las primeras descripciones del LET destacaban la ausencia de alteraciones epidérmicas propias del lupus, existe una proporción de casos que sí las muestran, aunque siempre en grado leve o moderado. Este hecho debe ser tenido en cuenta en la práctica clínica para no diagnosticar casos de LET como LECC o LECS por el hecho de presentar daño epidérmico en la biopsia.
A día de hoy existe evidencia en la literatura para considerar al LET un auténtico lupus y no una entidad aparte. El lugar que debe ocupar dentro de la clasificación del LEC es objeto de controversia. No obstante, si atendemos a las diferencias clínicas que presenta respecto al LECC es razonable incluirlo como un subtipo aparte, que algunos autores han denominado «lupus eritematoso cutáneo intermitente».
En cuanto al diagnóstico diferencial con otras entidades el LET muestra ciertas características que lo diferencian de la EPL. No sucede así al compararlo con la ILJ y la MRE, entidades que actualmente se tienden a englobar dentro del espectro del LET.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.