La COVID-19ha supuesto un reto a nivel mundial, debido a la alta capacidad de infección y patogenia del virus. El uso de vacunas para prevenir los síndromes respiratorios causados por el SARS-CoV-2 es prometedor y esencial para combatir la infección. Poco se sabe acerca de la vacuna frente a la COVID-19 en los pacientes con enfermedades cutáneas autoinmunes; sin embargo, se han reportado casos de inicio y exacerbación de lupus eritematoso cutáneo y sistémico tras el uso de inmunizadores1–9. Este informe describe una exacerbación de lupus eritematoso cutáneo crónico (LECC) transcurridos treinta días de la segunda dosis de la vacuna ChAdOx1 nCoV-19 (Oxford/AstraZeneca).
Una mujer de 40 años de edad, Fitzpatrick V, había sido sometida a seguimiento dermatológico por LECC en el cuero cabelludo, marcado por alopecia cicatricial frontoparietal extensiva, estable desde 2018. La paciente no exhibió otras enfermedades médicas crónicas. Acudió al Departamento de dermatología a principios de 2022, con prurito, quemazón y eritema en el cuero cabelludo, asociados a exudado serohemático. No se reportaron síntomas sistémicos, ni factores desencadenantes posibles, tales como infecciones recientes, consumo de cigarrillos, exposición a rayos ultravioleta e ingestión de medicamentos. Si embargo, la paciente reportó que había recibido la segunda dosis de la vacuna ChAdOx1 nCoV-19 treinta días antes del inicio de los síntomas.
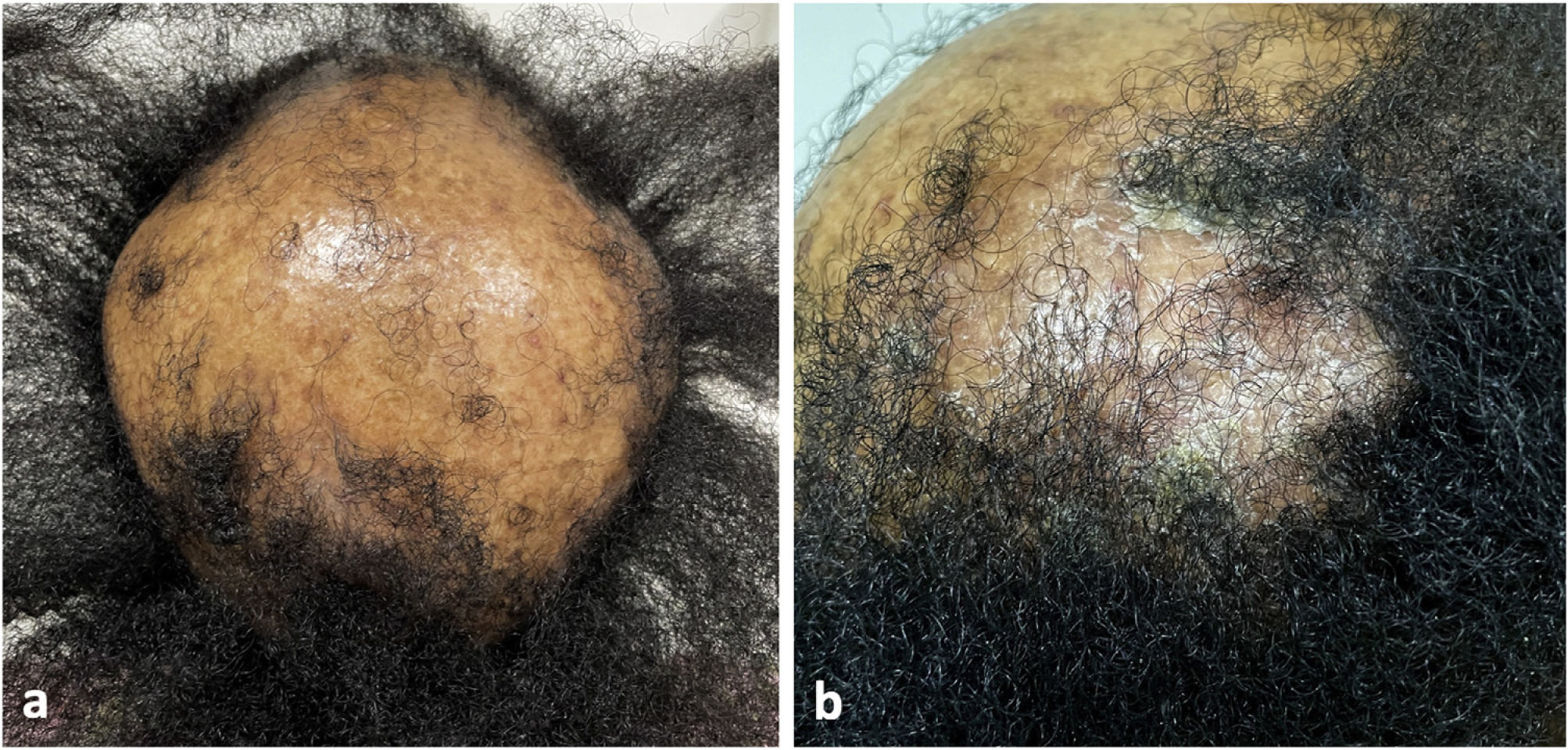
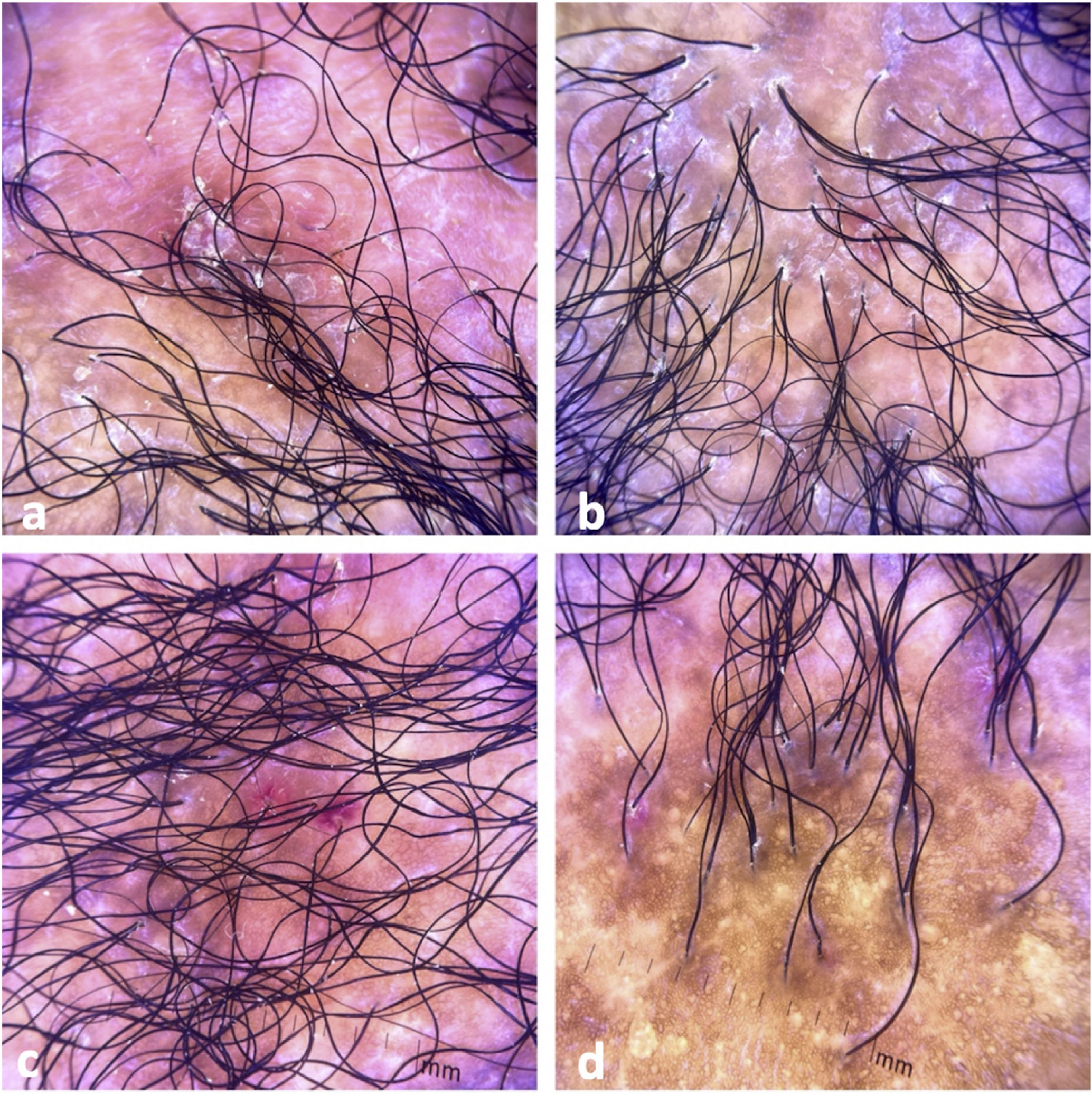
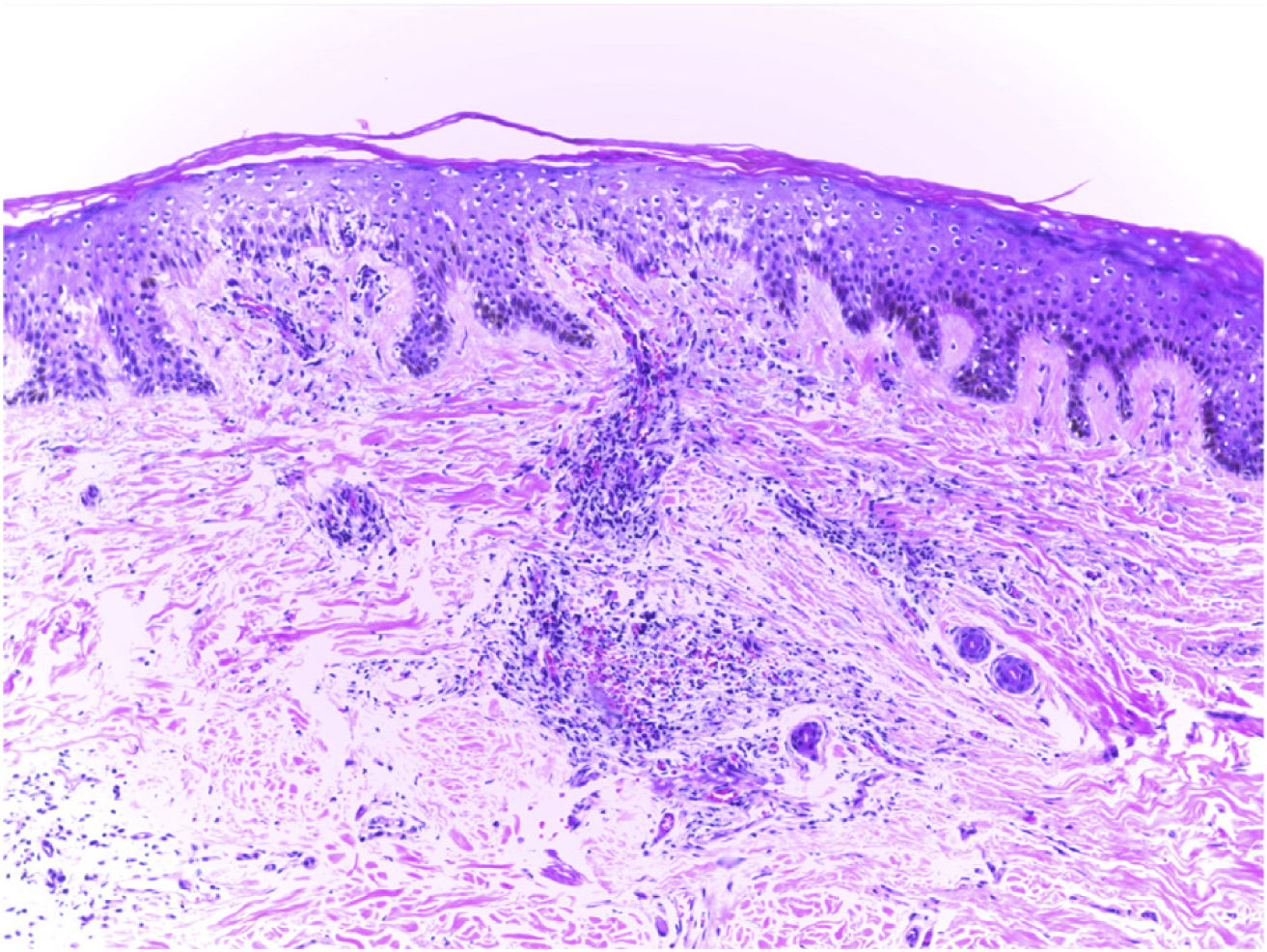
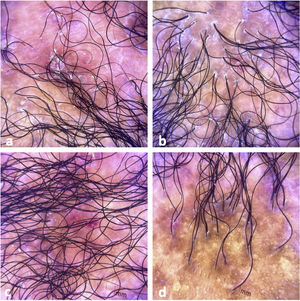
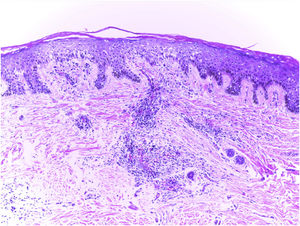
El examen clínico reveló alopecia cicatricial frontoparietal intercalado con pápulas y placas escamosas eritematosas, rodeadas de tallos del cabello ásperos y secos propios del lupus (Fig. 1). Los hallazgos tricoscópicos de la actividad de la enfermedad incluyeron descamación perifolicular, eritema, signos de incontinentia pigmenti y pili torti, además de alteraciones crónicas de LECC, tales como cabellos distróficos, zonas de color rojo lechoso, y estructuras de color blanco brillante (Fig. 2). Las pruebas de laboratorio mostraron hemograma y química sanguínea normales. El panel de antígenos nucleares extraíbles fue negativo. El estudio anatomopatológico reveló características de actividad de LECC: trastorno de maduración epidérmica con hiperqueratosis, degeneración vacuolar de la capa basal y espongiosis focal; infiltrado dérmico inflamatorio linfohistocítico perivascular y perianexal, con reducción de unidades foliculares, fibrosis intersticial y extravasación de eritrocitos en la dermis (Fig. 3). La tinción de azul alciano destacó un depósito de mucina dérmica. La evaluación clínica y las pruebas complementarias sugirieron el diagnóstico de exacerbación de LECC desencadenada por la vacuna frente a la COVID-19. Las lesiones reflejaron una mejora satisfactoria tras la terapia de corticosteroides tópicos.
Hallazgos tricoscópicos. (a) Descamación perifolicular, eritema, cabellos distróficos, zonas de color rojo lechoso, y estructuras de color blanco brillante. (b) Descamación perifolicular, eritema, signos de incontinentia pigmenti, pili torti, cabellos distróficos, y zonas fibróticas. (c) Descamación perifolicular, eritema intenso, y signos de incontinentia pigmenti. (d) Alopecia cicatricial con signos de incontinentia pigmenti, cabellos distróficos, y folículos vacíos.
Hallazgos anatomopatológicos: trastornos de maduración epidérmica con hiperqueratosis, degeneración vacuolar de la capa basal y espongiosis focal; infiltrado dérmico linfohistocítico perivascular y perianexal, con reducción de unidades foliculares, fibrosis intersticial y extravasación de eritrocitos en la dermis (hematoxilina–eosina, ×100).
Los efectos secundarios más comunes de las vacunas frente a la COVID-19 incluyen reacciones en el sitio de la inyección (eritema, edema y dolor), urticaria y erupciones morbiliformes3. El inicio o la exacerbación del lupus tras la vacuna son raros, describiéndose pocos casos en la literatura1–9. El estudio internacional VACOLUP indicó que la vacuna frente a la COVID-19 era bien tolerada por los pacientes con lupus eritematoso sistémico. Entre los 696 participantes evaluados, solo el 3% reportó un brote de LES confirmado médicamente tras la inmunización8. Considerando el lupus cutáneo, los autores no encontraron ningún informe sobre la forma crónica, como el caso presentado, ni sobre la exacerbación de la alopecia cicatricial en el lupus eritematoso cutáneo crónico tras la vacunación. Hasta la fecha, las publicaciones con compromiso cutáneo han sido descritas con la forma subaguda, con predominancia de las manifestaciones en el tronco y las extremidades1,3,4,7.
Los autores sugieren que la respuesta inmune generada por el inmunizador origina la activación de linfocitos T inflamatorios colaboradores de tipo 1 (Th1) y la producción de citocinas, con incremento de los niveles de interferón gamma (IFN-γ), interleucina-2, y factor de necrosis tumoral alfa (TNF-α)3,4. Este entorno inflamatorio contribuye al reclutamiento de células inmunes, convirtiéndose en un desencadenante potencial de manifestaciones de lupus cutáneo o sistémico.
A pesar del riesgo teórico de inicio o exacerbación del lupus tras la inmunización, la vacuna frente a la COVID-19 se recomienda a los pacientes con enfermedades autoinmunes, independientemente de la actividad o severidad del trastorno subyacente10. Por tanto, los profesionales sanitarios deberán animar a la vacunación y realizar vigilancia clínica sobre las nuevas manifestaciones del lupus, a fin de proporcionar un tratamiento temprano y evitar las complicaciones.
Conflicto de interesesLos autores declaran la ausencia de conflicto de intereses.