El bexaroteno está aprobado para el tratamiento de linfomas cutáneos de células T (LCCT) en estadio avanzado desde 1999. Sin embargo, se han publicado muy pocos datos sobre su seguridad y eficacia en el largo plazo. El objetivo del siguiente trabajo es determinar la eficacia y seguridad del bexaroteno en la serie de casos del Grupo Español de Linfomas Cutáneos (GELC) en su uso a largo plazo para el tratamiento de CTCL.
Material y métodoRealizamos una revisión retrospectiva multicéntrica de 216 pacientes con micosis fungoide (174) o síndrome de Sézary (42) tratados con bexaroteno solo o en combinación con otras terapias en 19 hospitales universitarios de referencia en España durante 10 años.
ResultadosSe incluyeron 133 hombres (62%) y 83 mujeres (38%), con una edad media de 63,5 años (27-95). El 45% recibió monoterapia con bexaroteno durante todo el período de estudio, el 22% comenzó con bexaroteno pero posteriormente recibió una terapia adicional, el 13% estaba bajo otro tratamiento pero en algún momento se añadió bexaroteno y el 20% restante recibió una terapia combinada desde el principio. La mediana de duración del tratamiento fue de 20,78 meses (1-114). La tasa de respuesta global fue del 70,3%. Se lograron respuestas completas y parciales en el 26% y el 45% de los pacientes, respectivamente. El tratamiento fue bien tolerado; las toxicidades más frecuentes fueron la hipertrigliceridemia (79%), la hipercolesterolemia (71%) y el hipotiroidismo (52%). No se observaron efectos secundarios de grado 5 relacionados con el tratamiento.
ConclusionesNuestro estudio confirma que el bexaroteno es una terapia segura y eficaz para el tratamiento a largo plazo de CTCL.
Bexarotene has been approved to treat advanced stage cutaneous T-cell lymphomas (CTCL) since 1999. However, very few data have been published on its long-term safety and efficacy profile. The aim of this study is to determine the tolerability to bexarotene and outcomes by collecting the 2nd largest case series to date on its long-term use vs CTCL.
Material and methodThis was a multicenter retrospective review of 216 patients with mycosis fungoides (174), or Sézary syndrome (42) on a 10-year course of bexarotene alone or in combination with other therapies at 19 tertiary referral teaching hospitals.
ResultsA total of 133 men (62%) and 83 women (38%) were included, with a mean age of 63.5 year (27–95). A total of 45% were on bexarotene monotherapy for the entire study period, 22% started on bexarotene but eventually received an additional therapy, 13% were on another treatment but eventually received bexarotene while the remaining 20% received a combination therapy since the beginning. The median course of treatment was 20.78 months (1–114); and the overall response rate, 70.3%. Complete and partial response rates were achieved in 26% and 45% of the patients, respectively. Treatment was well tolerated, being the most common toxicities hypertriglyceridemia (79%), hypercholesterolemia (71%), and hypothyroidism (52%). No treatment-related grade 5 adverse events were reported.
ConclusionsOur study confirms bexarotene is a safe and effective therapy for the long-term treatment of CTCL.
Los linfomas cutáneos primarios de células T (LCCT) son un grupo de linfomas no Hodgkin originados a partir de linfocitos T malignos localizados inicialmente en la piel. La micosis fungoide (MF) es su variante más frecuente y representa más de la mitad de todos los LCCT notificados, mientras que el síndrome de Sézary (SS) es mucho más raro (5%). La definición actual de estas neoplasias se basa en la actualización de 2018 de la clasificación OMS-EORTC (Organización Mundial de la Salud - Organización Europea para la Investigación y el Tratamiento del Cáncer) para los LCCT primarios1. Aunque la MF y el SS se consideran enfermedades incurables, la mayoría de los pacientes sobreviven muchos años. La MF suele tener un curso clínico indolente con una tasa de supervivencia a los 5 años del 88%, mientras que el SS tiene un mal pronóstico, siendo la tasa de supervivencia a los 5 años cercana al 36%. Además, el estadio clínico en el momento del diagnóstico predice la supervivencia en la MF: el 65-85% de los pacientes presentan una enfermedad en estadio IA o IB, con una mediana de supervivencia >12 años; los pacientes en estadio IVB, sin embargo, tienen una mediana de supervivencia <2,5 años2.
El algoritmo de tratamiento del LCCT también se basa en el estadio de la enfermedad mediante el sistema de estadificación tumor-nodo-metástasis-sangre (TNMB), revisado en 20073. La enfermedad en estadio inicial (IA-IIA) suele tratarse con terapias dirigidas a la piel, como corticosteroides tópicos, fototerapia PUVA (psolaren+ultravioleta A), o UV-B de banda estrecha, (NBUVB), quimioterapia tópica, terapia cutánea total con haz de electrones y radioterapia localizada. La enfermedad en estadios avanzados (IIB-IVB) y la enfermedad refractaria en estadios iniciales suelen requerir abordajes sistémicos que incluyen retinoides (principalmente bexaroteno), interferón α, inhibidores de la histona deacetilasa (vorinostat, romidespina), inmunoterapia dirigida (denileukina diftitox, alemtuzumab, brentuximab vedotin y, recientemente, mogamulizumab), quimioterapia, fotoaféresis extracorpórea y trasplante de células madre hematopoyéticas2. Se han formulado recomendaciones consensuadas por etapas para la selección del tratamiento adecuado4,5.
El bexaroteno (Targretin®; Cephalon pharmaceuticals, Inc., Maisons-Alfort, Francia) es un retinoide sintético selectivo del receptor X aprobado por la FDA en 1999 para tratar el LCCT en pacientes refractarios al menos a un tratamiento sistémico previo. En Europa se autorizó en el 20026. El bexaroteno tiene una gran afinidad por los receptores X retinoides (RXR, tipos α, β y γ) que, cuando se activan, tienen propiedades antiproliferativas y proapoptóticas, inhibiendo el crecimiento de líneas celulares tumorales hematopoyéticas y epiteliales, e induciendo una apoptosis dosis dependiente de linfocitos malignos7. A diferencia de otros retinoides, el bexaroteno no afecta a los linfocitos T reguladores, a las células de Langerhans de la piel ni a los queratinocitos, evitando así los conocidos efectos adversos de los fármacos inmunosupresores8. Además, el bexaroteno puede administrarse por vía oral, lo que también es una ventaja. Ha demostrado ser eficaz en todos los estadios del LCCT, con una tasa de respuesta global (RG) del 45% en los ensayos clínicos9,10. La hipertrigliceridemia y el hipotiroidismo central son los acontecimientos adversos dosis dependientes más frecuentes, notificados en el 79% y el 40% de los pacientes respectivamente. Van a requerir una dosificación individual del fármaco y el uso preventivo de hipolipemiantes y la sustitución de la hormona tiroidea9,10. Los acontecimientos adversos requieren la monitorización de los parámetros de laboratorio en el seguimiento y suelen controlarse bien con fármacos concomitantes11. Todos los retinoides son teratogénicos.
El uso de bexaroteno para la enfermedad en estadios iniciales y avanzados está avalado por 2 ensayos clínicos de fase II/III9. Sin embargo, los datos sobre su tolerabilidad y respuesta a largo plazo en un entorno real son escasos, habiéndose publicado sólo unos pocos estudios de cohortes en la literatura12–17.
El objetivo del presente estudio es evaluar retrospectivamente los resultados de un período de seguimiento de 10 años del bexaroteno, así como su perfil de seguridad, recogiendo por los miembros del Grupo Español de Linfomas Cutáneos la mayoría de los pacientes tratados con bexaroteno, y comparar estos resultados con los datos de la literatura médica científica actualmente disponibles. Por lo que sabemos, después de la serie presentada por Hamada et al., esta es la segunda serie más grande de pacientes con LCCT tratados con bexaroteno solo o en combinación con otras terapias hasta el momento publicada.
MétodosEn este ensayo retrospectivo multicéntrico se incluyeron a la mayoría de los pacientes adultos con MF o SS tratados con bexaroteno oral solo o en combinación con otras terapias, provenientes de 19 hospitales docentes terciarios de referencia españoles siguiendo el método de muestreo por conveniencia (fig. 1). Se incluyeron en el estudio un total de 216 pacientes (174 de los cuales tenían MF y 42 SS). Todos los pacientes cumplían los criterios diagnósticos de las clasificaciones de la Organización Mundial de la Salud (OMS) y la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC) para la MF y el SS. En todos los casos se realizó un estudio diagnóstico adecuado, y los pacientes fueron estadificados según la clasificación de la OMS y la EORTC para los linfomas cutáneos primarios, y se utilizó el sistema de estadificación TNMB para los LCCT. El tratamiento se dejó a criterio del médico.
Los pacientes recibieron cápsulas de 75mg de bexaroteno con una dosis variable de 150mg/m2 hasta 300mg/m2 una vez al día. La dosis se individualizó en función de la respuesta clínica y de los acontecimientos adversos. También se midieron periódicamente el perfil lipídico y los niveles de hormona tiroidea, y la mayoría de los pacientes recibieron concomitantemente hipolipemiantes y hormona tiroidea sustitutiva para prevenir o tratar los efectos adversos de laboratorio antes mencionados.
A continuación, se registraron y clasificaron los acontecimientos adversos relacionados con el bexaroteno según los criterios terminológicos comunes para acontecimientos adversos (CTCAE v.4.0) del Instituto Nacional del Cáncer. En cuanto a los resultados clínicos, se consideró respuesta completa (RC) la ausencia de evidencia de enfermedad en la piel u órganos extracutáneos durante al menos 1 mes. Las respuestas parciales (RP) fueron presentar ≥50% reducciones en el área de las lesiones cutáneas durante al menos 1 mes, mientras que la progresión de enfermedad (PE) significó≥50 aumentos en las lesiones cutáneas, o afectación sanguínea, ganglionar o visceral. La respuesta global (RG) incluía tanto la RC como la RP. La enfermedad estable (EE) se definió como la ausencia de cambios significativos en la piel o en los signos clínicos extracutáneos. Este estudio cumple plenamente los criterios establecidos por el Comité de Ética de la Investigación (Reg - 20070601).
ResultadosCaracterísticas de los pacientes y de la enfermedad. Antecedentes de tratamiento previoLas características de los pacientes y las terapias previas se muestran en la tabla 1.
Características de los pacientes y terapias previas
| Sexo, N (%) | |
| Hombre | 133 (61,6) |
| Mujer | 83 (38,4) |
| Edad, años (min–max) | |
| Al inicio del bexaroteno | 63,5 (27–95) |
| Al diagnóstico de LCLT | 55,22 (13–94) |
| Estadio, N (%) | |
| IA | 41 (19,2) |
| IB | 78 (36,4) |
| IIA | 5 (2,3) |
| IIB | 40 (18,7) |
| IIIA | 16 (7,5) |
| IIIB | 6 (2,8) |
| IVA | 25 (11,7) |
| IVB | 3 (1,4) |
| Terapias previas, N (%) | |
| Ninguno | 21 (9,7) |
| Corticosteroides tópicos | 177 (81,9) |
| PUVA | 113 (52,3) |
| NBUVB | 29 (13,4) |
| IFN-α | 53 (24,5) |
| Radioterapia | 36 (16,7) |
| Metotrexato | 22 (10,2) |
| Quimioterapia tópica | 21(9,7%) |
| Retinoides | 20 (9,3) |
La superficie corporal (SC) de las pacientes se utilizó para determinar la dosis óptima de bexaroteno al inicio, para posteriormente individualizar y ajustar dichas dosis. Los datos se muestran en la tabla 2, y las terapias concomitantes en la tabla 3.
Dosis y duración del tratamiento con bexaroteno y pauta de tratamiento (obsérvese que faltan los datos de 12 pacientes)
| Mediana | Min | Max | |
|---|---|---|---|
| Superficie corporal (m2) | 1,81 | 1,38 | 2,36 |
| Dosis inicial de bexaroteno (mg/dia) | 246,56 | 75 | 675 |
| Dosis máxima de bexaroteno (mg/dia) | 363,62 | 75 | 750 |
| Periodo en tratamiento con bexaroteno (meses) | 20,78 | 1 | 114 |
| N (%) | |
|---|---|
| Monoterapia con bexaroteno | 92 (45,1) |
| Terapia con bexaroteno en curso | 44 (21,6) |
| Otras terapias más bexaroteno añadidas posteriormente | 27 (13,2) |
| Terapia combinada | 41 (20.1) |
Terapias combinadas utilizadas concomitantemente con bexaroteno
| Terapias concomitantes | N |
|---|---|
| Ninguna | 101 |
| Corticoides tópicos | 3 |
| Fototerapia | 41 |
| IFN-α | 15 |
| Metotrexato | 5 |
| Radioterapia | 8 |
| Quimioterapia tópica | 7 |
| Fotoféresis extracorpórea | 5 |
| Fototerapia+IFN-α | 8 |
| Metotrexato+IFN-α | 1 |
| Fototerapia+ radioterapia+ quimioterapia tópica | 1 |
| Corticoides tópicos+quimioterapia tópica | 3 |
| Fototerapia+quimioterapia tópica | 2 |
| IFN-α+radioterapia | 3 |
| Corticoides tópicos+radioterapia | 1 |
| Corticoides tópicos+radioterapia+fototerapia+IFN-α | 1 |
| Corticoides tópicos+radioterapia+fototerapia+metotrexate | 1 |
| Corticoides tópicos+radioterapia+fototerapia | 1 |
| Corticoides tópicos+radioterapia+metotrexate+IFN-α+quimioterapia tópica | 1 |
| Corticoides tópicos+fototerapia+IFN-α+quimioterapia tópica | 1 |
| Fototerapia+IFN-α+radioterapia | 3 |
| Radioterapia+quimioterapia tópica | 1 |
| Fototerapia+metotrexato+radioterapia | 1 |
| Fototerapia+radioterapia | 1 |
| Corticoides tópicos+metotrexato+quimioterapia tópica | 1 |
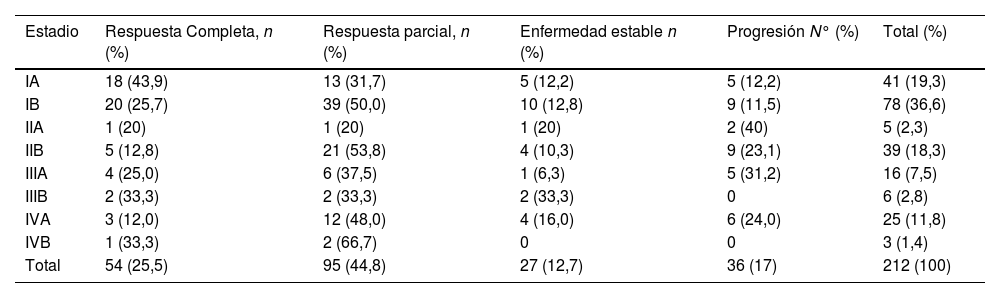
Se alcanzaron RC y RP en el 26% y el 45% de los pacientes, respectivamente. Por lo tanto, la tasa OR fue del 70% (RC+ RP=OR). El 13% de los pacientes presentaron EE, mientras que el 17% una progresión a pesar del tratamiento con bexaroteno. La mediana del tiempo de respuesta inicial fue de 8 meses. El tiempo transcurrido hasta las respuestas parciales y completas fue de 21 y 27 meses, respectivamente (tabla 4).
Las tasas de respuesta y el tiempo hasta alcanzarlas variaron en función del estadio clínico (tabla 5). Se tardó más en conseguir respuestas parciales (23 meses) y completas (30 meses) en el grupo en estadio temprano que en el tardío (14 y 19 meses, respectivamente). En general, los pacientes en estadio temprano recibieron bexaroteno durante más tiempo (24 meses) que los pacientes en estadio tardío (10 meses).
RC, RP, EE and PE según el estadio de la enfermedad
| Estadio | Respuesta Completa, n (%) | Respuesta parcial, n (%) | Enfermedad estable n (%) | Progresión N° (%) | Total (%) |
|---|---|---|---|---|---|
| IA | 18 (43,9) | 13 (31,7) | 5 (12,2) | 5 (12,2) | 41 (19,3) |
| IB | 20 (25,7) | 39 (50,0) | 10 (12,8) | 9 (11,5) | 78 (36,6) |
| IIA | 1 (20) | 1 (20) | 1 (20) | 2 (40) | 5 (2,3) |
| IIB | 5 (12,8) | 21 (53,8) | 4 (10,3) | 9 (23,1) | 39 (18,3) |
| IIIA | 4 (25,0) | 6 (37,5) | 1 (6,3) | 5 (31,2) | 16 (7,5) |
| IIIB | 2 (33,3) | 2 (33,3) | 2 (33,3) | 0 | 6 (2,8) |
| IVA | 3 (12,0) | 12 (48,0) | 4 (16,0) | 6 (24,0) | 25 (11,8) |
| IVB | 1 (33,3) | 2 (66,7) | 0 | 0 | 3 (1,4) |
| Total | 54 (25,5) | 95 (44,8) | 27 (12,7) | 36 (17) | 212 (100) |
En relación con los tratamientos combinados, se observó que el tratamiento con PUVA antes del bexaroteno aumentó la tasa de pacientes con RP (del 43% al 47,3%), mientras que la tasa de pacientes con PE descendió (del 20,6% al 13,4%). Los pacientes estables también se incrementaron en un 4%, sin embargo, estos datos no fueron significativos.
Un total de 44% de nuestros pacientes seguían en tratamiento de mantenimiento con bexaroteno (las dosis eran muy variables en función de la respuesta, los acontecimientos adversos y las comorbilidades del paciente, y a menudo oscilaban entre 150mg/m2 y 300mg/m2) cuando se recogieron los datos del estudio.
Efectos adversos (tabla 6)Los acontecimientos adversos más frecuentes fueron la hipertrigliceridemia (79%), seguida de la hipercolesterolemia (71%). Un total de 197 pacientes precisaron fármacos hipolipemiantes (146 y 51 pacientes recibieron estos fármacos antes y después de iniciar el bexaroteno, respectivamente). Se administraron fibratos, estatinas y ácidos grasos omega-3 a 160, 145 y 50 pacientes, respectivamente.
Efectos adversos asociados al tratamiento con bexaroteno notificados en nuestro estudio
| Todos los grados | Grado 1 | Grado 2 | Grado 3 | Grado 4 | |
|---|---|---|---|---|---|
| Hipertrigliceridemia | 170 | 74 | 47 | 32 | 17 |
| Hipercolesterolemia | 152 | 97 | 42 | 12 | 1 |
| Hipotiroidismo | 108 | 72 | 29 | 6 | 1 |
| Neutropenia | 26 | 11 | 2 | 8 | 5 |
| Hipertransaminasemia | 26 | 12 | 9 | 5 | 0 |
| Efectos adversos dermatológicos | 21 | 17 | 3 | 1 | 0 |
| Mialgia | 21 | 14 | 6 | 1 | 0 |
| Trastornos glucémicos | 20 | 8 | 5 | 7 | 0 |
| Alteraciones GI | 7 | 3 | 4 | 0 | 0 |
| Pancreatitis | 6 | 5 | 1 | 0 | 0 |
| Impotencia | 3 | ||||
| Anemia | 2 | ||||
| Astenia | 2 | ||||
| Mareos | 2 | ||||
| Fotodermatitis | 2 | ||||
| Disgeusia | 1 | ||||
| Sequedad ocular | 1 |
Se diagnosticó hipotiroidismo en el 52% de los pacientes. En total, 205 pacientes recibieron suplementos tiroideos, que se añadieron de forma preventiva en 121 pacientes antes del tratamiento con bexaroteno. En los 84 pacientes restantes, se añadió después de iniciar el bexaroteno.
No se notificaron acontecimientos adversos de grado 5.
DiscusiónEl uso de bexaroteno se aprobó basándose en 2 ensayos clínicos de fase II/III9,10 realizados en 58 pacientes con enfermedad en estadio inicial (estadios I-IIA) y 94 pacientes con enfermedad en estadio avanzado (estadios IIB-IVB). Sin embargo, los estudios que muestran el perfil de seguridad y eficacia en un entorno real son escasos. Por lo que sabemos, ésta es la séptima cohorte de pacientes con LCCT tratados con bexaroteno de la que se dispone actualmente en la literatura médica. En primer lugar, en el 2009 Abbott et al. publicaron su experiencia de 5 años con bexaroteno en 66 pacientes ingleses. Poco después en el 2012, Väkevä et al. publicaron su experiencia de 10 años con bexaroteno en 37 pacientes finlandeses, mientras que Quéreux et al. en el 2013 presentaron su experiencia de 10 años en 32 pacientes franceses. Por último, en el 2016, Sokolowska-Wojdylo et al. realizaron un estudio similar sobre sus resultados a 5 años en 21 pacientes polacos. Hay otras 2 series japonesas disponibles: Fujimura et al. (29 pacientes), y Hamada et al. (267 pacientes), que incluyen muchos tipos de LCCT y seguimientos más cortos. Por lo tanto, nuestra cohorte, presentada por el Grupo Español de Trabajo de Linfomas Cutáneos, parece ser la 2ª serie más amplia hasta el momento, ya que incluye 216 pacientes con LCCT (exclusivamente MF y SS) que fueron tratados con bexaroteno. Los datos en condiciones reales son esenciales para evaluar los resultados a largo plazo de la molécula y la tolerabilidad sin las condiciones ideales de los ensayos clínicos.
El 90% de nuestros pacientes ya habían recibido otras terapias tópicas o sistémicas antes del bexaroteno, lo que supone una tasa similar a la de otros estudios. La tasa de pacientes pretratados con terapias sistémicas fue del 44% (39% y 75% en las cohortes finlandesa y francesa, respectivamente, y 52% en la serie de Hamada).
Nuestro estudio confirma que el bexaroteno es eficaz para tratar el LCCT tanto en estadio temprano como avanzado, con una OR del 70,3% (RC, 25,5%; RP, 44,8%). Abbott et al. comunicaron una OR del 44% (RC, 9%; RP, 35%), Väkevä et al. del 75%, Quéreux et al. del 59% (RC, 13%; RP, 47%) y Sokolowska-Wojdylo et al. del 81%. Hamada et al. obtuvieron el OR más bajo de todos (46,8%) con una RC del 11,5%. En nuestra cohorte, el 12% de los pacientes lograron la estabilización de la enfermedad y el 17% no se controlaron y progresaron a pesar del uso de bexaroteno.
En nuestro estudio, la mayor respuesta clínica informada puede deberse a que más de la mitad de la población fue tratada con una terapia combinada (55%) en algún momento mientras recibía bexaroteno. En el estudio francés, menos pacientes (44%) fueron tratados en combinación con otras terapias sistémicas, obteniéndose una OR inferior (59%). Sin embargo, esta hipótesis no concuerda con otros estudios: por un lado, en el estudio británico, una tasa similar de pacientes en comparación con los de nuestro estudio (58%) recibían 1 o más terapias adicionales para el LCCT, con una OR mucho menor (44%); por otro lado, menos pacientes finlandeses (41%) recibieron terapia combinada más adelante en el curso del tratamiento con bexaroteno, con mejores tasas de respuesta (las OR fueron del 75% y el 73% en los grupos de monoterapia y terapia concomitante, respectivamente). Aunque el estudio polaco alcanzó la OR más alta (81%), hay que mencionar que tuvieron una elevada tasa de mortalidad (53%). La menor OR alcanzada por Hamada et al. podría deberse a la presencia de más pacientes en estadios avanzados frente a otras series.
Nuestro estudio no tiene potencia suficiente para comparar la eficacia de la monoterapia con bexaroteno frente a su combinación con otras terapias, ya que los regímenes, la duración y el calendario de los tratamientos combinados son heterogéneos. Según un ensayo controlado prospectivo aleatorizado, la combinación de PUVA más bexaroteno es segura y bien tolerada, aunque no se comunicaron diferencias significativas en las tasas de respuesta clínica18. Al igual que nosotros, Hamada et al. encontraron una diferencia en la OR entre los 2 grupos de pacientes con y sin adición de PUVA (57,6% frente a 25,5%).
Las tasas de respuesta también parecen estar relacionadas con la duración y las dosis del tratamiento. Cuanto mayor es la duración del tratamiento, mejores son los resultados clínicos: Abbott et al. informaron de una OR del 44% con un tratamiento medio de 11 meses, Quéreux et al. informaron de una OR del 59% con 17 meses de tratamiento, nuestro estudio informó de una OR del 70% con 21 meses de tratamiento y Väkevä et al. informaron de una OR del 75% con 26 meses de tratamiento. Una vez más, el estudio de Sokolowska-Wojdylo et al. parece ser la excepción a la regla, ya que lograron una OR del 81% con un tratamiento de 15 meses. La mayor duración de la terapia en un paciente se registró en nuestro estudio (114 meses) y la menor en el estudio realizado por Hamada et al. (0,3 meses con una mediana de 9,1 meses). En cuanto a las dosis, sus resultados indicaron que los pacientes con una dosis media más alta de bexaroteno tendían a mostrar mejores tasas de respuesta. Sin embargo, los pacientes en estadios avanzados recibieron dosis más bajas para evitar efectos secundarios adversos.
En nuestro estudio, el tiempo hasta la respuesta fue mayor que en estudios anteriores (las respuestas iniciales, parciales y completas se alcanzaron a los 8, 21 y 27 meses, respectivamente), con un tiempo medio hasta la respuesta de casi 2-4 meses12–15. Esto podría deberse a la dosis diaria más baja utilizada en nuestro estudio (364mg/día, es decir, 200mg/m2/día) frente a los 275 y 225mg/m2/día utilizados por Quéreux y col. y Abbot y col., respectivamente. De hecho, se ha demostrado que la respuesta clínica está relacionada con la dosis en los ensayos clínicos9,10, como también confirmaron Hamada et al.
En nuestro estudio, los casos más precoces parecen tener mejores resultados que los avanzados, lo que resulta controvertido en la literatura médica científica actualmente disponible. Los resultados de Väkevä, Sokolowska-Wojdylo y Hamada coinciden con los nuestros, mientras que Abbot obtuvo resultados opuestos, y la cohorte de Quéreux muestra una OR similar entre la enfermedad temprana y la avanzada. Abbott et al. plantean la hipótesis de que las mayores tasas de respuesta en sus pacientes con enfermedad en estadio avanzado pueden deberse a una mayor tolerancia a los efectos secundarios del bexaroteno en este grupo. Curiosamente, la respuesta clínica en nuestra cohorte parece ser más rápida en estadios avanzados.
Según la literatura médica científica actualmente disponible, el bexaroteno puede mantener respuestas duraderas (mediana de duración de la respuesta de 16 meses en la cohorte de Quéreux), y una vez alcanzada la respuesta clínica, la progresión es rara14. Las directrices recientes establecen que el bexaroteno debe continuarse como terapia de mantenimiento con una dosis mínima efectiva hasta la pérdida de la respuesta, ya que el LCCT tiende a progresar lentamente y no tiene tratamiento curativo, siendo el único objetivo de la terapia alcanzar la remisión más duradera5,13.
Nuestro trabajo también confirma que el bexaroteno fue bien tolerado, ya que sólo 24 pacientes (11%) experimentaron acontecimientos adversos de grado 4 relacionados con el fármaco, y 0 experimentaron acontecimientos adversos de grado 5. Como se informó anteriormente, los efectos secundarios más frecuentes fueron la hiperlipidemia y el hipotiroidismo, que parecían estar relacionados con la dosis17.
La hipertrigliceridemia fue el efecto secundario registrado con mayor frecuencia, en el 79% de los pacientes, y más de dos tercios de ellos fueron de bajo grado (grados 1 ó 2). Otras cohortes comunicaron 14 tasas similares (78%), al igual que el ensayo clínico inicial9,10 (64% y 79%). No obstante, la administración simultánea de hipolipemiantes suele controlar los niveles de lípidos, y en nuestra serie sólo se observaron 6 casos de pancreatitis, todos ellos reacciones de bajo grado (uno de grado 5 y otro de grado 2). La hipercolesterolemia también fue frecuente (70%) y generalmente leve. Casi todos los pacientes recibieron fármacos hipolipemiantes, aunque una cuarta parte de ellos los recibió tras el inicio del bexaroteno. De hecho, las nuevas directrices clínicas recomiendan pretratar a los pacientes con un fibrato 1 semana antes de iniciar el tratamiento con bexaroteno, preferiblemente con fenofibrato 150-300mg diarios11,19,20. A continuación deben controlarse los niveles de lípidos y, si es necesario, pueden añadirse otros agentes como las estatinas a los fibratos si persisten los niveles elevados de triglicéridos y colesterol de lipoproteínas de baja densidad. No obstante, esta combinación aumenta el riesgo de inducir miopatía, rabdomiólisis e insuficiencia renal aguda, por lo que se recomienda extremar las precauciones. Además, los fibratos se asocian a varios efectos adversos, como dolor muscular, elevación de los niveles de creatina cinasa e hipertransaminasemia, que requerirían la interrupción del tratamiento. Si se producen efectos secundarios relacionados con los fibratos o se necesita una estatina para controlar la hipercolesterolemia, Musolino et al. demostraron que los ácidos grasos omega-3 son una buena alternativa al fenofibrato, ya que son eficaces y bien tolerados.
Se observó hipotiroidismo en más de la mitad de los pacientes, y en casi todos los casos estos fueron leves (el 93% fueron de grado 1 o 2). Otras series comunicaron tasas más elevadas de este efecto secundario (74% y 93% en los estudios de Abbott y Quéreux, respectivamente, y 85,8% en el ensayo de Hamada), mientras que los 2 ensayos clínicos iniciales comunicaron tasas más bajas (40% y 39%)9,10, subestimando probablemente su tasa de incidencia real. No obstante, no suele haber casos graves de hipotiroidismo y, cuando se producen, siempre se controlan con dosis bajas de tiroxina, lo que significa que no es una reacción preocupante. Las guías clínicas recientes recomiendan añadir suplementos de hormona tiroidea de forma rutinaria desde el día 1 del tratamiento con bexaroteno, comenzando con 50μg de levotiroxina al día y titulándola individualmente en función de los niveles séricos de T411,19. En nuestro estudio, el 95% de los pacientes recibieron suplementos tiroideos, pero más de la mitad de ellos los iniciaron después de comenzar su régimen de bexaroteno. Así pues, añadir levotiroxina al bexaroteno podría evitar algunos de estos acontecimientos adversos. Además, corregir el hipotiroidismo ayuda a controlar la hiperlipidemia al aumentar el aclaramiento de lípidos, que se reduce en presencia de una función tiroidea baja20. Deben seguir administrándose hipolipemiantes y suplementos de hormona tiroidea durante el tratamiento para mantener estables los niveles de lípidos y T4, y sus niveles deben controlarse también durante el tratamiento.
Los efectos adversos antes mencionados parecen estar relacionados con la dosis10,17, por lo que la dosificación puede individualizarse para lograr el máximo beneficio clínico con las mínimas reacciones adversas. Algunas directrices recomiendan comenzar inicialmente con bexaroteno a dosis medias (150mg/m2 diarios) durante 2 a 4 semanas, y luego aumentar la dosis hasta alcanzar la dosis completa (300mg/m2 diarios) en pacientes sin toxicidad20, mientras que Hamada et al. recomiendan comenzar con la dosis completa para lograr mejores respuestas.
En general, el bexaroteno se tolera bien, y tiene la ventaja de ser menos inmunosupresor que otros fármacos8, lo que evita la aparición de más enfermedades infecciosas en estos pacientes (no observamos infecciones en nuestra cohorte, y tampoco en el ensayo de Quéreux). Además, se administra por vía oral, lo que realmente ayuda.
En cuanto a otros efectos secundarios, se produjo hipertransaminasemia en el 12% de nuestros pacientes, que se notificó en el ensayo de Väkevä (10%) por primera vez en 2012 y después en el ensayo de Quéreux (3%, solo la desarrolló 1 paciente), y en la serie de Hamada (15%).
Curiosamente, 3 pacientes desarrollaron impotencia, en la que las estatinas pueden desempeñar un papel. Se ha informado de que las estatinas pueden reducir los niveles de testosterona, favoreciendo la disfunción eréctil21,22. Sin embargo, esto es controvertido en la literatura, ya que hay estudios que apoyan que estos fármacos hipolipemiantes podrían tener efectos positivos sobre la función eréctil, especialmente para los que no responden a los inhibidores de la fosfodiesterasa tipo 523. Por lo tanto, se necesitan más estudios para investigar el papel de las estatinas en este síntoma.
Somos conscientes de que nuestro estudio conlleva algunas limitaciones. En primer lugar, presenta los principales inconvenientes de los estudios retrospectivos, incluido el sesgo de selección, con una población heterogénea que presenta diferentes características pronósticas basadas en diferentes comorbilidades, tratamientos previos y diferentes terapias combinadas, y el sesgo de información, ya que los datos registrados dependen de la disponibilidad y la exactitud de los registros sanitarios. En segundo lugar, no pueden extraerse conclusiones sólidas de los estudios retrospectivos, que sólo pueden generar nuevas hipótesis que deberán confirmarse en ensayos prospectivos controlados. Y, por último, al igual que en las cohortes publicadas anteriormente, no pudimos utilizar un sistema de puntuación estandarizado para evaluar la carga tumoral, utilizando en su lugar una evaluación global de las respuestas de los pacientes24.
ConclusionesEl bexaroteno parece ser eficaz, seguro y bien tolerado para tratar el LCCT temprano y avanzado, y debe continuarse como terapia de mantenimiento una vez alcanzada la RC. Puede utilizarse como monoterapia o combinado con otras terapias. La dosis debe individualizarse para lograr el máximo beneficio con efectos secundarios manejables. Además, es necesario realizar pruebas de laboratorio rutinarias para monitorizar cuidadosamente los efectos adversos más frecuentes (hiperlipidemia e hipotiroidismo), que suelen ser prevenibles y/o controlables con fármacos concomitantes.
Contribución de los autoresTodas las personas que cumplen los criterios de autoría figuran como autores, y todos los autores certifican que han participado lo suficiente en el trabajo como para asumir la responsabilidad pública de su contenido, incluida la participación en el concepto, el diseño, el análisis, la redacción o la revisión del manuscrito. Además, cada autor certifica que este material, o material similar, no ha sido ni será presentado ni publicado en ninguna otra publicación.
Conflictos de interesesNinguno declarado.