La hiperhidrosis se caracteriza por excesiva sudoración, habitualmente secundaria a disfunción autonómica con hipersecreción de las glándulas sudoríparas ecrinas. La hiperhidrosis primaria focal es la forma más frecuente, y afecta axilas, palmas, plantas y/o cara. Frecuentemente genera un gran impacto en la calidad de vida y en la actividad social. Su tratamiento es complejo. Los antitranspirantes tópicos son recomendados en primer lugar en la mayoría de casos de hiperhidrosis leve. Múltiples ensayos clínicos y estudios prospectivos avalan la eficacia y tolerabilidad de los anticolinérgicos orales y tópicos. En casos moderado/graves, el glicopirronio tópico, el cual ha sido evaluado en al menos 8 ensayos clínicos con más de 2.000 pacientes en total, podría ser considerado la primera línea farmacológica en la hiperhidrosis axilar mal controlada con antitranspirantes tópicos; seguido por inyecciones de toxina botulínica, sistemas de microondas y por anticolinérgicos orales. En este artículo revisamos el rol de los anticolinérgicos tópicos en el manejo de la hiperhidrosis focal en adultos y niños.
Hyperhidrosis, or excessive sweating, is characterized by overactivity of the eccrine sweat glands, usually associated with dysfunction of the autonomic nervous system. Primary focal hyperhidrosis is the most common form and can affect the axillae, palms, soles, and/or face, often leading to significantly impaired quality of life and social functioning. Treatment is complex. Topical antiperspirants are normally recommended as the first-line treatment for mild hyperhidrosis. Multiple clinical trials and prospective studies support the efficacy and tolerability of oral and topical anticholinergics in the management of hyperhidrosis. Topical glycopyrronium, which has been investigated in at least 8 clinical trials enrolling more than 2000 patients, is probably the first-line pharmacological treatment for axillary hyperhidrosis in patients with moderate to severe disease poorly controlled with topical antiperspirants. Second-line treatments include botulinum toxin injections, microwave treatment, and oral anticholinergics. We review the use of topical anticholinergics in the management of focal hyperhidrosis in adults and children.
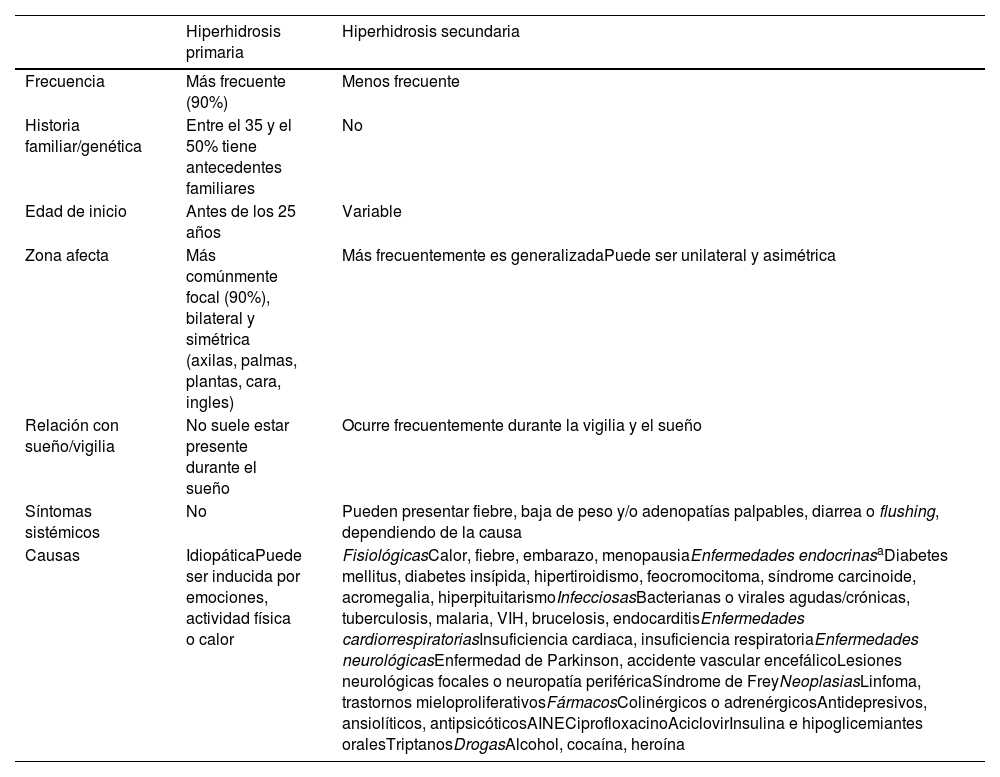
La hiperhidrosis se caracteriza por excesiva sudoración, habitualmente secundaria a disfunción autonómica que induce a la hipersecreción de las glándulas sudoríparas ecrinas. Afecta aproximadamente al 5% de la población. Se inicia frecuentemente entre los 14 y 25 años1,2. La hiperhidrosis se puede clasificar en primaria (en más del 90% de los casos) o secundaria. La hiperhidrosis primaria (HP) está asociada a una excesiva actividad neurogénica sobre glándulas ecrinas normales. Su fisiopatología es compleja, y se debería a una disfunción del sistema nervioso autonómico y/o a un control emocional anormal3. La hiperhidrosis secundaria es inducida por diversos trastornos como infecciones, neoplasias, alteraciones neuroendocrinas o fármacos (tabla 1)1.
Hiperhidrosis primaria y secundaria
| Hiperhidrosis primaria | Hiperhidrosis secundaria | |
|---|---|---|
| Frecuencia | Más frecuente (90%) | Menos frecuente |
| Historia familiar/genética | Entre el 35 y el 50% tiene antecedentes familiares | No |
| Edad de inicio | Antes de los 25 años | Variable |
| Zona afecta | Más comúnmente focal (90%), bilateral y simétrica (axilas, palmas, plantas, cara, ingles) | Más frecuentemente es generalizadaPuede ser unilateral y asimétrica |
| Relación con sueño/vigilia | No suele estar presente durante el sueño | Ocurre frecuentemente durante la vigilia y el sueño |
| Síntomas sistémicos | No | Pueden presentar fiebre, baja de peso y/o adenopatías palpables, diarrea o flushing, dependiendo de la causa |
| Causas | IdiopáticaPuede ser inducida por emociones, actividad física o calor | FisiológicasCalor, fiebre, embarazo, menopausiaEnfermedades endocrinasaDiabetes mellitus, diabetes insípida, hipertiroidismo, feocromocitoma, síndrome carcinoide, acromegalia, hiperpituitarismoInfecciosasBacterianas o virales agudas/crónicas, tuberculosis, malaria, VIH, brucelosis, endocarditisEnfermedades cardiorrespiratoriasInsuficiencia cardiaca, insuficiencia respiratoriaEnfermedades neurológicasEnfermedad de Parkinson, accidente vascular encefálicoLesiones neurológicas focales o neuropatía periféricaSíndrome de FreyNeoplasiasLinfoma, trastornos mieloproliferativosFármacosColinérgicos o adrenérgicosAntidepresivos, ansiolíticos, antipsicóticosAINECiprofloxacinoAciclovirInsulina e hipoglicemiantes oralesTriptanosDrogasAlcohol, cocaína, heroína |
AINE: antiinflamatorios no esteroideos.
La hiperhidrosis focal (HF) es la forma más frecuente de HP y afecta habitualmente axilas, palmas y plantas, ingles, pliegue inframamario y/o área craneofacial. Puede favorecer maceración cutánea, infecciones fúngicas o bacterianas y dermatitis irritativa. Puede generar un gran impacto en la calidad de vida, afectando y limitando la actividad social, el ejercicio, el trabajo y los estudios4–6. Una reciente revisión sistemática encontró tasas de ansiedad en hasta el 49% de estos pacientes, y de depresión en hasta el 60%5. En España, un estudio transversal (n=100) describió un 20% de depresión, y una relación proporcional entre la gravedad de la hiperhidrosis y la sintomatología depresiva4. En niños, la hiperhidrosis está infradiagnosticada e infratratada, y puede impactar gravemente la calidad de vida, incluso en menores de 12 años7.
El tratamiento de la HF es complejo. Existen múltiples alternativas tópicas, sistémicas, mínimamente invasivas y quirúrgicas. Los antitranspirantes tópicos generalmente son recomendados en primer lugar, especialmente en HF leve. En casos moderados/graves, sin respuesta a antitranspirantes tópicos, se han utilizado anticolinérgicos tópicos8 u orales9,10, inyecciones de toxina botulínica11,12, y diversos dispositivos como iontoforesis, radiofrecuencia13, ultrasonido y termólisis por microondas, entre otros14. En casos refractarios, pueden ser útiles diversas técnicas quirúrgicas, como la simpatectomía15. En este artículo revisamos el rol de los anticolinérgicos tópicos en el manejo de la HF en niños y adultos.
Características clínicas de la hiperhidrosis focal en niños y adultosEn prepúberes, la HF afecta en el 90% de los casos las palmas y plantas. La afectación de las axilas y de la cara es menos frecuente (15% y 6%, respectivamente)1,16. En adultos, la localización más frecuente son las axilas, en un 50%, seguido de las plantas de los pies (30%), palmas (24%) y la cara (10%). La afectación simultánea de varias zonas es frecuente1. La HF puede presentar una menor prevalencia en ancianos, lo que podría indicar una regresión de la patología en edades avanzadas1.
DiagnósticoEn la inmensa mayoría de casos el diagnóstico es clínico. En aquellos pacientes con inicio de la hiperhidrosis después de los 25 años, con hiperhidrosis generalizada, o asimétrica, unilateral, con afectación durante el sueño, o con presencia de síntomas sistémicos (tabla 1), se debe descartar una hiperhidrosis secundaria y realizar las pruebas complementarias pertinentes según la sospecha clínica. Las causas secundarias más frecuentes son trastornos endocrinológicos como la diabetes mellitus, hipertiroidismo e hiperpituitarismo, seguidas de trastornos neurológicos17.
Dentro de las escalas de evaluación de la hiperhidrosis, las más utilizadas según una reciente revisión sistemática son la Hyperhidrosis Disease Severity Scale (HDSS) (tabla 2) y el Dermatology life Quality Index (DLQI). Otra escala utilizada es la Hyperhidrosis Quality of Life Index (HidroQoL)6. Un método objetivo de evaluación es la medición de la producción de sudor por gravimetría.
Hyperhidrosis Disease Severity Scale (HDSS)
| ¿Cómo calificaría la intensidad de su hiperhidrosis? | |
|---|---|
| Puntuacióna | Respuesta |
| 1 | Mi sudoración nunca es perceptible y nunca interfiere con mis actividades diarias |
| 2b | Mi sudoración es tolerable pero en ocasiones interfiere con mis actividades diarias |
| 3b | Mi sudoración apenas es tolerable y con frecuencia interfiere con mis actividades diarias |
| 4b | Mi sudoración es intolerable y siempre interfiere con mis actividades diarias |
Los objetivos del tratamiento de la hiperhidrosis son reducir la sudoración y mejorar la calidad de vida de los individuos. Se puede lograr disminuyendo la producción de sudor por las glándulas sudoríparas y/o reduciendo la cantidad de estas11. Algunas recomendaciones básicas18 están resumidas en la tabla 3.
Recomendaciones para los pacientes con hiperhidrosis
| Evitar la ropa ajustada, prendas sintéticas y calzado oclusivo |
| Usar talco secante |
| Utilizar una primera capa de ropa para disimular el sudor |
| Evitar los alimentos condimentados y el alcohol |
| Evitar ambientes o situaciones que generen respuestas emocionales que agraven la patología |
| En hiperhidrosis plantar, cambiar frecuentemente los calcetines y zapatos, y usar plantillas absorbentes |
En general, los antitranspirantes tópicos se recomiendan en la HF axilar y palmoplantar como primer escalón terapéutico11,18. Sin embargo, tienden a ser eficaces mayoritariamente en las formas leves11. Los antitranspirantes son productos tópicos de venta libre, contienen sales minerales, como sales de aluminio en concentraciones variables (6%19, 15%20, 20%21,22 o 30%23, entre otras). Sus efectos adversos (EA) incluyen irritación local18. La tabla 4 explica el mecanismo de acción y recomendaciones para su utilización. En niños, pese a ser ampliamente utilizados en la práctica clínica24, no hemos encontrado estudios sobre el uso y tolerabilidad de productos antitranspirantes (sales de aluminio).
Concentración, mecanismo de acción y recomendaciones de uso de los antitranspirantes en la hiperhidrosis focal
| Concentración | Los antitranspirantes de venta libre (stick o roll-on) contienen una concentración máxima de 12,5% de CAHOtros productos y fórmulas magistrales pueden contener hasta un 40% de CAHOtras sales menos utilizadas contienen zirconio, vanadio e indio |
| Vehículos | Se pueden encontrar en agua, alcohol o glicerol (stick o roll-on), o en cremas o locionesLas lociones pueden permitir aplicar una cantidad más uniforme de producto |
| Mecanismo de acción | Las sales de aluminio interactúan con los mucopolisacáridos y forman precipitados que obstruyen el lumen de las glándulas sudoríparas ecrinas, pero persiste la producción de sudorPuede inducir atrofia de las glándulas ecrinas |
| Recomendaciones | Deben ser aplicados sobre la piel seca antes de dormirSe deben mantener 8h antes de lavar la zonaAplicar a diario las primeras semanas hasta observar disminución de la sudoración, y luego reducir a una o dos veces por semana |
| Efectos adversos | Aparición de miliaria en la zona aplicada (por retención de sudor)Dermatitis irritativa, dependiente de la concentración de CAHNo se ha demostrado la asociación con la enfermedad de Alzheimer o el carcinoma de mama |
Los anticolinérgicos reducen la sudoración al bloquear de forma competitiva los receptores muscarínicos de acetilcolina en las glándulas sudoríparas ecrinas.
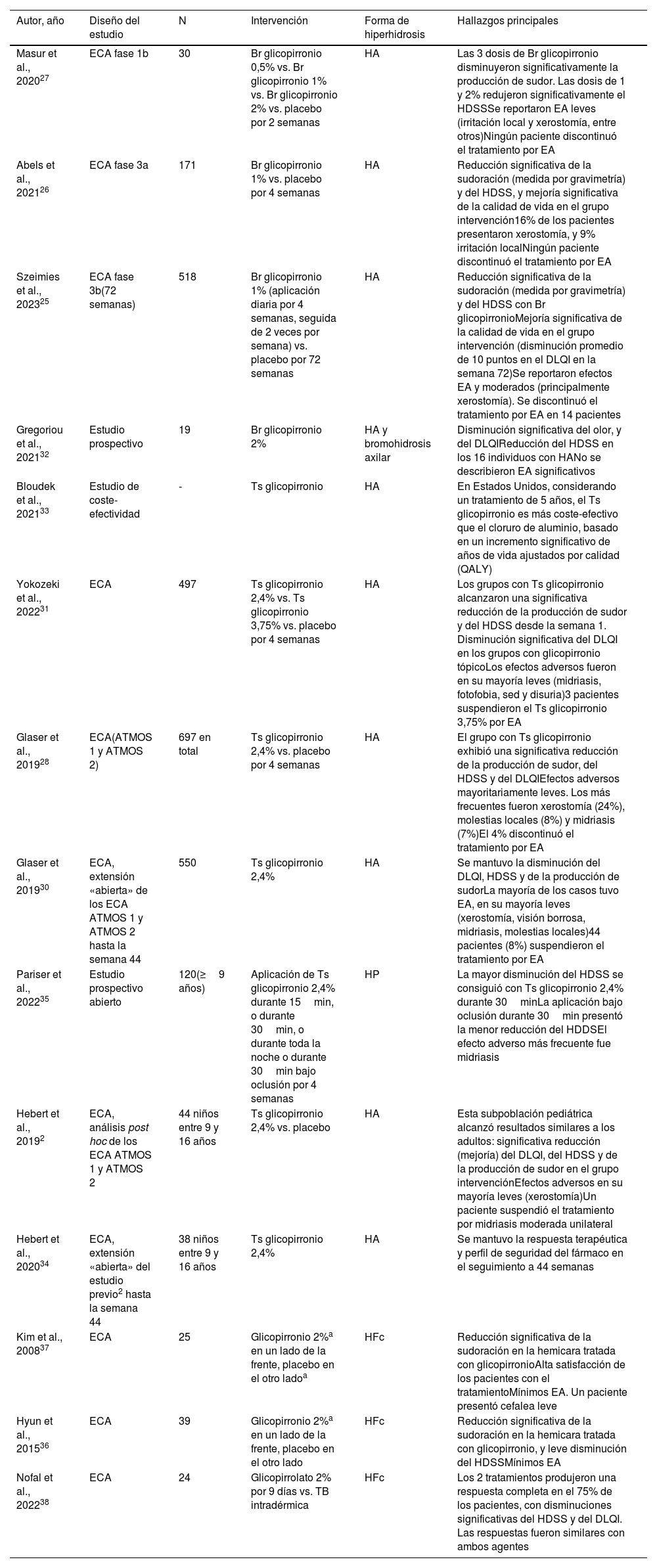
Glicopirronio tópicoHiperhidrosis axilarEl glicopirronio tópico está aprobado por la Food and Drug Administration (FDA) para el tratamiento de la hiperhidrosis axilar (HA) en pacientes ≥9años. Un reciente ensayo clínico aleatorizado (ECA) fase-3b evaluó la efectividad a largo plazo (72 semanas) del bromuro de glicopirronio 1% en 518 pacientes con HA. Mostró una reducción significativa de la sudoración (medida por gravimetría) y del HDSS, así como una mejoría significativa de la calidad de vida en el grupo intervención, con una disminución del HidroQoL y una reducción promedio de 10 puntos del DLQI en la semana 72. El tratamiento fue bien tolerado, y se observaron EA mayoritariamente leves (principalmente xerostomía). Se discontinuó por EA en 14 casos25. Resultados similares se observaron en 2 ECA previos fase-3a26 y fase-1b27 con 171 y 30 pacientes, respectivamente (tabla 5).
Estudios sobre el glicopirronio tópico en la hiperhidrosis focal
| Autor, año | Diseño del estudio | N | Intervención | Forma de hiperhidrosis | Hallazgos principales |
|---|---|---|---|---|---|
| Masur et al., 202027 | ECA fase 1b | 30 | Br glicopirronio 0,5% vs. Br glicopirronio 1% vs. Br glicopirronio 2% vs. placebo por 2 semanas | HA | Las 3 dosis de Br glicopirronio disminuyeron significativamente la producción de sudor. Las dosis de 1 y 2% redujeron significativamente el HDSSSe reportaron EA leves (irritación local y xerostomía, entre otros)Ningún paciente discontinuó el tratamiento por EA |
| Abels et al., 202126 | ECA fase 3a | 171 | Br glicopirronio 1% vs. placebo por 4 semanas | HA | Reducción significativa de la sudoración (medida por gravimetría) y del HDSS, y mejoría significativa de la calidad de vida en el grupo intervención16% de los pacientes presentaron xerostomía, y 9% irritación localNingún paciente discontinuó el tratamiento por EA |
| Szeimies et al., 202325 | ECA fase 3b(72 semanas) | 518 | Br glicopirronio 1% (aplicación diaria por 4 semanas, seguida de 2 veces por semana) vs. placebo por 72 semanas | HA | Reducción significativa de la sudoración (medida por gravimetría) y del HDSS con Br glicopirronioMejoría significativa de la calidad de vida en el grupo intervención (disminución promedio de 10 puntos en el DLQI en la semana 72)Se reportaron efectos EA y moderados (principalmente xerostomía). Se discontinuó el tratamiento por EA en 14 pacientes |
| Gregoriou et al., 202132 | Estudio prospectivo | 19 | Br glicopirronio 2% | HA y bromohidrosis axilar | Disminución significativa del olor, y del DLQIReducción del HDSS en los 16 individuos con HANo se describieron EA significativos |
| Bloudek et al., 202133 | Estudio de coste-efectividad | - | Ts glicopirronio | HA | En Estados Unidos, considerando un tratamiento de 5 años, el Ts glicopirronio es más coste-efectivo que el cloruro de aluminio, basado en un incremento significativo de años de vida ajustados por calidad (QALY) |
| Yokozeki et al., 202231 | ECA | 497 | Ts glicopirronio 2,4% vs. Ts glicopirronio 3,75% vs. placebo por 4 semanas | HA | Los grupos con Ts glicopirronio alcanzaron una significativa reducción de la producción de sudor y del HDSS desde la semana 1. Disminución significativa del DLQI en los grupos con glicopirronio tópicoLos efectos adversos fueron en su mayoría leves (midriasis, fotofobia, sed y disuria)3 pacientes suspendieron el Ts glicopirronio 3,75% por EA |
| Glaser et al., 201928 | ECA(ATMOS 1 y ATMOS 2) | 697 en total | Ts glicopirronio 2,4% vs. placebo por 4 semanas | HA | El grupo con Ts glicopirronio exhibió una significativa reducción de la producción de sudor, del HDSS y del DLQIEfectos adversos mayoritariamente leves. Los más frecuentes fueron xerostomía (24%), molestias locales (8%) y midriasis (7%)El 4% discontinuó el tratamiento por EA |
| Glaser et al., 201930 | ECA, extensión «abierta» de los ECA ATMOS 1 y ATMOS 2 hasta la semana 44 | 550 | Ts glicopirronio 2,4% | HA | Se mantuvo la disminución del DLQI, HDSS y de la producción de sudorLa mayoría de los casos tuvo EA, en su mayoría leves (xerostomía, visión borrosa, midriasis, molestias locales)44 pacientes (8%) suspendieron el tratamiento por EA |
| Pariser et al., 202235 | Estudio prospectivo abierto | 120(≥9 años) | Aplicación de Ts glicopirronio 2,4% durante 15min, o durante 30min, o durante toda la noche o durante 30min bajo oclusión por 4 semanas | HP | La mayor disminución del HDSS se consiguió con Ts glicopirronio 2,4% durante 30minLa aplicación bajo oclusión durante 30min presentó la menor reducción del HDDSEl efecto adverso más frecuente fue midriasis |
| Hebert et al., 20192 | ECA, análisis post hoc de los ECA ATMOS 1 y ATMOS 2 | 44 niños entre 9 y 16 años | Ts glicopirronio 2,4% vs. placebo | HA | Esta subpoblación pediátrica alcanzó resultados similares a los adultos: significativa reducción (mejoría) del DLQI, del HDSS y de la producción de sudor en el grupo intervenciónEfectos adversos en su mayoría leves (xerostomía)Un paciente suspendió el tratamiento por midriasis moderada unilateral |
| Hebert et al., 202034 | ECA, extensión «abierta» del estudio previo2 hasta la semana 44 | 38 niños entre 9 y 16 años | Ts glicopirronio 2,4% | HA | Se mantuvo la respuesta terapéutica y perfil de seguridad del fármaco en el seguimiento a 44 semanas |
| Kim et al., 200837 | ECA | 25 | Glicopirronio 2%a en un lado de la frente, placebo en el otro ladoa | HFc | Reducción significativa de la sudoración en la hemicara tratada con glicopirronioAlta satisfacción de los pacientes con el tratamientoMínimos EA. Un paciente presentó cefalea leve |
| Hyun et al., 201536 | ECA | 39 | Glicopirronio 2%a en un lado de la frente, placebo en el otro lado | HFc | Reducción significativa de la sudoración en la hemicara tratada con glicopirronio, y leve disminución del HDSSMínimos EA |
| Nofal et al., 202238 | ECA | 24 | Glicopirrolato 2% por 9 días vs. TB intradérmica | HFc | Los 2 tratamientos produjeron una respuesta completa en el 75% de los pacientes, con disminuciones significativas del HDSS y del DLQI. Las respuestas fueron similares con ambos agentes |
Br: bromuro; DLQI: Dermatology Life Quality Index; EA: efectos adversos; ECA: ensayo clínico aleatorizado; HA, hiperhidrosis axilar; HFc: hiperhidrosis facial; HP: hiperhidrosis palmar; HDSS: Hyperhidrosis Disease Severity Scale; min: minutos; Ts: tosilato; vs: versus.
En 2 ECA (697 pacientes con HA)28,29, la aplicación de tosilato de glicopirronio 2,4% por 4 semanas indujo una significativa reducción de la producción de sudor, del HDSS y del DLQI. Los EA fueron mayoritariamente leves [xerostomía (24%), molestias locales (8%) y midriasis (7%)]. El 4% discontinuó el tratamiento por EA. La extensión de estos ECA por 44 semanas reveló un mantenimiento de la respuesta y del perfil de seguridad30. Otro ECA japonés (n=497) que comparó tosilato de glicopirronio al 2,4% versus 3,75% versus placebo mostró resultados similares con mejoría clínica significativa en ambos grupos intervención31.
En un estudio prospectivo con 19 pacientes con bromhidrosis axilar, la aplicación de glicopirronio tópico 2% disminuyó significativamente el olor y el DLQI, así como el HDSS en los 16 individuos con HA32.
Por último, un análisis de coste-efectividad realizado en Estados Unidos reveló que el glicopirronio tópico era coste-efectivo para el tratamiento de la HA al compararse con antitranspirantes tópicos con cloruro de aluminio33.
En niños, un análisis post hoc de 2 ECA, que incluyó a 44 individuos de entre 9 y 16 años con HA, mostró que estos alcanzaban resultados similares a los adultos, con una significativa reducción (mejoría) del DLQI, del HDSS y de la producción de sudor al utilizar tosilato de glicopirronio al 2,4%. Los EA fueron leves y transitorios, y en solo un caso llevaron a la suspensión del fármaco (midriasis moderada unilateral transitoria)2. En la extensión de este ECA a 44 semanas, 38 niños incluidos, se mantuvo la efectividad y seguridad del fármaco34. Se recomienda evitar que los niños toquen el producto, ya que podrían tocarse luego los ojos y generar una midriasis24.
Hiperhidrosis palmarUn estudio prospectivo (n=120) evidenció que el tosilato de glicopirronio a diversas concentraciones podría ser una buena opción en el manejo de la HP35.
Hiperhidrosis facialUn ECA con 39 pacientes con HF facial mostró una reducción significativa de la sudoración en la hemicara tratada con el anticolinérgico, así como una leve disminución del HDSS36. Similares resultados se observaron en un ECA previo (n=25)37. En un ECA reciente (n=24), tanto el glicopirrolato 2% tópico como la inyección de TB alcanzaron resultados similares, con respuesta completa en el 75% de los individuos con hiperhidrosis facial38.
Oxibutinina tópicaUn ECA con 61 pacientes afectos de HF en diversas localizaciones (axilas, palmas o plantas) mostró que la administración de oxibutinina tópica 10% redujo significativamente el DLQI y el HDSS39. Otro ECA reciente con 30 pacientes con HP que evaluó la administración de oxibutinina en gel 1% versus oxibutinina en nanoemulgel 1% describió resultados satisfactorios para ambas formulaciones40. En un amplio ECA fase 3 (n=244), una loción de oxibutinina al 20% demostró disminuir el volumen de sudor en pacientes con HP. Un 53% del grupo intervención redujo la sudoración en al menos un 50%, y una alcanzó una disminución significativa del DLQI. No se observaron EA graves41.
En niños, en un estudio piloto (n=10) con oxibutinina tópica al 3% se incluyeron 4 adolescentes de entre 13 a 16 años con HA. Tres completaron el estudio, y alcanzaron una significativa disminución de la sudoración axilar. El fármaco fue bien tolerado42.
Bromuro de sofpironio tópicoEl bromuro de sofpironio está aprobado en Japón para el tratamiento de la HA en adultos. Un ECA fase III (n=281) mostró que la aplicación de bromuro de sofpironio 5% por 6 semanas inducía una significativa reducción del HDSS y de la sudoración medida por gravimetría en pacientes con HA. Los EA fueron mayoritariamente leves y se observaron en el 20% de los individuos. Solamente un individuo suspendió el tratamiento por EA43. La efectividad y el perfil de seguridad se mantuvieron en la extensión del estudio hasta las 52 semanas44. Un estudio prospectivo reciente (n=80) demostró que la reducción del HDSS podía observarse desde la primera semana de tratamiento31.
Umeclidinio tópicoUn ECA fase 2a (n=23) reveló que la aplicación de umeclidinio 1,85% durante 2 semanas disminuyó significativamente la sudoración axilar y el HDSS en más del 40% de los sujetos afectos de HA45.
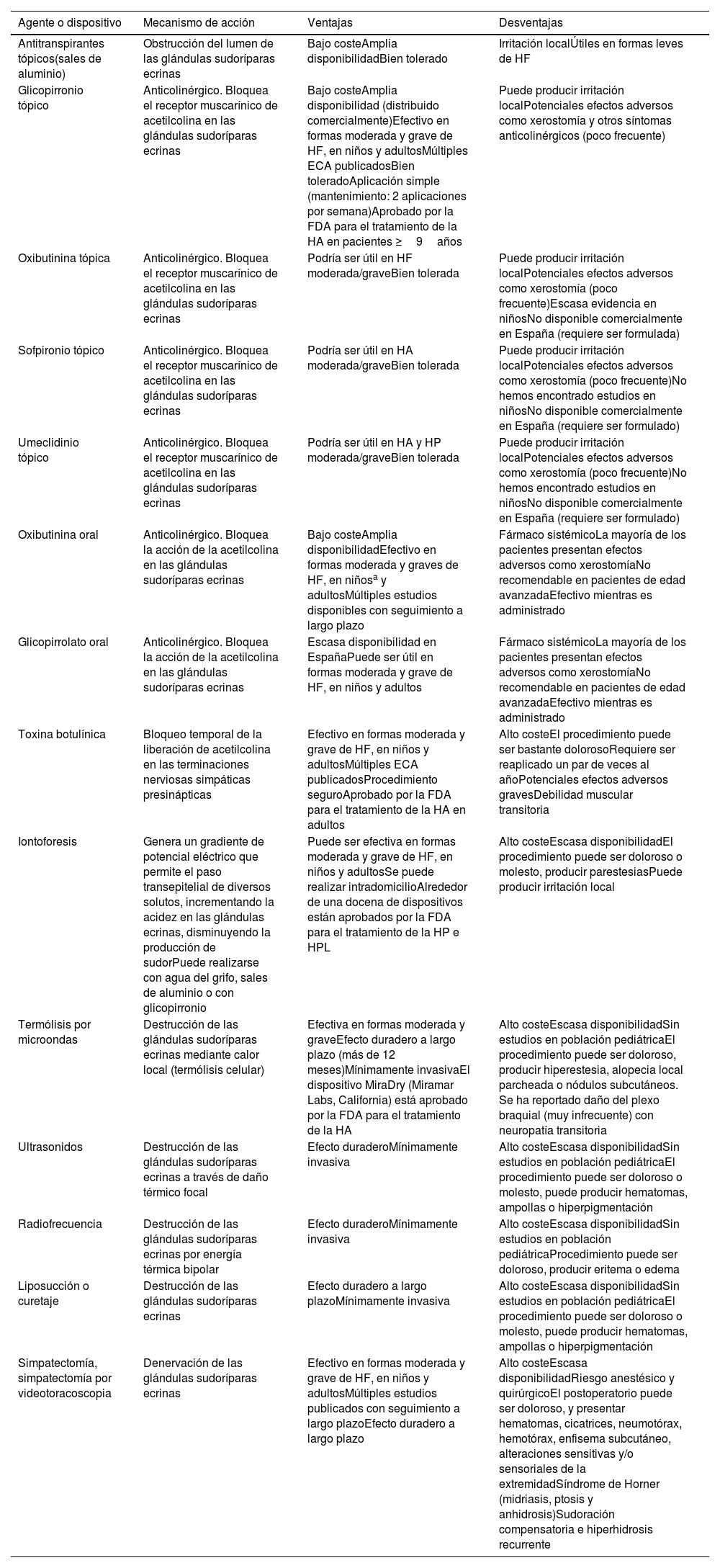
DiscusiónEl tratamiento de la hiperhidrosis puede ser complejo, y existen múltiples alternativas terapéuticas, tanto farmacológicas como dispositivos médicos o procedimientos quirúrgicos. La tabla 6 recoge las ventajas y desventajas de estas. Actualmente las terapias farmacológicas aprobadas por la FDA para el tratamiento de la HA incluyen el glicopirronio tópico y la toxina botulínica A (TB-A)15,18. No hay fármacos aprobados al día de hoy para el manejo de la HF en otras localizaciones corporales. Los anticolinérgicos sistémicos como la oxibutinina oral son ampliamente utilizados fuera de indicación en la práctica clínica, tanto en adultos como en niños, con múltiples estudios que han mostrado buenos resultados en la HF en general (axilar, palmoplantar y craneofacial), con una tolerancia aceptable10,15,46-51. Múltiples ECA, estudios prospectivos y revisiones sistemáticas avalan la efectividad y tolerancia de los anticolinérgicos tópicos en el tratamiento de la HF, incluyendo la HA, HP, HPL e HCF11,24,42,52. El glicopirronio tópico, el cual ha sido evaluado en al menos 8 ECA (incluyendo alrededor de 2000 pacientes)25-28,31,36,37, es el fármaco tópico con mayor evidencia en la actualidad. Su utilización puede limitar el desarrollo de síntomas anticolinérgicos como la xerostomía, observada en aproximadamente el 12% de los pacientes en tratamiento a largo plazo con glicopirronio tópico25, pero presente en alrededor del 75% de los individuos tratados con anticolinérgicos sistémicos como oxibutinina10. Así mismo, puede reducir los efectos adversos graves y el riesgo de abandono de la terapia, referida en el 2,7% de los casos con glicopirronio tópico a largo plazo y en el 17% de los pacientes con oxibutinina oral49. Es importante señalar que en los últimos años diversos estudios han sugerido una asociación entre el uso de anticolinérgicos sistémicos y el desarrollo de demencia, y recomiendan ser cauteloso al indicarlos en pacientes de mediana edad o ancianos53,54. El glicopirronio tópico contaría con un nivel de evidencia 1+ y grado de recomendación A para el tratamiento de la HA, según la clasificación Scottish Intercollegiate Guidelines Network (SIGN).
Alternativas terapéuticas disponibles para el tratamiento de la hiperhidrosis focal
| Agente o dispositivo | Mecanismo de acción | Ventajas | Desventajas |
|---|---|---|---|
| Antitranspirantes tópicos(sales de aluminio) | Obstrucción del lumen de las glándulas sudoríparas ecrinas | Bajo costeAmplia disponibilidadBien tolerado | Irritación localÚtiles en formas leves de HF |
| Glicopirronio tópico | Anticolinérgico. Bloquea el receptor muscarínico de acetilcolina en las glándulas sudoríparas ecrinas | Bajo costeAmplia disponibilidad (distribuido comercialmente)Efectivo en formas moderada y grave de HF, en niños y adultosMúltiples ECA publicadosBien toleradoAplicación simple (mantenimiento: 2 aplicaciones por semana)Aprobado por la FDA para el tratamiento de la HA en pacientes ≥9años | Puede producir irritación localPotenciales efectos adversos como xerostomía y otros síntomas anticolinérgicos (poco frecuente) |
| Oxibutinina tópica | Anticolinérgico. Bloquea el receptor muscarínico de acetilcolina en las glándulas sudoríparas ecrinas | Podría ser útil en HF moderada/graveBien tolerada | Puede producir irritación localPotenciales efectos adversos como xerostomía (poco frecuente)Escasa evidencia en niñosNo disponible comercialmente en España (requiere ser formulada) |
| Sofpironio tópico | Anticolinérgico. Bloquea el receptor muscarínico de acetilcolina en las glándulas sudoríparas ecrinas | Podría ser útil en HA moderada/graveBien tolerada | Puede producir irritación localPotenciales efectos adversos como xerostomía (poco frecuente)No hemos encontrado estudios en niñosNo disponible comercialmente en España (requiere ser formulado) |
| Umeclidinio tópico | Anticolinérgico. Bloquea el receptor muscarínico de acetilcolina en las glándulas sudoríparas ecrinas | Podría ser útil en HA y HP moderada/graveBien tolerada | Puede producir irritación localPotenciales efectos adversos como xerostomía (poco frecuente)No hemos encontrado estudios en niñosNo disponible comercialmente en España (requiere ser formulado) |
| Oxibutinina oral | Anticolinérgico. Bloquea la acción de la acetilcolina en las glándulas sudoríparas ecrinas | Bajo costeAmplia disponibilidadEfectivo en formas moderada y graves de HF, en niñosa y adultosMúltiples estudios disponibles con seguimiento a largo plazo | Fármaco sistémicoLa mayoría de los pacientes presentan efectos adversos como xerostomíaNo recomendable en pacientes de edad avanzadaEfectivo mientras es administrado |
| Glicopirrolato oral | Anticolinérgico. Bloquea la acción de la acetilcolina en las glándulas sudoríparas ecrinas | Escasa disponibilidad en EspañaPuede ser útil en formas moderada y grave de HF, en niños y adultos | Fármaco sistémicoLa mayoría de los pacientes presentan efectos adversos como xerostomíaNo recomendable en pacientes de edad avanzadaEfectivo mientras es administrado |
| Toxina botulínica | Bloqueo temporal de la liberación de acetilcolina en las terminaciones nerviosas simpáticas presinápticas | Efectivo en formas moderada y grave de HF, en niños y adultosMúltiples ECA publicadosProcedimiento seguroAprobado por la FDA para el tratamiento de la HA en adultos | Alto costeEl procedimiento puede ser bastante dolorosoRequiere ser reaplicado un par de veces al añoPotenciales efectos adversos gravesDebilidad muscular transitoria |
| Iontoforesis | Genera un gradiente de potencial eléctrico que permite el paso transepitelial de diversos solutos, incrementando la acidez en las glándulas ecrinas, disminuyendo la producción de sudorPuede realizarse con agua del grifo, sales de aluminio o con glicopirronio | Puede ser efectiva en formas moderada y grave de HF, en niños y adultosSe puede realizar intradomicilioAlrededor de una docena de dispositivos están aprobados por la FDA para el tratamiento de la HP e HPL | Alto costeEscasa disponibilidadEl procedimiento puede ser doloroso o molesto, producir parestesiasPuede producir irritación local |
| Termólisis por microondas | Destrucción de las glándulas sudoríparas ecrinas mediante calor local (termólisis celular) | Efectiva en formas moderada y graveEfecto duradero a largo plazo (más de 12 meses)Mínimamente invasivaEl dispositivo MiraDry (Miramar Labs, California) está aprobado por la FDA para el tratamiento de la HA | Alto costeEscasa disponibilidadSin estudios en población pediátricaEl procedimiento puede ser doloroso, producir hiperestesia, alopecia local parcheada o nódulos subcutáneos. Se ha reportado daño del plexo braquial (muy infrecuente) con neuropatía transitoria |
| Ultrasonidos | Destrucción de las glándulas sudoríparas ecrinas a través de daño térmico focal | Efecto duraderoMínimamente invasiva | Alto costeEscasa disponibilidadSin estudios en población pediátricaEl procedimiento puede ser doloroso o molesto, puede producir hematomas, ampollas o hiperpigmentación |
| Radiofrecuencia | Destrucción de las glándulas sudoríparas ecrinas por energía térmica bipolar | Efecto duraderoMínimamente invasiva | Alto costeEscasa disponibilidadSin estudios en población pediátricaProcedimiento puede ser doloroso, producir eritema o edema |
| Liposucción o curetaje | Destrucción de las glándulas sudoríparas ecrinas | Efecto duradero a largo plazoMínimamente invasiva | Alto costeEscasa disponibilidadSin estudios en población pediátricaEl procedimiento puede ser doloroso o molesto, puede producir hematomas, ampollas o hiperpigmentación |
| Simpatectomía, simpatectomía por videotoracoscopia | Denervación de las glándulas sudoríparas ecrinas | Efectivo en formas moderada y grave de HF, en niños y adultosMúltiples estudios publicados con seguimiento a largo plazoEfecto duradero a largo plazo | Alto costeEscasa disponibilidadRiesgo anestésico y quirúrgicoEl postoperatorio puede ser doloroso, y presentar hematomas, cicatrices, neumotórax, hemotórax, enfisema subcutáneo, alteraciones sensitivas y/o sensoriales de la extremidadSíndrome de Horner (midriasis, ptosis y anhidrosis)Sudoración compensatoria e hiperhidrosis recurrente |
ECA: ensayos clínicos aleatorizados; FDA: Food and Drug Administration; HA: hiperhidrosis axilar; HF: hiperhidrosis focal; HP: hiperhidrosis palmar.
Hasta recientemente, el glicopirronio tópico debía ser formulado en España, a un alto coste que limitaba su utilización. Desde abril del 2023 se encuentra disponible en España como fármaco (Axhidrox®, Cantabria Labs), su coste anual es de aproximadamente 200 euros el primer año (y luego, 160 euros por año). Previamente ya se encontraba disponible en al menos 11 países de Europa. Está aprobado por la European Medicines Agency (EMA) y por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) para el tratamiento de la HA en adultos. Es el único anticolinérgico tópico aprobado por la AEMPS para el tratamiento de la HA. En cuanto a su administración tópica, se deben aplicar dos pulsaciones del producto (crema) en cada axila todas las noches durante las primeras 4 semanas, y luego, a partir de la quinta semana, 2 pulsaciones por axila 2 noches a la semana. Otras formulaciones de glicopirronio se pueden encontrar comercialmente también en Norteamérica. Debido a su eficacia y perfil de seguridad, consideramos que podría ser considerado como primera línea farmacológica en la HA moderada/grave en adultos (tras el fracaso a antitranspirantes tópicos). En cuanto a su uso en otras localizaciones corporales (palmas/plantas y zona craneofacial), debemos destacar que la mayoría de estudios clínicos y evidencia disponible provienen de pacientes con HA, y no está actualmente aprobado para uso en dichas localizaciones. Sin embargo, creemos que el perfil de seguridad del glicopirronio tópico, sumado a cuestiones logísticas (coste y disponibilidad), permitiría plantear su uso (fuera de ficha técnica) para el manejo de la HP, HPL e hiperhidrosis facial con mala respuesta a otros tratamientos, o ante la no disponibilidad de otras alternativas terapéuticas. Debe advertirse a los pacientes evitar el contacto del producto con los ojos, especialmente cuando se aplica en la cara o en las manos, por el riesgo de midriasis y visión borrosa transitoria. Otras alternativas terapéuticas a considerar en diferentes tipos de HF incluyen los anticolinérgicos orales como la oxibutinina (nivel de evidencia 1- y grado de recomendación B), la iontoforesis, especialmente útil en casos de HF palmar y/o plantar, que podría estar limitada por su coste (aunque no es especialmente costosa a medio plazo) y disponibilidad24, y las inyecciones de TB-A (nivel de evidencia 1+ y grado de recomendación A para el tratamiento de la HA), de alta efectividad, pero que igualmente podrían estar limitadas por su disponibilidad, coste y (sobre todo en niños) el dolor asociado al procedimiento. En casos refractarios se podrían plantear diversos dispositivos médicos y procedimientos quirúrgicos como la simpatectomía18.
La HF pediátrica ha sido una patología infrarrepresentada en estudios clínicos, pese al impacto que puede generar en esta población24. En este subgrupo la valoración del riesgo-beneficio tiene un papel preponderante y debe ser cuidadosamente sopesada24 (tabla 6). Pese a la falta de estudios en niños, los antitranspirantes con sales de aluminio son ampliamente recomendados como tratamiento de inicio en la HA, HP y HPL24. El glicopirronio tópico ha demostrado en 2 EC que incluían niños buena efectividad y excelente perfil de seguridad2,34, con lo que podría indicarse como primera línea farmacológica en la HA moderada/grave refractaria a antitranspirantes tópicos. Su uso está aprobado en HA, pero consideramos que puede ser una alternativa válida en HP e HPL. La oxibutinina oral también ha sido empleada con éxito y buena tolerancia en niños16. Es recomendable titular la dosis, empezando desde 2,5mg y aumentar progresivamente, advirtiendo sobre EA esperables como la xerostomía. La iontoforesis y la TB son otras alternativas a considerar. No hemos encontrado estudios en niños sobre terapias mínimamente invasivas para hacer recomendaciones al respecto. La simpatectomía queda como último recurso en no respondedores.
LimitacionesEsta revisión está limitada por su carácter narrativo, no siendo una revisión sistemática de la literatura. Además, muchos de los estudios analizados son retrospectivos, o presentan una metodología heterogénea, con formas de evaluación y periodos de seguimiento diverso, y no existen estudios comparativos bien diseñados para evaluar la superioridad de un agente u otro. Sin embargo, es destacable el número de ECA disponibles.
ConclusionesLa HF es una patología prevalente y que puede tener un gran impacto en la calidad de vida. Basándonos en el perfil de seguridad, efectividad y coste, consideramos que tanto en niños como en adultos el glicopirronio tópico podría ser la primera alternativa farmacológica en HA moderada/grave refractaria a antitranspirantes tópicos. En otras localizaciones corporales, como palmas, plantas o zona facial, podría ser igualmente una alternativa a considerar en casos refractarios a otros tratamientos, aunque su uso se realizaría fuera de ficha técnica. Sería interesante el desarrollo de nuevos ECA que permitan valorar su utilidad en estos casos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesDaniel Morgado Carrasco y Raúl de Lucas han recibido honorarios de Cantabria Labs.